El síndrome de Aicardi-Goutières (SAG) es una enfermedad hereditaria rara cuya prevalencia exacta se desconoce. Descrito en 1984, por Jean Aicardi y Francoise Goutières, como una encefalopatía progresiva de aparición durante los primeros meses de vida, que cursa con linfocitosis en LCR y calcificaciones en los ganglios basales1. Cursa con irritabilidad, retraso psicomotor, espasticidad, distonía, crisis comiciales, episodios recurrentes de fiebre aséptica y microcefalia. La mortalidad se encuentra aumentada en esta fase encefalopática, aunque típicamente la enfermedad tiende a estabilizarse tras su inicio dejando secuelas neurológicas graves. Otras manifestaciones características que aparecen en su curso son las lesiones cutáneas tipo sabañón, afectación oftalmológica (fundamentalmente glaucoma), cardiaca o trastornos de la autoinmunidad2. En la patogenia de este síndrome resulta crucial el papel del interferón tipo I, cuya regulación se encuentra inducida y su producción aumentada3. Por ello uno de los hallazgos de laboratorio clásicos del síndrome es la determinación de niveles elevados de interferón-alfa en líquido cefalorraquídeo, así como pleocitosis y niveles igualmente elevados de neopterina y biopterina. Actualmente se está evaluando la utilidad como marcador biológico de la expresión de genes estimulados por interferón en sangre periférica, ya que se ha demostrado que estos permanecen altos incluso tras la fase encefalopática (interferon signature)3–5. Otro hallazgo cardinal son las anomalías en la neuroimagen consistentes en calcificación de ganglios basales y cambios leucodistróficos (figura). A día de hoy se conocen 7 genes cuyas mutaciones pueden derivar en una sobreestimulación de la vía del interferón: ADAR, RNASEH2A, RNASEH2B, RNASEH2C, SAMHD1, TREX1 e IFIH1. En el caso de TREX1, ADAR e IFIH1 se han identificado mutaciones en heterocigosis y, en el resto de genes, todas las mutaciones descritas son en homocigosis2. El descubrimiento del gen IFIH1 es el más reciente (2014)4, por lo que representa la mutación genética patogénica menos frecuente mientras que a mutaciones en RNASEH2B y TREX1 se les adjudica la mayor proporción de diagnósticos de SAG.
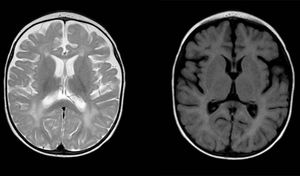
Alteración difusa y parcheada de la intensidad de señal de la sustancia blanca de ambos hemisferios cerebrales, hiperintensa en secuencias potencias en T2. Aumento de tamaño del espacio subaracnoideo de predominio frontal y temporal bihemisférico, con apertura del espacio interhemisférico, y tamaño ventricular aumentado (sin tensión), compatible con atrofia cortical y subcortical.
En las últimas décadas, gracias a los avances en genética que han permitido identificar las mutaciones específicas mencionadas, se ha evidenciado una variabilidad fenotípica amplia más allá de la presentación más clásica en función de los genes implicados. Presentamos los casos de 3 pacientes diagnosticados de SAG en los últimos 8 años, con el fin de analizar diferentes atributos clínicos según la genética responsable (tabla). De forma general, los hallazgos característicos del SAG son similares a los descritos en la última serie publicada: presentación neonatal (33%), microcefalia (66%), retraso psicomotor (100%), espasticidad (100%), retraso mental grave (66%) y calcificaciones en la TC de cráneo (66%), sin embargo solo un caso asocia epilepsia.
Características de los pacientes con síndrome de Aicardi-Goutières
| Caso 1 | Caso 2 | Caso 3 | |
|---|---|---|---|
| Genética | Mutación en homocigosis (p.Ala177Thr) en gen RNASEH2B | Mutación en homocigosis (341 G>A) en el gen TREX1 | Mutación en heterocigosis (c.992 C>G y p.Thr331Arg) gen IFIH1 |
| Edad actual | Tres años | Siete años y 4 meses | Doce años y 11 meses |
| Sexo | Masculino | Femenino | Masculino |
| Origen | Rumanía | España | Italia |
| AP | — | Semana 36: CIR Semana 37: microcefalia, calcificaciones placentarias | Labio hendido |
| Clínica | |||
| Edad inicio | Diez meses | Nacimiento | Segundo año de vida |
| Síntomas de inicio | Irritabilidad Regresión psicomotora | Tremulaciones, hipotonía, llanto débil, fallo de medro | Retraso motor |
| Retraso PM | Sí | Sí | Sí |
| Lenguaje | Bisílabos | No | Sí |
| Microcefalia | Sí | Sí | No |
| Sabañones | No | Sí | Sí |
| Epilepsia | No | Sí | No |
| Afectación motora | Tetraparesia espástica. GMFCS IV | Tetraparesia espástica grave. GMFCS V | Tetraparesia espástica. GMFCS IV |
| Trastorno del movimiento | No | Sí | No |
| Movimientos oculares anormales | No | No | No |
| Déficit visual | No | — | Miopía |
| Glaucoma | No | No | No |
| Déficit auditivo | — | — | No |
| Afectación cardíaca | No | Insuficiencia tricuspídea y mitral leves | No |
| Fiebre recurrente | No | No | No |
| Discapacidad intelectual | Sí | Sí, grave | Sí, leve |
| Otros | — | — | Síndrome de Singleton-Merten: alteraciones dentarias PNP sensitivo-motora axonal+desmielinizante |
| LCR | |||
| Citoquímica | Hiperproteinorraquia | Pleocitosis e hiperproteinorraquia | — |
| Neopterina (nmol/l) | 1.102 (12-55) | 1.813 (12-55) | — |
| Biopterina (nmol/l) | 66 (22-73) | 53 (22-73) | — |
| Niveles INF-alfa (UI/ml) | 25 (<2) | 75 (<2) | — |
| Sangre | |||
| Interferon signature | — | — | Aumento de la expresión del gen |
| Neuroimagen | |||
| Calcificaciones en TC | No | Sí. En ganglios de la base y periventriculares | Sí. En SB profunda a nivel frontal y en núcleos lenticulares simétricas |
| RM de cráneo | Alteración difusa y parcheada de la intensidad de la SB de ambos hemisferios cerebrales, hiperintensa en T2. Hay afectación de la SB subcortical (respetando las fibras U) y periventricular | Alteración generalizada de la SB, predomina afectación de la SB lobar incluidas las fibras U subcorticales de lóbulos frontales, temporales y occipitales, bilaterales y simétricas, sin afectación de la corteza cerebral | — |
Las mutaciones en homocigosis del gen RNASEH2B, como se ha puntualizado anteriormente, representan la variante patogénica más frecuentemente responsable del SAG y su representación fenotípica suele ser la más fiel a la presentación clásica4. Así ocurrió en nuestro paciente portador de dicha mutación, que inició a los 10 meses de edad un cuadro de irritabilidad y retraso psicomotor con neuroimagen y líquido-cefalorraquídeos característicos de la enfermedad.
Un 20% de los casos de SAG pueden tener una presentación neonatal con un inicio intrauterino de la enfermedad5. Mutaciones en cualquiera de los 7 genes pueden derivar en este fenotipo, pero se ha visto más frecuentemente asociado a la implicación del gen TREX4,5. En su presentación inicial el cuadro se asemeja al de las infecciones TORCH con hepatoesplenomegalia, hipertransaminasemia, trombocitopenia y alteraciones neurológicas que incluyen irritabilidad extrema, trastornos del movimiento y crisis comiciales5. Estos pacientes tienen un curso más grave de la enfermedad con mayor riesgo de mortalidad. Nuestra paciente diagnosticada de esta variante presentó un inicio neonatal de su enfermedad superponible al descrito y actualmente es la que mayor afectación clínica presenta.
Las mutaciones en ADAR1 y, sobre todo, IFIH1 son las que más frecuentemente se asocian a inicio más tardío de los síntomas, tras un primer año de vida con desarrollo psicomotor normal5. En algunos de estos casos el curso de la enfermedad es más benigno y podrían conservar de forma limitada el lenguaje y la motricidad. Nuestro paciente con mutación en IFIH1 tiene, además, la peculiaridad de contar con el diagnóstico adicional de síndrome de Singleton-Merten, entidad rara caracterizada por displasia dental, calcificaciones aórticas y osteoporosis, y que también es causada por una mutación del IFIH16.
Nuestro objetivo es destacar la importancia de la variabilidad fenotípica en el SAG y su relación con mutaciones genéticas específicas, tanto para considerar el diagnóstico en presentaciones que se desvíen de la forma clásica como para disponer de más información sobre la evolución y pronóstico de nuestros pacientes.