La información específica de cada país sobre el tratamiento pediátrico con hormona de crecimiento (GH) proviene de estudios multinacionales.
MétodosEn España, 1.294 niños participaron en el estudio internacional y observacional sobre genética y neuroendocrinología de la talla baja (GeNeSIS). En los pacientes tratados con GH (n=1.267) se evaluaron los acontecimientos adversos. En aquellos con deficiencia de GH (DGH, 78%) también se evaluó la efectividad.
ResultadosLa media de edad al inicio del estudio fue 9,8 años. La mediana (Q1-Q3) de duración del tratamiento fue 2,8 (1,6-4,4) años y la dosis inicial de GH 0,22 (0,20-0,25) mg/kg/semana. En 262 pacientes con DGH con datos a 4 años, la velocidad media (IC 95%) de crecimiento fue 4,3 (4,1 a 4,6) cm/año al inicio; 9,0 (8,7 a 9,4) cm/año tras un año y 5,5 (5,2 a 5,8) cm/año a los 4 años. La puntuación de desviación estándar (SDS) de talla fue —2,48 (—2,58 a —2,38) al inicio y —1,18 (—1,28 a —1,08) a los 4 años. La SDS de talla final menos la SDS de talla diana (n=241) fue —0,09 (—0,20 a 0,02). De 1.143 pacientes tratados con GH con seguimiento ≥1 año, 93 (8,1%) comunicaron acontecimientos adversos surgidos durante el tratamiento. En 7 niños se comunicaron acontecimientos adversos graves, que en 2 casos se consideraron posiblemente relacionados con GH.
ConclusiónLa terapia de sustitución con GH fue efectiva para el aumento de talla en los pacientes españoles. El perfil de seguridad fue acorde con el ya conocido para el fármaco.
Country-specific information on pediatric GH therapy is available from multi-national studies.
MethodsA total of 1294 children in Spain enrolled in the observational Genetics and Neuroendocrinology of Short-stature International Study (GeNeSIS). Adverse events were assessed in all GH-treated patients (n=1267) and effectiveness in those with GH deficiency (GHD, 78%).
ResultsMean age at time of entry to the study was 9.8 years. GH was initiated at a median (Q1-Q3) 0.22 (0.20−0.25) mg/kg/week and administered for 2.8 (1.6-4.4) years. For 262 patients with GHD and 4-year data, mean (95% CI) height velocity was 4.3 (4.1 - 4.6) cm/year at baseline, 9.0 (8.7 to 9.4) cm/year at 1-year, and 5.5 (5.2 to 5.8) cm/year at 4-years. Height standard deviation score (SDS) was —2.48 (—2.58 to —2.38) at baseline and -1.18 (—1.28 to —1.08) at 4 years. Final height SDS minus target height SDS (n=241) was −0.09 (−0.20 to 0.02). In 1143 GH-treated patients with ≥1 year follow-up, 93 (8.1%) reported treatment-emergent adverse events. Serious events were reported for 7 children, with 2 considered GH-related.
ConclusionThese data confirm the benefit of GH replacement therapy on height gain for the patients in Spain. The safety profile was consistent with that already known for GH therapy.
El objetivo principal del tratamiento con hormona del crecimiento (GH) durante la infancia y adolescencia es promover una talla normal. A partir de la introducción de la GH recombinante humana en 1985, miles de niños con una alteración del crecimiento mejoraron su estatura. La indicación principal para el tratamiento con GH sigue siendo la deficiencia de GH (DGH) en niños1 o adultos2. Sin embargo, su uso ha evolucionado con el tiempo y se han aprobado nuevas indicaciones. Además de la DGH, las indicaciones pediátricas actuales en nuestro país incluyen el síndrome de Turner, talla baja en niños que nacieron pequeños para su edad gestacional (PEG), el síndrome de Prader-Willi, la insuficiencia renal crónica, y la talla baja por haploinsuficiencia del gen SHOX (short-stature homeobox-containing gene)1,3–10.
Muchos estudios han mostrado que los acontecimientos adversos graves relacionados con GH son poco frecuentes, especialmente con las dosis aprobadas en la actualidad6,7,11–15, aunque en un pequeño número de pacientes se han notificado casos de hipertensión intracraneal, escoliosis y deslizamiento de la epífisis femoral1,14–16. Ha sido motivo de preocupación una posible asociación entre el tratamiento con GH y las alteraciones en el metabolismo de la glucosa, así como la aparición de neoplasias en pacientes que ya presentaban factores de riesgo12,14,17–19.
Los resultados a largo plazo y la seguridad del tratamiento con GH se han documentado en grandes registros internacionales, como Kabi International Growth Study (KIGS), National Cooperative Growth Study (NCGS), y Genetics and Neuroendocrinology of Short Stature International Study (GeNeSIS). Además, es importante conocer los datos específicos de cada país para evaluar la efectividad y seguridad de la práctica clínica y los regímenes de tratamiento en relación con la información global. El objetivo de este estudio fue evaluar la seguridad y efectividad del tratamiento con GH en pacientes pediátricos españoles a partir de los datos del estudio GeNeSIS.
MétodosCaracterísticas del estudio y población de pacientesGeNeSIS es un estudio observacional, abierto, prospectivo y multinacional con el objetivo de examinar la seguridad y efectividad a largo plazo del tratamiento con GH (Humatrope®, Eli Lilly and Company, Indianápolis, EE. UU.) en niños con talla baja. El diagnóstico y tratamiento de los pacientes se llevó a cabo según la práctica clínica habitual en endocrinología pediátrica. El estudio se realizó de acuerdo con los principios éticos de la Declaración de Helsinki y fue aprobado por los comités éticos locales conforme a las leyes de cada país. Se obtuvo consentimiento informado por escrito de los padres o tutores legales de cada niño participante para la recogida, tratamiento y publicación de los datos.
Se incluyó a pacientes que estaban recibiendo o iniciaban tratamiento con GH para mejorar el crecimiento. En el caso de presentar antecedentes de neoplasia o cualquier alteración relacionada con el gen SHOX, se incluyó solo a aquellos que no habían recibido tratamiento con GH anteriormente. Se excluyó a los pacientes con epífisis adulta, aunque podían permanecer en el estudio si el cierre de la epífisis aparecía durante su participación en el estudio. En España participaron 56 centros con unidades de endocrinología pediátrica.
En este trabajo se examinaron los datos procedentes de niños españoles prepúberes y púberes incluidos en el estudio GeNeSIS desde su inicio en 1999 hasta un corte realizado en septiembre de 2012. Todas las decisiones relacionadas con el diagnóstico y tratamiento las llevaron a cabo los médicos que atienden al paciente, y los datos que se presentan son tal y como los comunicaron los investigadores. Se evaluaron los parámetros auxológicos de un subgrupo de esta cohorte de niños españoles con diagnóstico de DGH que no habían recibido tratamiento con GH antes de iniciar el estudio y con datos a 4 años. Además, se evaluó la talla final (casi en la edad adulta) de otro subgrupo tratado con GH durante el estudio, hubiese recibido o no tratamiento con GH anteriormente.
Evaluaciones del estudioA la inclusión en el estudio se valoró la edad cronológica, la talla diana (media de las tallas de los padres±6,5 según sexo), el peso, el índice de masa corporal, la edad ósea y el pico máximo de GH en las pruebas de estimulación. Se registró la dosis inicial de GH de cada paciente. Al inicio del estudio y cada año durante el seguimiento se valoraron la talla, la velocidad de crecimiento (VC), la maduración ósea y el estadio puberal (según la clasificación de Tanner). En los pacientes que alcanzaron la talla final se evaluó la misma y su relación con la talla diana. Para calcular la puntuación de desviación estándar (SDS) se aplicaron los 2000 US National Center for Health Statistics standards20.
El análisis de seguridad se realizó en función de los acontecimientos adversos y acontecimientos adversos graves (AAG) notificados por el investigador en todos los pacientes españoles que recibieron el tratamiento con GH. Los AAG se definieron como aquellos que causaran la muerte del paciente, su hospitalización, una discapacidad persistente o significativa, una anomalía congénita, pusieran en riesgo la vida del paciente o fueran significativos en opinión del investigador. Los acontecimientos adversos se clasificaron según el diccionario Medical Dictionary for Regulatory Activities (MedDRA) versión 11.0. El investigador determinó la gravedad de cada acontecimiento y su relación con el tratamiento con GH. Así mismo, se evaluaron los acontecimientos adversos surgidos durante el tratamiento (AAST), definidos como acontecimientos que aparecieran por primera vez o cuya intensidad empeorara tras el inicio de la terapia con GH, en todos los pacientes tratados con GH (con o sin tratamiento previo antes de su inclusión) que hubieran acudido, al menos, a una visita de seguimiento. Se prestó especial atención a acontecimientos neoplásicos específicos (indicados en la clasificación de órganos y sistemas de MedDRA como «neoplasia benigna, maligna e inespecífica [incluidos quistes y pólipos]») así como a las alteraciones en el metabolismo de la glucosa.
Análisis estadísticosLos datos se presentan como medias y desviaciones estándar (DE) o medianas con el primer y tercer cuartiles (Q1-Q3), para las variables continuas y como frecuencias y porcentajes para las variables discretas. Las estimaciones de las medias se proporcionan con sus intervalos de confianza al 95% (IC 95%) asociados. Los análisis estadísticos se llevaron a cabo utilizando statistical analysis aystem (SAS®) 9.1., (SAS Institute Inc., Cary, NC, USA)
ResultadosDistribución y características de los pacientesEspaña participó en el estudio GeNeSIS con 1.294 niños (44% mujeres). En el momento de la inclusión, el 85% de los pacientes no habían recibido nunca tratamiento con GH y un 14% ya lo estaban recibiendo. Se excluyó de los análisis a 27 pacientes por no recibir tratamiento con GH o no tener información suficiente. En la tabla 1 se resumen los diagnósticos que motivaron el tratamiento con GH en los 1.267 pacientes evaluables. La mayoría de los niños tenía DGH (78,1%), en la mayoría de los casos en la forma idiopática clásica (65,3% del total tratado con GH). La siguiente categoría más importante fue PEG (10,9%), seguida por la deficiencia de SHOX (5,8%), que incluye principalmente a niñas con el síndrome de Turner.
Diagnósticos que motivaron el tratamiento con hormona de crecimiento (GH) por talla baja en 1.267 niños tratados con GH
| Diagnóstico | n (% del total) | % con respecto al nivel superior |
|---|---|---|
| Deficiencia de GH | 989 (78,1) | |
| Idiopática | 875 (69,1) | (88,5) |
| Clásica | 827 (65,3) | (94,5) |
| Disfunción neurosecretora | 44 (3,5) | (5,0) |
| Orgánica | 114 (9,0) | (11,5) |
| Adquirida | 28 (2,2) | (24,6) |
| Tumor intracraneala | 20 (1,6) | (71,4) |
| Otro | 8 (0,6) | (28,6) |
| Congénita | 86 (6,8) | (75,4) |
| Desarrollo hipofisario anómalob | 72 (5,7) | (83,7) |
| Síndromes clínicosc | 7 (0,6) | (8,1) |
| Alteración genética | 1 (0,1) | (1,2) |
| Otras malformaciones del SNC | 3 (0,2) | (3,5) |
| Pequeño para su edad gestacional | 138 (10,9) | |
| Causa desconocida | 132 (10,4) | (95,7) |
| Causa conocidad | 5 (0,4) | (3,6) |
| Síndromes por deficiencia de SHOX | 73 (5,8) | |
| Síndrome de Turner | 52 (4,1) | (71,2) |
| Síndrome de Léri-Weill | 15 (1,2) | (20,5) |
| Otro | 6 (0,5) | (8,2) |
| Otras causas de talla baja o crecimiento lineal reducido | 29 (2,3) | |
| Alteración genética | 8 (0,6) | (27,6) |
| Otroe | 21 (1,7) | (72,4) |
| Otros defectos del eje de GH | 22 (1,7) | |
| GH bioinactiva | 20 (1,6) | (90,9) |
| Otro | 2 (0,2) | (9,1) |
| Talla baja idiopática | 12 (0,9) | |
| Displasia esquelética | 4 (0,3) |
Debido a la naturaleza observacional del estudio, no siempre se proporcionó información sobre los niveles inferiores del diagnóstico o subniveles.
Craneofaringioma (n=6), meduloblastoma (n=5), germinoma (n=3), astrocitoma (n=1), ependimoma (n=1), adenoma hipofisario (n=1), otros no especificados (n=3).
Hipófisis posterior ectópica (n=32), hipoplasia hipofisaria (n=21), aplasia hipofisaria (n=6), defecto del tallo hipofisario (n=5), displasia septo-óptica (n=5), agrandamiento hipofisario (n=1).
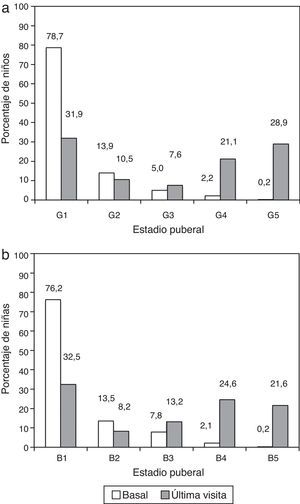
La media (IC 95%) de edad en el momento de inclusión en GeNeSIS era de 9,8 (9,7 a 10,0) años. La mayor proporción de pacientes estaba en el intervalo de edad de entre más de 10 y 15 años (45,2%), y un 38,0% en el de entre más de 5 y 10 años, con proporciones parecidas entre sexos en estos grupos de edad. Había una proporción ligeramente superior de mujeres (16,5%) que de varones (11,4%) en el grupo de edad ≤5 años, mientras que una proporción ligeramente mayor de varones (2,4%) que de mujeres (0,7%) tenían una edad >15 años. La mayoría de los pacientes eran prepúberes (estadio Tanner 1, fig. 1) al comienzo del tratamiento. En la visita final el 57,6% de los niños y el 59,3% de las niñas estaban en estadio puberal ≥3.
a) Estadio puberal de niños en la visita de inclusión y en la visita final del estudio GeNeSIS en España. b) Estadio puberal de niñas en la visita de inclusión y en la visita final del estudio GeNeSIS en España. El estadio puberal se evaluó a partir del desarrollo mamario (B) y genital (G) según la clasificación de Tanner.
La mediana de la dosis de GH en el momento de la inclusión en el estudio fue 0,22 (Q1-Q3, 0,20-0,25) mg/kg/semana; tras un año se mantuvo en 0,23 (0,21-0,25) mg/kg/semana, sin que se observasen cambios evidentes durante el tratamiento. La mediana de la dosis inicial estuvo en el mismo intervalo en todos los grupos diagnósticos, excepto en síndrome de Turner (0,32; Q1-Q3: 0,29-0,35 mg/kg/semana). La mediana (Q1-Q3) del período de seguimiento de los pacientes fue 2,4 años (1,0-4,0); 326 pacientes (25,7%) tuvieron un seguimiento superior a 4 años. El seguimiento máximo fue de 10,5 años. Debido a que el 14% de los pacientes ya recibían GH en el momento de su inclusión, la mediana (Q1-Q3) del tiempo total del tratamiento fue superior a 2,8 (1,6-4,4) años. Se notificó que 348 pacientes interrumpieron el tratamiento. Las razones documentadas, además de haber alcanzado la talla final o una talla/VC/edad ósea predefinidas, fueron: por decisión del médico en 35 pacientes, por decisión del paciente/progenitores en 32, por falta de eficacia en 15 y por acontecimientos adversos en 2 pacientes.
Efectividad en pacientes con deficiencia de hormona de crecimientoSe analizaron los datos auxológicos de 262 pacientes con DGH (167 niños y 95 niñas), que no habían recibido tratamiento con GH antes de iniciar el estudio y recibieron GH durante al menos 4 años. Sus características basales se describen en la tabla 2.
Características basales de los pacientes con deficiencia de hormona de crecimiento (GH) que no habían recibido tratamiento con GH al inicio del estudio y recibieron GH durante al menos 4 años y una cohorte con o sin tratamiento previo con GH al inicio del estudio y con información de la talla final
| Características basales | Grupo sin tratamiento previo con GH y con datos de seguimiento a 4 años N=262a | Grupo con datos de talla final y con o sin tratamiento previo con GH N=253b | ||||
|---|---|---|---|---|---|---|
| n | Media±DE | IC al 95% | n | Media±DE | IC al 95% | |
| Edad (años) | 262 | 9,8±3,1 | 9,4 a 10,2 | 253 | 11,7±2,5 | 11,4 a 12,0 |
| SDS de la talla | 262 | −2,48±0,80 | −2,58 a −2,38 | 253 | −2,43±0,67 | −2,51 a −2,35 |
| Velocidad de crecimiento (cm/año) | 201 | 4,3±1,6 | 4,1 a 4,6 | 202 | 4,4±1,6 | 4,2 a 4,7 |
| SDS de la velocidad del crecimiento | 199 | −1,26±1,52 | −1,48 a −1,05 | 199 | −0,95±1,26 | −1,13 a −0,77 |
| Peso (enkg) | 260 | 26,7±9,5 | 25,6 a 27,9 | 249 | 33, 2±10,4 | 31,9 a 34,5 |
| SDS del índice de masa corporal | 259 | −0,30±1,56 | −0,49 a −0,11 | 249 | 0,03±1,41 | −0,15 a 0,20 |
| SDS de la edad ósea | 191 | −2,55±1,21 | −2,72 a −2,37 | 197 | −2,08±1,16 | −2,25 a −1,92 |
| SDS de la talla diana | 250 | −0,97±0,73 | −1,07 a −0,88 | 241 | −1,12±0,75 | −1,22 a −1,03 |
| SDS de la talla–SDS de la talla diana | 250 | −1,51±0,96 | −1,63 a −1,39 | 241 | −1,33±0,84 | −1,43 a −1,22 |
| Pico máximo de la GH (μg/l) | 261 | 6,90c | 4,30–9,05d | 252 | 7,00c | 4,60 a 9,20d |
| Dosis de la GH (mg/kg/semana) | 255 | 0,22±0,04 | 0,21 a 0,22 | 248 | 0,21±0,04 | 0,20 a 0,21 |
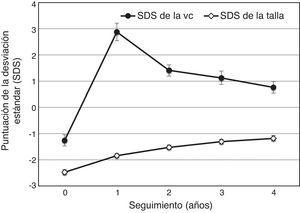
La VC aumentó de una media (IC 95%) al inicio del estudio de 4,3 (4,1 a 4,6) cm/año a 9,0 (8,7 a 9,4) al final del primer año; posteriormente fue de 5,5 (5,2 a 5,8) en el cuarto año. La SDS de la VC media (fig. 2) aumentó desde un valor por debajo de por debajo de la media poblacional al inicio del estudio (−1,3; IC 95%: −1,5 a −1,1) a otro por encima en el primer año (2,9; IC 95%: 2,6 a 3,2) manteniéndose elevada hasta el cuarto año (0,8; IC 95%: 0,5 a 1,0). La ganancia media (IC 95%) en la SDS de la talla fue de 0,64 (0,58 a 0,70) en el primer año y se mantuvo positiva hasta el cuarto año (0,15; 0,11 a 0,19) (fig. 2). La SDS de talla–SDS de talla diana aumentó con respecto al inicio del estudio (−1,51; IC 95%: −1,63 a −1,39) durante el primer año (−0,89; IC 95%: −0,99 a −0,78) y posteriormente, hasta el cuarto año (−0,21; IC 95%: −0,32 a −0,10).
Puntuaciones de desviación estándar (SDS) de la velocidad de crecimiento (VC) y de la talla de 262 pacientes españoles (167 varones, 95 mujeres) con deficiencia de hormona de crecimiento (GH) que no habían recibido nunca tratamiento con GH, al inicio del estudio y durante los 4 años de tratamiento con GH. Los datos se muestran como medias con intervalos de confianza al 95%.
Además, se evaluó el efecto del tratamiento con GH en la talla final en 253 pacientes con DGH (117 niños y 136 niñas) hubieran estado o no tratados al inicio del estudio. La tabla 2 muestra las características basales y la tabla 3 los datos de talla final. La SDS de la talla final en estos pacientes se aproximó a la de su talla diana, con un déficit medio (DE), respecto a la misma, de 0,09 (0,85).
Datos de la talla final en niños españoles con deficiencia de hormona de crecimiento (GH) (N=253), con o sin tratamiento previo con GH en el momento de la inclusión en el estudio
| Parámetro | n | Media±DE (IC 95%) |
|---|---|---|
| Edad en la que se alcanza la talla final (en años) | 253 | 16,4±1,7 (16,2 a 16,6) |
| Tiempo de tratamiento con GH (en años) | 246 | 4,3±2,1 (4,0 a 4,6) |
| Última VC antes de alcanzar la talla final (cm/año) | 243 | 2,5±1,9 (2,3 a 2,8) |
| SDS de la talla final | 253 | −1,21±0,89 (−1,31 a −1,10) |
| Ganancia en la SDS de la talla final | 253 | 1,22±0,89 (1,11 a 1,33) |
| SDS de la talla final–SDS de la talla diana | 241 | −0,09±0,85 (−0,20 a 0,02) |
El análisis de seguridad incluyó a 1.284 niños (704 varones, 573 mujeres, 7 sexo no especificado) que recibieron tratamiento con GH durante el estudio. La mediana (Q1-Q3) de la duración del tratamiento fue 2,5 (1,0-4,1) años. Entre los 1.143 pacientes que tenían más de una visita de seguimiento, se notificaron 121 AAST en 93 niños (8,1%) (tabla 4); 25 AAST en 23 niños (2,0%) fueron considerados por los investigadores como posiblemente relacionados con GH. En 7 pacientes se notificaron AAST neoplásicos específicos considerados no relacionados con el tratamiento, con la excepción de un paciente de 8,4 años tratado durante 0,3 años al que se diagnosticó nevus melanocítico que no se consideró acontecimiento grave.
Acontecimientos adversos graves registrados en la población total de los pacientes tratados con hormona de crecimiento y acontecimientos adversos surgidos durante el tratamiento
| Pacientes con acontecimientos adversos n (%) | Número de acontecimientos adversos N | |
|---|---|---|
| Población total para el análisis seguridad, N=1.284 | ||
| Pacientes con ≥1 AAG | 7 (0,5) | 9 |
| Relacionados con GH | 2 (0,2) | 2 |
| Neoplasia coroidea | 1 (0,1) | 1 |
| Epifisiolisis | 1 (0,1) | 1 |
| No relacionados con GH | 5 (0,4) | 7 |
| Apendicitis | 1 (0,1) | 1 |
| Epifisiolisis | 1 (0,1) | 1 |
| Cifoscoliosis | 1 (0,1) | 1 |
| Paraplejía | 1 (0,1) | 1 |
| Oclusión de una derivacióna | 1 (0,1) | 1 |
| Neoplasia de la médula espinal | 1 (0,1) | 1 |
| Fractura de extremidad superior | 1 (0,1) | 1 |
| Seguimiento de los pacientes tratados con GH, N=1.143 | ||
| Pacientes con ≥1 AAST | 93 (8,1) | 121 |
| Relacionados con GH | 23 (2,0) | 25 |
| Artralgia | 3 (0,3) | 3 |
| Escoliosis | 3 (0,3) | 3 |
| Ginecomastia | 2 (0,2) | 2 |
| Hipertensión intracraneal benigna | 1 (0,1) | 1 |
| Desarrollo óseo anómalo | 1 (0,1) | 1 |
| Neoplasia coroidea | 1 (0,1) | 1 |
| Epifisiolisis | 1 (0,1) | 1 |
| Fatiga | 1 (0,1) | 1 |
| Cefalea | 1 (0,1) | 1 |
| Hipoglucemia | 1 (0,1) | 1 |
| Hipotiroidismo | 1 (0,1) | 1 |
| Hematoma en el lugar de la inyección | 1 (0,1) | 1 |
| Elevación de IGF-I | 1 (0,1) | 1 |
| Deformidad de la rodilla | 1 (0,1) | 1 |
| Cifosis | 1 (0,1) | 1 |
| Lipoatrofia | 1 (0,1) | 1 |
| Nevus melanocítico | 1 (0,1) | 1 |
| Osteocondrosis | 1 (0,1) | 1 |
| Papiledema | 1 (0,1) | 1 |
| Operación vascular | 1 (0,1) | 1 |
| No relacionados con GH/relación desconocida | 70 (6,1) | 96 |
| Acontecimientos neoplásicos específicosb | 7 (0,6) | 7 |
| Nevus melanocítico (benigno) | 3 (0,3) | 3 |
| Neoplasia coroidea (benigna) | 1 (0,1) | 1 |
| Neoplasiac | 1 (0,1) | 1 |
| Papiloma cutáneo (benigno) | 1 (0,1) | 1 |
| Neoplasia de la médula espinal | 1 (0,1) | 1 |
Se incluyen además los AAST que se consideraron acontecimientos neoplásicos específicos y que se tuvieron como relacionados con el tratamiento con GH según el criterio de los investigadores.
AAG: acontecimientos adversos graves: AAST: acontecimientos adversos surgidos durante el tratamiento; GH: hormona de crecimiento.
En 7 pacientes (0,6%) se notificó al menos un AAG (tabla 4). Los investigadores consideraron que 2 estaban posiblemente relacionados con el tratamiento con GH: 1) una malformación vascular neoplásica en la capa coroidea del ojo izquierdo, que pudo ser extirpada por completo, en una niña de 13,5 años, con DGH idiopática aislada que había recibido tratamiento con GH durante 0,9 años; y 2) una epifisiólisis en un niño de 14,6 años con deficiencias de hormonas hipofisarias, incluyendo DGH, diagnosticado de hipófisis posterior ectópica.
Dos pacientes interrumpieron el tratamiento debido a acontecimientos adversos: 1) Varón de 11,9 años, con DGH secundaria a meduloblastoma, con sospecha de neoplasia de la médula espinal y oclusión de una derivación ventrículo peritoneal, que interrumpió el tratamiento con GH tras 1,6 años; ambos acontecimientos se clasificaron como graves y no relacionados con GH. 2) Varón de 16,5 años, con DGH idiopática, que suspendió el tratamiento con GH después de 3,4 años al ser diagnosticado de resistencia a la insulina que no se consideró relacionada con el tratamiento.
DiscusiónEste estudio proporciona datos a largo plazo sobre la utilización del tratamiento con GH en una amplia cohorte de niños reclutados en España en el estudio observacional GeNeSIS. Los pacientes recibieron GH para el tratamiento de talla baja debida a diferentes diagnósticos, partiendo de una talla inferior a -2 desviaciones estándar. El estudio demostró que el tratamiento fue efectivo para mejorar el déficit de talla en pacientes con DGH, de acuerdo con los resultados internacionales, sin mostrar problemas importantes de seguridad durante el seguimiento.
En el 78% de los pacientes, el diagnóstico fue DGH, a diferencia de los resultados en la población total de GeNeSIS, en el que fue del 64%. El diagnóstico de PEG, el siguiente más frecuente, apareció en el 11% de los pacientes españoles, en comparación con el 6% de la población total. La deficiencia de SHOX, incluido el síndrome de Turner, se notificó en el 6% de los pacientes, frente al 12% en la población total del estudio. Existe una gran variabilidad en los estudios sobre la prevalencia de la deficiencia de SHOX, excluido el síndrome de Turner, debido en parte a los distintos métodos para la detección y selección de los pacientes21,22; además, el uso de técnicas de diagnóstico molecular no era fácilmente accesible para los investigadores españoles en el momento del estudio. Por ello, nuestros resultados indican que la haploinsuficiencia de SHOX podría estar infradiagnosticada en España.
La edad al comienzo del tratamiento con GH estuvo entre los 10 y 15 años en el 45% de los pacientes. La media de edad de los que no habían recibido tratamiento previo con GH al inicio del seguimiento fue de 9,8 años, mayor que la comunicada en otros estudios de DGH23–25. Sin embargo, más del 75% eran prepúberes al comienzo de la terapia y más del 90% se encontraban en un estadio de Tanner ≤2. Se sabe que la eficacia de GH es mayor a edades más tempranas y en estadio prepuberal3,24–26.
En el presente análisis, la evaluación de la efectividad de GH se realizó en los pacientes con DGH, especialmente en los que nunca habían recibido tratamiento antes de su inclusión en el estudio. Durante el primer año de tratamiento, la VC media aumentó más del doble, y posteriormente se redujo, como era previsible23,24, aunque la media se mantuvo siempre por encima del valor inicial hasta el cuarto año. Los resultados de VC e incremento de talla fueron consistentes con los comunicados en otros estudios3,23–26. La SDS de la talla mostró un aumento progresivo, partiendo de una media de −2,5 antes del tratamiento y llegando a −1,2 después de 4 años. Cuando se evaluó la talla final de los pacientes con DGH tratados con GH, su SDS de talla final fue −1,21 (IC 95% −1,31 a −1,10), dentro del intervalo de talla normal poblacional. La diferencia alcanzada entre la SDS de la talla final y la SDS de la talla diana fue de −0,09, concordante con valores alcanzados en otros estudios27–29.
El número de acontecimientos adversos notificados en los pacientes durante las visitas de seguimiento fue consistente con el de otras comunicaciones. El tipo de acontecimientos adversos notificados está de acuerdo con el perfil de seguridad conocido del tratamiento con GH12,14,30. Hubo solo 2 AAG que los investigadores consideraron posiblemente relacionados con GH: una malformación vascular de la capa coroidea del ojo izquierdo que se trató quirúrgicamente y un episodio de epifisiólisis. Dos pacientes interrumpieron el tratamiento debido a AAG, uno de ellos debido a un mal funcionamiento de una derivación ventrículo-peritoneal y a una neoplasia de la médula espinal, que no se consideraron relacionados con GH; y otro paciente debido al desarrollo de resistencia a la insulina que tampoco se consideró relacionada con la terapia.
Una limitación de este estudio es su propia naturaleza observacional, con tratamiento abierto y resultados proporcionados según el criterio de los investigadores. No obstante, también indica que es representativo de la práctica clínica habitual. Debido a su diseño no intervencionista, son los propios investigadores quienes decidieron en cada caso si los pacientes cumplían los criterios para el diagnóstico de DGH y de disfunción neurosecretora de GH. Por otro lado, en España todos los casos de pacientes a los que se les prescribe GH son evaluados por comités de expertos que supervisan el cumplimiento en cada caso de los criterios diagnósticos antes de comenzar el tratamiento. En cualquier caso, al no existir una evaluación centralizada para todos los casos, pueden existir algunas diferencias en la aplicación de dichos criterios. Además, no se debe olvidar que en la actualidad sigue existiendo incertidumbre sobre el método diagnóstico óptimo para el DGH3, lo que parece más de especial interés en el DGH aislado e idiopático. Una limitación adicional fue que los datos de referencia para el cálculo de la SDS no eran los específicos de cada país. Con el fin de proporcionar coherencia entre los resultados de los pacientes de los 30 países que participaban en el programa GeNeSIS y facilitar el análisis de los resultados para toda la muestra de pacientes incluidos, los valores de referencia para los cálculos de la SDS para la talla, VC e IMC se basaron en los datos de EE. UU. y Reino Unido20,31,32. Los estudios españoles de crecimiento pueden presentar diferencias en la metodología y, en consecuencia, en resultados, respecto a los estudios internacionales, si bien la talla adulta en EE. UU. y Reino Unido es similar a la de España, por lo que no serían esperables diferencias importantes en este estudio33.
En conclusión, los resultados comunicados sobre esta muestra de pacientes de España participantes en el estudio GeNeSIS, la cohorte más amplia analizada en la última década en España, concuerdan con los de otros ensayos clínicos y registros internacionales. Aunque el patrón de diagnósticos que motivan el tratamiento con GH para talla baja puede diferir de unos países a otros, el estudio confirmó la efectividad y la seguridad de la terapia de sustitución de GH en la cohorte española. En los niños con DGH, el tratamiento con GH consiguió aumentar progresivamente la talla a lo largo de un seguimiento de 4 años y dio lugar a una talla final en la edad adulta cercana a la talla diana prevista.
FinanciaciónEli Lilly and Company financia el estudio GeNeSIS.
Conflicto de interesesCLT y MOI declaran no tener ningún conflicto de interés. ECC, LAVS y LEGP son empleados a tiempo completo en Eli Lilly and Company.
GeNeSIS es un estudio patrocinado por Eli Lilly and Company. Los autores quieren dar las gracias a todos los pacientes participantes y a sus familias, así como a todos los investigadores españoles del estudio GeNeSIS que les atendían. Los autores agradecen también al equipo del estudio por llevarlo a cabo y al Dr. Peter Bates de Cambridge Medical Writing Services (Reino Unido) por su ayuda en la preparación del manuscrito.