La transmisión vertical del virus de inmunodeficiencia humana en los países desarrollados se ha reducido drásticamente a menos del 2% en los últimos 15 años, tras la aplicación de distintas medidas profilácticas: el uso de antirretrovirales, la cesárea electiva y la lactancia artificial exclusiva. El seguimiento de estos niños sanos es la situación más común relacionada con la infección por el VIH que los pediatras no especialistas deben afrontar en la actualidad en la práctica clínica habitual en España. Estas recomendaciones, emitidas por la Sociedad Española de Infectología Pediátrica, pretenden resumir los principales aspectos de este seguimiento, incluyendo el manejo en sala de partos, el tipo de lactancia, la profilaxis antirretroviral neonatal, el diagnóstico de la infección por el VIH, las comorbilidades en la época neonatal, la toxicidad a corto y a medio plazo, las inmunizaciones y otras medidas profilácticas y el seguimiento a largo plazo.
Human immunodeficiency virus vertical transmission in developed countries has dramatically decreased to less than 2% over the last 15 years due to the consecutive implementation of different prophylactic measures, including the use of antiretrovirals, elective cesarean section and refraining from breastfeeding. The follow-up of these otherwise healthy children is, by far, the most common situation related to HIV infection that general pediatricians currently face in routine clinical care in Spain. These Recommendations issued by the Spanish Society of Pediatric Infectious Diseases attempt to summarize the main aspects of this follow-up, including birth management, type of feeding, neonatal antiretroviral prophylaxis, HIV infection diagnosis, common early comorbidities, short- and mid-term toxicities, vaccination and other prophylactic measures and long-term follow-up.
En los últimos 15 años, las terapias antirretrovirales (ARV) de gran actividad (TARGA) han aumentado la calidad y la esperanza de vida de las personas infectadas por el virus de la inmunodeficiencia humana (VIH). Asimismo, han permitido reducir la tasa de transmisión vertical (TV) del VIH hasta cifras inferiores al 1-2%. Ambos hechos han contribuido a que un número creciente de mujeres con infección por el VIH decidan cumplir su deseo de ser madres1. En España, la incidencia de nuevas infecciones por VIH en mujeres se estima en 20 casos por millón y año, la mayoría de ellas jóvenes e infectadas por transmisión sexual2. Aunque disponemos de excelentes guías de práctica clínica, nacionales3 e internacionales4–6 sobre el manejo de la gestante con infección por VIH y de su recién nacido, se trata de documentos extensos y poco prácticos para médicos no especialistas en infectología. Las recomendaciones que se presentan pretenden resumir el manejo terapéutico y el seguimiento clínico del niño expuesto al VIH (y no infectado en la mayoría de los casos) desde su nacimiento, de forma rigurosa, concisa y útil para el pediatra no experto y de acuerdo con los documentos del Plan Nacional del Sida3,7.
Antecedentes maternos y manejo en sala de partosEn la gestante infectada por el VIH, el seguimiento del embarazo y del tipo de parto que lleven a cabo conjuntamente el obstetra e el internista deberá ser exquisito y de acuerdo con las guías específicas3–6, con el fin de garantizar la salud materno-fetal y de evitar la TV del VIH. Ante un parto vaginal, se evitarán en lo posible maniobras cruentas (monitorización invasiva, microtomas de calota, instrumentalización o episiotomía) y se procurará mantener la bolsa amniótica íntegra el mayor tiempo posible. Se manipulará al recién nacido con guantes, se cortará el cordón umbilical rápidamente y se le limpiará cuidadosamente la piel antes de administrar la vitamina K por vía intramuscular. El neonatólogo deberá, además, indagar sobre algunos antecedentes relacionados con el riesgo de TV (tabla 1) y que serán de ayuda en la elección de la profilaxis neonatal, y también acerca de algunas situaciones patológicas más prevalentes en la mujer con VIH y que asocian riesgo para el recién nacido (tabla 2).
Factores de riesgo para la transmisión vertical del VIH
| En relación con el embarazo: |
| – Carga viral materna (ARN-VIH, copias/ml) elevada; mayor riesgo si persiste detectable más allá de la semana 32 de gestación |
| – Primoinfección durante el embarazo, por asociar viremias más altas la infección aguda |
| – Ausencia de TARGA materno durante el embarazo (relación inversamente proporcional: mayor tiempo de TARGA, menor riesgo) |
| – Infección por VIH sintomática, sida |
| – Inmunodepresión, recuento de linfocitos CD4<200-250/mm3 |
| – Consumo de opiáceos durante la gestación |
| – Relaciones sexuales no protegidas |
| – Coinfecciones (virus de las hepatitis B o C), infecciones agudas del grupo TORCH u otras infecciones del canal del parto |
| – Maniobras invasivas durante el embarazo (amniocentesis, biopsia corial…) |
| En relación con el parto: |
| – La cesárea electiva es un factor protector |
| – Prematuridad |
| – Rotura prematura/prolongada de membranas amnióticas (a partir de 4 horas) |
| – Procedimiento invasivos en el feto (pH de calota…), partos instrumentados |
| – Sangrado vaginal, episiotomía extensa |
| – Expulsivo prolongado (>4 horas) |
| En relación con la lactancia materna (contraindicada en nuestro medio): |
| – Lactancia mixta (mayor riesgo que la lactancia materna exclusiva) |
| – Duración superior a 6 meses |
| – Carga viral materna elevada |
| – Inmunosupresión materna |
Patologías comunes en los embarazos de gestantes con infección VIH
| Uso de otros fármacos y/o drogas de abuso durante el embarazo |
| Relaciones sexuales no protegidas |
| Coinfecciones (virus de las hepatitis B y C, tuberculosis, sífilis, malaria…) |
| Infecciones del tracto genital: herpes, otras lesiones ulcerosas, condilomas… |
| Prematuridad; retraso del crecimiento intrauterino |
| Diabetes gestacional8 |
La patología neonatal más frecuente en los recién nacidos hijos de madres infectadas por el VIH ha ido variando a lo largo de los años. Actualmente, la mayoría de las gestantes realizan un adecuado control del embarazo y no son consumidoras de drogas durante este. Sin embargo, existen algunas patologías que son más frecuentes en estos recién nacidos:
- 1.
Coinfecciones maternas susceptibles de ser transmitidas al niño durante el embarazo y/o el parto y más frecuentes entre la población femenina con infección VIH9; en la mayoría de los casos, el manejo no es distinto del realizado en la población general.
- •
Herpes simple genital. La infección por herpes en el canal genital de la mujer infectada por el VIH es más persistente y tiene mayor probabilidad de reactivarse durante el parto (hasta en el 10%).
- •
Infección por citomegalovirus. Mayores prevalencia y riesgo de TV en la gestante con VIH. Se recomienda el estudio (por reacción en cadena de la polimerasa [PCR] en sangre, saliva u orina, antígeno en orina, cultivo tradicional o shell-vial…) en el recién nacido con bajo peso para la edad gestacional o con hallazgos clínicos indicativos10,11.
- •
Sífilis. La coinfección por sífilis y VIH en la gestante aumenta el riesgo de TV de VIH.
- •
Toxoplasma. La toxoplasmosis congénita y, en especial, la coriorretinitis deben descartarse en los hijos de madres con infección aguda o reactivación de toxoplasmosis durante el embarazo.
- •
Tuberculosis. Especial atención en gestantes originarias de determinadas áreas geográficas con alta prevalencia.
- •
La infección por el virus de la hepatitis C. La coinfección materna por el VIH asocia un mayor riesgo de TV del virus de la hepatitis C.
- •
La infección por el virus de la hepatitis B, HTLV I y II, virus del papiloma humano, malaria o enfermedad de Chagas (Trypanosoma cruzi): el recién nacido puede permanecer asintomático y debe ser objeto de seguimiento.
Otras patologías relacionadas con la exposición a los ARV, el uso de drogas, la edad materna o complicaciones propias del embarazo son:
- •
- 2.
Prematuridad12. Complicación perinatal más frecuente en las gestantes que reciben TARGA, en especial si este incluye inhibidores de la proteasa.
- 3.
Restricción del crecimiento intrauterino. Más frecuente en gestantes de edad avanzada, con complicaciones obstétricas (eclampsia o pre-eclampsia, síndrome HELLP)13, toxicomanías (tabaco, alcohol, opiáceos, cannabis…) y en algunas infecciones congénitas (toxoplasmosis, citomegalovirus y el propio VIH).
- 4.
Malformaciones. No se ha descrito una mayor incidencia de malformaciones en los niños expuestos a ARV14. Solo el efavirenz se incluye en la categoría D («prueba positiva de riesgo fetal humano») de la FDA15. Se recomienda incluir de forma prospectiva y anónima a toda gestante que reciba ARV en la web del proyecto Antiretroviral Pregnancy Registry (www.apregistry.com).
- 5.
Síndrome de abstinencia. Cuando exista el antecedente de consumo de drogas y/o clínica neonatal sugestiva. Alteraciones neuroconductuales cuando la madre ha sido consumidora de cocaína durante el embarazo.
- 6.
Toxicidad asociada a la exposición a ARV (véase el texto correspondiente).
Está demostrado que el VIH se transmite a través de la lactancia materna. Por lo tanto, desde el inicio de la epidemia se estableció que en los lugares en los que fuera seguro, accesible económicamente y aceptado culturalmente se alimentara de forma exclusiva con fórmula artificial a los recién nacidos de madre con infección por el VIH16. En España, los hijos de madre con infección por el VIH no deben recibir lactancia materna; deben alimentarse con fórmula artificial de manera exclusiva3. La Sociedad Española de Infectología Pediátrica (SEIP) considera que es responsabilidad de las autoridades sanitarias proporcionar la fórmula adaptada de forma gratuita a las madres con VIH durante los primeros 12 meses de vida del lactante, como ya ocurre en algunas comunidades autónomas. A las madres que lo deseen, se les podrá facilitar el tratamiento hormonal adecuado para la inhibición de la lactancia.
Profilaxis neonatal de la transmisión vertical del virus de la inmunodeficiencia humana: fármacos y pautasEl régimen de profilaxis ARV que se debe administrar al neonato viene determinado por el riesgo de TV del VIH, que depende fundamentalmente de la carga viral materna en el momento del parto y de que la madre haya recibido TARGA durante el embarazo. Otros factores de riesgo que se deben considerar se resumen en la tabla 1.
La profilaxis neonatal debe iniciarse en las primeras 6 horas de vida y, en cualquier caso, antes de las 12 horas. En la mayoría de las ocasiones en nuestro medio, la gestante con buen control del embarazo recibe TARGA y llega al parto con viremia plasmática indetectable (<50 copias/ml) y sin otros factores de riesgo: en estos casos, la profilaxis neonatal con zidovudina (ZDV) en monoterapia es suficiente (tabla 3).
Pautas recomendadas de profilaxis neonatal con ARV
| Zidovudina en monoterapia: gestante con buen control del embarazo, que recibe TARGA, llega al parto con viremia plasmática indetectable (<50 copias/ml) y sin otros factores de riesgo |
| ZDV por vía oral (10mg/ml), en el recién nacido de >34 semanas: 4mg/kg cada 12 horas, durante 4 semanas. Por vía EV: 1,5mg/kg cada 6 horas; pasar a vía oral (a la dosis antes indicada) cuando tolere, y completar 4 semanas |
| En prematuros ≤34 semanas: 2mg/kg cada 12 horas por vía oral durante 2 semanas; después 2mg/kg cada 8 horas 2 semanas más (vía EV: 75% de la vía oral). |
| En prematuros ≤30 semanas: 2mg/kg cada 12 horas por vía oral durante las 4 semanas (vía EV: 75% de la vía oral) |
| Triple terapia: cualquier recién nacido cuya madre llegue al parto con viremia detectable (>50 copias/ml) |
| ZDV por vía oral (10mg/ml, misma pauta), más… |
| 3TC por vía oral (10mg/ml): en las primeras 12 horas de vida; 2mg/kg cada 12h durante 4 semanas, más… |
| NVP por vía oral (10mg/ml), se escogerá entre una de las dos pautas siguientes: |
| – 3 dosis de NVP (4mg/kg): la 1.ª en las primeras 48 horas de vida; la 2.ª y la 3.ª a las 48 y 96 horas de la 1.ª, respectivamente |
| – 2mg/kg al día durante 7 días, y 4mg/kg al día durante la segunda semana, y suspender. Si la madre ha recibido ≥3 dosis de NVP pre-parto: NVP a 4mg/kg al día durante 14 días, iniciándola a las 48-72 horas de vida |
| (Nota: con estas pautas, no se han notificado rash o hepatotoxicidad graves por NVP) |
| Prematuro de riesgo: prematuridad en que la madre no llegue al parto con carga viral indetectable (<50 copias/ml) o en los que coincidan otros factores de riesgo |
| ZDV por vía oral (10mg/ml, según pauta). Puede valorarse añadir en algunos casos: |
| Dosis única de NVP por vía oral a la madre si no la recibía ya (200mg, al menos 2 horas antes del parto) o al recién nacido (2mg/kg, vía oral) |
TARGA - Terapia antirretroviral de gran actividad.
ZDV - Zidovudina.
ARV - Antirretroviral.
EV - Endovenoso.
3TC - Lamivudina.
NVP - Nevirapina.
Un estudio reciente ha demostrado que la doble terapia o la triple terapia en el neonato consiguen menores tasas de TV en madres que se diagnostican tarde y que no reciben ARV antes del parto17. Aunque la eficacia de la triple terapia no ha sido demostrada en otras situaciones que asocian mayor riesgo de TV, se recomienda su uso en cualquier recién nacido cuya madre llegue al parto con viremia detectable (>50 copias/ml). La combinación con la que existe mayor experiencia en el neonato es zidovudina más lamivudina más nevirapina (NVP) (tabla 3).
En el prematuro, para quien no se dispone de datos farmacocinéticos de lamivudina, NVP u otros ARV, se utilizará preferentemente la pauta de ZDV en monoterapia. En los casos de prematuridad en que la madre no llegue al parto con carga viral indetectable (<50 copias/ml), o en los que coincidan otros factores de riesgo para la TV del VIH, puede considerarse la administración de una dosis única de NVP a la madre si no la recibía ya (200mg por vía oral, al menos 2 horas antes del parto) o al recién nacido (2mg/kg, por vía oral)6,18. Dicha dosis mantiene niveles plasmáticos de NVP en el prematuro hasta el octavo día de vida y no ha asociado problemas de toxicidad hasta la fecha.
En caso de que la madre presente fracaso virológico por mutaciones asociadas a resistencia, se iniciará la pauta de profilaxis neonatal con triple terapia, a la espera de obtener un estudio genotípico de resistencias y diseñar una terapia apropiada para el neonato, siendo necesario recurrir siempre a un experto en estos casos.
Toxicidad hematológica asociada a la exposición a antirretroviralesLas alteraciones hematológicas son muy comunes en el niño sano hijo de madre con infección por el VIH y expuesto a ARV. Aunque miles de gestantes han recibido ARV, existen escasos estudios sobre la toxicidad de estos fármacos en el feto, a excepción de la ZDV, el más ampliamente prescrito y del que se tiene una información más completa y duradera19,20. El uso de ZDV en el embarazo se asocia a anemia y neutropenia, tanto en la gestante como en el neonato. También se han descrito trombocitopenia21 y linfopenia, en todos los casos leves y sin significación clínica. Para el seguimiento de esta toxicidad, es suficiente realizar un hemograma y una bioquímica (glucosa, electrólitos, función renal y hepática; concentraciones séricas de bilirrubina si exposición a atazanavir) al nacimiento y después, junto con las extracciones necesarias para el estudio de la TV del VIH.
Aunque el origen de la anemia suele ser multifactorial, sobre todo en el prematuro, en el niño a término la exposición a ZDV es su causa principal, como se demostró con claridad en el estudio ACTG 07622. Se trata de una anemia macrocítica sin repercusión clínica, con un nadir en los valores de hemoglobina que coincide con la finalización de la profilaxis (a las 4-6 semanas de vida) y que se sitúa en torno de los 10g/dl, para normalizarse a partir de entonces y hasta el sexto mes de vida. En la literatura, se describen anemias de mayor gravedad en el prematuro o en el neonato con bajo peso al nacimiento, cuando se utiliza ZDV por vía intravenosa o con terapias combinadas, aunque raramente requieren de la interrupción del tratamiento, de transfusiones u otras terapias19.
En la Cohorte de Madrid, hasta un 42% de los pacientes presentó neutropenia, que se asoció a prematuridad, bajo peso al nacimiento y origen subsahariano19; esta no fue causa de infecciones significativas y se recuperó sin necesidad de tratamiento. Al igual que en otras series europeas23–25, la neutropenia persistió (incluso hasta los 8 años de vida) en un pequeño porcentaje de niños.
Toxicidad mitocondrial asociada a la exposición a antirretroviralesMúltiples publicaciones han relacionado en los últimos años la exposición a ARV en hijos de madre con VIH con la presencia de hiperlactacidemia y acidosis láctica como marcadores de toxicidad mitocondrial26–28. Aunque parece evidente la capacidad de los ARV —especialmente didanosina y estavudina— de deplecionar el ADN mitocondrial, persiste la duda de la verdadera repercusión clínica de este hallazgo en el lactante expuesto29. La cohorte francesa describió una incidencia del 30-40% de hiperlactacidemia asintomática persistente en el tiempo y autolimitada, con manifestaciones neurológicas asociadas potencialmente graves sщlo en el 0,5% de дщы pacientes30. Por contra, la mayoría de trabajos realizados en Estados Unidos ponen en duda esta asociación, especialmente en cuanto a дф afectación neurológica31,32. Dos estudios españoles28,33 demuestran la presencia de hiperlactacidemia asintomática en más de la mitad de estos niños, prácticamente sin afectación del neurodesarrollo asociada. Ambos trabajos difieren en cuanto a la relación causal entre la exposición a ARV y estos hallazgos analíticos. Otro estudio reciente34 relaciona la aparición de hiperlactacidemia en esta población con una depleción del complejo IV de la cadena mitocondrial.
Así pues, debemos ser cuidadosos al establecer una relación de causalidad entre el uso de ARV y la aparición de daño mitocondrial clínicamente significativo en esta población. Actualmente, no se recomienda monitorizar las concentraciones plasmáticas de lactato, debiéndose limitar su determinación a los pacientes con patología sugestiva de disfunción mitocondrial, con manifestaciones neurológicas (convulsiones, retraso psicomotor…) o sistémicas (mal estado general, náuseas, vómitos, hipertransaminasemia…). En caso de estar indicada su determinación, es muy importante realizar la extracción en reposo, evitando causas secundarias de falsa hiperlactacidemia (llanto, uso de compresores…) y determinar concomitantemente la concentración de alanina plasmática. Se considerará como hiperlactacidemia patológica un lactato >2,1mmol/l asociado a alanina >435mmol/l. Si se establece el diagnóstico de hiperlactacidemia patológica sintomática se deberá suspender la profilaxis ARV si el paciente la recibe, instaurar medidas de soporte y valorar el inicio de un tratamiento vitamínico y con coenzimas, así como la consulta a un especialista en metabolopatías.
Diagnóstico de la infección por el virus de la inmunodeficiencia humana en el lactanteDiagnosticar o descartar la infección por el VIH en el lactante expuesto son los objetivos principales del estudio del hijo de madre con VIH. El diagnóstico precoz de la infección VIH y el consiguiente inicio de la TARGA disminuyen significativamente su morbimortalidad en el lactante afectado. Asimismo, la exclusión de la infección por VIH genera gran tranquilidad en la familia.
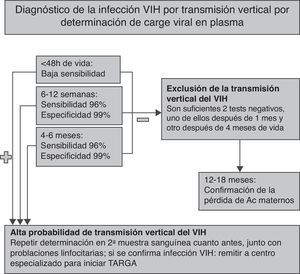
En los 2-3 primeros meses de vida, la infección por el VIH cursa, en la mayoría de los casos, sin clínica o con sintomatología inespecífica leve, por lo que el diagnóstico precoz se basa en pruebas de laboratorio. El paso transplacentario de anticuerpos específicos anti-VIH maternos y su persistencia en el niño hasta los 12-18 meses de edad obligan a emplear durante dicho periodo pruebas diagnósticas virológicas que permitan detectar directamente el genoma del VIH (por PCR) o sus proteínas. Las pruebas virológicas permiten el diagnóstico definitivo de la infección por el VIH en la mayoría de los niños en el primer mes y prácticamente en todos los niños a la edad de 6-12 semanas3–6,35.
En el recién nacido y el lactante, la prueba de detección del número de copias de ARN viral en plasma por PCR (ARN-VIH, carga viral) es el test diagnóstico de elección; la sensibilidad de esta técnica en la primera semana de vida es del 25-40%, para aumentar al 90-100% a partir de la tercera semana de vida. Los tests de detección del ADN viral (integrado en el genoma de las células mononucleares de sangre periférica) de primera generación están descatalogados en España, pues identifican peor la infección por subtipos no-B del VIH; sin embargo, algunos tests de detección de ADN viral desarrollados posteriormente han superado dicha limitación y se utilizan en algunos centros para el diagnóstico de la TV, con una sensibilidad y una especificidad equivalentes, o incluso superiores, a los tests de carga viral.
En ausencia de criterios clínicos compatibles con el diagnóstico de sida en el lactante que no ha recibido lactancia materna, la TV del VIH puede descartarse con 2 cargas virales negativas, una después del mes y otra después de los 4 meses de vida3,4. Por el contrario, cualquier viremia positiva debe confirmarse cuanto antes en una segunda extracción. Una carga viral positiva en la primera semana de vida indica infección intraútero, mientras que un resultado positivo ulterior (con un resultado negativo al nacer) es compatible con una infección intraparto35. En el lactante no infectado, se recomienda comprobar la pérdida de los anticuerpos VIH maternos (serorreversión), que suele ocurrir entre los 12 y los 18 meses de vida. El algoritmo para confirmar o descartar la TV del VIH, así como la edad a la que se recomienda la realización de las pruebas analíticas, se resumen en la figura 1.
Algunas situaciones especiales se resumen en los párrafos siguientes:
- –
En el recién nacido que recibe profilaxis ARV combinada (≥2 fármacos), se desconoce la sensibilidad de la carga viral para el diagnóstico de la infección por el VIH, por lo que podría estar justificada alguna determinación de genoma viral adicional, generalmente a las 2-3 semanas de vida, lo que puede ocurrir también en otros casos que generen duda (madre con control del embarazo insuficientemente documentado, madre infectada por virus con mutaciones de resistencia, etc.).
- –
Habitualmente, en el lactante infectado por TV y en ausencia de TARGA, las cifras de carga viral en plasma se sitúan por encima de 100.000 copias/ml. La especificidad de la carga viral para el diagnóstico disminuye para niveles bajos de viremia; en estos casos, se recomienda repetirla cuanto antes para confirmar o descartar un resultado positivo.
- –
En España, el subtipo predominante de VIH es el B. Ante madres provenientes de zonas geográficas donde predominan otros subtipos del VIH (C en África e India; E en el sudeste asiático), se aconseja utilizar técnicas de carga viral con buena sensibilidad para estos subtipos. Excepcionalmente, puede ser necesario recurrir a laboratorios de referencia o al estudio simultáneo de muestras maternas y del niño; en estos casos, se recomienda consultar con un experto y un seguimiento estrecho.
En la madre que se diagnostica de infección por el VIH en el posparto deberá interrumpirse de forma inmediata la lactancia materna si procede y estudiar la posible infección del lactante mediante una determinación de carga viral. Si esta fuera negativa, debería repetirse a las 4-6 semanas de la primera, a los 3 y a los 6 meses4. Es recomendable también comprobar la serorreversión a los 12-18 meses de vida (aunque si la primoinfección materna ha ocurrido al final del embarazo o en el posparto, es posible que el lactante sea seronegativo ya en la primera determinación). Cualquier carga viral positiva obliga a ratificarla en una segunda muestra de forma inmediata. El uso de profilaxis con ARV está solo justificado si el recién nacido tiene menos de 72 horas de vida y/o ha recibido lactancia materna. Aunque no hay evidencia científica al respecto, la mayoría de los expertos recomiendan utilizar triple terapia durante un mes (tabla 3) en esta situación.
Seguimiento durante el primer año de vida- –
Quimioprofilaxis primaria de la infección por Pneumocystis jirovecii. El lactante expuesto al VIH en quién el estudio por PCR no permita descartar de forma razonable la TV del virus (situación excepcional hoy en día) recibirá trimetropima y sulfametoxazol (150mg por m2 de superficie corporal y día de trimetoprima, en 1-2 dosis), diaria o 3 días a la semana (consecutivos o alternos), a partir de las 6 semanas de vida, tras completar la profilaxis ARV10. Deberá mantenerse este tratamiento hasta descartar la infección por VIH.
- –
Pauta vacunal. El lactante sano expuesto al VIH tiene, al nacimiento, niveles más bajos de anticuerpos específicos (a Haemophilus influenzae tipo B, tos ferina, neumococo y tétanos) transferidos por vía transplacentaria36. Además, presenta mayor vulnerabilidad a las infecciones comunes al convivir con personas con riesgo de inmunodepresión y, en ocasiones, en situaciones socioeconómicas precarias. La respuesta vacunal de estos pacientes es igual que en la población general y el calendario a aplicar es el mismo, aunque debe hacerse de forma rigurosa. Las vacunas con virus atenuados no están contraindicadas, incluida la vacuna antirrotavirus. En las comunidades en que esté incluida en el calendario vacunal, la BCG debe posponerse hasta haber descartado la TV del VIH37. Se recomienda la vacunación antigripal anual a partir de los 6 meses de edad, para evitar la gripe en el conviviente inmunodeprimido38.
- –
Otras pruebas complementarias. Dada la escasa morbilidad asociada a la exposición a ARV en esta población (teratogenia o toxicidad) identificada hasta la fecha, no se justifica la práctica rutinaria de otros estudios (ecografía u otras pruebas de imagen, valoración por especialistas…) en ausencia de signos o síntomas durante el primer año de vida.
El beneficio obtenido en la prevención de la TV del VIH compensa sobradamente la toxicidad que, hasta la fecha, se ha asociado a la exposición a ARV en el corto y medio plazo. Sin embargo, los efectos adversos observados en el adulto infectado por VIH, la potencial toxicidad a largo plazo en el niño sano expuesto y la aparición continua de nuevos fármacos y familias de ARV hacen que sea recomendable arbitrar un mecanismo que permita la identificación y el registro de los potenciales efectos adversos a largo plazo de dicha exposición en estos pacientes. En opinión de la SEIP, sería deseable la creación de una base de datos anónima, de ámbito nacional y con el apoyo de las autoridades sanitarias con este fin; sería imprescindible la obtención del consentimiento informado de los tutores legales del niño (y del propio paciente más adelante) previa a la inclusión en ella. Esta reflexión contrasta con la realidad asistencial en España: algunos centros especializados limitan el seguimiento de estos pacientes al momento de la serorreversión; otros realizan una visita anual hasta los 5 años, y otros siguen a los niños a lo largo de toda la edad pediátrica.
Algunos aspectos de la salud a largo plazo de estos pacientes han sido estudiados sin que se hayan identificado, hasta la fecha, diferencias significativas respecto del resto de la población:
- •
Crecimiento somático: los ARV pueden tener cierto impacto negativo en el crecimiento intrauterino, generalmente leve; estos niños recuperan un peso y talla normal, ya a los 6 y 18 meses39,40, y lo mantienen en la edad escolar41.
- •
Desarrollo neuropsicológico: el cerebro en desarrollo es especialmente sensible al daño mitocondrial, por lo que este aspecto es especialmente preocupante. En cualquier caso, existen 2 estudios que describen resultados normales en los estudios neuropsicológicos en edades tempranas, hasta los 3 años42,43.
- •
Carcinogénesis: no se ha descrito hasta la fecha una mayor incidencia de cáncer en estos niños44. Sin embargo, un estudio reciente de la cohorte francesa describe un número de casos mayor al esperado de neoplasias del sistema nervioso central con histologías infrecuentes45.
- •
Hematopoyesis: se han descrito niveles más bajos de neutrófilos y linfocitos en escolares sanos expuestos a ARV46, sin significación clínica.
Otros aspectos de los que no se dispone de datos específicos en el seguimiento a largo plazo son las funciones hepática, renal o cardiaca, la potencial toxicidad ósea o el desarrollo sexual y la fertilidad una vez estos niños sanos alcancen la edad adulta.
ConclusionesLa reducción de la TV del VIH a cifras por debajo del 1% es un objetivo alcanzable actualmente en nuestro medio mediante un trabajo riguroso y multidisciplinar (internistas, obstetras, matronas y pediatras); un pequeño error en algún eslabón de la cadena puede significar un nuevo caso de infección por VIH. Es necesario un diagnóstico precoz de la infección por VIH en todas las gestantes, que permita la instauración de un TARGA adecuado, un seguimiento escrupuloso del embarazo y la elección cuidadosa e individualizada del tipo de parto. En el recién nacido, deberá evitarse la lactancia materna e iniciar precozmente la profilaxis ARV indicada en cada caso. En la mayoría de los casos, la TV del VIH se puede descartar de forma razonable a las 6 semanas de vida, y de forma definitiva a partir de los 4 meses. El seguimiento a medio y largo plazo de estos niños sanos permitirá detectar y tratar cualquier potencial toxicidad, así como identificar los ARV que asocian menos efectos adversos en la gestante con infección VIH y su recién nacido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Miembros del Grupo de trabajo sobre infección por VIH en el niño de la Sociedad Española de Infectología Pediátrica (SEIP): Marisa Navarro, coordinadora, Unidad de Enfermedades Infecciosas de Pediatría, Hospital Gregorio Marañón, Madrid; José Antonio Couceiro Gianzo, Servicio de Pediatría, Complejo Hospitalario de Pontevedra, Pontevedra; María Isabel de José, Servicio de Enfermedades Infecciosas Pediátricas, Hospital Universitario La Paz; Clàudia Fortuny, Unitat d¿Infectologia, Servei de Pediatria del Hospital Sant Joan de Déu, Universitat de Barcelona, Barcelona; Raúl González, asesor regional para PTMI y atención y tratamiento del VIH pediátrico. OMS, Oficina Regional para las Américas, Washington DC, Estados Unidos; María Isabel González-Tomé, Servicio de Pediatría, Unidad de Inmunodeficiencias, Hospital Doce de Octubre, Madrid; María José Mellado, Servicio de Pediatría, Hospital Carlos III, Madrid; David Moreno-Pérez, Unidad de Infectología e Inmunodeficiencias, Servicio de Pediatría, Hospital Carlos Haya, Málaga, Facultad de Medicina, Universidad de Málaga; Antoni Mur, Servei de Pediatria, Hospital del Mar, Universitat Autònoma de Barcelona, Barcelona; Antoni Noguera-Julian, Unitat d¿Infectologia, Servei de Pediatria, Hospital Sant Joan de Déu, Universitat de Barcelona, Barcelona; José Tomás Ramos, Servicio de Pediatría, Hospital de Getafe, Madrid; Pablo Rojo, Servicio de Pediatría, Unidad de Inmunodeficiencias, Hospital Doce de Octubre, Madrid; Jesús Saavedra, Hospital Gregorio Marañón, Madrid; Pere Soler-Palacín, Unitat de Patologia Infecciosa i Immunodeficiències de Pediatria, Hospital Universitari Vall d¿Hebron, Universitat Autònoma de Barcelona, Barcelona. Autores invitados: Juncal Echeverría, Hospital Donostia, San Sebastián y Andrea Martín-Nalda, Unitat de Patologia Infecciosa i Immunodeficiències de Pediatria, Hospital Universitari Vall d¿Hebron, Universitat Autònoma de Barcelona, Barcelona.
El listado de los miembros del Grupo de trabajo sobre infección por VIH en el niño de la Sociedad Española de Infectología Pediátrica (SEIP) y el resto de los autores se presentan en el anexo 1.