La hiperbilirrubinemia representa la causa más común de reingreso hospitalario en la primera semana de vida. Su detección continúa siendo un desafío, debido especialmente al alta precoz que puede asociarse con un retraso en el diagnóstico.
La identificación de los niños con riesgo de desarrollar hiperbilirrubinemia significativa es una de las principales prioridades de la sanidad pública.
En este documento, se presenta un enfoque para el manejo de la ictericia del recién nacido, según recomendaciones basadas en la evidencia médica y en la opinión del Comité de Estándares de la Sociedad Española de Neonatología.
Hyperbilirubinaemia is one of the most frequent causes of hospital readmission during the first week of life. Its detection is still a big challenge, mainly due to the early discharge from the hospital that can be associated with a delay of the diagnosis.
The identification of those newborns at risk of developing significant hyperbilirubinaemia is one of the main priorities in the public health care system.
An approach to the management of newborn jaundice is presented in this article, following the recommendations based on the medical evidence and on the opinion of the Standards Committee of the Spanish Society of Neonatology.
La hiperbilirrubinemia es una situación clínica común y generalmente benigna en el recién nacido (RN) a término y en el prematuro (PT) tardío1. Representa la causa más común de reingreso hospitalario en la primera semana de vida2. El alta precoz de un RN sano, particularmente aquellos con lactancia materna (LM) no totalmente establecida, puede asociarse con un retraso en su diagnóstico3. En determinadas circunstancias (déficit de glucosa-6-fosfato deshidrogenasa [G6PD], sepsis, etc.) una situación de hiperbilirrubinemia grave y aguda puede ocurrir, y producir daño cerebral a pesar de una apropiada intervención4.
Buena parte del manejo de la ictericia neonatal está basado en niveles de evidencia bajos5,6. En esta revisión se presenta un enfoque para su manejo, según recomendaciones basadas en la evidencia1,7-9.
MétodoSe realizó una búsqueda bibliográfica en la base de datos PubMed (Mesh) de las palabras clave: ictericia, hiperbilirrubinemia, recién nacido, prematuro tardío, guías.
Para graduar la calidad de la evidencia se ha seguido la clasificación adoptada por el Center of Evidence-Based Medicine (http://www.cebm.net) (tabla 1) y la fuerza de la recomendación se realiza con base en las recomendaciones de la Canadian Task Force on Preventive Health Care10 (tabla 2).
Niveles de evidencia
| Nivel | Fuente de la evidencia |
|---|---|
| 1a | Revisión sistemática (RS) con homogeneidad de estudios controlados aleatorizados (ECA) |
| 1b | ECA individual (con estrecho intervalo de confianza) |
| 2a | RS (con homogeneidad) de estudios cohortes |
| 2b | Estudio de cohortes individual (o ECA de menor calidad) |
| 3a | RS (con homogeneidad) de estudios caso-control |
| 3b | Estudio individual caso-control |
| 4 | Serie de casos (o estudios de caso-control o de cohorte de menor calidad) |
| 5 | Opinión de expertos sin valoración crítica explícita, o basados en tisiología, investigación de laboratorio «primeros principios» |
Fuente: Oxford Centre for Evidence-Based Medicine.
Grados de recomendación para las intervenciones específicas de prevención
| A. Existe buena evidencia para recomendar la intervención clínica de prevención |
| B. Existe moderada evidencia para recomendar la intervención clínica de prevención |
| C. La evidencia disponible es conflictiva y no permite hacer recomendaciones a favor o en contra de la intervención clínica preventiva, sin embargo, otros factores podrían influir en la decisión |
| D. Existe moderada evidencia para recomendar en contra de la intervención clínica de prevención |
| E. Existe buena evidencia para recomendar en contra de la intervención clínica de prevención |
| I. Existe evidencia insuficiente para hacer una recomendación; sin embargo, otros factores podrían influir en la decisión |
Fuente: «New grades for recommendations from the Canadian Task Force on Preventive Health Care»10.
Los niños amamantados tienen mayor riesgo de desarrollar hiperbilirrubinemia que los alimentados con fórmula artificial. Sin embargo, los riesgos conocidos de desarrollar una encefalopatía aguda por bilirrubina son muy pequeños cuando se sopesan con los beneficios de la LM. El primer abordaje para mitigar la hiperbilirrubinemia asociada a la LM es asegurar que esta se realice satisfactoriamente. Un aporte calórico pobre y/o deshidratación asociada a una lactancia inadecuada puede contribuir al desarrollo de hiperbilirrubinemia por aumento de la circulación enterohepática de bilirrubina11,12.
Recomendaciones- •
Se debe aconsejar a las madres que amamanten a sus RN al menos 8-12 veces al día durante los primeros días7,13 (recomendación I).
- •
Debe ser establecido un programa de apoyo a la lactancia en toda institución sanitaria con nacimientos, que debe ser continuado en atención primaria (nivel de evidencia 5, recomendación I).
- •
Los RN que pierden más del 10% de su peso natal deberían ser evaluados por un profesional entrenado en lactancia (nivel de evidencia 5, recomendación I)1.
- •
No se recomienda suplementar rutinariamente con agua o suero glucosado a los RN con LM no deshidratados1,7 (recomendación D).
La estimación visual de los niveles de bilirrubina por el grado de ictericia puede conducir a errores, particularmente en niños de pigmentación oscura7,14. Como alternativa a la determinación de la bilirrubina sérica, la medición de bilirrubina transcutánea (BTc) es no invasiva, y proporciona información instantánea y de calidad superior a la evaluación clínica, siendo útil como cribado7,12. La BTc es una medida del color amarillento de la piel blanqueada, y aunque proporciona una buena estimación del nivel de bilirrubina total sérica (BTS), no la sustituye4. Dado que la fototerapia (FT) blanquea la piel, la BTc no es fiable durante el tratamiento con FT ni en las primeras horas tras su retirada7. Otras limitaciones de los bilirrubinómetros transcutáneos son que no se deben usar en las primeras 24h de vida, y su uso debe ser cauteloso en edad gestacional (EG) <35 semanas1,8.
La mayoría de los estudios han indicado que la BTc tiende a infraestimar la BTS, particularmente para niveles de BTS más elevados. Así, está recomendado medir la BTS4,12:
- •
Si el valor de BTc es ≥70% del valor límite de BTS recomendado para el uso de FT15.
- •
Si el valor de BTc es >14,6mg/dl o está a menos de 3mg/dl de un valor indicativo de tratamiento7,16.
- •
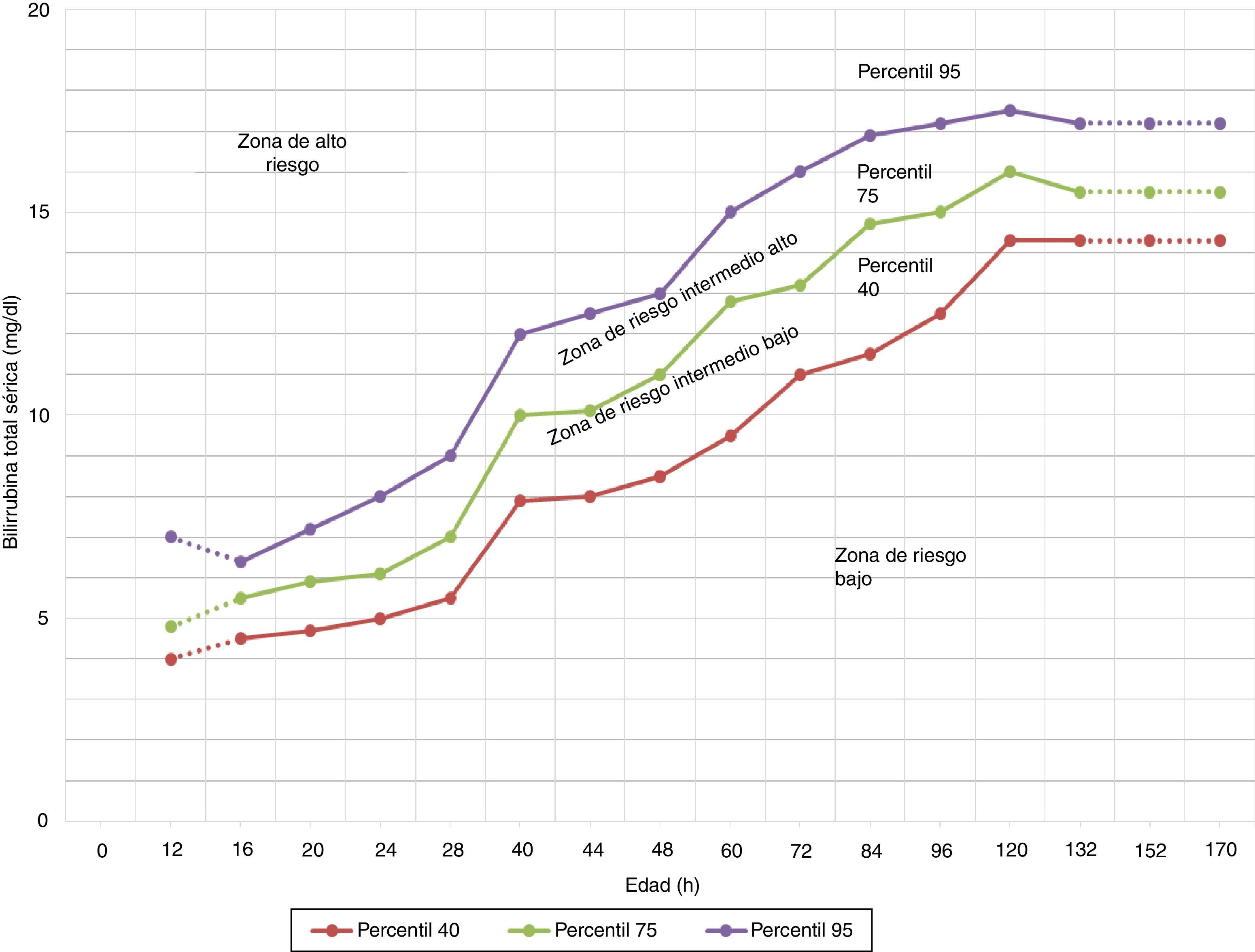
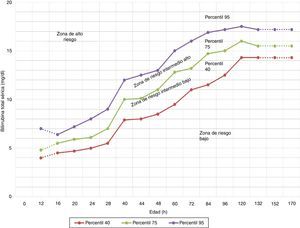
Si el nivel transcutáneo está por encima de la línea de riesgo intermedio-alto del nomograma de Bhutani et al.17 (fig. 1).
Figura 1.Nomograma de Bhutani et al. para designación del riesgo entre 2.840 recién nacidos (RN) sanos con ≥36 semanas de gestación y peso natal ≥2.000g, o con ≥35 semanas de gestación y peso natal ≥2.500g, basado en los valores de bilirrubina séricos específicos por hora. El nivel de bilirrubina sérico era obtenido antes del alta, y la zona en la que caía el valor predecía la probabilidad de que un nivel de bilirrubina posterior superase el percentil 95.
Fuente: modificado de Academia Americana de Pediatría7.
- •
Si durante el seguimiento después del alta, el valor de BTc es >13mg/dl18.
- •
Las maternidades deberían tener establecidos protocolos para la evaluación clínica (visual) de la ictericia. Esta debería ser evaluada cuando se midan los signos vitales del RN (al menos cada 8-12h en las primeras 24h) y después, como mínimo, 24 a 48h más tarde7 (recomendación I).
- •
La capacidad de los profesionales sanitarios para predecir los niveles de bilirrubina, basándose en la progresión cefalocaudal de la ictericia, es limitada (nivel de evidencia 1b)14,19. En cada RN ictérico se debe realizar una medición de bilirrubina, y la BTc puede ser usada como primer paso9.
- •
Es necesario realizar una determinación de BTS ante un valor elevado de BTc, antes de tomar una decisión terapéutica, y en todas las mediciones posteriores una vez iniciada la FT (nivel de evidencia 1b, recomendación A)4,9.
- •
Valores de BTc superiores a 14,6mg/dl son imprecisos y deben ser comprobados con la BTS8,16.
- •
En la indicación de FT o exanguinotransfusión (ET), no se debe restar la bilirrubina directa de la total7 (recomendación I).
- •
La concentración de BTS puede ser estimada con una muestra sanguínea venosa o capilar1 (recomendación I). En un estudio los niveles capilares eran más altos, pero en otro eran más bajos que los venosos20,21. No está recomendado la obtención de una muestra venosa para confirmar un nivel capilar1,7.
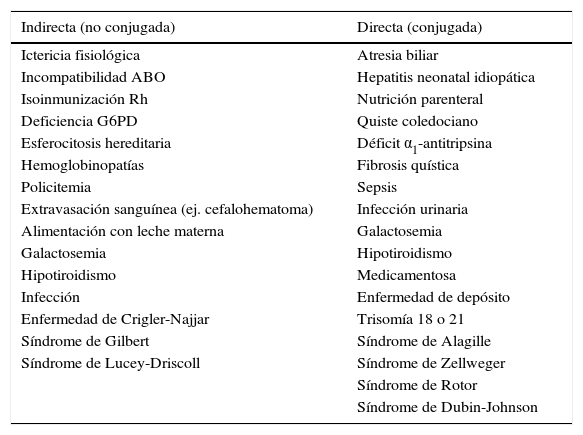
La ictericia neonatal precoz es generalmente debida a hiperbilirrubinemia no conjugada (tabla 3). La existencia de hiperbilirrubinemia significativa (aquella subsidiaria de tratamiento según las recomendaciones actuales) o prolongada obliga a investigar su etiología1.
Causas de hiperbilirrubinemia neonatal
| Indirecta (no conjugada) | Directa (conjugada) |
|---|---|
| Ictericia fisiológica | Atresia biliar |
| Incompatibilidad ABO | Hepatitis neonatal idiopática |
| Isoinmunización Rh | Nutrición parenteral |
| Deficiencia G6PD | Quiste coledociano |
| Esferocitosis hereditaria | Déficit α1-antitripsina |
| Hemoglobinopatías | Fibrosis quística |
| Policitemia | Sepsis |
| Extravasación sanguínea (ej. cefalohematoma) | Infección urinaria |
| Alimentación con leche materna | Galactosemia |
| Galactosemia | Hipotiroidismo |
| Hipotiroidismo | Medicamentosa |
| Infección | Enfermedad de depósito |
| Enfermedad de Crigler-Najjar | Trisomía 18 o 21 |
| Síndrome de Gilbert | Síndrome de Alagille |
| Síndrome de Lucey-Driscoll | Síndrome de Zellweger |
| Síndrome de Rotor | |
| Síndrome de Dubin-Johnson |
- •
Investigar la causa de ictericia cuando el RN requiera FT intensiva por hiperbilirrubinemia significativa1 (recomendación I).
- •
En toda mujer embarazada se debe realizar estudio de su grupo sanguíneo (ABO y Rh) (recomendación D) con cribado sérico para anticuerpos isoinmunes inusuales (recomendación B).
- •
Si una madre no tiene determinado prenatalmente el grupo sanguíneo, o es Rh negativo, está recomendado el tipaje sanguíneo del RN y test de Coombs directo en la sangre de cordón (recomendación B).
- •
Si la sangre materna es grupo 0, Rh positivo, es opcional evaluar la sangre de cordón, pero no siempre será necesario si hay una adecuada vigilancia7 (recomendación I).
- •
La evaluación de grupo sanguíneo y Coombs directo debería ser realizada en niños con ictericia precoz o en la zona de riesgo intermedio-alto (ver nomograma de Bhutani et al., fig. 1) de madres con grupo sanguíneo 0 (recomendación B)1.
- •
Los niños con deficiencia de G6PD tienen una elevada incidencia de hiperbilirrubinemia grave (nivel de evidencia 1b). Se recomienda medir el nivel de G6PD en todo niño ictérico que esté recibiendo FT y cuya historia familiar u origen étnico muestre la posibilidad de esta deficiencia, o también en todo niño con respuesta pobre a la FT1,7 (nivel de evidencia 5, recomendación I).
- •
Se debe realizar medición de bilirrubina directa en los niños que tengan ictericia con 3 o más semanas para identificar colestasis. Comprobar en ellos el resultado del cribado tiroideo y de galactosemia (recomendación I).
- •
Realizar sedimento de orina y urocultivo a los niños con aumento de bilirrubina directa22, y evaluación adicional de laboratorio para descartar sepsis en los casos indicados7 (recomendación I).
- •
Si el nivel de bilirrubina directa está aumentado (>1,5mg/dl o >20% de BTS), se recomienda una evaluación de las causas de colestasis7,8,23 (recomendación I).
En todo RN con ictericia en las primeras 24h de vida se debe medir la BTS en un plazo máximo de 2h. En el caso de no alcanzar el umbral para tratamiento, se recomienda continuar midiendo el nivel de bilirrubina cada 6h, hasta que el nivel esté por debajo de dicho umbral de forma estable o en descenso.
A partir de las 24h de vida, si se constata ictericia en un RN, se debe medir la bilirrubina (BST o BTc) lo antes posible (máximo en 6h). Si no existe indicación de FT, se propone el siguiente esquema de monitorización8:
- a.
RN con EG ≥38 semanas, clínicamente bien y con un nivel de bilirrubina por debajo del umbral para FT pero dentro de 3mg/dl de dicho umbral: repetir la medición de bilirrubina al cabo de 18h para RN con factores de riesgo para hiperbilirrubinemia y al cabo de 24h si no existen factores de riesgo.
- b.
RN con EG ≥38 semanas, clínicamente bien y con un nivel de bilirrubina por debajo del umbral para FT con más de 3mg/dl de diferencia: no repetir de forma rutinaria la medición de bilirrubina.
- •
En todo RN con ictericia en las primeras 24h de vida, realizar medición de BTS (recomendación I).
- •
Solicitar medida de bilirrubina si la ictericia parece excesiva para la edad del niño (recomendación I).
- •
Todo nivel de bilirrubina debe ser interpretado de acuerdo con la edad del niño en horas1,7,24 (recomendación I).
La combinación de una BTS (interpretada de acuerdo con la edad del niño en horas y extraída antes de las 48h de edad) con la EG mejora la predicción de una concentración de BTS posterior ≥20mg/dl (nivel de evidencia 2b)25.
La guía de la American Academy of Pediactrics (AAP) y la guía del National Institute for Health and Care Excellence (NICE) concluyen que la combinación de una medición precoz de bilirrubina con la evaluación de los factores de riesgo clínico constituye un fuerte predictor para hiperbilirrubinemia, a pesar de la falta de evidencia de que esta estrategia reduzca kernicterus5.
Existe controversia respecto a la necesidad de medir de forma universal la bilirrubina en RN que no estén visiblemente ictéricos, pero la introducción de un cribado universal de bilirrubina pre-alta puede aumentar los costes, y la calidad de la evidencia para su recomendación es limitada (no existe evidencia de que disminuya la incidencia de kernicterus)4.
La identificación precoz de los niños con riesgo de desarrollar hiperbilirrubinemia significativa tiene una importancia clave en su prevención. La guía NICE encuentra evidencia en 4 factores de riesgo8:
- a.
EG <38 semanas.
- b.
Hermano previo con ictericia que requirió FT.
- c.
LM exclusiva.
- d.
Ictericia en las primeras 24h de vida.
En ausencia de enfermedad hemolítica, la EG del RN es el factor de riesgo clínico individual más importante26.
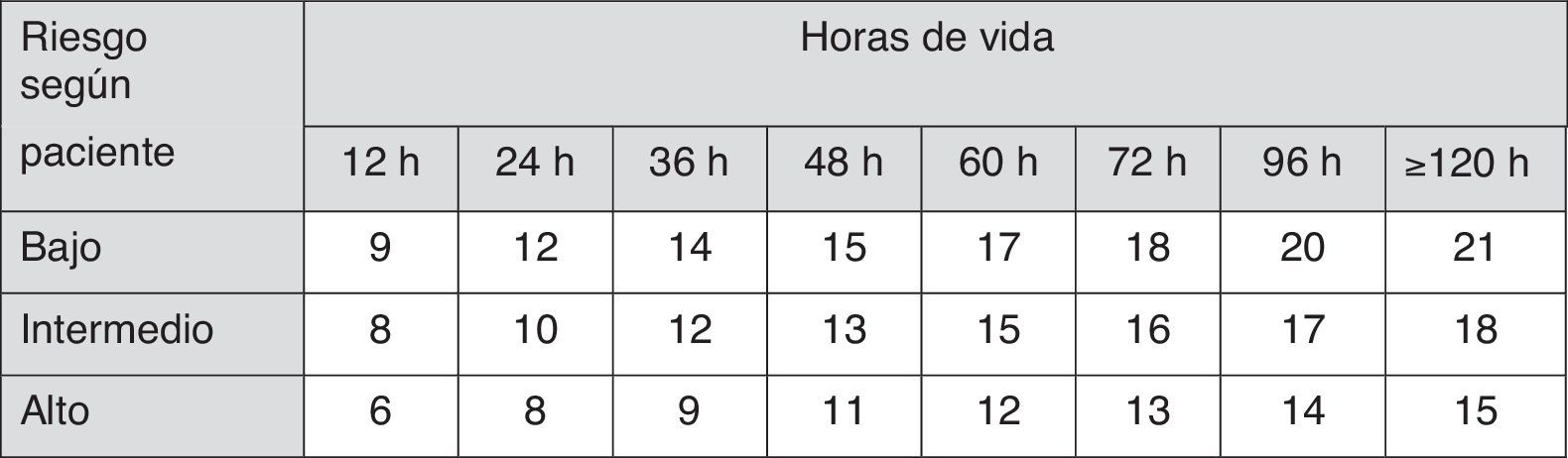
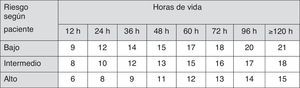
La AAP establece también factores de riesgo para neurotoxicidad por hiperbilirrubinemia4, que son usados en la toma de decisiones terapéuticas (fig. 2).
Indicaciones de FT en RN de 35 o más semanas de gestación. Estas indicaciones están basadas en evidencia limitada y los valores reflejados son aproximaciones. Se debería usar FT intensiva cuando la concentración de BTS exceda el valor indicado en la casilla correspondiente (valores expresados en mg/dl). Pacientes de bajo riesgo: EG ≥38 semanas y sin patología asociada. Pacientes de riesgo intermedio: EG ≥38+factores de riesgo de neurotoxicidad o 35-37+6 sin patología asociada. Pacientes de riesgo alto: 35-37+6 con factores de riesgo de neurotoxicidad. Factores de riesgo de neurotoxicidad: enfermedad hemolítica isoinmune, deficiencia de G6PD, asfixia, letargia significativa, inestabilidad térmica, sepsis, acidosis o albúmina <3g/dl.
BTS: bilirrubina total sérica; EG: edad gestacional; FT: fototerapia intensiva; G6PD: glucosa-6-fosfato deshidrogenasa; RN: recién nacido.
Fuente: modificado de Academia Americana de Pediatría7.
El nomograma de Bhutani et al. (fig. 1) ha sido ampliamente usado para predecir qué niños están o no en riesgo de hiperbilirrubinemia12. Sin embargo, en algunos estudios se ha demostrado que algunos niños con BTc pre-alta en la zona de bajo riesgo o riesgo intermedio-bajo pueden alcanzar un nivel de BTS que requiera FT27.
Recomendaciones- •
Se debe llevar a cabo, en todo RN, una evaluación del riesgo de desarrollar hiperbilirrubinemia antes del alta. Esta evaluación es particularmente importante en los niños dados de alta antes de las 72h de vida7 (recomendación I).
- •
Todos los hospitales deben proporcionar información verbal y escrita a los padres en el momento del alta, que incluya una explicación de la ictericia y cómo debe ser monitorizada7 (recomendación I).
- •
Todos los RN deben ser examinados por un profesional sanitario en los primeros días tras el alta para evaluar su bienestar y la presencia de ictericia. El momento y localización de la evaluación será determinado por la duración de la estancia en la maternidad y la existencia de factores de riesgo para hiperbilirrubinemia7 (recomendación I).
- •
Todo RN dado de alta antes de las 24h de edad debería ser revisado en las siguientes 24h (recomendación I).
- •
Si la concentración de BTS pre-alta no requiere intervención inmediata, se debe registrar su valor, el momento en que es obtenida, y la zona de riesgo, proporcionando una copia a los padres. El seguimiento debe ser individualizado en función de la evaluación del riesgo (recomendación I).
- •
Una concentración de BTS consistente con riesgo elevado debería conducir a una mayor vigilancia, con seguimiento en las siguientes 24 a 48h y un bajo umbral para realizar control de BTS o BTc1 (recomendación I).
- •
Para algunos RN dados de alta antes de las 48h, pueden ser necesarias 2 visitas de seguimiento, la primera entre las 24 y 72h, y la segunda entre las 72 y 120h (recomendación I).
- •
Si no se puede garantizar un adecuado seguimiento en presencia de riesgo elevado, puede ser necesario retrasar el alta hasta que este pueda ser asegurado o haya pasado el período de mayor riesgo (72-96h) (recomendación I).
- •
En el caso de isoinmunización, estos pacientes tienen riesgo de anemia severa tardía. Se recomienda control de hemoglobina después de 2 semanas si esta era baja al alta y a las 4 semanas si era normal (nivel de evidencia 5, recomendación I)1.
Disminuye la progresión a hiperbilirrubinemia grave en RN con hiperbilirrubinemia moderada (nivel evidencia 1a)1.
FT convencional: un grupo único de luces fluorescentes. Es menos eficaz (la intensidad está reducida)1. Los niveles de irradiación mínima recomendados son 8-12uW/cm2/nm28.
FT intensiva: implica el uso de altos niveles de radiación en la banda de 430 a 490nm (generalmente 30uW/cm2/nm o mayor) aplicada a la mayor área de superficie. Las fuentes de luz más efectivas para FT intensiva son aquellas que usan tubos fluorescentes especiales azules de alta intensidad, o un diodo luminoso especialmente diseñado (fototerapia LED)29,30. También se puede obtener FT intensiva usando 2 unidades de FT convencional o disminuyendo la distancia hasta 10cm de altura con respecto al RN, excepto con las lámparas halógenas que no pueden ser posicionadas más cerca de lo recomendado por el fabricante. Se recomienda FT intensiva para todos los niños con hiperbilirrubinemia significativa, o con riesgo muy elevado de desarrollarla1.
Un diodo luminoso de alta intensidad (super LED) ha mostrado proporcionar FT intensiva más eficaz que los tubos fluorescentes especiales azules, siendo un tratamiento de rescate seguro para la hiperbilirrubinemia grave31.
Las guías actuales de la AAP para la indicación de FT intensiva en RN de 35 o más semanas (fig. 2)4,7 han sido ampliamente adoptadas en muchos países.
La concentración de bilirrubina sérica debería ser evaluada en 2 a 6h del inicio de la FT1. Cuando los niveles de bilirrubina estén estables o en descenso, las mediciones se deben repetir cada 6-12h8.
Alimentación durante la FT: la alimentación enteral debe ser continuada. La interrupción de la LM y/o la suplementación con líquidos orales, como parte del tratamiento de la hiperbilirrubinemia, están asociados con una menor duración de la lactancia (nivel de evidencia 2b)32,33; además, el mantenimiento de dicha lactancia con la FT no está asociado con resultados adversos34. Cuando se precise FT intensiva, esta no se debe interrumpir para la alimentación; se debe continuar administrando alimentación enteral, siendo la leche materna extraída el alimento de elección, apoyando la lactancia para que pueda reiniciarse cuando termine el tratamiento8.
Recomendaciones- •
La FT convencional es una opción si la concentración de BTS es de 2 a 3mg/dl más baja que el umbral de indicación de FT intensiva1 (recomendación I).
- •
Existe la opción de usar manta de fibra óptica aunque sea menos efectiva que la FT convencional y requiera tratamiento más prolongado (nivel evidencia 1a)35. Su ventaja es que permite que el RN sea amamantado sin interrumpir la FT y que no se requieren parches oculares1.
- •
Se debe suspender la FT una vez que los niveles de bilirrubina estén por debajo del valor umbral para tratamiento en 2 medidas separadas 6-12h (nivel de evidencia 1b, recomendación A)9,36.
- •
La concentración de BTS debería ser medida 12-24h después de suspender la FT para valorar el rebote de bilirrubina, especialmente en casos de prematuridad o hemólisis, no siendo necesario retrasar el alta hospitalaria para dicho control (nivel de evidencia 4, recomendación I)37.
- •
La LM debe ser continuada durante la FT (recomendación A)1. Los niños amamantados no deberían ser rutinariamente suplementados con fórmula, agua o suero glucosado para el tratamiento de la ictericia (nivel de evidencia 1b, recomendación E)7,9,33.
- •
El aporte adicional de líquidos (vía oral o intravenosa) en RN amamantados debe quedar restringido a aquellos con riesgo elevado de ET (nivel de evidencia 1b, recomendación A)1,38.
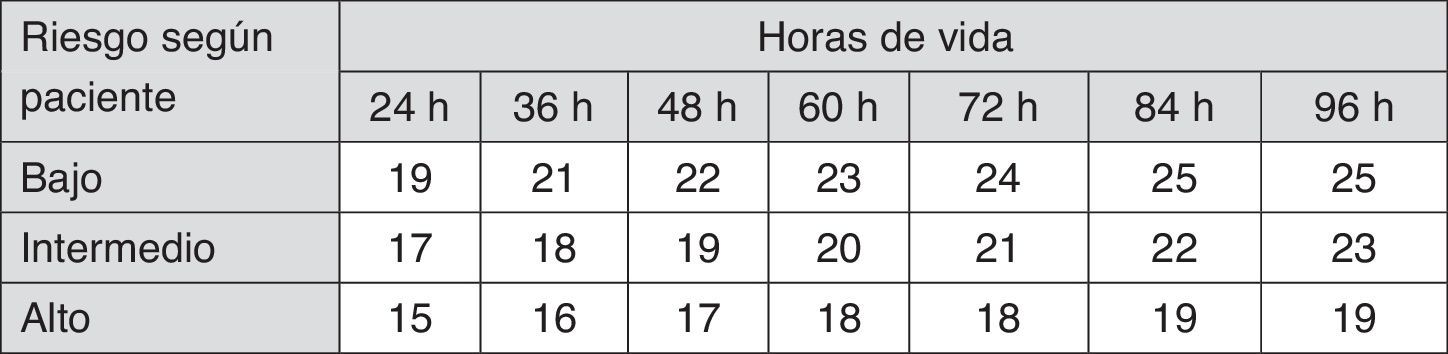
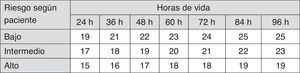
Las recomendaciones para el tratamiento con ET vienen dadas en la figura 37.
Indicaciones de exanguinotransfusión en RN de 35 o más semanas de gestación. Estas indicaciones están basadas en evidencia limitada y los valores reflejados son aproximaciones. Se debe practicar una exanguinotransfusión cuando la concentración de BTS exceda el valor indicado en la casilla correspondiente (valores expresados en mg/dl). Pacientes de bajo riesgo: EG ≥38 semanas y sin patología asociada. Pacientes de riesgo intermedio: EG ≥38+factores de riesgo o 35-37+6 sin patología asociada. Pacientes de riesgo alto: 35-37+6 con factores de riesgo. Factores de riesgo: enfermedad hemolítica isoinmune, deficiencia de G6PD, asfixia, letargia significativa, inestabilidad térmica, sepsis, acidosis o albúmina <3g/dl. La indicación dentro de las primeras 24h es incierta y varía en función de las circunstancias clínicas y la respuesta a la fototerapia.
BTS: bilirrubina total sérica; EG: edad gestacional; G6PD: glucosa-6-fosfato deshidrogenasa; RN: recién nacido.
Fuente: modificado de Academia Americana de Pediatría7.
- •
Cuando la concentración de BTS se encuentre por encima del umbral para ET indicado en la figura 3, se debe administrar de forma inmediata FT intensiva y ser derivado a un centro de referencia (recomendación B)1.
- •
Todo RN con ictericia y signos clínicos de encefalopatía aguda por bilirrubina debe recibir de forma inmediata una ET, aunque la BTS esté disminuyendo (nivel de evidencia 4, recomendación I)1,7,8.
- •
Se recomienda suspender la alimentación enteral durante la ET y 6h desde el fin del procedimiento (nivel de evidencia 5, recomendación I)9.
En la enfermedad hemolítica isoinmune, la administración de gammaglobulina inespecífica endovenosa (0,5-1g/kg en 2-4h) disminuye la concentración de bilirrubina y la necesidad de ET (nivel de evidencia 1a)1,9,39.
RecomendacionesExposición a la luz solarAunque la luz solar proporciona suficiente radiación en la banda de 425 a 475nm para suministrar FT, las dificultades prácticas para exponer de forma segura a un RN al sol evitando la quemadura solar imposibilitan el uso de la luz del sol como herramienta terapéutica segura y no está recomendado7. El estudio controlado aleatorizado de Kumar, publicado en 2016, muestra que el uso de la luz solar con filtros especiales podría tener un efecto similar a la FT convencional en RN a término y PT tardío con ictericia leve40.
ConclusionesLa identificación de los niños en riesgo de desarrollar hiperbilirrubinemia significativa y la prevención de encefalopatía bilirrubínica continúan siendo prioridades en la salud pública. Mediante la combinación de la EG con el nivel de bilirrubina hora-específico pre-alta se puede, con considerable confianza, cuantificar el riesgo de hiperbilirrubinemia grave en la mayoría de los niños. Realizando un seguimiento apropiado, la mayoría de los casos de kernicterus pueden ser prevenidos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.