La resistencia a fármacos supone una dificultad añadida en el diagnóstico y tratamiento de la tuberculosis (TB), habiéndose comunicado en España una tasa de resistencia a isoniacida (H) en niños de hasta el 9,6%1. Se presenta un brote de TB resistente a H incidiendo en el cribado de los contactos, así como las peculiaridades diagnósticas y terapéuticas de los casos pediátricos.
El caso índice fue un varón de 39 años con TB laríngea y pulmonar cavitada bacilífera, que cuidaba a niños de la comunidad de vecinos. Fue aislado en el hospital desde el diagnóstico y tratado con H, rifampicina (R), pirazinamida (Z) y etambutol (E). Siete semanas después se confirmó la resistencia a H (mutación S315T del gen katG), suspendiéndose esta y añadiendo estreptomicina (S) y moxifloxacino. Presentó una rotura fibrilar muscular que motivó la suspensión del moxifloxacino, completando finalmente 12 meses de tratamiento.
En el estudio de contactos se realizó prueba de tuberculina (PT) y en aquellos con induración menor de 5mm, se repitió a los 2 meses. En niños hasta 14 años, se realizó QuantiFERON® (Cellestis, Victoria, Australia) y radiografía (Rx) de tórax. A aquellos con PT≥5mm y Rx normal, se les hizo una ecografía mediastínica para detección de posibles adenopatías no visibles en la Rx, considerando patológicas las mayores de 1cm.
Se estudió a 16 adultos y 15 niños. Ninguno era inmigrante ni estaba vacunado con BCG. Seis niños tuvieron PT=0mm (tabla 1) y recibieron quimioprofilaxis primaria con H hasta que se comprobó en todos que la segunda PT también era negativa.
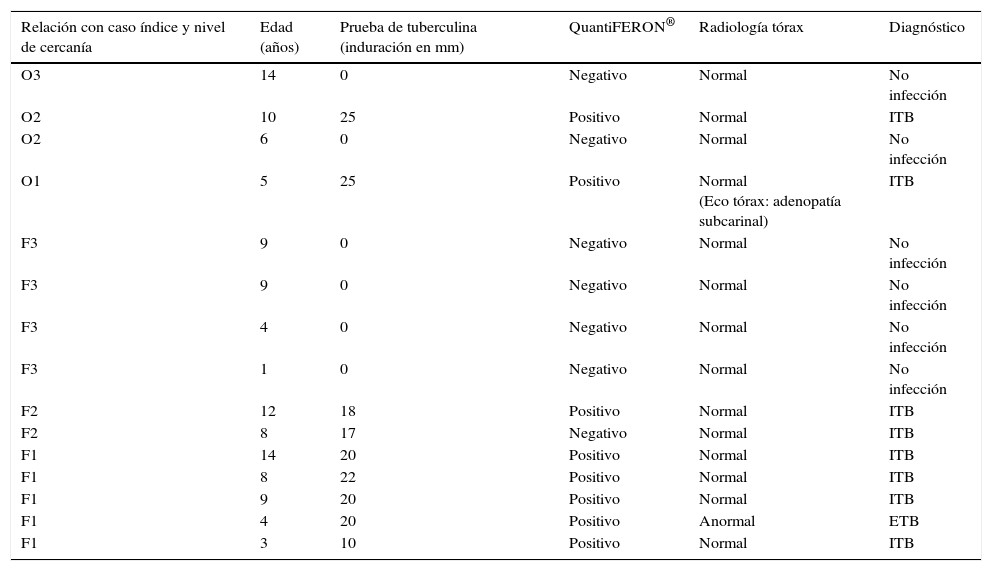
Datos epidemiológicos, clínicos y radiológicos de los niños estudiados
| Relación con caso índice y nivel de cercanía | Edad (años) | Prueba de tuberculina (induración en mm) | QuantiFERON® | Radiología tórax | Diagnóstico |
|---|---|---|---|---|---|
| O3 | 14 | 0 | Negativo | Normal | No infección |
| O2 | 10 | 25 | Positivo | Normal | ITB |
| O2 | 6 | 0 | Negativo | Normal | No infección |
| O1 | 5 | 25 | Positivo | Normal (Eco tórax: adenopatía subcarinal) | ITB |
| F3 | 9 | 0 | Negativo | Normal | No infección |
| F3 | 9 | 0 | Negativo | Normal | No infección |
| F3 | 4 | 0 | Negativo | Normal | No infección |
| F3 | 1 | 0 | Negativo | Normal | No infección |
| F2 | 12 | 18 | Positivo | Normal | ITB |
| F2 | 8 | 17 | Negativo | Normal | ITB |
| F1 | 14 | 20 | Positivo | Normal | ITB |
| F1 | 8 | 22 | Positivo | Normal | ITB |
| F1 | 9 | 20 | Positivo | Normal | ITB |
| F1 | 4 | 20 | Positivo | Anormal | ETB |
| F1 | 3 | 10 | Positivo | Normal | ITB |
F: familiar; O: ocio; 1: contacto íntimo, más de 6 h al día; 2: contacto diario, menos de 6 h al día; 3: contacto esporádico, no diario.
Ocho niños con PT ≥5mm y Rx tórax normal fueron catalogados de infección tuberculosa latente (ITBL), iniciaron HR hasta que se conoció la resistencia, completando posteriormente hasta 6 meses de R (6R). Uno de ellos presentó en la ecografía mediastínica una adenopatía subcarinal de 2,3cm siendo clasificado y tratado por protocolo de este estudio como ITBL. Permaneció asintomático y la adenopatía desapareció en la ecografía tras 4 meses del tratamiento. Una niña presentó una hipertransaminasemia asintomática que se solucionó con la suspensión y reintroducción progresiva de la medicación. Un adolescente incumplió el tratamiento de forma recurrente completando finalmente 5R.
El QuantiFERON® fue negativo en los niños sin infección y positivo en aquellos con ITBL, a excepción de una niña de 8 años con PT=17mm y contacto estrecho con el caso índice.
Un niño de 4 años con PT=20mm y adenopatías en la Rx fue clasificado como enfermedad tuberculosa (ETB) iniciando HRZE. Sus muestras fueron negativas y tras conocerse la resistencia a H en la fuente de contagio, completó 6RZE. Posteriormente, fue seguido en consulta durante un año.
Respecto a los adultos estudiados, 10 tuvieron la primera PT positiva y uno más la segunda. Todos tuvieron Rx normal, fueron catalogados de ITBL y recibieron 4R.
España presenta una tasa de resistencia a H > 4%, por lo que en los casos de ETB se deben utilizar 4 fármacos inicialmente a no ser que se conozca que la cepa es sensible a H2. Las pautas recomendadas son 6-9 RZE, 2 RZES/7 RE o 2 RZE/7-10 RE, pudiéndose incluir una quinolona los 2 primeros meses3,4. En nuestro niño con ETB se comenzó con 4 fármacos y se completaron tan solo 6RZE al utilizar Z durante todo el tratamiento y por la poca carga de enfermedad.
En nuestra unidad realizamos la pauta de ITBL con 3HR permitiendo disminuir el tiempo de tratamiento, mejorar el cumplimiento y cubrir inicialmente la posibilidad de resistencia a H. En los casos con resistencia documentada a H debe utilizarse 4-6 R3,5.
A 6 niños se administró quimioprofilaxis primaria con H de forma ineficaz al desconocer en ese momento la resistencia al fármaco, aunque afortunadamente en todos la segunda PT fue también negativa.
El diagnóstico de resistencia se retrasó 7 semanas. El GenoType MTBDRplus® (Hains Life Science, Nehren, Alemania) identifica de forma rápida la mayor parte de las mutaciones responsables de la resistencia a R (rpoB) e H (inhA y katG) facilitando la detección precoz de resistencia.
El QuantiFERON® tuvo buena concordancia con la PT para el diagnóstico de la ITBL aunque presentó un falso negativo. Esta técnica apoya el diagnóstico de la ITBL sobre todo en pacientes vacunados e inmunodeprimidos aunque no debe sustituir a la PT.
El paciente con PT=23mm, asintomático, con Rx de tórax normal pero con una adenopatía en la ecografía mediastínica fue catalogado y tratado en este estudio como ITBL y no como ETB con buena evolución ecográfica. Estas adenopatías en el niño asintomático solo visibles por tomografía computarizada o ecografía no parecen específicas de enfermedad6.