Las recomendaciones incluidas en este documento forman parte de una revisión actualizada de la asistencia respiratoria en el recién nacido. Están estructuradas en 12 módulos, y en este trabajo se presenta el módulo 8. El contenido de cada módulo es el resultado del consenso de los miembros del Grupo Respiratorio y Surfactante de la Sociedad Española de Neonatología. Representan una síntesis de los trabajos publicados y de la experiencia clínica de cada uno de los miembros del grupo.
The recommendations included in this document will be part a series of updated reviews of the literature on respiratory support in the newborn infant. These recommendations are structured into 12 modules, and in this work module 8 is presented. Each module is the result of a consensus process amongst all members of the Surfactant and Respiratory Group of the Spanish Society of Neonatology. They represent a summary of the published papers on each specific topic, as well as the clinical experience of each one of the members of the group.
La ventilación mecánica convencional intenta imitar la respiración espontánea administrando volúmenes corrientes semejantes a los fisiológicos a frecuencias respiratorias normales. Cuando precisamos aumentar el volumen corriente para mantener un adecuado intercambio gaseoso provocamos un aumento de las presiones generadas en el pulmón que pueden favorecer el desarrollo de la displasia broncopulmonar o el escape aéreo.
La ventilación de alta frecuencia (VAF) intenta minimizar este daño pulmonar. Emplea volúmenes corrientes muy pequeños (menores que el espacio muerto anatómico), a frecuencias respiratorias supra fisiológicas (superiores a 150 respiraciones/minuto), permitiendo de esta forma mantener una ventilación adecuada.
La VAF fue inicialmente descrita en 19691, con unos resultados prometedores en el modelo animal.
Existen 3 tipos principales de VAF en función de los dispositivos utilizados para aplicarla2:
Alta frecuencia oscilatoria (VAFO). Consiste en un circuito cerrado que mantiene una presión positiva continua, con una bomba de pistón o una membrana vibrante integradas. Los movimientos del pistón o las oscilaciones de la membrana desplazan la columna de gas del interior del circuito hacia el pulmón durante la inspiración creando una presión positiva y la extraen durante la espiración al crear una presión negativa. Por tanto, la espiración en este tipo de ventilación es activa. Es la más utilizada en nuestros centros3.
Alta frecuencia por jet (VAFJ). Administra pulsos de gas humidificado a nivel del tubo endotraqueal mediante el uso de un inyector a chorro (jet). La espiración es pasiva.
Alta frecuencia por interruptor de flujo (VAFIF). Es una forma mixta de VAF que utiliza una válvula (solenoide) que actúa como un obturador, abriéndose y cerrándose a alta frecuencia.
En nuestro entorno disponemos de diferentes tipos de ventiladores para la VAF. Algunos de estos se describen en la tabla 1.
Tipo de ventiladores de VAF
| Tipo | VAFO | VAFJ | VAFIF |
|---|---|---|---|
| Ventiladores | Sensor Medics® Fabian® SLE 5000® Babylog® | Life Pulse® (Bunnell) | Infant Star® VN500® |
VAF: ventilación de alta frecuencia; VAFIF: ventilación alta frecuencia por interruptor de flujo; VAFJ: ventilación alta frecuencia por jet; VAFO: ventilación alta frecuencia oscilatoria.
Presión de distensión continua de la vía aérea (cmH2O) (PDC). Es la presión mantenida dentro del circuito respiratorio y transmitida al alvéolo. Es utilizada para el reclutamiento pulmonar y por tanto para la oxigenación.
Amplitud (Δp). Diferencia de presión por encima y por debajo de la PDC expresada como cmH2O (en algunos respiradores se expresa como porcentaje). Es responsable de la ventilación alveolar.
Frecuencia respiratoria en hertzios (Hz) (FR). Es a la que la amplitud oscila; 1Hz=60 ciclos/min.
Ventilación y oxigenaciónVentilación. La eliminación de CO2 viene determinada por el volumen corriente al cuadrado por la FR (concepto conocido como DCO2). El parámetro que más determina el lavado de CO2 es el volumen corriente.
El volumen corriente está influenciado por la amplitud. Pequeños cambios en la amplitud o en la distensibilidad pulmonar (y con ello en el volumen corriente) producirán un efecto importante en la ventilación. La FR mantiene una relación inversa con el volumen corriente. El volumen corriente aumenta conforme disminuimos la FR.
El mecanismo preciso mediante el cual se establece el intercambio gaseoso no ha sido aclarado. Se postulan diferentes posibilidades: ventilación alveolar directa, efecto Pendelluft y difusión facilitada (convección)4.
Oxigenación. El mayor determinante de la oxigenación es el mantenimiento de la capacidad funcional residual (CFR) a base de PDC.
IndicacionesRecién nacido prematuro con síndrome de dificultad respiratoriaLos múltiples estudios controlados que han comparado la VAF con la ventilación convencional no han tenido los esperanzadores resultados obtenidos con la experimentación animal. Han fracasado en demostrar una mejoría significativa de las variables estudiadas. Las principales explicaciones de estos contradictorios resultados probablemente estarían relacionadas con las diferentes estrategias terapéuticas utilizadas, variabilidad de la práctica clínica intercentros, variabilidad en los pacientes incluidos y en los avances experimentados en la ventilación mecánica convencional5,6.
Los resultados observados en los más de 4.000 recién nacidos estudiados en los diferentes ensayos clínicos que compararon la VAF, con estrategia de alto volumen pulmonar, y la ventilación convencional, utilizando frecuencias respiratorias superiores a 60 ciclos por minuto con volúmenes corrientes mínimos, son similares.
Con la estrategia de alto volumen pulmonar, se observó una mayor frecuencia de síndrome de fuga aérea y no se describieron un mayor número de hemorragias intraventriculares de grado ¾ o leucomalacia periventricular, por lo que la VAF con estrategia de alto volumen no predispone a un aumento del daño neurológico.
No hay una clara evidencia que la VAF ofrezca una ventaja superior a la ventilación convencional en el tratamiento inicial ventilatorio del síndrome de dificultad respiratoria del recién nacido prematuro7,8. Sin embargo, posiblemente uno de cada 5 recién nacidos de muy bajo peso recibe VAF en algún momento de su ingreso en cuidados intensivos.
El seguimiento a largo plazo de adolescentes entre 11 y 14 años, nacidos antes de las 29 semanas de edad gestacional y que fueron incluidos en estudios aleatorizados comparando la VAFO con el tratamiento ventilatorio convencional inmediatamente después del nacimiento, muestra una función pulmonar superior en los que recibieron VAFO sin una mayor alteración funcional9.
En cuanto al tratamiento de rescate, existen escasos ensayos clínicos que estudien el uso de la VAF como rescate en pacientes prematuros con síndrome de dificultad respiratoria grave y con enfisema intersticial. Los resultados más comunes son favorables a la VAF en cuanto a la resolución del problema respiratorio, pero no encontraron diferencias en mortalidad o displasia broncopulmonar6,9.
Síndrome de fuga aérea: enfisema pulmonar intersticial, neumotórax y fístula broncopleuralLos estudios realizados comparando la VAF y la ventilación convencional, cuando no había un uso generalizado de surfactante, observaron que en los recién nacidos prematuros con síndrome de fuga aérea el uso de VAF mejoraba el intercambio gaseoso con menores presiones pico y medias y se asociaba a una más rápida mejoría del enfisema pulmonar intersticial y una menor mortalidad, sugiriendo que esta modalidad respiratoria es una herramienta eficaz en el tratamiento de los síndromes de fuga aérea10.
Hernia diafragmáticaEstudios retrospectivos y observacionales sugieren que el uso de VAFO podría mejorar las tasas de mortalidad, de displasia broncopulmonar y disminuir las necesidades de oxigenación de membrana extracorpórea (ECMO) en recién nacidos afectos de hernia diafragmática congénita aislada11,12.
El primer ensayo clínico que comparó la VAFO versus ventilación mecánica convencional en recién nacidos afectos de hernia diafragmática congénita de diagnóstico prenatal no observó diferencias estadísticamente significativas en la mortalidad y en la incidencia de displasia broncopulmonar entre ambos grupos. Destacaron un menor tiempo de ventilación y menor necesidad de circulación extracorpórea en el grupo de ventilación convencional13.
Enfermedad pulmonar aguda sin respuesta a la ventilación mecánica convencional, candidata de oxigenación de membrana extracorpórea (ECMO)La VAFO es una herramienta de rescate más efectiva que la ventilación convencional en aquellos recién nacidos candidatos a ECMO por enfermedad pulmonar grave reversible. Mejora el intercambio gaseoso en el recién nacido a término o casi a término con grave fallo respiratorio sin un aparente incremento de la morbilidad. Se asocia a una menor incidencia de enfermedad pulmonar crónica y hemorragia intracraneal en aquellos recién nacidos que fueron tratados satisfactoriamente con VAFO y fueron comparados con aquellos que no respondieron y precisaron de ECMO.
La habilidad de la VAFO para mejorar el intercambio gaseoso en los recién nacidos candidatos a ECMO depende de la enfermedad causal, siendo más efectiva en las neumonías, aspiración de meconio y déficit de surfactante14.
El uso combinado de óxido nítrico inhalado y VAFO podría ser más efectivo que la terapia única en el tratamiento de los recién nacidos con enfermedad pulmonar grave reversible e hipertensión pulmonar reduciendo el uso de la ECMO. Esta mejoría se ha observado especialmente en recién nacidos con aspiración de meconio15.
Otras enfermedadesPequeños trabajos avalan el uso de la VAF en casos de aumento de la presión intraabdominal que dificulte la ventilación mecánica convencional (onfalocele, la gastrosquisis o la enterocolitis necrosante) y hemorragia pulmonar16.
Manejo prácticoLa principal indicación de la VAF como hemos visto es la necesidad de reclutamiento pulmonar. La estrategia propuesta sería la de open lung, utilización de una presión media en la vía aérea (MAP) suficiente que permita el máximo reclutamiento alveolar evitando la atelectasia.
No existen datos objetivos que permitan establecer unos criterios de entrada en VAF. El consenso clínico consideraría el uso de esta modalidad en las siguientes situaciones10:
- 1.
Durante la ventilación mecánica convencional cuando se necesite presiones inspiratorias pico mayores de 25cmH2O para conseguir una adecuada ventilación.
- 2.
Cuando es necesario suplementar oxígeno por encima de 0,6 tras optimizar la ventilación mecánica convencional con signos de sobredistensión (curvas presión-volumen, C20/C <0,8).
- 3.
Fuga aérea.
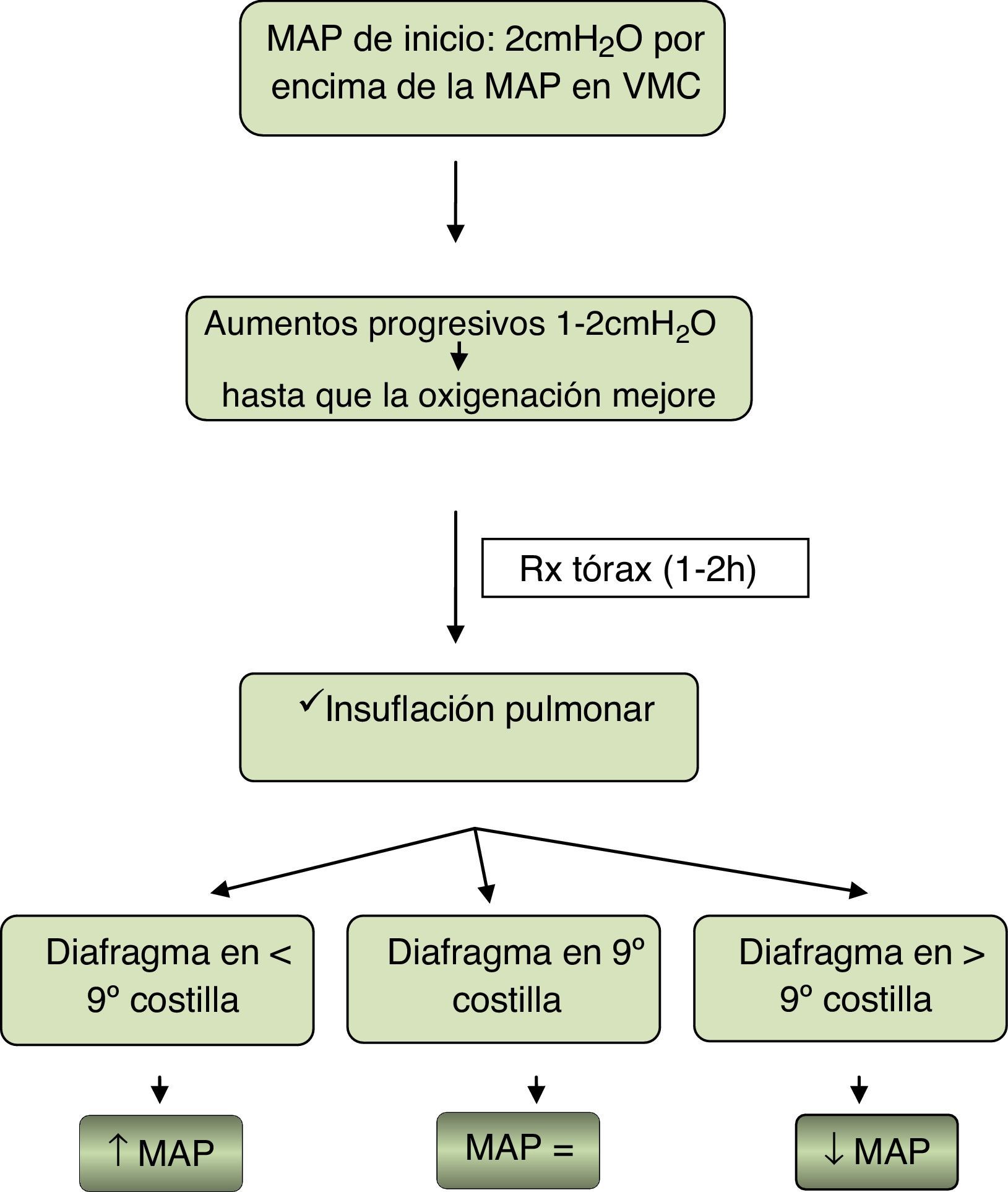
Oxigenación. En la figura 1 se propone un algoritmo como guía para el manejo inicial y el mantenimiento de la VAF con la intención de conseguir una optimización máxima del volumen pulmonar evitando la hiperinsuflación:
En el caso del uso de VAF debido a fuga aérea se iniciará con la misma PDC que en ventilación mecánica convencional y se mantendrá una actitud más conservadora tolerando FiO2 y pCO2 más altas.
No todos los ventiladores de alta frecuencia producen la misma hiperinsuflación con la misma MAP. Además, se ha de tener en cuenta otros signos de hiperinsuflación, como el aplanamiento diafragmático o la compresión de la silueta cardiaca.
Ventilación. La amplitud inicial se situará en entre un 40-50% (dependerá del tipo de respirador que utilicemos) y se irá ajustando en intervalos del 10% para mantener un volumen corriente entre 1,5-2cc/kg y/o una pCO2 adecuada para cada paciente. La FR se pautará en relación con el peso del paciente: en menores de 1.500g pueden usarse FR de 12-15Hz, mientras que en prematuros tardíos o recién nacidos a término pueden manejarse alrededor de 10Hz. Pueden ser necesarias FR más bajas en caso de enfermedad pulmonar grave.
Algunos respiradores permiten la posibilidad de añadir volumen garantizado en VAFO. Se ha de demostrar el beneficio teórico de esta asociación con respecto a mantener en rangos óptimos los niveles de pCO2.17.
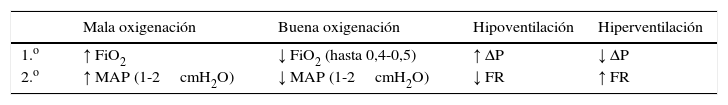
En la tabla 2 se propone una pauta de actuación para la oxigenación y ventilación en VAF.
Pauta de actuación para la oxigenación y ventilación en VAF
| Mala oxigenación | Buena oxigenación | Hipoventilación | Hiperventilación | |
|---|---|---|---|---|
| 1.o | ↑ FiO2 | ↓ FiO2 (hasta 0,4-0,5) | ↑ ΔP | ↓ ΔP |
| 2.o | ↑ MAP (1-2cmH2O) | ↓ MAP (1-2cmH2O) | ↓ FR | ↑ FR |
ΔP: amplitud; FiO2: concentración de oxígeno administrado; FR: frecuencia respiratoria; MAP: presión media en vía aérea; VAF: ventilación de alta frecuencia.
Destete. Una vez se ha conseguido reclutar el pulmón y las necesidades de oxígeno han disminuido hasta aproximadamente 0,3-0,35, se procederá a intentar disminuir progresivamente la MAP cada 12h, manteniendo la FiO2 en los límites deseados. La velocidad de descenso dependerá de la enfermedad y del momento evolutivo en el que se encuentre el paciente.
Una vez la MAP esté por debajo de 10-12cmH2O se considerará la progresión hacia la extubación, que se puede realizar previo paso a ventilación mecánica convencional o directamente desde VAF (con MAP entre 8-10cmH2O).
Cuidados especiales. Las siguientes recomendaciones son una guía general para un óptimo control del paciente que recibe VAF:
- •
El volumen corriente administrado varía con los cambios en las condiciones pulmonares, por lo que se recomienda un estrecho control de la pO2 y la pCO2, recomendándose el uso de medidores transcutáneos.
- •
Se debe verificar la expansión pulmonar mediante radiografía de tórax siempre que se realicen modificaciones sustanciales de la MAP.
- •
La presión arterial y el gasto cardiaco deben ser optimizados, incluyendo un control exhaustivo de los mismos y contemplando el uso de volumen y/o inótropos para su mantenimiento.
- •
La sedoanalgesia±relajación muscular pueden ser necesarios en ocasiones cuando el esfuerzo respiratorio del paciente interfiere con la ventilación.
- •
La aspiración traqueal está indicada siempre que disminuya la vibración de la caja torácica, aumente el CO2 o empeore la oxigenación sin ninguna otra causa aparente. Se recomienda el uso de los sistemas de aspiración cerrados para evitar el desreclutamiento pulmonar durante las desconexiones.
Hemodinámicas. Cuando es necesario utilizar una MAP alta para conseguir el reclutamiento pulmonar, podemos encontrar las siguientes complicaciones derivadas del aumento de la presión intratorácica, como el aumento de la presión venosa central o la disminución del retorno venoso y del gasto cardiaco.
Atrapamiento aéreo.
Recomendaciones- 1.
La VAF es un tratamiento de rescate en pacientes con grave afectación pulmonar si el tratamiento con ventilación convencional ha fracasado (B).
- 2.
La combinación con óxido nítrico inhalado es más efectiva (B).
- 3.
No ofrece ventajas comparándola con la ventilación convencional en el soporte respiratorio inicial del síndrome de distrés respiratorio del recién nacido prematuro (A).
- 4.
La estrategia de una MAP óptima puede ser la más adecuada (B).
El ex-utero intrapartum treatment (EXIT) es un procedimiento que nos permite estabilizar la vía aérea fetal antes que el nacimiento se complete, mientras el recién nacido permanece en soporte útero-placentario. Nos ofrece un tiempo de seguridad para el acceso a la vía aérea fetal en casos de grave obstrucción extrínseca18,19.
ProcedimientoPara su elaboración es necesaria la participación de un equipo multidisciplinar compuesto por obstetras, neonatólogos, anestesistas, cirujanos pediátricos y enfermeras. El procedimiento EXIT se realiza en quirófano. La madre se sitúa en decúbito supino en la mesa de operaciones, con una ligera inclinación lateral izquierda. Preoperatoriamente se administraron tocolíticos. Se le coloca un catéter epidural para controlar el dolor intra y postoperatorio. La inducción a la anestesia a la madre es seguida de una rápida secuencia de intubación y ventilación asistida. Se ha de mantener una correcta presión arterial materna para asegurar la perfusión placentaria. Se ha de optimizar la oxigenación materna para evitar la hipoxia fetal. Se administra relajante muscular y fentanilo directamente al feto a través de una inyección intramuscular por punción externa transuterina. Posteriormente se procede a la histerotomía. Una vez el útero es abierto, la cabeza y los brazos fetales son expuestos y se intenta la intubación de la vía aérea.
La monitorización fetal consiste en pulsioximetría continua en la extremidad superior expuesta y ultrasonidos para examinar el flujo sanguíneo del cordón umbilical y su frecuencia cardiaca.
Una vez finalizado el procedimiento (que puede durar hasta 150min), se pinza el cordón umbilical y se coloca el recién nacido en la cuna de reanimación para su cuidado y tratamiento neonatológico19,20.
IndicacionesGrandes masas cervicales o faríngeas como teratomas, higromas quísticos, hemangiomas o linfangiomas. Aunque son lesiones poco frecuentes, pueden ocasionar una obstrucción de la vía aérea superior en el feto que complica gravemente la reanimación en la sala de partos. Si no podemos conseguir la permeabilidad de la vía aérea puede provocar acidosis, hipoxia y, como consecuencia, daños neurológicos irreversibles o fallecimiento en el recién nacido.
Esta complicación resulta más trágica ya que muchos de estos pacientes, si se consigue solucionar la malformación aislada, tienen un desarrollo posterior normal21. Previamente, es necesario un adecuado y detallado diagnóstico prenatal que valore el grado de compresión de la vía aérea y la dificultad en la reanimación respiratoria del recién nacido.
Con la ecografía podemos observar signos indirectos de obstrucción aérea y esofágica secundaria como polihidramnios, aumento del volumen pulmonar, diafragma revertido, ascitis e hidrops fetalis (CHAOS). La resonancia magnética permite un estudio más detallado facilitándonos la planificación del EXIT y de las intervenciones necesarias (intubación, traqueotomía, punción de la masa en caso de linfangiomas o resección)22.
Otras indicaciones del EXIT son22,23:
- 1.
Punción percutánea guiada por ecografía durante el procedimiento EXIT en linfangiomas gigantes cervicales.
- 2.
Revertir las oclusiones traqueales fetales en la hernia diafragmática congénita.
- 3.
Anormalidades torácicas: derrames pleurales masivos y MAQ gigantes.
- 4.
Eliminación de shunt toraco-amnióticos. Toracotomías y resecciones de lóbulos pulmonares.
- 5.
Canalizaciones de vasos centrales previas al ECMO.
La planificación del procedimiento EXIT está indicado en patologías graves de obstrucción de vía aérea fetal (A).
Oxigenación por membrana extracorpórea (ECMO)La ECMO es un sistema capaz de mantener las funciones vitales sustituyendo artificialmente el corazón, pulmón, o ambos, de manera temporal hasta restablecer las funciones cardiorrespiratorias propias.
El empleo de ECMO se debe aplicar en situaciones reversibles24.
Elementos del circuito de ECMOCompuesto principalmente por cánula de drenaje venoso, línea venosa, bomba, oxigenador, línea arterial y cánula de retorno arterial o venosa dependiendo del tipo de asistencia.
FisiologíaLa ECMO se realiza tras conseguir un drenaje venoso seguido de un intercambio de CO2 y O2 a través de una membrana artificial (oxigenador) e impulsada la sangre por una bomba para ser devuelta a la circulación sistémica, ya sea vía venosa (ECMO veno-venoso) o arterial (ECMO veno-arterial).
En el sistema veno-venoso se realiza la función respiratoria y en el veno-arterial las funciones respiratoria y cardiaca. Este soporte puede ser parcial o total, dependiendo de las necesidades.
Indicaciones y contraindicacionesLa mayor parte de los neonatos que necesitan soporte con ECMO son pacientes en fallo respiratorio con hipertensión pulmonar, que les conduce a una situación de hipoxemia mantenida25.
La causa inicial es variable, y también influye en la eficacia final de la ECMO. La hernia diafragmática congénita, el síndrome de aspiración meconial, la hipertensión pulmonar persistente y el síndrome de distrés respiratorio son las enfermedades respiratorias en las que más frecuentemente se utiliza26.
Indicaciones25,27Índice de oxigenación (IO)=presión media vía aérea×FiO2×100
Índice de oxigenación ≥40: indicación.
Índice de oxigenación ≥20: considerar su uso.
ContraindicacionesAbsolutas- 1.
Cromosomopatías letales.
- 2.
Lesión cerebral grave irreversible.
- 3.
Hemorragia intraventricular grado III o mayor.
- 1.
Afectación irreversible del órgano (posibilidad de trasplante).
- 2.
Menor de 2kg de peso.
- 3.
Menor de 34 semanas de edad posmenstrual.
- 4.
Enfermedad con alta probabilidad de tener mal pronóstico.
La eficacia de la ECMO radica en la capacidad del paciente para recuperarse de la enfermedad pulmonar en un periodo corto de tiempo (14-21 días).
A partir de la segunda semana de ECMO, los riesgos y las complicaciones relacionados con el procedimiento (formación de coágulos, infección nosocomial, fallos mecánicos del propio circuito, etc.) se incrementan. En la mayoría de centros, se acepta como duración máxima los 20-30 días de ECMO, aunque con la mejora de su uso estos tiempos se han incrementado.
La retirada de la ECMOEl principal indicador es la recuperación adecuada de las funciones pulmonar y cardiaca. A medida que mejora la oxigenación se reduce la asistencia progresivamente hasta retirarla.
ComplicacionesEn la tabla 3 se enumeran las posibles complicaciones27 de la ECMO.
Complicaciones mecánicas y del paciente en oxigenación por membrana extracorpórea (ECMO)
| Complicaciones mecánicas | Complicaciones del paciente |
|---|---|
| Coágulos en circuito | Hemólisis |
| Problemas de cánulas | Diálisis/Hemofiltración |
| Aire en circuito | Hemorragia intracraneal |
| Fallo de oxigenador | Convulsiones |
| Fallo de la bomba | Hipertensión |
| Fallo del calentador | Infección |
| Rotura circuito | Arritmia |
La ECMO está indicada en patología pulmonar neonatal grave reversible con un tiempo limitado de uso (B).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Dr. Félix Castillo Salinas. Servicio de Neonatología, Hospital Universitario Vall d’Hebrón, Barcelona. Dra. Dolores Elorza Fernández. Servicio de Neonatología.,Hospital Universitario La Paz, Madrid. Dr. Antonio Gutiérrez Laso. Servicio de Neonatología, Hospital Universitario La Fe, Valencia. Dr. Julio Moreno Hernando. Servicio de Neonatología, Hospital Universitario Sant Joan de Déu, Barcelona. Dr. Gerardo Bustos Lozano. Servicio de Neonatología, Hospital Universitario 12 de Octubre, Madrid. Dr. Manuel Gresa Muñoz. Servicio de Neonatología, Hospital Materno-Insular Las Palmas, Las Palmas. Dr. Xavier Miracle Echegoyen. Servicio de Neonatología, Hospital Clínic-Maternidad, Barcelona. Dr. Jon López de Heredia Goya. Servicio de Neonatología, Hospital de Cruces, Barakaldo. Dra. Marta Aguar Carrascosa. Servicio de Neonatología, Hospital Universitario La Fe, Valencia. Dr. José Ramón Fernández Lorenzo, Servicio de Neonatología, Complejo Universitario de Vigo. Dra. María del Mar Serrano. Hospital Materno-Infantil Carlos Haya, Málaga. Dra. Ana Concheiro Guisan. Servicio de Neonatología, Complejo Hospitalario Universitario de Vigo. Dra. Cristina Carrasco Carrasco. Servicio de Neonatología, Hospital Universitario Sant Joan de Déu, Barcelona. Dr. Juan José Comuñas Gómez. Servicio de Neonatología, Hospital Universitario Vall d’Hebrón, Barcelona. Dra. María Teresa Moral Pumarega. Hospital Universitario 12 de Octubre, Madrid. Dra. Ana María Sánchez Torres. Servicio de Neonatología, Hospital Universitario La Paz, Madrid. Dra. María Luisa Franco. Servicio de Neonatología, Hospital Universitario Gregorio Marañón, Madrid.