en la experiencia clínica en cuidados intensivos pediátricos es relativamente frecuente encontrar quilotórax, dado que suele aparecer en el postoperatorio de cirugías cardiotorácicas. Sin embargo, todavía hay incertidumbre acerca de su tratamiento en cuanto a la elección de las distintas opciones terapéuticas, su eficacia y factores pronósticos para una respuesta positiva.
Objetivosdescribir nuestra experiencia en el manejo de los pacientes con quilotórax ingresados en una unidad de cuidados intensivos pediátricos. Buscar factores pronósticos de respuesta a los diversos tratamientos.
Material y métodose trata de un estudio descriptivo y analítico, retrospectivo, que abarca el periodo 2000–2007. Se incluyeron los casos de quilotórax pediátrico de cualquier etiología atendidos en dicho periodo en nuestra unidad (excluidos casos neonatales congénitos). Se registraron variables demográficas, etiología, evolución del débito, complicaciones, tipo de tratamiento con resultado y efectos secundarios y evolución clínica. Se analizó estadísticamente la posible relación entre diversas variables (edad, etiología, débito) y la evolución y la respuesta a tratamientos.
Resultadosse recogió un total de 24 pacientes, la mitad de cada sexo. Un 70,8% (17) eran menores de 1 año. El 79,2% (19) se encontraban en el postoperatorio de una cirugía por cardiopatía congénita. Las complicaciones más destacables fueron sepsis (3/24 casos, 12,5%), hipoalbuminemia (3/24, 12,5%), alteración hemodinámica (2/24, 8,3%) y sepsis por catéter (2/16, 12,5%). El tratamiento con dieta exenta en grasas o rica en ácidos grasos de cadena media fue eficaz en 9/21 casos (43%) y la nutrición parenteral total en 3/5 (60%), frente a la perfusión de somatostatina en 8/11 (73%), usada como segunda o tercera elección. Los efectos secundarios en relación con ella fueron hipoglucemia, hiperglucemia y molestias digestivas, un paciente en cada caso, y no causaron complicaciones. No se encontraron factores pronósticos de la evolución ni de la respuesta a los diversos tratamientos.
Conclusionesencontramos pacientes con sepsis, hipoalbuminemia y trastornos hemodinámicos como complicaciones relacionadas con el quilotórax. El tratamiento con somatostatina no presentó complicaciones graves y en un 73% de los pacientes tratados se produjo curación del quilotórax.
Chylothorax is a fairly common condition seen in paediatric intensive care units, since it usually appears in the postoperative care of cardiothoracic surgery. Nevertheless, there is still uncertainty on the most effective treatment option and the prognostic factors for a positive response.
ObjectivesTo describe our experience in the management of patients with chylothorax admitted to our paediatric intensive care unit (PICU). To look for prognostic factors for a response to the different treatments.
Material and methodThis is a descriptive and analytical, retrospective study, that includes the period 2000–2007. All cases of chylothorax of any aetiology diagnosed during this period in our PICU were included (excluding congenital neonatal cases). Demographic variables, aetiology, evolution of the debit, complications, type of treatment with results and side effects were recorded, along with the clinical progress. The possible relationship between the different variables (age, aetiology, debit), and progress, as well as response to treatments was analysed.
ResultsA total of 24 patients, 12 males and 12 females, were included, of which 70.8% (17) were under 1 year of age. A total of 79.2% (19) were in postoperative care after surgery for a congenital heart disease. The most notable complications were sepsis (3/24 cases, 12.5%), hypoalbuminaemia (3/24, 12.5%), haemodynamic changes (2/24, 8.3%) and catheter-associated sepsis (2/16, 12.5%). The treatment with fat-free or rich in medium chain triglycerides diet was effective in 9/21 cases (43%) and total parenteral nutrition in 3/5 (60%), as opposed to the infusion of somatostatin in 8/11 (73%), used in second or third line. Somatostatin side effects were hypoglycaemia, hyperglycaemia and digestive disturbances, one patient in each case, and not causing complications. We did not find prognostic factors as regards progression or for the response to the different treatments.
ConclusionsSepsis, hypoalbuminaemia and haemodynamic disturbances were found to be complications associated to chylothorax. The treatment with somatostatin did not produce severe side effects, and there was a positive response in 73% of those treated with it.
El quilotórax puede aparecer como complicación de otras muchas enfermedades1–5, incluso aparecer con carácter idiopático. En la edad pediátrica, suele ser secundario a cirugía cardíaca o torácica.
Esta enfermedad puede producir complicaciones diversas: insuficiencia respiratoria, desnutrición por pérdida proteínica y aumento de susceptibilidad a infecciones por pérdida de inmunoglobulinas y linfocitos. Clásicamente, su tratamiento se basaba en medidas de soporte nutricional y drenaje del derrame. En algunas ocasiones era, y sigue siendo, preciso recurrir a técnicas quirúrgicas, como derivaciones pleuroperitoneales o esclerosis pleural6,7. El tratamiento con dieta exenta de grasas, la nutrición parenteral total, así como el uso de somatostatina (SST) o análogos, parece poder cambiar el curso de la enfermedad, pero faltan estudios concluyentes sobre eficacia, indicación, dosis y duración del tratamiento. Especialmente controvertida es la verdadera efectividad de la somatostatina, por lo cual tampoco hay acuerdo acerca del momento de introducirla en el tratamiento. También falta conocimiento sobre factores pronósticos de la evolución.
El objetivo de este artículo es describir nuestra experiencia en el manejo del quilotórax, desde el punto de vista de una unidad de cuidados intensivos pediátricos, así como buscar factores pronósticos del curso de la enfermedad y de la respuesta a los diversos tratamientos.
MetodologíaSe planteó un estudio retrospectivo, descriptivo y analítico, basado en la revisión de los pacientes con diagnóstico de quilotórax en edad pediátrica (hasta los 14 años cumplidos) en un hospital terciario. Se realizó una búsqueda de casos en el registro hospitalario de diagnósticos y en el de la unidad de cuidados intensivos pediátricos. Se excluyeron los casos atendidos en el servicio de neonatología por las características intrínsecas de dichos pacientes y las posibles diferencias en el manejo. Se definió quilotórax como la presencia de derrame pleural de aspecto lechoso, con una concentración de triglicéridos >100mg/dl o entre 50 y 100mg/dl con celularidad aumentada y una proporción de linfocitos en el recuento celular >80%. Las decisiones acerca del tratamiento se basaron en el criterio del médico responsable, no hay un protocolo de manejo para esta enfermedad.
Las variables recogidas de cada paciente se agrupaban en datos demográficos, etiología, descripción del quilotórax, complicaciones, tratamiento y resultado. Se clasificó la etiología como primaria (idiopática y cromosomopatías con alteraciones linfáticas, como el síndrome de Down) o secundaria (cirugía cardíaca, otras cirugías, traumatismo y otras). En los pacientes de cirugía cardíaca se anotó el tipo de cardiopatía y de cirugía, y si presentaban o no signos de disfunción ventricular derecha, definida como presencia de edemas, hepatomegalia o signos ecocardiográficos compatibles, valorados por un cardiólogo pediátrico.
Respecto a las características del quilotórax, se anotó el número de días transcurridos desde el desencadenante hasta el diagnóstico, así como el débito diario.
Las complicaciones se subdividieron en relativas al quilotórax (sepsis, hipoalbuminemia, definida como albúmina plasmática<3g/dl, e hipogammaglobulinemia) y relacionadas con el tratamiento (sepsis por catéter, alteraciones de la glucemia no en contexto de SST o análogos, complicaciones de la nutrición enteral y complicaciones relacionadas con SST o análogos). Las sepsis se definieron en relación con el catéter por un cultivo posterior del germen en su punta o por crecimiento diferencial compatible en hemocultivos.
En cuanto al tratamiento, se valoró el uso de dieta exenta de grasas o con fórmula con predominio de triglicéridos de cadena media (TCM), la nutrición parenteral total, es decir, con dieta absoluta, el empleo de SST o análogos y la necesidad de cirugía. Para cada uno de ellos se anotó el día de inicio, duración, día de respuesta (definida como reducción, mantenida posteriormente, y al menos a la mitad, del débito respecto al de los 3 días previos), recidiva y fracaso (decisión del médico responsable de cambio o adición de otra terapia específica).
El resultado clínico se clasificó como curación, mejoría o fallecimiento.
Los resultados se procesaron con los programas Microsoft Excel 2003 y SPSS 11.5 para Windows. Se hizo estadística descriptiva de todas las variables. Posteriormente, se aplicaron diversas pruebas para analizar la posible correlación entre débito inicial y duración o débito total (test de Pearson), entre características del paciente (edad, sexo, tipo de cardiopatía y tipo de cirugía) y débito total y duración, así como para valorar la asociación entre uso de SST y débito total y duración (pruebas de Mann-Whitney y de Kruskal-Wallis).
ResultadosSe recogieron datos de 24 pacientes, correspondientes al periodo entre enero de 2001 y enero de 2007. Todos los pacientes habían precisado ingreso en la unidad de cuidados intensivos pediátricos (UCIP) en algún momento a causa de su enfermedad fundamental, si bien podían no encontrarse ya en esa unidad en el momento de inicio del derrame. Sus edades estaban comprendidas entre 15 días y 12 años. De todos ellos, 17 (70,8%) tenían una edad ⩽12 meses. La mitad de los pacientes eran varones y la otra mitad, mujeres.
Etiopatogenia del quilotóraxEn 19 (79,2%) casos, el antecedente próximo era una cirugía cardíaca por cardiopatía congénita. Otros 4 casos correspondían a una fijación de columna vertebral por escoliosis, una neumonectomía en una necrosis pulmonar infecciosa y dos episodios en una paciente con un linfangiohemangioma mediastínico. Finalmente, en un caso no se encontró un desencadenante, se trataba de un paciente con afección multiorgánica y antecedente, varios meses antes, de parto traumático. En 18 (75%) casos, el derrame estaba situado en el lado izquierdo, en 3 en el derecho y en otros 3 era bilateral.
La distribución de los casos entre los pacientes con cardiopatía congénita queda reflejada en las tabla 1. En 12 (63,2%) de ellos, se realizó cirugía correctora y, en el resto, paliativa. En 9 casos quedó lesión residual tras la cirugía.
Resumen de los casos secundarios a cirugía cardíaca por cardiopatía congénita
| Tipo de cardiopatía congénita | Cirugía realizada |
| Cortocircuitos izquierda-derecha (3) | Correctora (3) |
| Comunicación interauricular (CIA) | |
| Comunicación interventricular (CIV), CIA y ductus | |
| Canal auriculoventricular completo | |
| Anomalías aórticas (5) | Correctora (5) |
| Recoartación de aorta | |
| Coartación con VDDS y CIV | |
| Coartación con canal A-V incompleto | |
| Doble arco aórtico | |
| Coartación de aorta | |
| Obstrucción del tracto de salida del ventrículo derecho (4) | Correctora (3) |
| Tetralogía de Fallot | |
| Tetralogía de Fallot con atresia pulmonar | |
| Ventrículo derecho de doble salida (VDDS) | |
| Atresia pulmonar con atresia tricuspídea e hipoplasia de ventrículo derecho | Glenn (1) |
| Síndromes de ventrículo izquierdo hipoplásico (5) | Norwood (2) |
| En el contexto de cardiopatía compleja (2) | Glenn (3) |
| Transposiciones de grandes arterias (2) | Correctora (1) |
| Con CIV y estenosis pulmonar (1) | Glenn (1) |
Los datos de disfunción ventricular derecha se recogieron de forma fiable en 20 pacientes, que la tenían sólo 7 de ellos.
Características del drenajeLos parámetros del drenaje pleural quedan resumidos en la tabla 2.
Resumen de los parámetros del drenaje pleural
| Características del drenaje | Media±DE | Intervalo |
| Tiempo entre desencadenante y diagnóstico de quilotórax (días) | 10,1±6,3 | 2–25 |
| Débito en el primer día (ml/kg) | 12,5±9,6 | |
| Débito total (ml/kg) | 183,8±469,5 | |
| Duración (días) | 15±12,3 | 2–48 |
DE: desviación estándar.
No se halló correlación significativa del débito en el primer día con la duración y con el débito total. Tampoco se encontró ninguna característica de los pacientes (edad al inicio, sexo, causa, tipo de cardiopatía o de intervención quirúrgica, lesión residual ni inicio de nutrición enteral) correlacionada con el débito inicial ni con la evolución del proceso.
ComplicacionesLas complicaciones observadas en posible relación con el quilotórax fueron sepsis en 3 (12,5%) pacientes, alteraciones hemodinámicas por depleción de volumen en 2 (8,3%) pacientes e hipoalbuminemia en 3 (12,5%) pacientes. Los casos en que aparecieron alteraciones hemodinámicas estaban en el postoperatorio de cirugía cardíaca, por lo cual no se puede atribuir exclusivamente a una depleción de volumen dichas alteraciones. Los pacientes con hipoalbuminemia entraron en esta situación a pesar de una reposición sistemática del líquido drenado con seroalbúmina intravenosa; no se pudo estudiar las diferencias en la forma de efectuar la reposición. No se realizó determinación de concentraciones de inmunoglobulinas, si bien todos los pacientes que sufrieron sepsis tenían factores de riesgo para infección, como la ventilación mecánica o la sonda vesical, entre otros. Ninguno presentaba linfocitopenia. No se ha podido determinar el posible foco de origen de estas sepsis. En 2 de estos pacientes no se aisló el germen causal y el diagnóstico fue de sepsis clínica. En el otro, el paciente con pluripatología, se produjeron dos episodios con aislamiento en sangre de Enterobacter cloacae y Pseudomonas aeruginosa.
Encontramos 16 pacientes portadores de catéteres vasculares centrales durante la duración del episodio de quilotórax. Dos de ellos presentaron sepsis en relación con el catéter, no incluidos entre los pacientes mencionados anteriormente con sepsis. Los gérmenes encontrados fueron Staphylococcus epidermidis resistente a oxacilina en un paciente y, en el otro, un episodio por el mismo germen y otro por S. hominis.
La dieta sólo produjo una diarrea transitoria en un lactante con fórmula rica en TCM. Sólo un paciente precisó ventilación mecánica, durante 9 días, por la insuficiencia respiratoria debida al quilotórax.
Tratamiento dietéticoTras la colocación del drenaje pleural, se inició dieta exenta de grasas o, en el caso de lactantes alimentados con fórmula artificial, se empleó una con predominio de TCM. Sólo en 3 pacientes no se instauró dieta, por rápida evolución favorable o por decisión facultativa.
La duración del tratamiento dietético fue de entre 5 y 35 días, media±desviación estándar (DE) de 14,9±9,3 días; algunos continuaron en su domicilio sin constar cuánto tiempo adicional. No se reintrodujo la dieta normal hasta la resolución del quilotórax en caso de respuesta.
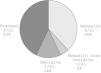
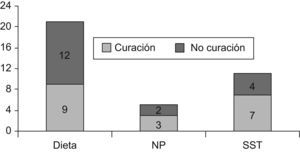
De los 12 (57,1%) pacientes con respuesta inicial favorable (fig. 1), ésta se produjo en los primeros 5 días de dieta en 9 (75%) casos. Se observó que de los 9 pacientes en los que se dio por fracasado el tratamiento dietético, en 6 de ellos se esperó menos de 5 días para tomar la decisión de añadir otro tratamiento. Esto se debió a la situación clínica general de gravedad o inestabilidad en uno o varios aparatos o sistemas, según apreciación de su médico responsable, quien optó por dejar en nutrición parenteral total o añadir somatostatina. Finalmente, se obtuvo una tasa de curación con tratamiento dietético de 9/21 (42,9%).
Nutrición parenteralLa nutrición parenteral (NP) con dieta absoluta se usó como tratamiento de segunda línea en 4 pacientes y de entrada en 1 paciente. Su duración varió entre 8 y 34 días (media±DE, 16±11). Hubo 3 pacientes con respuestas favorables, 2 de ellos en menos de 4 días. En 2 casos se consideró fracaso de la NP con menos de 4 días de tratamiento. Se reintrodujo la nutrición enteral sin esperar a la resolución completa. No se observaron recidivas.
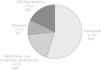
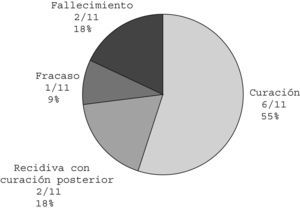
Terapia farmacológica: somatostatina y análogosEl tratamiento con SST se empleó en 10 pacientes y con octreotida en uno (en total, 45,9%), en 3 casos, iniciado antes del sexto día de evolución. La duración varió entre 2 y 29 días (media±DE, 12,7±8,1); 8 pacientes respondieron al tratamiento, 2 fallecieron y en uno fracasó (fig. 2). Este caso se trata del paciente con un trombo auricular derecho, y en él se obtuvo respuesta con una perfusión de heparina a 20U/kg/h durante 5 días.
Dos pacientes presentaron recidiva del quilotórax, en uno de los casos bien tolerada, por lo cual no se reinició tratamiento, en otro se resolvió con dieta.
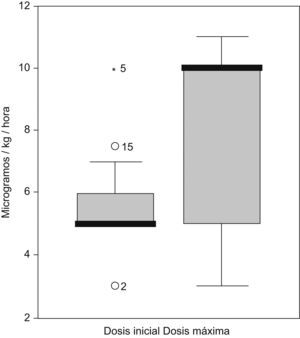
Se optó por la administración en perfusión continua en todos los casos. La dosis inicial fue de media 5,5±2μg/kg/h, entre 3 y 10. La dosis máxima alcanzada fue de entre 3 y 11μg/kg/h, en 7 casos por encima de 5μg/kg/h (media, 8,1±2,9). La diferencia es estadísticamente significativa (p=0,027) para el test de Wilcoxon (fig. 3). El aumento y el descenso de dosis se hizo de forma empírica. La respuesta casi universal al tratamiento con SST no permitió comparar las características de los pacientes respondedores y no respondedores.
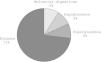
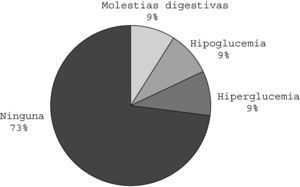
Las complicaciones relacionadas con el uso de SST (fig. 4) no tuvieron repercusiones significativas y se resolvieron con descenso de dosis o suspensión transitoria del tratamiento.
La comparación de los pacientes tratados inicialmente con dieta con aquellos en los que se inició la SST antes del sexto día de evolución dio como resultado que estos últimos tuvieron un mayor débito total (media, 374,5±1.198,7ml contra 2.611,6±3.914,1ml; p=0,004) y, probablemente, una mayor duración del cuadro (media, 10,6±10,1 días contra 20,3±14,6 días; p=0,056).
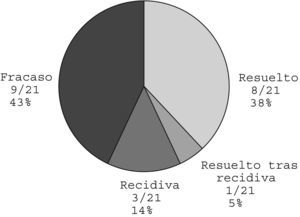
Comparación de tratamientos y factores predictores de respuestaEn la comparación de diversas características de los pacientes (sexo, etiología, cardiopatía e intervención quirúrgica), no se consiguió determinar ningún factor predictor de fracaso de la dieta sin grasas ni de recidiva en ninguno de los tratamientos. La comparación de los resultados de las distintas terapias empleadas aparece en la figura 5.
Evolución de los pacientesEn 21 casos se produjo una resolución completa del proceso. En un paciente se produjo una recidiva del derrame pleural sin repercusión respiratoria, por lo cual no se reinstauró tratamiento.
Dos pacientes fallecieron. Uno de ellos por sepsis con fallo multiorgánico, probablemente no relacionada directamente con su quilotórax, que ya estaba prácticamente resuelto y había tenido un moderado débito. El otro paciente falleció por insuficiencia respiratoria resistente.
Por último, en ninguno de nuestros pacientes se emplearon técnicas quirúrgicas específicas para la resolución del proceso.
DiscusiónLa causa más frecuente en nuestro estudio es la cirugía cardíaca o torácica, como se describe en la literatura disponible8,11,13. La proporción de los distintos tipos de cardiopatías y de las intervenciones correspondientes difiere de la publicada por Chan et al8, en cuya serie predominan (más de la mitad de los casos) las lesiones obstructivas al tracto de salida del ventrículo derecho. Esta diferencia se podría explicar por los distintos tipos de pacientes aceptados en cada centro, entre otras causas.
La localización predominante del derrame en el lado izquierdo hace pensar en un predominio de la lesión directa del conducto torácico, si bien es difícil valorar en qué medida un aumento de presión en la cava superior por fallo cardíaco pudo incidir en algunos casos. En un paciente, un trombo en la aurícula derecha pudo actuar como mecanismo obstructivo al drenaje venoso.
El análisis de los datos de débito y de las complicaciones muestra que se trata de una afección con una gran variabilidad en su presentación. Es preciso considerar la posibilidad de su aparición incluso varias semanas tras el posible desencadenante. Ningún paciente falleció claramente en relación con su quilotórax, lo que coincide con lo descrito en toda la literatura, que muestra una baja mortalidad. No hemos encontrado datos en la literatura para comparar resultados en cuanto a cifras de complicaciones. En todo caso, dada la complejidad de estos pacientes, es difícil achacar exclusivamente al quilotórax su aparición.
El tratamiento dietético se fundamenta en la observación de que una dieta baja en grasas, o con predominio de TCM, disminuye el flujo linfático, lo que favorece la curación del quilotórax. En nuestro caso, el porcentaje de curaciones fue inferior al observado en otros estudios, que hablan de hasta un 80%9. En todo caso, ninguno de ellos se trata de estudios prospectivos ni ensayos clínicos aleatorizados. Nuestros resultados se puede explicarlos por varios motivos: en primer lugar, según nuestros datos y los de otros autores11, parecería razonable esperar, al menos, 5 días para valorar la respuesta a la dieta, si la situación clínica lo permitiera; esto no fue posible en una elevada proporción de pacientes. Por otra parte, la duración del tratamiento dietético fue corta en comparación con las recomendaciones de la literatura11, que la sitúan entre 3 y 6 semanas, si bien ningún estudio avala una duración concreta. En algunos pacientes se optó por la nutrición parenteral total como sustituto de la nutrición enteral. El tiempo necesario para observar una respuesta favorable fue similar al de la dieta exenta de grasas.
La somatostatina es una hormona sintetizada en diversas localizaciones del organismo. En el intestino, disminuye las secreciones, enlentece el tránsito y disminuye el flujo sanguíneo10. Por esto último produce una disminución del flujo linfático, y favoreie la curación del derrame quiloso. Faltan ensayos clínicos diseñados para demostrar su eficacia y para establecer dosis, duración del tratamiento y vía y forma óptimas de administración, aunque se viene utilizando desde los años noventa11. Cabe destacar que encontramos una diferencia estadísticamente significativa entre la dosis inicial empleada y la dosis máxima, por lo cual podría ser necesario aplicar, de entrada, una dosis mayor que la habitual en nuestra unidad. Posteriormente, han aparecido análogos como la octreotida, con una mayor vida media y, aparentemente, menor incidencia de efectos secundarios12–14. Los efectos secundarios descritos para la somatostatina y análogos son: exantema, náuseas, diarrea, elevación de transaminasas, obstrucción intestinal, distensión abdominal transitoria, enterocolitis necrosante, hipotiroidismo transitorio, hipoglucemia e hiperglucemia. Comparando con los datos de Roehr et al11, coincidimos en el elevado porcentaje de respuestas positivas, la observación de que la respuesta se daba en los primeros 5 o 6 días, la buena tolerancia al tratamiento y las dosis empleadas. Sin embargo, en nuestra serie se trató a los pacientes de forma más prolongada (aproximadamente una diferencia de 12 contra 8 días de media). No se debe emplear el estudio de Roehr et al11 ni el nuestro como estimador de eficacia de tratamientos ni de incidencia de complicaciones.
En conclusión, en nuestro estudio no hemos encontrado características de los pacientes que permitan predecir la evolución de su quilotórax. No hemos podido correlacionar la aparición de lesión residual, en los casos de cirugía cardíaca, ni el inicio de alimentación enteral con una evolución distinta.
La mortalidad en relación con el quilotórax en nuestra serie fue nula. Por el contrario, encontramos una serie de complicaciones destacables: sepsis en 3 de los 24 pacientes (12,5%), hipoalbuminemia en 3 (12,5%) casos y trastornos hemodinámicos en 2 (12,5%). Se produjo sepsis en relación con el catéter en 2 de los 16 pacientes que lo tenían durante la ocurrencia del quilotórax (12,5%).
El tratamiento con dieta exenta de grasas o rica en TCM conllevó la resolución del quilotórax en 9 de los 21 pacientes en los que se aplicó (43%). En 9 de los 12 casos en los que se produjo respuesta inicial al tratamiento dietético (75%), ésta se observó en los primeros 5 días. En 3 de 5 pacientes se produjo la curación con el uso de nutrición parenteral total.
En 8 de 11 pacientes en los que se aplicó la somatostatina se observó una curación del quilotórax (73%). Se observaron efectos secundarios en 3 de estos 11 pacientes (27%): hipoglucemia, hiperglucemia y molestias digestivas.
No encontramos ningún factor pronóstico de respuesta a los diversos tratamientos.