La pubertad precoz periférica (PPP) es el resultado de la aparición anormalmente precoz de la pubertad, debido al aumento de esteroides sexuales sin evidenciarse activación del eje hipotálamo-hipófiso-gonadal. Es una patología mucho más infrecuente que la pubertad precoz central (PPC) y es secundaria a trastornos de origen genético o a patologías adquiridas muy heterogéneas.
En los últimos años, los avances moleculares han contribuido notablemente en el conocimiento de la fisiopatología de algunos de estos trastornos, muy en particular, en el síndrome de McCune-Albright y la testotoxicosis. Asimismo, las técnicas de imagen y de cuantificación hormonal han permitido mejorar el diagnóstico precoz de trastornos adquiridos, especialmente, patología tumoral causante de PPP.
Desafortunadamente, los avances médicos objetivados en el diagnóstico no se han visto reflejados en el tratamiento médico del síndrome de McCune-Albright y la testotoxicosis. A pesar de haber probado diversas opciones terapéuticas en ambos trastornos, a día de hoy, los resultados son muy desalentadores, especialmente en el síndrome de McCune-Albright. A nuestro entender, este fracaso se sustenta en la ausencia de ensayos clínicos bien diseñados con la inclusión de un número adecuado de pacientes seguidos hasta el final de su crecimiento.
Peripheral precocious puberty (PPP) is the result of the presence of precocious puberty due to the increase of sex steroids with no evidence of activation of the hypothalamic-pituitary-gonadal axis. It is much less common than central precocious puberty (CPP) and it is secondary to either genetic disorders or very heterogeneous acquired diseases.
In recent years, molecular advances have made remarkable progress in understanding the pathophysiology of some of these disorders, most notably in McCune-Albright syndrome and testotoxicosis. In addition, new imaging techniques and better hormone assays have improved the early diagnosis of acquired disorders, particularly tumour disease causing PPP.
Unfortunately, medical advances in the diagnosis of these disorders have not been reflected in the medical treatment of McCune-Albright syndrome and testotoxicosis. Despite having tried various treatment options in both disorders, the results are very disappointing, especially in patients with McCune-Albright syndrome. To our knowledge, this failure is based on the absence of well-designed clinical trials that include an adequate number of patients followed up until the end of their growth.
El término pubertad precoz periférica (PPP) se utiliza para designar aquellos cuadros clínicos de pubertad precoz (aparición de caracteres sexuales junto a adelanto de la maduración ósea y aceleración del crecimiento antes de los 8 años en niñas y 9 años en niños) que no son mediados por el eje hipotálamo-hipófiso-gonadal; es decir, aquellas situaciones en las que no hay elevación de gonadotropinas1–4.
A diferencia de lo que ocurre con la pubertad precoz central (PPC)5, no hay datos epidemiológicos generales sobre PPP. Tampoco existen datos de incidencia y prevalencia de algunos trastornos específicos como el síndrome de McCune Albright (SMA) y la testotoxicosis.
EtiopatogeniaMucho más infrecuente que la PPC, puede ser de origen genético o adquirido (véase tabla 1).
Clasificación etiológica de la pubertad precoz periférica
| Niño |
| Genética |
| Variantes de LHR (testotoxicosis) |
| Hiperplasia suprarrenal congénita |
| Mutación gen DAX1 |
| Adquirida |
| Tumor testicular/suprarrenal |
| Tumores productores de β-HCG |
| Esteroides sexuales exógenos |
| Niña |
| Genética |
| Síndrome de McCune-Albright (muy raro en niños) |
| Adquirida |
| Quiste ovárico |
| Tumor ovárico/suprarrenal |
| Esteroides sexuales exógenos |
| Niño/niña |
| Hipotiroidismo primario (excepcional) |
La forma congénita más frecuente de PPP es la hiperplasia suprarrenal congénita en el varón, ya que produce un exceso de andrógenos y, secundariamente, aparición de caracteres sexuales masculinos de manera precoz. En este trabajo, nos centraremos en otros trastornos genéticos causantes de PPP.
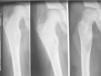
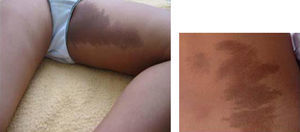
Síndrome de McCune-AlbrightDesde la descripción inicial de McCune y Albright en 19366,7 hasta el momento actual, el conocimiento de la fisiopatología y las bases moleculares de este síndrome se han desarrollado extraordinariamente. De manera que, aunque tradicionalmente se describía la tríada clásica de PPP, manchas café con leche y displasia fibrosa ósea (figs. 1 y 2), en la actualidad, se considera un síndrome heterogéneo con un amplio espectro de manifestaciones endocrinas y no endocrinas8-10.
Este cuadro clínico se produce por una mutación somática activante de la subunidad α de la proteína G (20q13.2), primordial en la señalización intracelular de células endocrinas y de otros tejidos11. En la mayoría de las ocasiones, se trata de una mutación sin sentido ocasionada por una sustitución de una arginina en posición 201 por una histidina. Con menor frecuencia podemos encontrar una serina, leucina o glicina sustituida por una histidina. Por otra parte, es preciso reseñar que aquellas mutaciones que aparecen en etapas precoces de la embriogénesis presentan una distribución muy amplia en distintos tejidos, constituyendo un fenotipo más severo, mientras que las mutaciones que ocurren más tardíamente en el desarrollo afectan a menor número de tejidos y, por consiguiente, presentan un fenotipo más leve o incompleto12. Por tanto, la expresividad clínica es muy heterogénea y, en ocasiones, no es fácil encontrar la triada clásica ni descubrir la mutación en sangre periférica, lo que puede complicar el diagnóstico8-10.
La presencia de pubertad precoz es la anomalía endocrina más frecuente asociada a este síndrome, apareciendo entre los 2 y 6 años. Este cuadro se caracteriza por aparición de telarquia fluctuante junto con episodios cíclicos de sangrado vaginal y aceleración de la velocidad de crecimiento. Es preciso reseñar que en este síndrome no es habitual una progresión puberal normal; es decir, pueden aparecer episodios repetitivos de sangrado vaginal sin un desarrollo mamario importante. Estos episodios cíclicos son fruto de la alteración de la subunidad α de la proteína G que resulta en una activación del ovario, formando quistes productores de estrógenos. De esta forma, la resolución espontánea de estos quistes produce una caída de los estrógenos seguida de episodios de sangrado vaginal8.
La evolución natural de esta entidad es muy variable, alternando periodos asintomáticos con otros de frecuentes sangrados vaginales. Así, en los episodios de sangrado vaginal abundante será necesario descartar la presencia de quistes ováricos de gran tamaño que puedan producir torsión ovárica. Por otra parte, estas niñas presentan un mal pronóstico de talla ya que desarrollan una aceleración progresiva del crecimiento con una fusión precoz de las epífisis. De manera infrecuente pueden desarrollar otros trastornos endocrinos, como hipercortisolismo, hipertiroidismo, acromegalia, hiperplasia adrenal autónoma y osteomalacia hipofosfatémica8-10.
La manifestación clínica no endocrina más frecuente del SMA es la displasia ósea, que condiciona una morbimortalidad considerable por la presencia de dolores óseos importantes y por el incremento notable del riesgo de fracturas patológicas y de transformación sarcomatosa maligna. No obstante, en los últimos años se está mejorando notablemente la calidad de vida de estos pacientes gracias al empleo de bifosfonatos8.
Los niños afectos de SMA pueden presentar macroorquidismo sin otros signos clínicos ni biológicos de pubertad precoz. Este hecho es debido a mutaciones de la subunidad α de la proteína G que se presentan únicamente en las células de Sertoli, produciendo una hipertrofia de estas. De forma infrecuente, menos del 15% de las ocasiones, los niños con SMA asocian PPP. Esta expresividad clínica tan diferente observada en niños y niñas parece que pudiera estar relacionada con un fenómeno de imprinting, de tal forma que si la mutación se expresa en células de Sertoli conduce a macroorquidismo, mientras que si lo hace en las células de Leydig se expresaría como PPP8,9.
Testotoxicosis o pubertad precoz familiar del varónEs una forma de PPP isosexual e independiente de la activación de LHRH, que acontece únicamente en varones y es producida por elevación de los niveles de testosterona de forma autónoma, condicionando la aparición de caracteres sexuales secundarios en los varones afectos de forma muy precoz (entre el primer y cuarto año de vida), con incremento de la velocidad de crecimiento y aceleración de la maduración ósea13.
Esta perturbación precoz de la síntesis de testosterona es producida por una mutación activante del receptor de LH que se hereda de forma dominante, aunque pueden existir mutaciones de novo, afectando únicamente a varones14.
La testotoxicosis puede producir trastornos psicológicos en el niño afectado, derivados de la activación muy precoz de la pubertad, así como virilización rápida, cierre prematuro epifisario y talla baja adulta. Por otro lado, estos pacientes pertenecen al grupo de PPP, pero a diferencia del resto de entidades causantes de PPP en el varón, en este caso existe aumento de tamaño testicular bilateral, lo que puede hacer sospechar una PPC. No obstante, la ausencia de elevación de LH tras test de estimulación junto a los antecedentes familiares, deben orientarnos a este cuadro clínico13,15.
Hipoplasia suprarrenal congénita por mutación del gen DAX1 (dosage-sensitive sex reversal, adrenal congenital hypoplasia, critical region on X chromosome)Los niños con mutaciones en DAX1 presentan insuficiencia suprarrenal por hipoplasia de estas glándulas y, típicamente, en la etapa adulta desarrollan hipogonadismo hipogonadotropo. Sin embargo, hay casos descritos de PPP en la primera infancia. Este hecho parece estar relacionado con los niveles tan elevados de ACTH existentes que pudieran actuar sobre la célula de Leydig, estimulando la síntesis de testosterona. Por tanto, las mutaciones del gen DAX1 tienen un efecto dual sobre el desarrollo puberal: PPP en la infancia e hipogonadismo en la etapa adulta16, habiéndose descrito, finalmente, un efecto de mini-pubertad con aumento testicular17.
AdquiridaLa PPP adquirida es secundaria al aumento de esteroides sexuales exógenos o endógenos. Aunque es infrecuente, se han descrito sujetos que han presentado caracteres sexuales secundarios de forma precoz tras la ingesta de anticonceptivos orales o esteroides anabolizantes, así como tras el contacto, a través de la piel, con preparados que contienen estrógenos o testosterona10.
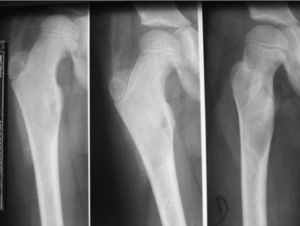
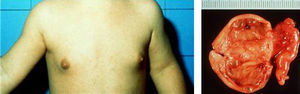
De causa endógena, en los varones hay que descartar tumores secretores de andrógenos originados en el testículo (tumores de células de Leydig) y en la glándula suprarrenal. Por otro lado, en las niñas con signos de PPP es menester descartar tumores secretores de estrógenos localizados en ovario (fig. 3) o en glándula suprarrenal, sin olvidar la posible presencia de quistes ováricos funcionales benignos como causa de hiperestrogenismo10,18-20.
A) Lactante de 18 meses de edad que, en el momento del diagnóstico, presenta aceleración del crecimiento desde hace 5 meses (talla en +5 SDS), acompañada de telarquia bilateral y sangrado vaginal. Nótense la telarquia y el incremento de pigmentación areolar bilaterales. B) Pieza de ovario izquierdo. El estudio anatomo-patológico reveló que existía un luteoma.
Los tumores germinales productores de gonadotropina coriónica humana (HCG) son capaces de producir PPP en los varones ya que la HCG tiene un efecto similar a la hormona luteinizante sobre el testículo, estimulando la síntesis de testosterona. Estos tumores se localizan fundamentalmente en hígado, cerebro, mediastino y gónadas. Por el contrario, en las niñas, estos tumores no son causantes de pubertad precoz porque la presencia aislada de LH, sin un aumento concomitante de FSH, es insuficiente para desarrollar clínica de este tipo10,18-20.
Evaluación diagnósticaAnamnesisDebe interrogarse sobre la aparición cronológica de los diferentes caracteres sexuales.
Debe valorarse la existencia o no de aceleración de crecimiento en las gráficas de talla para edad y sexo.
Debe preguntarse sobre la existencia de síntomas de hipertensión intracraneal (cefalea, vómitos, disminución de la agudeza visual).
Debe conocerse la posibilidad de haber ingerido fármacos que contengan esteroides sexuales.
Debe demandarse información a los padres acerca de su talla (cálculo de talla diana) y de su desarrollo puberal, incluyendo también abuelos, tíos y hermanos del caso índice3,4,18-20.
Examen físicoAnte cualquier paciente con sospecha de PPP será preciso recoger las siguientes variables 3,4,18-20.
- –
Peso, talla, velocidad de crecimiento, índice de masa corporal.
- –
Presión arterial, frecuencia cardiaca.
- –
Acné, vello corporal, estrías.
- –
Presencia de bocio.
- –
Palpación abdominal (tumor suprarrenal, hepático, ovárico) (fig. 3).
- –
Estadio puberal de Tanner.
- –
Palpación y medición de testículos para descartar asimetría testicular.
- –
Manchas café con leche (fig. 1).
La determinación de gonadotropinas basales y tras estímulo con LHRH (100μg/m2 iv) es primordial para el diagnóstico diferencial entre PPC y PPP. Si bien no existe unanimidad en la comunidad científica internacional sobre el punto de corte de LH para definir PPC y PPP, la mayoría de autores lo sitúan entre 5 y 8 U/l3,4,21.
Además del estudio de gonadotropinas basales y tras estímulo, existen otras determinaciones sanguíneas que servirán de complemento en el diagnóstico diferencial de PPP3,4,18-20; son las que siguen:
- –
Testosterona: sus niveles séricos son de utilidad para el diagnóstico de pubertad precoz en el niño. Así, valores por encima de 0,5ng/ml se consideran en rango puberal.
- –
17-β-estradiol: escasa sensibilidad, ya que valores normales, no descartan pubertad precoz; sin embargo, se encuentra muy elevada en presencia de tumores ováricos y suprarrenales productores de estrógenos, así como ante quistes ováricos aislados o asociados a SMA.
- –
DHEA-S, androstendiona (Δ4) y 17-OH-progesterona: útiles en el niño con sospecha de pubertad precoz. Si encontramos cifras de DHEA-S por encima de 700μg/dl en un niño en edad prepuberal, es altamente sugerente de tumor suprarrenal. Elevaciones moderadas, tras prueba de imagen normal, nos obligan a descartar una hiperplasia suprarrenal de presentación tardía.
- –
β-HCG (fracción β de gonadotropina coriónica humana): de utilidad como marcador tumoral en casos de pubertad precoz periférica con tamaño testicular menor de 4ml en el que no se encuentra alteración testicular ni suprarrenal (cuando se trata de tumores germinales extragonadales: hígado, mediastino, cerebro). Los tumores germinales testiculares productores de β-HCG producen asimetría testicular (a veces tamaño testicular>4ml).
- –
T4 libre y TSH: para descartar hipotiroidismo primario, causa excepcional de pubertad precoz.
Por otra parte, disponemos de una serie de pruebas de imagen de enorme utilidad para el diagnóstico diferencial de las distintas formas de pubertad precoz3,4,18-21:
- –
Cálculo de la edad ósea mediante radiografía de mano-muñeca izquierda: en los casos de pubertad precoz hay paralelamente aceleración de la edad ósea, en comparación con las variantes de la normalidad. No obstante, en casos de reciente diagnóstico de PPP, la edad ósea puede ser similar a la edad cronológica.
- –
Ecografía testicular: se realizará siempre que haya sospecha de pubertad precoz en el varón que presenta asimetría testicular. Asimismo en situaciones de sospecha de pubertad precoz con elevación de testosterona y volumen testicular inferior a 4ml.
- –
Ecografía abdominal: de utilidad para valorar área suprarrenal, tanto en sospecha de tumores virilizantes en el varón, como en niñas con sospecha de pubertad precoz periférica por un tumor productor de estrógenos. Asimismo se realizará cuando haya indicios de tumor hepático productor de β-HCG.
- –
Ecografía pélvica: se realizará en todos los casos de pubertad precoz. Por un lado, permite descartar patología causante de PPP (tumores ováricos, quistes ováricos) y, por otro, valora la existencia de signos de impregnación estrogénica.
- –
RM craneal: de obligada realización en todos los casos de PPC, tanto en niños como niñas. También se efectuará en casos de PPP en el niño por sospecha de tumor productor de β-HCG extragonadal no hepático.
- –
Serie ósea: para excluir la presencia de displasia fibrosa asociada a SMA.
- –
Estudio del gen del receptor de LH (LHR) en la testotoxicosis.
- –
Estudio del gen DAX1 ante la sospecha de una hipoplasia suprarrenal congénita.
- –
Estudio gen la subunidad α de la proteína G: la rentabilidad en sangre periférica es modesta. Por lo que es de interés efectuar el estudio en tejidos afectos (ovario, hueso).
Desarrollo mamario uni o bilateral antes de los 8 años de edad, sin evidencia de otros signos de pubertad precoz tales como: aceleración del crecimiento, edad ósea incrementada y aparición de vello púbico y/o axilar. Es una entidad relativamente frecuente, con una incidencia de hasta 21,2 casos por 100.000/año. En la mayoría de ocasiones (hasta un 60%) aparece antes de los 2 años de edad y tiende a la regresión espontánea (entre 6 meses a 6 años). El otro pico de presentación es entre los 5 y 7 años, y es en estas situaciones donde se han descrito mayor porcentaje de telarquias exageradas y mayor prevalencia de pacientes (hasta un 14% según las series) que pueden progresar a un cuadro clínico de PPC.
A día de hoy, la etiología de este trastorno es desconocida, aunque se barajan varias hipótesis: a) activación transitoria parcial del eje hipotálamo-hipofisario-gonadal, con aumento de niveles séricos de FSH; b) fallo de la involución folicular con o sin formación ovárica quística; c) sensibilidad excesiva del tejido mamario a la misma cantidad de estrógenos; d) contaminantes ambientales o productos alimentarios con actividad estrogénica; e) posibles formas incompletas de SMA (en particular, formas muy floridas de telarquia prematura)22,23.
Menarquia prematura aisladaProceso de sangrado vaginal periódico en niñas de edades comprendidas entre 1 y 9 años, sin acompañarse de otros signos de desarrollo sexual secundario. De etiología desconocida, aunque se especula con las mismas teorías que en el caso de la telarquia prematura. Se trata de un diagnóstico de exclusión donde previamente deben descartarse otras entidades que cursan con sangrado periódico: síndrome de McCune-Albright, procesos tumorales vaginales o uterinos, enfermedad inflamatoria pélvica, cuerpo extraño en vagina o exposición a estrógenos exógenos22–24.
TratamientoAnte procesos adquiridos de PPP, se procederá, si es posible, a resolver la causa (quistes, tumores, esteroides exógenos).
Una atención especial merece el tratamiento del SMA y de la Testotoxicosis (tablas 2–4).
Fármacos utilizados en el tratamiento del síndrome de McCune-Albright
| Fármaco | Año publicación (referencia bibliográfica) | Diseño/tamaño muestral | Duración estudio | Eficacia | Efectos secundarios |
| Testolactona (40mg/kg/día) | 199327 | Estudio piloto12 niñas | 3 años | DudosaFrecuente activación central de la pubertadIncumplimiento terapéutico frecuente | Dolor abdominalCefaleaDiarrea Hipertransaminasemia |
| Fadrozol (240-480μg/kg/día) | 200328 | Estudio piloto16 niñas | 2-3 años | IneficazFrecuente activación central de la pubertad | Dolor abdominalInhibición de la síntesis de cortisol y aldosterona |
| Tamoxifeno (20mg/día) | 200331 | Estudio piloto28 niñas | 1 año | Disminución significativa de sangrado vaginal Desaceleración de la velocidad de crecimiento y de la maduración ósea | Aumento de tamaño uterino y ovárico durante el tratamiento |
| Letrozol (1,5-2mg/m2/día) | 200729 | Estudio piloto9 niñas | 1-3 años | Disminución significativa de sangrado vaginal Desaceleración de la velocidad de crecimiento y de la maduración ósea | Aumento de tamaño ováricoIncremento de quistes ováricosUna niña presentó rotura de quiste ovárico tras 2 años de tratamiento |
| Anastrozol (1mg/día) | 200830 | Estudio piloto28 niñas | 1 año | Ineficaz | Bien tolerado |
Fármacos utilizados en el tratamiento de testotoxicosis
| Fármaco | Año publicación (referencia bibliográfica) | Diseño/tamaño muestral | Duración estudio | Eficacia | Efectos secundarios |
| Espironolactona (5,7mg/kg/día)+ testolactona (40mg/kg/día) | 199933 | Estudio descriptivo10 niños | 6 años | No hay datos sobre talla adultaDesaceleración de la velocidad de crecimientoEstabilización de la edad óseaEl 100% presenta activación central de la pubertad | Testolactona: dolor abdominal, cefalea, diarrea, hipertransaminemiaEspironolactona: cefalea, hipercaliemia, molestias intestinales, cefalea |
| Ketoconazol (15-20mg/kg/día) | 200515 | Estudio descriptivo5 niños | 5-9 años | Talla adulta acorde con talla genéticaNingún caso de activación central de la pubertad | Hipertransaminasemia transitoria en un paciente |
| Ketoconazol (10mg/kg/día) | 200834 | Estudio descriptivo5 niños | 5 a 8 años | Eficacia modesta: menos de un 50% alcanza talla adulta acorde con talla genética.El 40% presenta activación central de la pubertad | No descritos |
| Ciproterona (70mg/m2/día) | 200834 | Estudio descriptivo5 niños | 5 a 8 años | Eficacia modesta: menos de un 50% alcanza talla adulta acorde con talla genéticaEl 40% presenta activación central de la pubertad | No descritos |
| Bicalutamida (50mg/día)+ anastrozol (1mg/día) | 200635 | Estudio descriptivo2 casos | Paciente 1: 44 mesesPaciente 2: 17 meses | No hay datos de talla adultaReducción significativa de VC y madurez óseaNecesidad de análogos de GnRH en 1 de los casos | No descritos |
| Anastrozol (1mg/día)+ ciproterona (70mg/m2/día) | 200836 | Estudio descriptivo2 niños | 4 años | No hay datos de talla adultaReducción significativa de VC y de madurez ósea | No descritos |
| Bicalutamida (50mg/día)+ letrozol (2,5mg/día) o anastrozol (1mg/día) | 201037 | Estudio descriptivo2 casos | 5 años | No hay datos de talla adultaReducción significativa de VC y madurez óseaNecesidad de análogos de GnRH en los 2 casos | No descritos |
| Bicalutamida (12,5, 25, 50 o 100mg/día)+ anastrozol (0,5 o 1mg/día) | 201038 | Estudio piloto en fase II en 14 pacientes | Evaluación del primer año de terapia | Reducción muy modesta de VCReducción moderada de la maduración óseaEl 43% precisa asociar análogos de GnRH | Ginecomastia en 6 pacientes.Dolor de mamas en 2 pacientes.Elevación transitoria de transaminasas en un paciente.Dolor muscular en un paciente |
Dosis y coste de distintos fármacos utilizados en el tratamiento de la pubertad precoz periférica
| Mecanismo de acción | Dosis habituales | Intervalo de dosis (h)/presentación (mg) | Coste mensual aproximado (euros)a | |
| Ketoconazol | Inhibidor enzima p450 | 15-20mg/kg/día | 8/200 | 84 |
| Espironolactona | Antiandrógeno débil | 2-5mg/kg/día | 12/100 | 51 |
| Ciproterona | Progestágeno con acción antiandrogénica | 70mg/m2/día | 24/50 | 41 |
| Bicalutamida | Potente antiandrógeno no esteroideo | 2mg/kg/día | 24/50 | 96 |
| Testolactona | Inhibidor de aromatasa de primera generación | 20-40mg/kg/día | 6/50 | 1528 |
| Anastrozol | Inhibidor de aromatasa de tercera generación | 1mg/día | 24/1 | 282 |
| Letrozol | Inhibidor de aromatasa de tercera generación | 2,5mg/día | 24/2,5 | 293 |
| Tamoxifeno | Bloqueante del receptor de estrógenos | 20mg/día | 24/20 | 8 |
| Triptorelina | Análogo de GnRH | 80-120 (g/kg/mes) | Mensual/presentación: 3,75mg/1ml | 162 |
Cálculo basado en una dosis para 30kg, 130cm y superficie corporal de 1 m2 (peso y talla media de un niño de 9 años). Adaptado de Lenz et al37.
Los objetivos del tratamiento en este tipo de pacientes serán evitar trastornos psicológicos derivados de un adelanto puberal, frenar los sangrados cíclicos y conseguir un buen pronóstico de talla final. A día de hoy, desafortunadamente, no existe ningún tratamiento que haya demostrado cumplir dichos objetivos en este tipo de pacientes, debido a varias razones: a) inexistencia de ensayos clínicos aleatorizados; b) estudios piloto, sin grupo control, con un número muy reducido de pacientes; c) ausencia de datos de talla adulta, y d) en muchas ocasiones, es necesario asociar análogos de GnRH al presentar secundariamente una activación central de la pubertad (PP mixta)3,4,10,25.
Para el tratamiento de esta entidad, clásicamente, se han utilizado dos grupos terapéuticos: inhibidores de la aromatasa e inhibidores del receptor de estrógenos (véase la tabla 2). Así, a mediados de los años ochenta, aparecieron datos prometedores en 5 niñas tratadas con un inhibidor de aromatasa de primera generación, la testolactona26; sin embargo, el seguimiento a largo plazo de este mismo grupo de pacientes mostró que los sangrados vaginales no se detenían y persistía la recurrencia de quistes ováricos, con el riesgo de torsión que esto supone. Además, el cumplimiento terapéutico no era el adecuado debido a la ingente cantidad de pastillas diarias que debían tomar27. Con posterioridad, se diseñó un nuevo estudio piloto en 16 pacientes con fadrozol (inhibidor de segunda generación) obteniendo, de igual forma que con testolactona, unos resultados desalentadores junto a un efecto inhibidor dependiente de la dosis de la síntesis de cortisol y aldosterona28.
Más recientemente, aparecieron los inhibidores de tercera generación: letrozol y anastrozol. En un estudio de 9 pacientes con SMA tratadas con letrozol durante 12 a 36 meses se mostró una desaceleración de la velocidad de crecimiento, una disminución de la edad ósea, así como una reducción en el número de sangrados vaginales. No obstante, durante el estudio se objetivó un aumento del tamaño ovárico, así como un incremento de la formación de quistes ováricos, con un caso descrito de rotura de un quiste tras 2 años de tratamiento29. Teniendo en cuenta estas últimas observaciones, habrá que esperar nuevos datos en mayor número de pacientes con un periodo de estudio más prolongado. Respecto al anastrozol, recientemente se ha constatado su ineficacia en el tratamiento de la PPP30.
El otro fármaco utilizado en el tratamiento médico de estas pacientes ha sido el tamoxifeno, un inhibidor del receptor de estrógenos. Los datos preliminares, tras un año de tratamiento, de un estudio piloto con tamoxifeno publicado en 200331 parecían alentadores, a pesar de haber objetivado aumento de tamaño uterino y ovárico durante el período de estudio. Sin embargo, llama la atención que desde el año 2003 no se hayan comunicado nuevos datos.
Por otra parte, no existe un consenso firme en cuanto a la actitud terapéutica ante la presencia de quistes ováricos en estas pacientes. En este sentido, parece que la tendencia actual ante la presencia de un quiste en una niña o adolescente es considerar la realización de punción-aspiración del mismo, mediante laparoscopia, cuando supere un volumen de 20ml (3,2cm de diámetro) y, muy especialmente, cuando supere 75ml (5,2cm de diámetro) dado el enorme riesgo de torsión ovárica existente32. Estas consideraciones podrían ser perfectamente aplicables a niñas afectas de SMA, donde el riesgo de torsión es todavía mayor.
TestotoxicosisLos objetivos del tratamiento son similares a los del grupo anterior y, al igual que en el SMA, carecemos de ensayos clínicos aleatorizados que hayan evaluado la eficacia real de las distintas opciones terapéuticas utilizadas. Además, disponemos de pocos datos a talla adulta y, en muchas ocasiones, ha sido necesaria la asociación de análogos de GnRH (véase la tabla 3).
En esta situación, debemos actuar sobre el exceso de andrógenos existente, inhibiendo su síntesis o bloqueando su acción. De esta forma, tradicionalmente se han planteado dos formas de tratamiento9,10: a) inhibir la síntesis de testosterona mediante la utilización de ketoconazol, y b) bloquear el receptor de andrógenos e inhibir la síntesis de estrógenos, que son los esteroides sexuales que actúan directamente sobre las epífisis y producen un cierre prematuro de estas.
Actualmente, disponemos de datos de talla adulta en 5 pacientes tratados con ketoconazol. En este grupo de niños afectados de testotoxicosis, la talla final media fue de 173cm (talla diana: 175cm), el tratamiento fue bien tolerado y ninguno de los niños incluidos presentó una activación central precoz de la pubertad15. Por el contrario, no disponemos de datos de talla adulta del tratamiento que combina testolactona y espironolactona. Únicamente aparecieron datos preliminares a los 6 años de seguimiento, objetivando desaceleración de la velocidad de crecimiento y del adelanto puberal; sin embargo, todos los pacientes desarrollaron PPC y precisaron la asociación de análogos de GnRH33. Por otra parte, este régimen de tratamiento presenta el inconveniente de que su monitorización se realiza mediante parámetros clínicos (velocidad de crecimiento, maduración ósea y estadio puberal), ya que no hay cambios en los niveles de testosterona.
También se ha utilizado un progestágeno bloqueador del receptor de andrógenos (ciproterona) como única terapia de testotoxicosis, siendo bien tolerado, aunque con modestos resultados en cuanto a talla final y con activación central de la pubertad de forma precoz en un 40% de los pacientes. En este mismo trabajo, aparecen datos de talla adulta en niños tratados con ketoconazol siendo la eficacia similar a la ciproterona y con el mismo porcentaje de casos de PPC secundaria34. Esta modesta eficacia de testolactona puede ser debida a que la dosis utilizada ha sido notablemente inferior a la empleada en estudios previos15.
Con posterioridad, han ido surgiendo distintas modalidades terapéuticas que han asociado un inhibidor de aromatasa de tercera generación con bloqueadores del receptor de andrógenos35-37. Estos trabajos tienen en común el escaso número de pacientes y la ausencia de datos a talla adulta. En la misma línea, el estudio piloto en fase II BATT38 incluye a 14 pacientes a los que se les pauta tratamiento con un antiandrógeno no esteroideo muy potente (bicalutamida) a dosis progresivas, junto con un inhibidor de aromatasa de tercera generación (anastrozol). Los resultados preliminares de este estudio, tras un año de tratamiento, son muy modestos y no exentos de efectos secundarios (véase la tabla 3).
Finalmente, es preciso reseñar que tanto en el SMA como en la testotoxicosis deberemos tener en cuenta no sólo la eficacia y los posibles efectos secundarios de la terapia a instaurar, sino también la manera de dosificar los fármacos (los comprimidos son difíciles de ingerir, más aún, si es cada 6 horas) y el coste de los mismos (tabla 4). Así, por ejemplo, un paciente afecto de testotoxicosis, de unos 30kg de peso, que reciba terapia con bicalutamida y anastrozol y que, a su vez, necesite terapia con análogos de GnRH (fenómeno de escape frecuente con esta terapia), estará gastando aproximadamente 540 euros mensuales.
Áreas de controversia y perspectivas futurasDiagnóstico del síndrome de McCune-AlbrightSerá preciso continuar investigando aquellos pacientes con fenotipo no clásico (falta de todos los criterios), en especial, aquellos sujetos con telarquia prematura exagerada y test de LHRH prepuberal. Para ello, será primordial el avance en los conocimientos moleculares asociados a este trastorno y, muy en particular, en la búsqueda de métodos diagnósticos que puedan evitar la necesidad de estudios en tejidos como hueso y/o ovario.
Tratamiento del síndrome McCune-AlbrightNo hay evidencia científica suficiente para recomendar ninguna terapia en este síndrome (grado de recomendación y nivel de evidencia científica AI). Es preciso continuar con los estudios iniciados y conocer datos a talla adulta, evaluando los posibles efectos secundarios del tratamiento instaurado a más largo plazo. A la espera de conocer los resultados de estas investigaciones, será preciso individualizar cada paciente y pautar el tratamiento del que se disponga de más experiencia, teniendo en cuenta su tolerancia, así como su coste (grado de recomendación y nivel de evidencia científica CIII).
Tratamiento de testotoxicosisNo hay evidencia científica suficiente para recomendar terapia con ketoconazol en este síndrome (grado de recomendación y nivel de evidencia científica AI). No obstante, a nuestro entender, presenta una serie de ventajas sobre el resto de fármacos utilizados hasta el momento: a) datos a talla adulta; b) bien tolerado, ocasionalmente produce hipertransaminasemia transitoria a las dosis utilizadas; c) es muy infrecuente la aparición de PPC durante esta terapia; d) control de la eficacia del tratamiento no sólo mediante el seguimiento de la velocidad de crecimiento y la regresión de caracteres sexuales, sino también con los niveles circulantes de testosterona, y e) bajo coste (grado de recomendación y nivel de evidencia científica CIII).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.