El tratamiento inicial de las infecciones del tracto urinario (ITU) es empírico por lo que es prioritario conocer la resistencia antibiótica de los microorganismos más frecuentes en una población. Además, tras la sospecha de pielonefritis aguda se debe descartar la presencia de cicatriz renal que puede dar lugar a complicaciones posteriores.
Presentamos un estudio longitudinal y retrospectivo de todos los menores de 14 años diagnosticados de ITU desde el 1 de enero del 2009 hasta el 31 de diciembre del 2009. Se analizaron los datos de sensibilidad a antimicrobianos de los patógenos urinarios más importantes, el seguimiento posterior y la presencia de cicatrices.
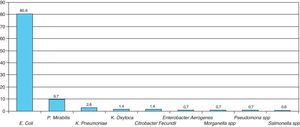
Las bacterias aisladas con mayor frecuencia fueron: Escherichia coli (80%) Proteus mirabillis (9,7%) y Klebsiella pneumoniae (4,2%). En el antibiograma, E. coli presentó una alta sensibilidad frente a fosfomicina (99,1%), cefotaxima (98,2%) cefuroxima (97,3%) y gentamicina (95,6%). La sensibilidad obtenida frente a amoxicilina-clavulánico fue del 83,2%, mientras que la obtenida frente a cotrimoxazol fue del 78,9%.
Se encontraron cicatrices pospielonefríticas en el 19% de los pacientes con ITU febril, 17% de los no ingresados y 20% de los ingresados.
The initial treatment of the urinary tract infections (UTI) is empirical and it is a priority to determine the antibiotic resistance of most common germs in a population. Furthermore, due to the suspicion of acute pyelonephritis the presence of renal scarring should be ruled out as this may lead to further complications.
A retrospective longitudinal study was performed on all children under 14 years diagnosed with UTI from January 1 2009 to December 31 2009. The in vitro susceptibility to the most important urinary pathogens was analysed, along with the presence of scars, and a subsequent follow-up.
The most frequently isolated bacteria were E. coli (80%), P. mirabilis (9.7%) and K. pneumoniae (4.2%). In the antibiogram, E coli showed a high sensitivity to fosfomycin (99.1%), cefotaxime (98.2%) cefuroxime (97.3%) and gentamicin (95.6%). The sensitivity obtained against amoxicillin-clavulanate was 83.2%, while that obtained against cotrimoxazole was 78.9%.
Post-pyelonephritis scars were found in 19% of patients with febrile UTI, 17% out-patients and 20% of those admitted.
Las infecciones del tracto urinario (ITU) constituyen una patología relativamente frecuente en la infancia, con una prevalencia de ITU en menores de dos años con fiebre del 7% y en niños hasta 19 años con síntomas urinarios del 7,8%1. Una vez establecido el diagnóstico de sospecha, se inicia antibioterapia empírica hasta conocer los resultados del urocultivo y la sensibilidad antimicrobiana. Es prioritario conocer previamente la resistencia antibiótica de una población para poder plantear un tratamiento empírico efectivo2.
El seguimiento posterior de los pacientes de riesgo es igualmente importante para identificar la presencia de cicatrices renales, indetectables si no se realizan estudios de imagen como la gammagrafía renal a los 4-6 meses de la infección3 y que pueden causar hipertensión, proteinuria, complicaciones durante el embarazo o incluso insuficiencia renal progresiva4.
Material y métodosEstudio longitudinal y retrospectivo de todos los menores de 14 años diagnosticados de ITU mediante urocultivo positivo en un hospital de nivel terciario desde el 1 de enero del 2009 hasta el 31 de diciembre del 2009. Se recogen las siguientes variables: edad, género, síntomas, tratamiento antibiótico empírico, hospitalización, resultado del urocultivo y antibiograma. Se incluyeron todos los niños con diagnóstico de ITU, independientemente de que se tratara de su primera ITU o que hubieran padecido otras con anterioridad.
La recogida de orina se realizó mediante chorro medio, previo lavado de la región genital con jabón, en niños con control de esfínteres y mediante sondaje vesical en niños sin control de esfínteres.
Las muestras de orina se cultivaron en placas de agar Columbia y agar Mac Conkey según los procedimientos de Microbiología de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). Se consideró urocultivo positivo el aislamiento de >105UFC/ml en las muestras recogidas mediante chorro medio y>104UFC/ml en las orinas recogidas mediante sondaje vesical5.
Los pacientes diagnosticados de ITU se ingresaron si cumplían los criterios del protocolo de diagnóstico y tratamiento de la infección urinaria en urgencias de nuestro hospital (tabla 1).
Criterios de ingreso de niños diagnosticados de infección de orina
| ALTO RIESGO: MANEJO INTRAHOSPITALARIO | 1.- Edad<3 meses |
| 2.- Afectación del estado general | |
| 3.- Vómitos/Deshidratación | |
| 4.- Intolerancia a la medicación o alimentación oral | |
| 5.- Antecedentes patológicos: uropatía, nefropatía, inmunodeficiencia. | |
| 6.- Alteración de la función renal o electrolitos | |
| 7.- Neuropatía grave u otra patología de base. | |
| 8.- Aspectos sociales y/o familiares: sospecha de mal control del tratamiento en el entorno familiar. | |
| RIESGO MEDIO: Si dos o más criterios: MANEJO INTRAHOSPITALARIO | • Ecografía prenatal dilatada |
| • Neutrofilia>15.000 o neutropenia<4.500 | |
| • Proteína C reactiva>50mg/L | |
| • Procalcitonina>1ng/ml | |
| •> 48h de fiebre | |
El análisis de los datos se realizó mediante el programa estadístico SPSS v17.0. Para comparar los resultados de las variables cualitativas dicotómicas, se utilizó la prueba de chi cuadrado considerando significativos valores de p< 0,05.
ResultadosSe incluyeron en el estudio 144 niños con sospecha de ITU y confirmación posterior mediante urocultivo positivo (62% niñas). La media de edad fue de 2,6 años (rango 0,01-13 años; 1,48 años en varones; 3,2 años en niñas) y la mediana de 1 año (0,3 años en varones, 2 años en niñas).
El 64% cursaron con fiebre, con una duración de la misma previa al diagnóstico de 2,2 días, el 37% presentó hiporexia, el 21% tuvo vómitos, y un 13,8% manifestaron disuria.
Las alteraciones observadas en el análisis de orina de los pacientes con urocultivo positivo dependiendo de que precisaran ingreso o no se muestran en la tabla 2, diferenciando entre los niños que cursaron con fiebre y los que no lo hicieron.
Características clínicas, analíticas y seguimiento de los niños diagnosticados de infección de orina
| INGRESADOS | NO INGRESADOS | |||
| FIEBRE N=51 | AFEBRIL N=14 | FIEBRE N=41 | AFEBRIL N=38 | |
| Sexo | V=43,1% | V=57,1% | V=24,4% | V=40% |
| Edad (mín-máx) en años | 1,16 (0,01-8) | 0,2 (0,04-0,4) | 2,8 (0,25-9) | 5,1 (0,11-13) |
| Vómitos | 21,6% | 57,1% | 19,5% | 89,5% |
| Hiporexia | 31,7% | 64,3% | 28,9% | 10,5% |
| Síndrome miccional | 7,8% | 0% | 24,4% | 76,3% |
| E. leucocitaria % (N) | 86,4% (44) | 41,7% (12) | 76,3% (38) | 75,7% (37) |
| Nitritos % (N) | 43,2% (44) | 8,3% (12) | 28,9% (38) | 24,3% (37) |
| Piuria % (N) | 86,8% (38) | 50% (10) | 73,1% (26) | 66,7% (24) |
| Bacteriuria % (N) | 68,4% (38) | 50% (10) | 73,1% (26) | 50% (24) |
| Gram % (N) | 78,9% (38) | 38,5% (13) | 53,3% (15) | 62,5% (8) |
| Leucocitos (DT) | 18.035 (7.067) | 13.951 (4.715) | 15.223 (4.964) | 14.302 (4.876) |
| Neutrófilos (DT) | 60,6% (13,6) | 33,7% (13) | 54,8% (25,5) | 63,9% (16) |
| PCR mg/L (DT) | 109,9 (82) | 9,3 (20) | 77,5% (24) | 4,3 (4,3) |
| Derivados a consulta | 98% | 92,9% | 43,8% | 18,6% |
| DMSA hecho (N) | 68,6% (35) | 35,7% (5) | 29,3% (12) | 5% (2) |
| DMSA patológico (N) | 20% (7) | 20% (1) | 16,7% (2) | 0% |
DMSA: Gammagrafía renal con ácido dimercaptosuccínico; DT: Desviación típica; PCR: Proteína C Reactiva.
Los pacientes con ITU febril que precisaron ingreso presentaron una leucocitosis media de 18.035/ml con una neutrofilia media del 60%. La media de la proteína C reactiva en estos niños fue de 109,9mg/L. Los pacientes con sospecha de infección de orina febril que no precisaron ingreso tuvieron una media de leucocitos en sangre de 15.223/ml con una neutrofilia del 54,8%. La media de la proteína C reactiva fue de 77mg/L (tabla 2).
Los pacientes con ITU afebril tenían una media de edad de 3,7 años (mínimo 0,4, máximo 13 años). Un 55,8% fueron niñas. Precisaron ingreso 14 pacientes (26,9%) con una edad media de 2,2 meses. Se derivaron a la consulta 20 niños (38,5%), 92,9% de los que precisaron ingreso y se realizó DMSA diferida en 7 de ellos (13,5%) siendo patológica en el 14% (tabla 2).
Del total de los pacientes diagnosticados de ITU un 45% precisó ingreso (54% de los niños febriles). La edad media al ingreso fue de 0,9 años y la mediana de 0,3 años.
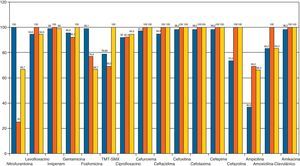
Las bacterias aisladas con mayor frecuencia fueron: Escherichia coli (80%) Proteus mirabillis (9,7%) y Klebsiella pneumoniae (4,2%) (fig. 1). En el antibiograma, E. coli presentó una alta sensibilidad frente a fosfomicina (99,1%), cefotaxima (98,2%) cefuroxima (97,3%) y gentamicina (95,6%). La sensibilidad obtenida frente a amoxicilina-clavulánico fue del 83,2%, mientras que la obtenida frente a cotrimoxazol fue del 78,9%. El antibiótico que demostró menor sensibilidad fue la ampicilina (36,8%) (fig. 2).
P. mirabillis presentó buena sensibilidad frente a amoxicilina-clavulánico (100%), a cefuroxima (100%) y cefotaxima (100%). Le siguen gentamicina (92,3%) y fosfomicina (76,9%). Ampicilina y cotrimoxazol mostraron una sensibilidad baja (ambos 69%) (fig. 2).
K. pneumoniae presentó buena sensibilidad a amikacina (100%), cefotaxima (100%), cefuroxima (100%), gentamicina (100%) y cotrimoxazol (100%). La sensibilidad frente a amoxicilina-clavulánico fue intermedia (83,3%) y mala frente a fosfomicina (66,7%) y nitrofurantoína (66,7%). Fue resistente en el 66,3% a ampicilina (fig. 2).
El tratamiento empírico utilizado con mayor frecuencia en los pacientes ingresados fue gentamicina en monoterapia (67%) utilizando una dosis única diaria, tratamiento de elección según el protocolo de diagnóstico y tratamiento de ITU en nuestro hospital, basado en los protocolos diagnóstico-terapéuticos de la Asociación Española de Pediatría (AEP). Otros tratamientos empíricos fueron: ampicilina asociada a gentamicina (14%), sobre todo en menores de 3 meses de vida, y cefotaxima (9%), en pacientes menores de un mes, febriles, en los que los resultados de la punción lumbar no fueron concluyentes, o bien en pacientes con algún tipo de nefropatía o uropatía previa, en los que se decidió no utilizar gentamicina debido a su nefrotoxicidad. El tratamiento intravenoso se mantuvo hasta las 24 horas de la defervescencia de la fiebre pasando posteriormente a tratamiento oral según antibiograma, por lo que no se consideró necesario monitorizar los niveles farmacológicos de gentamicina. Los pacientes no ingresados con ITU febril fueron tratados en su mayoría con cefixima (37%), seguido de amoxicilina-clavulánico (24%).
Los pacientes afebriles que no precisaron ingreso fueron tratados con amoxicilina-clavulánico (34%), cefixima (34%), cefuroxima (8%), cotrimoxazol (5%) y fosfomicina (5%).
Se derivaron para estudio a la consulta de Nefrología Infantil 88 niños, lo que constituye el 61% del total, el 74% de las ITU que cursaron con fiebre y el 98% de las que precisaron ingreso. Sin embargo, solo el 44% de los pacientes con sospecha de pielonefritis que se trataron de manera ambulatoria fueron revisados posteriormente en consulta encontrando un 12% de alteraciones urológicas en estos niños.
Se realizó una gammagrafía renal con ácido dimercaptosuccínico (DMSA) a los 6 meses del episodio a un 29% de los niños con ITU febril que no precisaron ingreso, comparado con un 69% de los menores con ITU febril que sí lo precisaron (p<0,001). Se encontraron cicatrices pospielonefríticas en el 19% de los pacientes con ITU febril, 16,7% de los no ingresados y 20% de los ingresados. En todos los casos se trataba del seguimiento de la primera ITU salvo un paciente que había padecido otra ITU previa en el extranjero y por tanto no tenía estudio previo.
DiscusiónEn la selección de la antibioterapia empírica para tratar una ITU hay que tener en cuenta multitud de factores: edad del paciente, presencia de patología de base, función renal, historia previa de ITU, toma de profilaxis antibiótica y tolerancia del fármaco, dato que favorece o no la adherencia al tratamiento.
Se debe seleccionar un antibiótico cuyo porcentaje de resistencias frente a los principales agentes etiológicos implicados en la ITU sea inferior a un 10-20%6. No conviene olvidar que la sensibilidad antimicrobiana varía de una región a otra, y las conclusiones obtenidas en otras publicaciones no tienen por qué ser aplicables en nuestro medio. Esto hace que revisar la sensibilidad de los patógenos más frecuentes en nuestra área sea crucial para realizar un tratamiento adecuado.
En nuestra área de salud, las bacterias que con mayor frecuencia causaron las ITU se mostraron muy sensibles a las cefalosporinas de segunda y tercera generación, a la gentamicina y a la fosfomicina (excepto Proteus spp.). La resistencia a amoxicilina-clavulánico fue más elevada, por lo que no es conveniente como tratamiento empírico en sospecha de pielonefritis en nuestra zona de salud. Los resultados de nuestra serie mostraron que cotrimoxazol no debe ser utilizado como primera elección en las ITU al presentar una sensibilidad inferior al 80%. Llama la atención la ausencia de ITU debidas a Enterococcus spp. durante el periodo de estudio, germen que sí se ha aislado en nuestro hospital en otros periodos, y cuya importancia radica en la resistencia intrínseca de dicha bacteria frente a aminoglucósidos y cefalosporinas de tercera generación. Ante la ausencia de mejoría tras 24-48 horas de antibioterapia intravenosa empírica, sobre todo en lactantes menores de 3 meses, debe sospecharse dicho germen y plantear la posibilidad de añadir aminopenicilinas al tratamiento.
Tras la publicación de Hoberman et al7, las consideraciones de las guías NICE8 y el documento de consenso de la Asociación Española de Pediatría9, se ha producido un cambio importante en el tratamiento empírico de las pielonefritis agudas en la infancia en España, ya que se han modificado los protocolos de actuación y muchos niños con sospecha de pielonefritis aguda, que antes eran hospitalizados, ahora se tratan de manera ambulatoria con seguimiento clínico posterior. Esta nueva actuación terapéutica no aumenta significativamente el número de cicatrices pospielonefríticas, tal y como han demostrado diversos estudios10–12. Sin embargo, sigue siendo recomendable realizar la DMSA a los 4-6 meses de la ITU 13,14.
Un 66% de los niños que fueron tratados de manera ambulatoria en nuestra serie no fueron remitidos o revisados posteriormente en consulta, lo que impidió hacer una valoración y un seguimiento de los pacientes de riesgo. En el 29% de los pacientes con ITU febril que no precisaron ingreso se realizó la DMSA y entre ellos la incidencia de cicatrices fue de un 16,7% comparable a otras series de pacientes con DMSA realizada exclusivamente de manera diferida 15.
En resumen, cotrimoxazol y ampicilina no deben ser utilizados como tratamiento empírico de elección en nuestra área de salud para tratar una ITU, debido a las altas tasas de resistencia mostradas por E. coli frente a dicho antibiótico. La resistencia frente a amoxicilina-clavulánico es moderada, por lo que tampoco parece recomendable su indicación empírica en los casos de sospecha de pielonefritis aguda.
Los pacientes con sospecha de pielonefritis aguda que no cumplen criterios de ingreso deben ser tratados con cefixima oral. Sin embargo, si la sospecha es de cistitis/ITU baja, no deben utilizarse antibióticos de amplio espectro. En tal caso una buena opción terapéutica sería fosfomicina o nitrofurantoína. Cefuroxima-axetilo también sería una posibilidad terapéutica, aunque debe tenerse en cuenta que existen otros antibióticos eficaces con menor espectro de acción. Nuestro estudio muestra un porcentaje de resistencias elevado frente a amoxicilina-clavulánico. Debido a ello no debería ser considerado como la primera opción terapéutica en la cistitis/ITU baja.
Todos los pacientes con sospecha de pielonefritis aguda tratados de manera ambulatoria deben ser estudiados y seguidos en la consulta, de la misma manera que los que precisaron ingreso, ya que la incidencia de cicatrices pospielonefríticas es similar en ambos grupos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.