Introducción
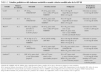
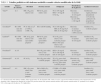
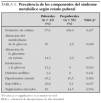
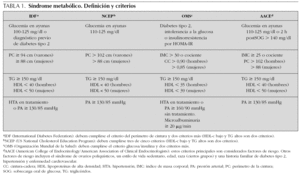
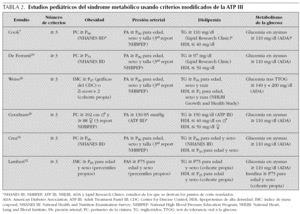
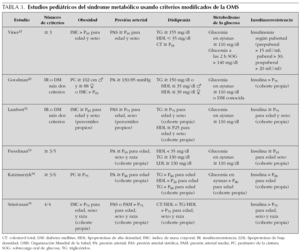
El síndrome metabólico (SM) se ha definido como la asociación de varios factores de riesgo precursores de enfermedad cardiovascular arteriosclerótica y de diabetes tipo 2. En 1988, Reaven observó que algunos factores de riesgo como dislipemia, hipertensión e hiperglucemia solían aparecer comúnmente agrupados, y denominó a esta asociación síndrome X1. Postuló que la insulinorresistencia desempeñaba un papel primordial en su fisiopatología, de ahí que también comenzara a denominarse síndrome de insulinorresistencia. Hoy en día se prefiere utilizar el término síndrome metabólico. Aunque descrito hace 40 años, sólo recientemente, prestigiosas organizaciones y asociaciones de índole sanitaria han propuesto guías clínicas para facilitar su diagnóstico y seguimiento2-4 (tabla 1). También se creó el European Group for the Study of Insulin Resistance (EGIR) para el estudio y definición del mismo5. Son cada vez más numerosas las publicaciones que hablan de la presencia del SM durante la infancia, si bien su prevalencia (3-4 %) es baja comparada con adultos6. Cook et al7 estudiaron un grupo de adolescentes entre 12-19 años. Encontraron una prevalencia del 4,2 %, (6,1 % en varones y 2,1 % en mujeres) evidenciando que aumentaba mucho en sujetos con sobrepeso u obesidad (28,7 % en obesos, 6,1 % en sujetos con sobrepeso y 0,1 % en sujetos normales). El 80 % de los adolescentes con SM eran obesos. En las tablas 2 y 3 se ven diferentes definiciones del SM utilizadas por distintos autores, tomadas y modificadas de Chi et al8.
El propósito principal de este estudio fue el de establecer la prevalencia del SM y sus componentes en niños con obesidad.
Pacientes, material y métodos
Un total de 97 niños y adolescentes entre 6 y 14 años formaron parte del estudio: 58 varones (60,8 %) y 39 mujeres (40,2 %). Fueron estudiados en la consulta de Endocrinología Pediátrica del hospital Costa del Sol de Marbella. Se estableció como criterio de inclusión la existencia de obesidad (IMC ≥ P95 para la edad y sexo según tablas del Estudio de Crecimiento Andaluz, 20059). Quedaron excluidos aquellos pacientes portadores de enfermedades endocrinas, genéticas o metabólicas. Se midieron el peso y la talla con una balanza electrónica digital y un tallímetro homologado. La medida de la circunferencia de la cintura se realizó en el punto medio entre el reborde costal inferior de la última costilla y las crestas ilíacas. Se calculó el índice de masa corporal (IMC = kg/m2). Se calificó la maduración sexual de acuerdo con la clasificación de Tanner10,11. Se midió la presión arterial en el brazo derecho con el paciente en posición sentada y tras 5 min de reposo, mediante oscilometría (Oscilometer 9300. NIBP Monitor. Cas Medical Systems Inc.) utilizando un manguito de tamaño adecuado para el diámetro del brazo. Se realizaron tres medidas consecutivas, y se utilizó la media de las tres. También se obtuvo consentimiento informado.
Protocolo
Tras 12 h de ayuno se realizó una prueba de tolerancia oral a la glucosa con 1,75 g/kg (máximo 75 g), y se determinó la glucemia basal a los 120 min. Se determinaron las concentraciones de triglicéridos, colesterol total (CT), el colesterol de lipoproteínas de alta densidad (HDL-c), proteína C reactiva (PCR), ácido úrico e insulina mediante metodologías estandarizadas. El colesterol de lipoproteínas de baja densidad (LDL-c) se determinó mediante cálculo (cuando los triglicéridos no superen los 400 mg/dl). Se calcularon los índices HOMA-R (glucemia en mmol/l x insulinemia en μU/ml/22,5)12, QUICKI (1/log insulina en μU/ML + log glucosa en mg/dl)13 y el cociente glucosa/insulina en ayunas (mg/dl/μU/ml).
Definición de síndrome metabólico
La presencia de SM se estableció por la existencia de al menos tres de los siguientes componentes:
1.Alteración del metabolismo de la glucosa: de acuerdo con los criterios de la Asociación Americana de Diabetes (ADA) definimos la alteración de la glucemia en ayunas (AGA) como una glucemia en ayunas entre 100 y 125 mg/dl; la alteración de la tolerancia a la glucosa (ATG) como una glucemia a las 2 h de la sobrecarga entre 140 y 199 mg/dl, y la diabetes mellitus (DM) como una glucemia en ayunas de más de de 126 mg/dl o una glucemia a las 2 h de la sobrecarga de 200 mg/dl o más14,15.
2.Hipertrigliceridemia: valores en ayunas de 110 mg/dl o superiores.
3.HDL-c bajo: valores en ayunas de 40 mg/dl o menores.
4.Hipertensión arterial: presión arterial sistólica o diastólica igual o superior a P90 para la edad, tomando como referencia los valores del estudio RICARDIN II16.
5.Obesidad visceral: valores del perímetro de la cintura por encima de P90, tomando como referencia los datos publicados en el documento de consenso del grupo colaborativo de la AEP-SENC-SEEDO (2002)17.
Se utilizó una segunda definición de SM similar a la anterior en todo salvo en que un valor de HOMA-R igual o superior a 3,8 formó parte del componente Alteración del metabolismo de la glucosa.
Definición de insulinorresistencia
Se consideró insulinorresistencia un valor de HOMA-R igual o superior a 3,8.
Análisis estadístico
Para los cálculos estadísticos se utilizó el programa SPSS versión 12.0. Se realizó un análisis descriptivo de la muestra de pacientes expresado con la media y la desviación estándar. En el análisis bivariado, para la comparación de subgrupos en cuanto a variables continuas se utilizó la t de Student para muestras independientes (en el caso de n > 30 y distribución simétrica) y el test de la U de Mann-Whitney (en caso contrario). En cuanto a las variables cualitativas o categóricas, se usaron el test de chi al cuadrado y la odds ratio (OR), con sus intervalos de confianza (IC) del 95 %. Se consideró que las diferencias eran estadísticamente significativas para una p < 0,05.
Resultados
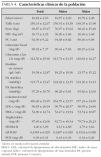
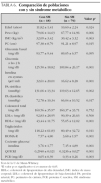
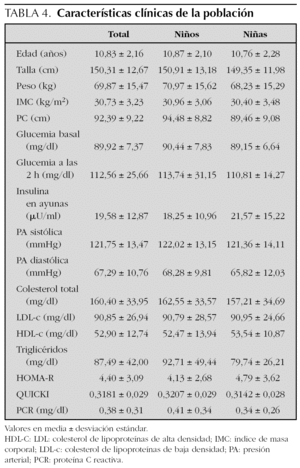
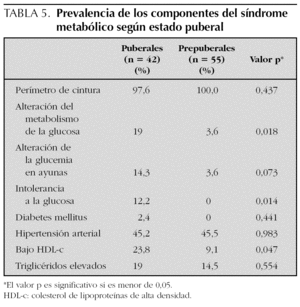
Las características clínicas de la población se muestran en la tabla 4. No se encontraron diferencias entre sexos. Del total de los sujetos estudiados, 55 (56,7 %) eran prepuberales (estadio 1 de Tanner) y 42 (43,3 %) habían iniciado o finalizado la pubertad (estadios 2-5). Los sujetos puberales tenían concentraciones más altas de glucemia (en ayunas y tras sobrecarga) e índice HOMA-R, y más bajos de HDL-c e índice QUICKI (diferencias estadísticamente significativas). También mostraron concentraciones de insulina más altas, aunque en este caso la diferencia no fue significativa.
Prevalencia del síndrome metabólico y sus componentes
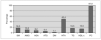
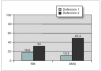
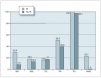
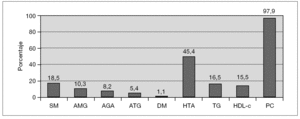
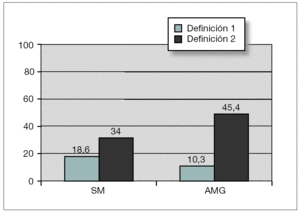
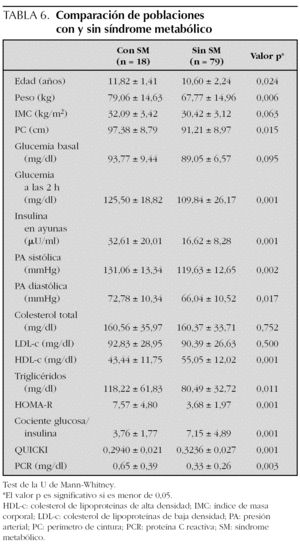
El SM se encontró en 18 sujetos, lo que supone una prevalencia del 18,6 % (20,7 % en varones y 15,4 % en mujeres, diferencia no significativa). En sujetos prepuberales fue del 12,7 % y en puberales, del 26,2 % (p = 0,091). Sólo un sujeto no presentó ninguno de los cinco componentes del SM, mientras que 33 (34 %) presentaron uno de ellos y 45 (46,4 %) dos. La prevalencia de cada uno de los componentes del SM fue del 10,3 % para la alteración del metabolismo de la glucosa (AMG) (8,2 % para la AGA; 5,4 % para la ATG y 1,1 % para la DM); 97,9 % para el perímetro de la cintura (PC); 16,5 % para la hipertrigliceridemia; 15,5 % para el HDL-c bajo y 45,4 % para la hipertensión arterial (HTA) (40,2 % para la sistólica y 22,7 % para la diastólica) (fig. 1). No hubo diferencias entre sexos. Comparando sujetos prepuberales y puberales, se pudo apreciar que las diferencias fueron estadísticamente significativas en la alteración del metabolismo de la glucosa (en concreto en la ATG) y en las concentraciones bajas de HDL-c, ambos más prevalentes en sujetos puberales. La diferencia casi alcanzó significación estadística en la alteración de la glucemia en ayunas (tabla 5). Aplicando la segunda definición del síndrome (SM2), en la que un HOMA-R igual o superior a 3,8 formó parte del criterio de alteración del metabolismo de la glucosa, la prevalencia del mismo aumentó hasta el 34 %, con un incremento de la prevalencia del componente, alteración del metabolismo de la glucosa (AMG2), desde el 10,3 % hasta el 45,4 % (fig. 2). Las diferencias entre poblaciones con y sin SM se pueden apreciar en la tabla 6. Los sujetos que lo presentaron mostraron concentraciones más altas de PCR, así como mayor nivel de insulinorresistencia (valores más altos de HOMA-R e insulina y más bajos de QUICKI y cociente glucosa/insulina).
Figura 1.Prevalencia del síndrome metabólico y sus componentes. AGA: alteración de la glucemia en ayunas; AMG: alteración del metabolismo de la glucosa; DM: diabetes mellitus; HDL-c: colesterol de lipoproteínas de alta densidad; HTA: hipertensión arterial; ITG: intolerancia a la glucosa; PC: perímetro de la cintura; SM: síndrome metabólico; TG: triglicéridos.
Figura 2. Prevalencia del síndrome metabólico según definición empleada. AMG: alteración del metabolismo de la glucosa; SM: síndrome metabólico.
Insulinorresistencia
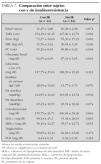
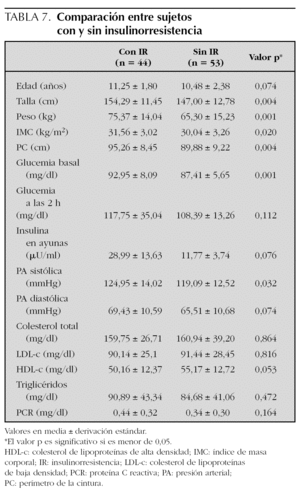
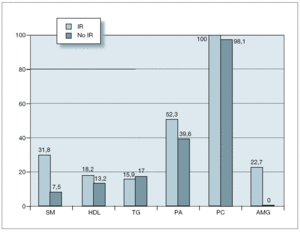
Definida como un HOMA-R igual o superior a 3,8, la presentaron el 45,4 % de los sujetos, sin diferencias entre sujetos prepuberales y puberales ni entre sexos. Sí se encontraron diferencias entre sujetos con SM (77,8 %) y sin él (38 %). Comparando sujetos con y sin insulinorresistencia, pudimos apreciar que los que la presentaron eran de mayor edad, más obesos y con pubertad más avanzada. También presentaron mayores valores de tensión arterial, glucemia e insulina en ayunas y menores de HDL-c (tabla 7). Analizando la prevalencia de cada uno de los componentes que forman parte del SM en estas dos poblaciones, encontramos que sólo fue significativa la mayor presencia de alteración en el metabolismo de la glucosa, ya que todos los casos de AGA, ATG y DM se dieron en sujetos con insulinorresistencia (fig. 3). De los 44 sujetos con insulinorresistencia, el 31,8 % presentaba SM, en contraposición al 7,5 % entre aquellos que no la presentaban, diferencia estadísticamente significativa.
Figura 3.Insulinorresistencia y componentes del síndrome metabólico. AMG: alteración del metabolismo de la glucosa; HDL: lipoproteínas de alta densidad; IR: insulinorresistencia; PA: presión arterial; PC: perímetro de la cintura; SM: síndrome metabólico; TG: triglicéridos.
Discusión
La prevalencia del SM en nuestra población ha sido del 18,6 %. Comparándola con la encontrada por otros autores que han utilizado como nosotros una definición derivada de la propuesta por el National Cholesterol Education Program-Adult Treatment Panel III (NCEP-ATP III), observamos que es más baja que la hallada en estudios realizados en niños obesos americanos por Cook (28,7 %), Cruz (30 %), Weiss (38,7 %), y Ferranti (31,2 %)7,18-20, pero similar a la encontrada por Yoshinaga en Japón (17,7 %)21 y Agirbasli en Turquía (21 %)22. Como ocurre en la literatura médica consultada, cuando aplicamos la misma definición pero incluyendo medidas de insulinorresistencia como un índice HOMA-R igual o superior a 3,8 (es decir, utilizando una definición derivada de la propuesta por la OMS), la prevalencia casi se duplica, y es similar a la encontrada por autores que han utilizado definiciones parecidas como Viner en Inglaterra (33 %)23, Atabek en Turquía (27,2 %)24 y algo más elevada que la de Invitti en Italia (23 %)25. Siguiendo la misma metodología que nosotros, Goodman et al aplicaron a la misma población obesa dos definiciones diferentes del SM. La prevalencia que encontraron fue del 38,9 % aplicando los criterios de la OMS modificados y del 19,5 % aplicando los del NCEP26. De cualquier manera, la comparación de prevalencias entre diversos estudios tiene un valor relativo, ya que incluso definiciones derivadas de la misma organización difieren notablemente entre ellas (tablas 2 y 3). Esto se debe a la utilización de diferentes puntos de corte para cada uno de los componentes del síndrome.
Muy significativo es el dato de que sólo un sujeto de los estudiados no presentaba ninguno de los cinco componentes del SM, mientras que casi la mitad de los sujetos estudiados presentaba dos de ellos. Estas cifras son similares a las expresadas por otros autores como Cook y Cruz, que encuentran que el 56 y el 38 %, respectivamente, de sus poblaciones presentaban al menos dos componentes7,18. Posiblemente, estos sujetos, con el paso del tiempo y sin intervenciones preventivas, acabarían padeciendo el SM. Csabi, en Hungría, observó que la duración de la obesidad era significativamente mayor en los niños que padecían el SM que en aquellos que no (7,0 ± 2,8 años frente a 4,2 ± 2,4 años)27. Otros estudios han demostrado la persistencia de los componentes del síndrome en el tiempo28-30. El Cardiovascular Risk in Young Finns Studymostró la persistencia de estos componentes seis años después de su primera evaluación29, y el Bogalusa Heart Study, que el 60 % de los niños clasificados como de alto riesgo, lo seguían estando ocho años después28. Estos hallazgos apoyan la hipótesis que afirma que el desarrollo del SM es un proceso de larga evolución y que, por lo tanto, una intervención temprana mediante modificación de hábitos alimentarios, incremento de la actividad física o utilización de fármacos que aumenten la sensibilidad a la insulina podría modificar favorablemente su historia natural y la de sus componentes, evitando su aparición o enlenteciendo su progresión. Es de resaltar la alta prevalencia de HTA, mayor que la encontrada en la mayoría de los estudios previamente comentados, aunque Csabi en Hungría encuentra cifras similares (41,6 %) a pesar de utilizar como punto de corte el P9527. También Dubose en Kansas, utilizando como nosotros el P90, encontró una prevalencia del 58 %, sensiblemente mayor que la nuestra31. El dato de que casi todos los sujetos estudiados presentaban un PC superior al > P90 nos hace sugerir que tal vez no tenga sentido utilizar dicho perímetro como un componente del SM, con la dificultad añadida de la necesidad de contar con tablas de percentiles del mismo. Sería más fácil y de la misma utilidad usar el IMC como componente del SM, sobre todo considerando que existen estudios que sugieren incluso que el IMC puede correlacionarse mejor con las cifras de presión arterial y con la dislipemia32. Es también llamativa la alta prevalencia de AGA. La explicación creemos que está en que, siguiendo las últimas recomendaciones de la ADA, hemos utilizado una glucemia de 100 mg/dl como límite superior, en vez de 110 mg/dl, límite empleado en la mayoría de los estudios revisados15. Si hubiéramos utilizado dicho límite, la prevalencia de AGA habría sido del 2,04 %. Yoshinaga, en Japón, utilizando el mismo límite que nosotros, encuentra una prevalencia del 2 %21. En los estudios que emplean el valor de 110 mg/dl, oscila desde el 0,8 % encontrado por Viner23 en Inglaterra o el 0,3 % de Invitti25, en Italia, hasta el 10 % de Atabek24, en Turquía. La prevalencia encontrada de ATG es similar a la halladas por otros autores en España, situándose en un punto medio entre el 7,2 % de Bueno33, en Zaragoza, y el 2,8 % de Cabrinety34, en Barcelona. Colino35, en Alicante, sólo la encuentra en el 1 % de sus sujetos, mientras que Yeste36, en Barcelona, en el 19,2 %. Fuera de nuestro país, la prevalencia encontrada también varía notablemente. Así Shalitin37, en Israel, la encuentra en el 13,5 %; Viner23, en Inglaterra, en el 11 %; Invitti25, en Italia, en el 4,1 %; Csabi27, en Hungría, en el 28 %; Mazza38, en Argentina, en el 7 %; Barja39, en Chile, en el 11,5 %, y Cruz18, en EE.UU., en el 27 %. Comparar nuestra prevalencia, tanto de hipertrigliceridemia como de concentraciones bajas de HDL-c, con la encontrada en otros estudios es difícil, pues es en estos dos parámetros en los que mayor es la variabilidad en cuanto a los puntos de corte utilizados. Nuestros puntos de corte son bastante restrictivos, sobre todo en lo referente a los niveles de triglicéridos. Por ejemplo, en el estudio de Navarra, el P90 para niños entre 6 y 14 años se encuentra en un rango de 75-90 mg/dl y de 79-93 mg/dl para niñas40. En el estudio Galinut, Galicia, esos mismos valores oscilan entre 81 y 98 mg/dl para niños y entre 85 y 109 mg/dl para niñas41. A pesar de ello, utilizando nuestros mismos criterios, Cook7 publica una prevalencia de hipertrigliceridemia y bajo HDL del 51,5 y del 50 %, respectivamente, mucho más alta que la encontrada por nosotros.
Comparación de poblaciones con y sin síndrome metabólico
Los sujetos con SM son de mayor edad, con pubertad más avanzada, más obesos y presentan un mayor nivel de insulinorresistencia y cifras más elevadas de PCR. También Lambert et al42 observaron una fuerte relación entre las concentraciones de PCR, el IMC y la insulinemia en ayunas. Nuestros hallazgos son similares a los publicados por Ford et al43, que aplicaron a una población de adolescentes de entre 12 y 17 años exactamente la misma definición del síndrome utilizada por nosotros. Encontraron que los sujetos con SM presentaban concentraciones más elevadas de PCR, reflejando un grado de inflamación que, como en el adulto, pudiera incrementar el riesgo de padecer en el futuro enfermedades cardiovasculares o diabetes.
Insulinorresistencia
Aunque el concepto teórico de insulinorresistencia está claramente definido, no es fácil su aplicación clínica. Los métodos sensibles como el clamp euglucémico o como el modified minimal model frequently sampled intravenous glucosa tolerant test son demasiado complicados para la práctica clínica y para estudios epidemiológicos. En 1985 Matthews y en 2000 Katz describen los índices HOMA-R y QUICKI para el asesoramiento de insulinorresistencia12,13. Sus resultados se correlacionaron bien con los obtenidos utilizando el clamp euglucémico y desde entonces, numerosos estudios se han realizado utilizándolos y confirmando su utilidad, si bien no han sido establecidos aún valores unánimemente aceptados como indicadores de IR44,45. Hemos elegido un valor de HOMA-R de 3,8 o superior por ser uno de los más altos reflejados en la literatura, con la finalidad de ser restrictivos a la hora de diagnosticar un estado mórbido como la insulinorresistencia. Aun así, hemos encontrado que casi la mitad de los sujetos la presentaban, con claras diferencias entre quienes padecían SM y quienes no, lo cual sugiere que es uno de los factores principales en la etiología del síndrome. García et al 46, en Almería, utilizando el mismo criterio que nosotros, encontraron que el 73 % de sus obesos la presentaban, con diferencias entre sujetos puberales (95 %) y prepuberales (56 %). Si, como proponen recientemente Tresaco et al47, hubiéramos establecido un valor de HOMA-R igual o superior a 3, el 61,8 % de nuestra población la habría presentado, elevándose hasta el 94,4 % entre aquellos con SM. Todos los casos de AGA, ATG y DM se dieron en sujetos con insulinorresistencia (fig. 3). Esto refuerza los hallazgos de estudios previos que han demostrado una fuerte asociación entre el SM y el riesgo posterior de padecer DM2. Así, cuando se utilizan definiciones del SM que requieren su presencia, el padecer el SM incrementa mucho más el riesgo de padecer DM2 que cuando las definiciones utilizadas no la requieren48-50.
En conclusión, la prevalencia del SM en niños obesos en nuestra población es del 18,6 %. Ésta aumentaría al 34 % utilizando una definición del SM que incluyera la demostración de un estado de insulinorresistencia. Casi la mitad de los sujetos estudiados presentaban al menos dos de los componentes del síndrome y eran candidatos a presentarlo con el paso del tiempo. También casi la mitad de los sujetos estudiados presentan un estado de insulinorresistencia, y este porcentaje se eleva hasta el 77,8 % en sujetos con SM, lo cual indica que se trata de un factor etiopatogénico importante en su génesis.
Correspondencia: Dr. L. Tapia Ceballos.
Hospital Costa del Sol.
Ctra. Nacional, 340, km 187. 29600 Marbella. Málaga. España.
Correo electrónico: leotapiaceb@hotmail.com
Recibido en noviembre de 2006.
Aceptado para su publicación en junio de 2007.