Introducción
La enfermedad inflamatoria intestinal (EII) engloba una serie de entidades crónicas, la enfermedad de Crohn (EC), la colitis ulcerosa (CU) y cuadros de histología indeterminada o colitis indeterminada (CI). Todos ellos se caracterizan por una autoinflamación que afecta primariamente al tracto gastrointestinal con una evolución crónica e impredecible.
El objetivo terapéutico está dirigido a controlar los brotes de actividad, mantener la remisión a largo plazo, normalizar el estado nutricional y, en definitiva, a mejorar su calidad de vida. El tratamiento empleado tradicionalmente, similar en todas ellas aunque con matices, ha consistido en la utilización de aminosalicilatos, antibióticos, terapia nutricional y corticoides. Un segundo escalón de control lo constituye todo un arsenal de agentes inmunosupresores y/o inmunomoduladores: azatioprina, 6-mercaptopurina, metrotexato y ciclosporina. A pesar de ello, en ocasiones aparecen cuadros refractarios al tratamiento o corticodependientes con efectos secundarios muy adversos.
Los avances en el conocimiento de la fisiopatología de estas enfermedades han permitido el desarrollo de nuevas terapias biológicas, de las cuales el más ensayado es el infliximab, un anticuerpo monoclonal quimérico dirigido contra el factor de necrosis tumoral alfa (TNF-α)1.
El objetivo del trabajo es la revisión retrospectiva de la experiencia acumulada en nuestro centro con infliximab, a lo largo de siete años (1999-2006) haciendo especial hincapié en sus indicaciones y su perfil de eficacia y seguridad.
Material y métodos
Se inició el tratamiento con infliximab (Remicade®, Schering-Plough) en octubre de 1999 en EII refractaria, inicialmente en EC y, posteriormente se amplió su indicación tanto a CU (2004) como a CI (2004).
Pacientes
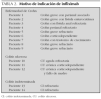
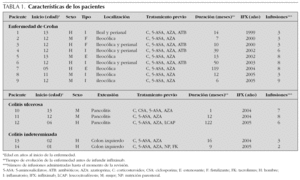
Se revisaron 14 pacientes (8 niños y 6 niñas), mayoritariamente de inicio en edad prepuberal o puberal (media de 9,6 años y rango de 1 a 13 años). Sus características pormenorizadas se exponen en la tabla 1.
Enfermedad de Crohn (9 pacientes): 5 con patrón inflamatorio, 2 fistulizantes (1 transesfinteriana y 1 enterocutánea) y 2 estenosantes (1 cecal y 1 sigmoidea). La localización era mayoritariamente ileocólica (8/9) y en un caso, exclusivamente ileal. Hubo afectación perianal asociada en 4 pacientes. Refractarios a la medicación "convencional" y a antibióticos en las formas perianales con/sin fístula. Pacientes con colitis: los 3 pacientes con CU presentaban una lesión extensa (pancolitis), y lesiones más limitadas (colon izquierdo) en los dos casos de CI. Se definió como CI aquella colitis que, a pesar de un estudio amplio y exhaustivo, no pudo ser clasificada ni como CU ni como EC según criterios endoscópicos e histológicos. Eran refractarios a la medicación "convencional", y aun algunos de ellos habían probado de forma experimental otras medicaciones o procedimientos de rescate. El paciente 12 se sometió a seis sesiones de leucocitoaféresis2, y el paciente 14 (dependiente de nutrición parenteral), a tacrolimus3 durante seis meses.
El tiempo de evolución de la enfermedad hasta la primera infusión de infliximab fue muy variable de un paciente a otro (media, 30,7 meses; rango, 1 a 122 meses).
Método
Protocolo de administración de infliximab
Se deben obtener los informes de uso compasivo y de consentimiento informado. Evaluación previa a la primera infusión con estudios de laboratorio (hemograma y bioquímica con función hepática, proteína C reactiva [PCR] y velocidad de sedimentación globular [VSG]), estudios encaminados a descartar inmunodeficiencia (cifras de inmunoglobulinas y serología de virus de la inmunodeficiencia humana [VIH]), autoinmunidad (presencia de anticuerpos antinucleares [ANA], y anticuerpos anti-ADN de doble cadena [ anti-dsDNA], ante ANA positivos) y tuberculosis (prueba de tuberculina y radiografía de tórax); y serologías para los virus de las hepatitis B y C. Evaluación intratratamiento con controles de hemograma, bioquímica y ANA periódicos4,5. Posología y forma de administración según las recomendaciones del laboratorio (Remicade®, Schering-Plough) a razón de 5 mg/kg por vía intravenosa. Administración en las siguientes 2 a 3 h a un ritmo progresivo (ritmo máximo de 5 ml/kg/h). Premedicación protocolizada con antihistamínico (difenhidramina a 1 mg/kg, un máximo de 50 mg).
Mantenimiento de medicación inmunosupresora de base (generalmente azatioprina ajustada/optimizada según valores de la enzima tiopurina metiltransferasa [TPMT]), para reducir los riesgos de inmunoalergenicidad del infliximab6 y, por el contrario, disminución progresiva de la dosis de corticoides en función de la respuesta y la tolerancia.
El protocolo de número de dosis administradas fue incrementándose de forma gradual y paralela a los resultados de la literatura imperante del momento7. En los primeros tres pacientes (antes de 2002), solamente la pauta de inducción con tres dosis (0, 2 y 6 semanas) y, a partir de ese momento, inducción y mantenimiento (cada 8 semanas, ante inducción eficaz) durante un año, salvo contraindicación, complicación o pérdida de respuesta. Sus indicaciones se reflejan en la tabla 2.
Valoración de respuesta
Enfermedad de Crohn. En todos los pacientes antes de cada nueva infusión se determinaron los índices de actividad (índice de actividad de la enfermedad de Crohn pediátrica [PCDAI] score)8 y los valores de PCR y VSG, para valorar su evolución clínico-analítica a lo largo de todo el tratamiento, así como la actitud terapéutica frente al tratamiento corticoideo (disminución o supresión).
En las formas de EC grave refractaria (PCDAI > 30) se evaluó la consecución de respuesta o remisión clínica a la semana 10 y a la semana 54. La respuesta clínica se definió como un descenso de 15 puntos o más respecto al PCDAI basal con una puntuación final por debajo de 30, mientras que la remisión clínica se definió como una disminución del PCDAI a cifras inferiores de 10. En las formas de EC fistulizante refractaria se evaluó la mejoría o cierre de las mismas tanto a nivel clínico (aspecto y drenaje) como radiológico (resonancia magnética)9. En las formas perianales refractarias no fistulosas se evaluó su mejoría o resolución clínica. En las formas con corticodependencia se evaluó la capacidad para disminuir la dosis de corticoterapia desde el inicio de las infusiones con infliximab (parcial o total). En las formas con alteración en el ritmo de crecimiento se evaluó la mejoría en los Z scores de talla (gráficas Carrascosa, Barcelona 2004) a los 6 y 12 meses de iniciar infliximab10.
Colitis ulcerosa y colitis indeterminada. En todos los pacientes, antes de cada nueva infusión se determinaron los índices de actividad (índice de Truelove-Witts modificado)11 y los valores de PCR y VSG.
En las formas con colitis refractaria (aguda o crónica) se evaluó la consecución de respuesta o remisión clínica a la semana 10 y a la semana 54. La respuesta clínica se definió como un descenso de 5 puntos o más respecto al Seo score basal, mientras que la remisión clínica se definió como una disminución del Seo score a cifras inferiores a 10. En las formas con corticodependencia se evaluó la capacidad para disminuir la dosis de corticoterapia desde el inicio de las infusiones con infliximab. En las formas con alteración en el ritmo de crecimiento se evaluó la mejoría en los Z scores de talla a los 6 y 12 meses de iniciar el tratamiento con infliximab.
Valoración de seguridad
Se recopilaron todos aquellos acontecimientos adversos que pudieran ser atribuidos a infliximab, al resto de medicación concomitante o a la combinación de todos ellos. Se puso especial énfasis en las reacciones infusionales agudas (RIA) (aparecen durante la infusión de infliximab o en la primera hora tras finalizarla, en forma de hipotensión, sensación de disnea, fiebre o cualquier exantema, incluyendo urticaria); reacciones infusionales tardías o retardadas (aparecen tras más de 24 h de finalizar la infusión de infliximab, en forma de artralgias o edemas); desarrollo de autoanticuerpos (ANA y/o anti-dsDNA); riesgo de infecciones de cualquier origen (aparecen a lo largo del seguimiento de estos pacientes y en los 3 meses inmediatamente posteriores a la suspensión de las infusiones); desarrollo o empeoramiento de enfermedades neurológicas (desmielinizante) y/o cardíacas (insuficiencia cardíaca congestiva); riesgo de neoplasias (linfoma); hepatotoxicidad, y/o mielotoxicidad12,13.
Resultados
Número de infusiones
Se realizó un total de 77 infusiones (media, 5,5; rango, de 2 a 9). A partir del año 2002 todo paciente que no completó el año de tratamiento (ocho dosis) fue por distintos impedimentos que aparecieron a lo largo del tiempo: RIA grave (paciente 8), RIA asociada a pérdida de eficacia (paciente 10), pérdida de eficacia sin evidencia de RIA (paciente 12), complicación infecciosa con necesidad quirúrgica (paciente 4) y ausencia de eficacia (pacientes 13 y 14).
Perfil de eficacia
La eficacia del infliximab se desglosó por tipo de EII, pues ésta difería de forma significativa entre ellas, y a su vez, por indicación u objetivo. Todo ello se resume en las tablas 3, 4 y 5.
Enfermedad de Crohn
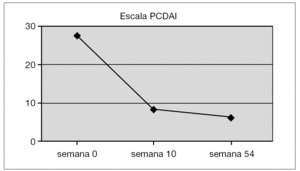
En la figura 1 se puede apreciar el descenso de la cifra media de PCDAI score a lo largo del seguimiento de estos pacientes: en las semanas 0 (26,7 puntos), 10 (9,4 puntos) y 54 (7,2 puntos).
Figura 1.Media del índice de actividad de la enfermedad de Crohn pediátrica (escala PCDAI) de los enfermos de Crohn.
En las formas graves (PCDAI > 30) se logró una remisión clínica a la semana 10 del 80 %, que descendió al 60 % en la semana 54. La fístula enterocutánea no obtuvo ningún tipo de respuesta clínica y obligó a un abordaje quirúrgico que solucionó el problema. Por el contrario, la fístula anal se cerró de forma rápida (antes de la semana 10) y se mantenía aún cerrada a la semana 54. La clínica perianal se resolvió de forma rápida en los dos casos, pero el paciente que tan sólo recibió tres dosis de infliximab sufrió una recidiva de la clínica perianal a los 4 meses de la última infusión, a diferencia del otro paciente (con seis dosis), que no había experimentado empeoramiento perianal en la semana 54. El paciente que recibió infliximab por corticodependencia pudo abandonar dicha medicación en menos de 16 semanas sin padecer ninguna recidiva posterior. En cuanto a la posibilidad de reducir corticoides desde el inicio de las infusiones con infliximab, en el cómputo de todos los pacientes con Crohn, el 89 % pudo reducir la dosis y hasta el 55,5 % de ellos pudo suprimir totalmente la medicación esteroidea. El paciente que recibió infliximab por alteración en el ritmo de crecimiento sin corticodependencia asociada experimentó una mejoría significativa de talla (Z score) a los 6 y 12 meses de iniciar las infusiones.
Colitis ulcerosa
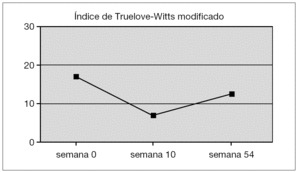
En la figura 2 se puede apreciar la evolución que presentó la cifra media del índice de Truelove-Witts modificado a lo largo del tiempo, con un leve ascenso al final del seguimiento, por imposibilidad de mantener a los pacientes en remisión: en la semana 0 (18,6 puntos), en la 10 (7,0 puntos) y en la 54 (13,3 puntos).
Figura 2.Media del índice de Truelove-Witts modificado de los pacientes de colitis ulcerosa.
Los tres pacientes, independientemente de ser formas agudas o crónicas, obtuvieron una remisión clínica inicial (100 %), pero ésta tan sólo se mantuvo en uno de los enfermos (33 %). Los dos pacientes con formas crónicas corticodependientes pudieron reducir la dosis corticoidea, e incluso uno de ellos llegó a suspenderla (50 %). El paciente con alteración del crecimiento asociado a corticodependencia no experimentó ninguna mejoría en los Z score de talla a lo largo de las 54 semanas de seguimiento.
Colitis indeterminada
Los dos pacientes etiquetados de colitis indeterminada no respondieron de forma adecuada a las infusiones de infliximab; si bien hubo una respuesta inicial por parte de uno de ellos, no alcanzó la remisión a las 10 semanas. Ante estos pobres resultados se decidió no proseguir con las infusiones de mantenimiento.
Perfil de seguridad
El resumen de efectos adversos que deberían ser controlados y que podrían justificar la interrupción del tratamiento con infliximab queda recogido en la tabla 6.
Discusión
El infliximab, paradigma y pionero de la terapia biológica, es un anticuerpo monoclonal quimérico tipo IgG1 dirigido contra el TNF-α. El TNF-α es una citoquina proinflamatoria fundamental en la cascada inflamatoria que inicia y perpetúa la EC y otras enfermedades inflamatorias crónicas como la artritis reumatoide. Se produce principalmente por los linfocitos T y macrófagos activados, e induce la síntesis de muchas otras citoquinas proinflamatorias (IL-1 y IL-6). En definitiva, activa los leucocitos, induce reactantes de fase aguda e inhibe la apoptosis de las células inflamatorias1.
A pesar de que la fisiopatología exacta de las enfermedades inflamatorias intestinales es distinta, con una mayor respuesta inflamatoria celular o tipo Th1 (linfocitos T cooperadores) (interleucina [IL] 12, IL-23, IL-18 y factor de necrosis tumoral IA [TL IA]) con activación macrofágica en la EC y una humoral o tipo Th2 (IL-5 y IL-13) en la CU con síntesis de anticuerpos y activación de células natural killers (NK), al compartir la participación del TNF-α (células productoras de TNF-α aumentadas en la lámina propia del intestino en EC y cantidades elevadas de TNF-α en la mucosa en CU), ambas se benefician del tratamiento con infliximab14,15.
Desde las primeras descripciones en la década de 1990 sobre el uso de infliximab, se han sucedido innumerables publicaciones y se han producido continuos cambios, tanto en la forma de administración como en sus indicaciones16-19. La realización de estudios prospectivos, multicéntricos y aleatorizados ha sentado las bases de posología actual y permitido demostrar su perfil de seguridad y eficacia tanto en la EC (ACCENT 2002)17 como en la CU (ACT 2005)19.
Su empleo en pediatría se remonta a 1993 (una adolescente de 13 años con EC refractaria)20 y, desde entonces, distintos autores han ido aportando su experiencia, aunque en menor número y envergadura que las referidas a adultos, pero que han dejado entrever un perfil de seguridad y una eficacia similar al de éstos21-26. Actualmente, pendiente de ser publicado un estudio prospectivo, multicéntrico y aleatorizado sobre Crohn pediátrico (estudio REACH, presentación del póster en NASPGHAN Annual meeting, octubre de 2005), el infliximab no goza aún de aprobación para uso pediátrico.
Las indicaciones aprobadas a día de hoy para infliximab, según la ficha técnica (27 de octubre de 2006), incluyen tanto la EC luminal como fistulizante refractarias, la EC corticodependiente, las manifestaciones extraintestinales de la EC (ocular, cutánea y/o articular) y la CU, aunque en la práctica clínica su espectro se amplía a la CI y a la inflamación del reservorio resistente. En pediatría, la presencia de alteración en el ritmo de crecimiento con o sin corticodependencia puede ser razón suficiente para decidir iniciar infliximab27, como sucedió en buena parte de nuestros pacientes (pacientes 6, 7, 11 y 12).
Decidimos desglosar el perfil de eficacia por tipo de EII, a pesar de nuestro reducido número de pacientes, obligados por la literatura, pues sus diferencias en tasa de remisión son significativamente distintas. Respecto a la EC, nuestras cifras de remisión a largo plazo (60 %) se parecen mucho más a las del estudio de Crohn pediátrico REACH pendiente de ser publicado (56 %) que a las del estudio ACCENT de adultos (30 %), lo cual evidencia la necesidad de realizar estudios propiamente pediátricos que confirmen o descarten si la tasa de eficacia en adultos es extrapolable a la población pediátrica. La capacidad para reducir corticoterapia fue del 55,5 %, cifras similares a las publicadas por Stephens et al22 (57 %) o las de Lamireau et al28 (53 %). La eficacia en la CU ha sido bastante controvertida hasta la publicación del estudio ACT (diciembre de 2005), con una remisión a largo plazo del orden del 20 % y sin estudio multicéntrico pediátrico a la vista. Asumir conclusiones con tres pacientes no parece tener ningún sentido, pero sí nos gustaría transmitir la observación, al igual que Russell y Katz, de que no deberíamos considerar la CU como una unidad, sino que parece que la probabilidad de respuesta difiere entre las formas agudas y las crónicas, y es especialmente mala en las corticodependientes de muy larga evolución25. Si la experiencia en CU ya es menor respecto al Crohn, los pocos estudios publicados en CI se reducen a prácticamente dos en 2003, de pocos pacientes y que coinciden en una menor capacidad de respuesta y remisión clínica a corto y largo plazo29,30. Ninguno de nuestros dos pacientes logró alcanzar la remisión clínica a las 10 semanas.
En cuanto al perfil de seguridad de infliximab, nosotros, al igual que el resto de grupos, coincidimos en reacciones infusionales e infecciones como efectos adversos más frecuentes. Las reacciones infusionales, todas ellas agudas, aparecieron en el 10,3 % de las infusiones y en el 42,8 % de los pacientes, cifras muy similares a las de Crandall y Mackner31 (en el 8,5 % de las infusiones y en el 38,6 % de los pacientes), y a todas ellas les siguió una pérdida de eficacia a largo plazo, probablemente en relación con la aparición de anticuerpos antiinfliximab (ATI) o anticuerpos humanos antiquiméricos (HACA)32. Los cuatro incidentes infecciosos no pusieron en ningún momento en riesgo la vida de nuestros pacientes, a pesar de que uno de ellos, un absceso ileal en el paciente 4, obligó a interrumpir el tratamiento con infliximab y a realizar un desbridamiento quirúrgico. El caso de mielotoxicidad (leucopenia en la paciente 11) se resolvió de forma espontánea reduciendo la dosis de azatioprina.
En estos últimos 10 años, con la incorporación de la terapia biológica, se ha vivido una auténtica revolución en la mejoría de la calidad de vida de estos pacientes al mantenerlos en remisión de su enfermedad de forma prolongada1. Con su aplicación repetida se despejaron las primeras dudas, pero se han ido generando muchas otras, como hemos podido comprobar en el primer simposio internacional de EII pediátrica celebrado recientemente en Roma (noviembre 2006), y que finalizó sin alcanzar consensos claros en distintos puntos clave: momento idóneo de aplicación de terapia biológica dentro del algoritmo terapéutico, prolongación del tratamiento con infliximab una vez alcanzada la remisión y/o necesidad de inmunosupresores o inmunomoduladores asociados bajo su tratamiento.
La tendencia actual se podría resumir en: una mayor exigencia terapéutica, persiguiendo una curación de mucosa (healing mucosa)33, una incorporación precoz de la terapia biológica en el algoritmo de tratamiento (top-down strategy), pretendiendo modificar el curso natural de la enfermedad34-36 y unos tratamientos más prolongados en el tiempo, especialmente en las formas fistulosas, evitando recaídas precoces37.
En nuestro centro decidimos hace años aplicar tratamientos prolongados en el tiempo, pues consideramos positivo el riesgo-beneficio, al igual que el resto de la comunidad médica internacional. Sin embargo, la gran duda la constituye el posible riesgo de desarrollar neoplasias, específicamente linfomas38-40. Es un tema aún no resuelto, ni confirmado ni descartado, y que podría frenar las futuras estrategias que auguran al infliximab un mayor protagonismo en el tratamiento de estas enfermedades.
Su futuro, por tanto, pasará necesariamente por la realización de más estudios multicéntricos exclusivamente pediátricos. Sin ellos no podremos responder a las preguntas a las que, nos guste o no, tendremos que enfrentarnos a lo largo del camino. Los estudios efectuados en población adulta podrán responder algunas de ellas, pero el resto dependerá del esfuerzo que todos estemos dispuestos a realizar para encontrarlas.
Correspondencia: Dr. O. Segarra Cantón.
Pintor Huguet, 62, 1.º 3.ª 08226 Terrassa. Barcelona. España.
Correo electrónico: oscarsegarra@hotmail.com
Recibido en febrero de 2007.
Aceptado para su publicación en julio de 2007.