Objetivo primario, definir el tratamiento y la monitorización del niño crítico con enfermedad hemato-oncológica en las unidades de cuidados intensivos españolas. El objetivo secundario fue, tras una revisión de la literatura, contextualizar el enfoque obtenido y detectar posibles puntos de mejora.
Material y métodosEstudio observacional, descriptivo y transversal. Se envió en el periodo abril del 2011-mayo del 2011 una encuesta online a 324 intensivistas y adjuntos de pediatría registrados en la Sociedad Española de Cuidados Intensivos Pediátricos.
ResultadosSe obtienen 105 respuestas globales, 59/105 indicaron acordar el tratamiento con el oncólogo. Ante hipotensión, taquicardia y requerimiento de inotrópicos, 85/105 realizan siempre monitorización no invasiva de presión arterial asociando además medición intraarterial (85/105) y casi siempre presión venosa central (70/105). Ante dificultad respiratoria, se instaura siempre (36/105) o frecuentemente (60/105) ventilación no invasiva. De forma previa a iniciar ventilación mecánica convencional, 72/105 consideran el pronóstico global del paciente. Ante fallo renal agudo oligúrico, las técnicas de depuración extrarrenal son ampliamente utilizadas (74/105). En caso de mal pronóstico, la adecuación del tratamiento es considerada de forma frecuente (75/103) y conjunta con el oncólogo (91/103) y la familia (81/103).
ConclusionesSe observa gran similitud en las respuestas a pesar de que el manejo de este tipo de pacientes no está estandarizado. En caso de dificultad respiratoria, el uso de ventilación no invasiva como primera asistencia está ampliamente extendido. El desarrollo de futuros estudios observacionales prospectivos y multicéntricos permitiría conocer los resultados derivados de este enfoque.
Primary objective, to describe the management and monitorization of critically ill pediatric hemato-oncology patient (CIPHO) in the Spanish pediatric intensive care units (PICU). Secondary objective, through a literature review, to identify possible areas of improvement.
Material and methodsObservational transversal descriptive study. An anonymous web-based survey was sent to 324 Spanish pediatric intensivists from April 2011 to May 2011. None of them were pediatric residents.
ResultsThe survey was answered by 105 intensivists, 59/105 always agreed their treatment with the oncologist. In case of hemodynamic instability, non-invasive blood pressure monitoring is always done by 85/105 and almost always optimized by intra-arterial measuring (85/105) and central venous pressure (70/105). If respiratory failure the use of non-invasive ventilation (NIPPV) is always (36/105) or frequently (60/105) established prior to conventional mechanical ventilation. To replace or withdraw non-invasive ventilation only 44/96 of the respondents to this question use a clinical protocol. Before the instauration of conventional mechanical ventilation the oncological prognosis is considered by 72/105. In case of acute oliguric renal failure the renal replacement techniques are widely used (74/105). The withdrawal of sustaining life support is frequently discussed (75/103) and agreed with the oncologist (91/103) and caregivers (81/103).
ConclusionsIn our study, despite there is not a defined standard-of-care, the respondents showed similar therapeutics and monitorization choices. The use of NIPPV as first respiratory assistance is extended. Prospective, observational and multicenter studies should be developed to establish the results of this management in this population.
En la actualidad, el manejo de los pacientes pediátricos críticos con enfermedad oncohematológica (PPCOH) no está estandarizado1,2. Cuando ingresan en unidades de cuidados intensivos pediátricos (UCIP), los protocolos de tratamiento y monitorización que se les aplican son los mismos que se emplean con pacientes no oncológicos3.
La supervivencia de los PPCOH ha mejorado en los últimos años4 gracias a un mejor manejo de las complicaciones asociadas y el desarrollo y la evolución de terapias nuevas1,2,4. Por desgracia, la morbimortalidad en la UCIP continúa siendo alta y abundan los debates acerca de cuál es la mejor opción terapéutica en cada momento o de cuándo han de retirarse los tratamientos previamente iniciados5.
Cada año se dan aproximadamente 1.100 casos nuevos de cáncer pediátrico en España6. No existe ninguna institución dedicada exclusivamente al paciente pediátrico con enfermedad oncohematológica. Estos pacientes son atendidos en 47 hospitales con diferentes características y equipamiento3,6. Posiblemente, esta heterogeneidad, a pesar de la supervivencia del 80%, sea un obstáculo para la estandarización y la optimización de los tratamientos empleados. El objeto de este estudio es describir el manejo y el seguimiento de los PPCOH en las UCIP españolas y tratar a continuación, mediante una breve revisión de la literatura científica, algunas de las cuestiones suscitadas.
MétodosEstudio transversal, observacional y descriptivo realizado mediante una encuesta en línea (formulario de GoogleDoc®) enviada a 324 intensivistas pediátricos españoles registrados en la Sociedad Española de Cuidados Intensivos Pediátricos. El estudio no incluyó a médicos residentes. La encuesta, presentada en la tabla 1, se realizó de manera anónima. Se envió a los intensivistas independientemente de la complejidad de sus unidades y sus pacientes. Se enviaron recordatorios de la encuesta cada 2 semanas desde abril del 2011 hasta mayo del 2011. En caso de falta de respuesta, el encuestado no se tenía en cuenta en el análisis final. El análisis descriptivo de las respuestas se realizó con el programa SPSS 16.0 para Windows.
Preguntas incluidas en la encuesta
| 1. En pacientes ingresados por trasplante de células madre hematopoyéticas o en unidades de oncohematología, ¿el tratamiento médico siempre se decide conjuntamente entre el oncólogo y el intensivista? |
| 2. ¿Cree que el manejo de estos pacientes siempre se adecua a su complejidad y su pronóstico? |
| 3. ¿Qué tipo de monitorización utiliza en pacientes pediátricos críticos oncohematológicos con inestabilidad hemodinámica y requerimiento de inotrópicos? |
| 4. En el manejo del fallo respiratorio o la hipoxemia, ¿la ventilación no invasiva con presión positiva (VNIPP) es el primer método de soporte que utiliza? |
| 5. En caso de utilizar la VNIPP, ¿aplica un protocolo para retirarla o sustituirla por otro tipo de soporte? |
| 6. ¿Considera la instauración de la ventilación mecánica convencional independientemente del pronóstico de la enfermedad de base? |
| 7. ¿Su unidad de cuidados intensivos pediátricos (UCIP) está equipada para la oxigenación de membrana extracorpórea? |
| 8. Manejo respiratorio en caso de hipoventilación o hipoxemia refractaria a ventilación mecánica convencional |
| 9. En caso de fallo renal agudo oligúrico (creatinina superior en 2 DE o más a la media para la edad del paciente o doble de la basal), ¿cuál de las siguientes medidas no se aplican nunca en su unidad? |
| 10. En su hospital, ¿el estatus convulsivo en pacientes pediátricos críticos con enfermedad oncohematológica se considera motivo de ingreso en la UCIP? |
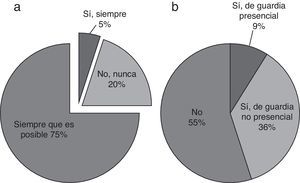
| 11. Si el paciente fallece en la UCIP, ¿está acompañado de un oncólogo? |
| 12. ¿Su hospital cuenta con un oncólogo de guardia? |
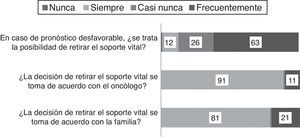
| 13. En casos de pacientes pediátricos críticos oncohematológicos con pronóstico desfavorable, ¿se trata la posibilidad de retirar el soporte vital? |
| 14. ¿La retirada del soporte vital se decide conjuntamente con el oncólogo? |
| 15. ¿La decisión de retirar el soporte vital se toma con el acuerdo de la familia? |
Ciento cinco intensivistas (32% de los que recibieron la encuesta) cumplimentaron el cuestionario. En su opinión, el tratamiento realizado era el apropiado para la complejidad y el pronóstico del PPCOH siempre (18%) o frecuentemente (78%) (tabla 2).
Equipo asistencial
| ¿Cree que el manejo de estos pacientes siempre se adecua a su complejidad y su pronóstico? | Nunca | Siempre | Casi nunca | Frecuentemente |
| 0 (0%) | 20 (18%) | 3 (3%) | 82 (78%) | |
| En pacientes ingresados por TCMH o en unidades de oncohematología, ¿el tratamiento médico siempre se decide conjuntamente entre el oncólogo y el intensivista? | Sí | No | Siempre que es posible | |
| 25 (24%) | 21 (19%) | 59 (56%) | ||
Respuestas (%).
PPCOH: paciente pediátrico crítico con enfermedad oncohematológica; TCMH: trasplante de células madre hematopoyéticas; UCIP: unidad de cuidados intensivos pediátricos.
El 56% de los encuestados considera que las decisiones concernientes al tratamiento y el cuidado del paciente han de tomarse conjuntamente entre el oncólogo y el intensivista en la medida de lo posible (tabla 2).
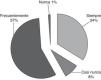
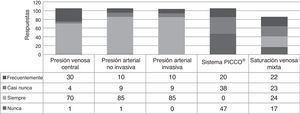
Monitorización hemodinámicaEl 80% de los intensivistas siempre emplean monitorización no invasiva de presión arterial. También asocian medición intraarterial (empleada siempre por 85/105) o presión venosa central (PVC; empleada siempre por 70/105 y frecuentemente por 30/105). La termodilución transpulmonar arterial periférica (sistema PICCO®) no se utiliza nunca o casi nunca. Además, 24/86 recurren siempre a la saturación venosa mixta de oxígeno (fig. 1).
Manejo respiratorioEn caso de fallo respiratorio o hipoxemia, los intensivistas utilizan la ventilación no invasiva de presión positiva (VNIPP) como primer método de asistencia respiratoria siempre (36/105) o frecuentemente (60/105) (fig. 2). Solo el 48% de los encuestados aplica protocolos estandarizados para sustituir o retirar la VNIPP (tabla 3).
Manejo respiratorio
| Pregunta | Sí | No |
|---|---|---|
| En caso de utilizar la VNIPP, ¿aplica un protocolo para retirarla o sustituirla por otro tipo de soporte? | 46 (48%) | 50 (52%) |
| ¿Considera la instauración de la ventilación mecánica convencional independientemente del pronóstico de la enfermedad de base? | 33 (31%) | 72 (69%) |
| ¿Su UCIP dispone de ECMO? | 30 (29%) | 75 (71%) |
Respuestas (%).
ECMO: oxigenación con membrana de circulación extracorpórea; UCIP: unidad de cuidados intensivos pediátricos; VNIPP: ventilación no invasiva con presión positiva.
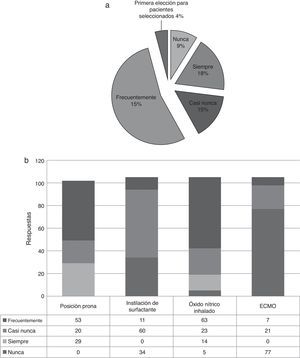
El 69% de los encuestados tienen en cuenta el pronóstico del paciente antes de instaurar la ventilación mecánica (VM) convencional. En caso de hipoxemia o de no constatarse mejoría, 29/102 colocan siempre al paciente en posición de decúbito prono. En casos de hipoxemia refractaria a la VM o la posición prona (PP), 19/105 instauran siempre ventilación de alta frecuencia oscilatoria (VAFO) (fig. 3). El 10% (11/105) de los encuestados usan con frecuencia surfactante pulmonar. En casos de hipoxemia refractaria, 63/102 (60%) administran frecuentemente óxido nítrico inhalado. La oxigenación por membrana extracorpórea (ECMO) es utilizada por 7/105 de los intensivistas en caso de ser necesaria (fig. 3).
Manejo renalEn casos de daño renal agudo oligúrico, el 97% de los encuestados utiliza terapias continuas de depuración extrarrenal (TCDE) si el paciente no responde a la administración de diuréticos en bolo o por perfusión continua (tabla 4).
Manejo de fallo renal agudo y estatus epiléptico
| Manejo renal | ||
| En caso de FRA oligúrico (creatinina superior en 2 DE o más a la media para la edad del paciente o doble de la basal),¿cuáles de las siguientes medidas no se aplican nunca en su unidad? | ||
| Diuréticos (bolo o perfusión) | 0 (0%) | |
| Diálisis peritoneal | 12 (11%) | |
| Hemodiálisis | 28 (27%) | |
| TCDE | 3 (3%) | |
| Se aplican todas | 62 (59%) | |
| Estatus epiléptico | ||
| ¿El estatus convulsivo en el PPCOH es motivo de ingreso en su UCIP? | Sí | No |
| 102 (97%) | 3 (3%) | |
Respuestas (%).
DE: desviación estándar; FRA: fallo renal agudo; PPCOH: paciente pediátrico crítico con enfermedad oncohematológica; TCDE: terapia continua de depuración extrarrenal.
El estatus epiléptico es considerado motivo de ingreso en la UCIP por 102/105 de los intensivistas encuestados (tabla 4).
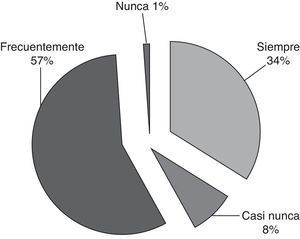
Toma de decisiones y atención al final de la vidaEn caso de pronósticos muy desfavorables, la posibilidad de retirar las terapias de soporte vital se plantea frecuentemente (63/102, 60%). El oncólogo y el intensivista toman esta decisión conjuntamente en el 87% de los casos (91/103) y los cuidadores participan siempre (81/103) o frecuentemente (21/103) (fig. 4). Cuando es posible, el oncólogo acompaña al paciente en el momento de su muerte (79%, fig. 5).
DiscusiónNuestra encuesta, la primera sobre este tema hecha a intensivistas pediátricos europeos, fue cumplimentada por un tercio de los intensivistas españoles miembros de la Sociedad Española de Cuidados Intensivos Pediátricos. Aunque no hay datos previos sobre el manejo general de los PPCOH, casi todos los encuestados consideran que su manejo se adecua a la complejidad y el pronóstico del PPCOH. Además, a pesar de que no se ha establecido un estándar para el manejo del PPCOH, observamos que los encuestados toman decisiones similares con respecto al tratamiento de las distintas situaciones clínicas estudiadas. Los procedimientos y los tratamientos elegidos parecen similares a los empleados en otros niños con enfermedad crítica y el intensivista y el oncólogo a menudo tomaron de manera conjunta las decisiones con respecto al final de la vida para adecuar la terapia a las necesidades del niño.
Discusión de las respuestasEquipo asistencialObservamos que el 19% de los encuestados no han integrado la colaboración con el especialista oncológico en su práctica clínica, a pesar de considerarse esencial en el tratamiento del PPCOH, ya que contribuye con toda claridad a reducir las decisiones inadecuadas y constituye uno de los pilares de la atención al PPCOH7. El equipo asistencial a cargo del paciente ha de ser sensible a las necesidades individuales e incorporar, en la medida de lo posible, un abordaje interdisciplinar en esta población7.
Monitorización hemodinámicaSegún nuestro estudio, los métodos invasivos de monitorización hemodinámica siempre se emplean en el PPCOH cuando está indicado o es necesario. Como hemos visto, la monitorización de la presión arterial, invasiva o no, y de la PVC se incluyen de manera generalizada en el manejo del PPCOH de los encuestados8. En el caso de la PVC, es posible que la necesidad de colocar un catéter venoso central para la administración de medicamentos quimioterapéuticos facilite su monitorización.
No se sabe con certeza cuál es la presión arterial media óptima, y además varía en función del paciente y la enfermedad9,10. Las medidas de presión sanguínea por métodos no invasivos pueden resultar imprecisas, siendo necesario hacer la media de mediciones repetidas de presión para optimizar el tratamiento hemodinámico8,11. Nuestro estudio mostró que la monitorización del PPCOH casi siempre se inicia con técnicas no invasivas que, si resulta necesario, son sustituidas más adelante por técnicas invasivas.
Solo el 20% valora el uso de la monitorización por termodilución transpulmonar arterial periférica; su uso es factible y parece seguro en estos pacientes. Los parámetros de termodilución pueden contribuir información clínica importante para evaluar la carga de volumen, lo que ayuda a tomar decisiones adecuadas en lo concerniente al tratamiento con inotrópicos y la fluidoterapia. Su uso infrecuente podría estar asociado a: 1) la escasa disponibilidad de esta tecnología en los UCIP españoles, y 2) la falta de experiencia y de datos para su interpretación12,13.
Por último, casi el 40% de los intensivistas incluidos en nuestro estudio no monitorizan habitualmente la saturación venosa mixta de oxígeno. Es importante mantener la oxigenación óptima de los tejidos14. Muchos parámetros se miden con este objeto15. Actualmente, la utilidad y la conveniencia de realizar una monitorización adecuada de la saturación venosa mixta de oxígeno para valorar el aporte de oxígeno a los tejidos están demostradas11 y su uso debe pautarse en el manejo del PPCOH siempre que esté indicado y sea posible16.
Manejo respiratorioNo se han realizado estudios prospectivos que confirmen la eficacia de la ventilación con VNIPP en niños inmunocomprometidos o PPCOH. Parece que podría aplicarse sin complicaciones.17 La VNIPP es factible y se tolera bien17, y podría evitar la intubación en al menos la mitad de los pacientes. Su uso se ha extendido en las UCIP españolas y 96/105 de los encuestados la utilizan como primera medida de soporte respiratorio. La VNIPP ha de iniciarse de manera precoz y no se han encontrado diferencias claras en las características clínicas y las puntuaciones de gravedad entre los pacientes que responden a ella y los que no17. A pesar del uso frecuente de la VNIPP, el 50% de los encuestados declaró no utilizar un protocolo estandarizado para su retirada o sustitución.
En caso de dificultad respiratoria grave, la VM convencional está indicada en el manejo del PPCOH.5 El síndrome de distrés respiratorio agudo (SRDA) es un diagnóstico común en el PPCOH18,19 que normalmente progresa a una situación de hipoxemia refractaria potencialmente mortal20. El SDRA está asociado a un riesgo significativo de mortalidad, a pesar de haberse producido, con el paso del tiempo, una mejoría general en su evolución4. Casi el 60% de los niños tratados con trasplantes de células madre hematopoyéticas (TCMH) desarrollan SDRA a consecuencia del propio tratamiento o de infecciones bacterianas, virales o micóticas. Se trata también de un fenómeno común en pacientes oncológicos que no han recibido un TCMH.
Hay varias técnicas disponibles para mejorar la oxigenación en el PPCOH hipoxémico.21 El método de VM empleado puede influir significativamente en el curso del daño pulmonar, y el volutrauma y el atelectrauma han de evitarse mediante la elección de una estrategia protectora pulmonar adecuada20,22. Debe aplicarse un volumen corriente bajo en base al peso estimado (6ml/kg) para evitar la hiperinsuflación dinámica, siendo esta la única estrategia que ha demostrado mejorar consistentemente la evolución del SDRA23,24. La presión positiva al final de la espiración ha de emplearse con cautela para mantener el reclutamiento alveolar, prevenir la atelectasia pulmonar y facilitar la sincronía en pacientes con respiración espontánea25.
Actualmente, carecemos de suficientes datos para recomendar el uso rutinario de la VAFO23, la posición prona26, la instilación de surfactante o el óxido nítrico inhalado20.
El 81% de los encuestados utiliza la VAFO y el 4% la elige como primera estrategia terapéutica en pacientes seleccionados. En general, la VAFO mejora la relación de la presión parcial arterial de oxígeno y la fracción de oxígeno inspirado (PaO2/FiO2) y, posiblemente, la supervivencia23,27.
Queda por aclarar el papel de la PP y los resultados de estudios prospectivos son controvertidos24,28. Varios mecanismos pueden explicar sus beneficios22, como, por ejemplo, mejoras en el reclutamiento pulmonar y una distribución más homogénea de la insuflación alveolar29. La PP también repercute en la síntesis de algunas citocinas proinflamatiorias, como la interleucina-6, por lo que sus efectos no pueden ser exclusivamente locales. La PP es una opción terapéutica empleada comúnmente por los intensivistas encuestados en caso de fallo respiratorio hipoxémico con falta de respuesta a la VM.
La instilación de surfactante parece prometedora30 en relación con los extensos cambios bioquímicos y biofísicos del sistema surfactante pulmonar en el SDRA21,31. Únicamente el 10% de los encuestados aplica esta terapia con frecuencia y su uso se puede valorar en niños con daño pulmonar directo30. No se conocen con exactitud el momento y la dosificación óptimos para su administración32. Tamburro et al. apuntaron sus posibles beneficios, sentando la base para futuros ensayos clínicos21. En cuanto al óxido nítrico inhalado, su uso para aumentar la vasodilatación pulmonar y lograr una oxigenación mejor está muy extendido entre los encuestados (73%). La evidencia científica no apoya su protocolización y su uso debe tener en cuenta las características individuales del paciente.
En cuanto a la ECMO, no hay suficientes datos que apoyen claramente su uso en el PPCOH, debiendo emplearse cuando se presenten manifestaciones clínicas que supongan una indicación razonable. Se ha recomendado en el SDRA porque evita la sobredistensión pulmonar y el uso de concentraciones altas de oxígeno. En España, su uso se limita a un número reducido de unidades. Es posible que la ECMO sea una terapia adecuada para el PPCOH. Hace falta establecer criterios de inclusión y protocolos de tratamiento adecuados para recoger datos de estas experiencias y promover el avance del estándar de atención.
Manejo renalEl fallo renal agudo incrementa de manera considerable la morbimortalidad. Requiere un tratamiento intensivo dirigido fundamentalmente a conseguir una perfusión renal adecuada y, por tanto, la normalización de la diuresis. Por lo general, el tratamiento se inicia con la administración de diuréticos en bolo o por perfusión.
Los encuestados en nuestro sondeo emplean frecuentemente TCDE33. En el PPCOH, también pueden emplearse para tratar la sobrecarga de fluidos o como terapia curativa en una gran variedad de trastornos y en la disfunción multiorgánica (atenuación de la inflamación y mejora de la oxigenación en niños ventilados mecánicamente)33,34. La intensidad no está aún bien definida, aunque se sabe que el uso de TCDE a altas dosis no mejora la supervivencia ni la recuperación de la función renal en pacientes con fallo renal agudo. En relación con esto, Rajasekaran et al. explican en un estudio retrospectivo reciente que el uso de TCDE no está relacionado con la supervivencia a largo plazo de pacientes pediátricos con TCMH34.
Estatus epilépticoCasi todos los encuestados consideran la presencia de estatus epiléptico como motivo de ingreso en la UCIP. En el PPCOH, las crisis podrían derivarse de la enfermedad oncológica, el tratamiento con radioterapia o quimioterapia o procesos infecciosos35. Nuestra encuesta no incluía preguntas sobre el tratamiento farmacológico. Actualmente se recomiendan algunos fármacos nuevos, como el levetiracetam36,37.
Decisiones sobre el final de la vidaEs sabido que la mayoría de las muertes en la UCIP requieren conversaciones o decisiones acerca del cuándo o del cómo limitar el apoyo al paciente mediante la retirada de terapias de soporte vital5,38. Esta situación se presenta frecuentemente en los PPCOH. En los hospitales infantiles el trabajo se centra en tratamientos que persiguen curar la enfermedad. A menudo, la muerte se percibe como un fracaso y es tabú hablar de ella o reconocer que puede ocurrir hasta muy avanzada la estancia hospitalaria del niño. No hay un modelo específico para la atención adecuada al niño moribundo o en lo concerniente a decisiones sobre el final de la vida, más allá de la necesidad de intensificar el tratamiento sintomático y analgésico para conseguir una calidad de vida aceptable. Parece evidente que es necesario mantener conversaciones directas sobre la retirada de los tratamientos para conseguir mejorar el manejo de estos pacientes7,39. La información comprensible sobre el estado de salud del niño influye en la habilidad de los padres de participar en la toma de decisiones sobre el final de la vida40. Tanto el trabajo colaborativo como la participación familiar se consideran buenos y son aplicados por los intensivistas consultados. En los que refieren la ausencia de oncología en caso de fallecimiento, se estaría probablemente aludiendo a que su hospital no cuenta con un oncólogo de guardia.
Nuestro estudio tiene varias limitaciones. Fue concebido como un estudio transversal observacional, por lo que los resultados están influenciados por el número de participantes. Además, debido a las características del sondeo y el tipo de respuestas, solo se pudo realizar un análisis descriptivo. Nuestro sondeo tampoco estaba estandarizado, dada la inexistencia de trabajos o publicaciones previas similares. Por lo que respecta al diseño del estudio, hubo varios factores de confusión que fue imposible eliminar (p. ej., la complejidad de la unidad de cuidados intensivos o el número de ingresos de PPCOH y su motivo). El diseño anónimo, que no incluía preguntas acerca de las características de la UCIP de cada participante, ha influido en las respuestas y los resultados han de interpretarse como percepciones subjetivas de cómo debería tratarse a estos pacientes más que de la manera en que son, de hecho, tratados. En el futuro, deberían realizarse estudios observacionales y prospectivos para describir el manejo de pacientes pediátricos oncológicos en la UCIP para obtener información sobre qué se hace realmente y, de ser necesario, implantar terapias nuevas o diferentes.
ConclusionesA pesar de la inexistencia de un estándar de atención, los intensivistas españoles mostraron un nivel de coincidencia elevado en lo concerniente a las decisiones terapéuticas tomadas en pacientes pediátricos con enfermedad oncohematológica crítica, con el uso de la VNIPP como primer método de soporte respiratorio ampliamente extendido. Los resultados de esta encuesta no establecen nuevos protocolos o criterios de tratamiento, pero pueden servir de base para conocer el manejo general del PPCOH con el propósito de desarrollar estudios y consensos en el futuro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los intensivistas pediátricos, por su disposición y amabilidad. A los miembros del grupo de trabajo sobre paciente oncohematológico grave o inestable (OncoCIPed) de la Sociedad Española de Cuidados Intensivos Pediátricos.