La sepsis vertical precoz es una causa importante de morbimortalidad neonatal. La evidencia científica apunta a que la mayoría de los recién nacidos infectados presentan clínica en las primeras horas de vida. Tras la aplicación de las medidas para la prevención de sepsis vertical y el descenso en su incidencia, se han propuesto cambios en el manejo de estos niños. No obstante, la realización de exploraciones complementarias dolorosas aún sigue siendo una práctica muy extendida.
Material y métodosEstudio prospectivo realizado entre 2011 y 2015. Se incluyó a todos los recién nacidos con edad gestacional ≥ 35 semanas, asintomáticos al nacimiento que presentaban uno o más factores de riesgo infeccioso. Durante su estancia en maternidad se realiza observación clínica periódica para la detección de síntomas compatibles con infección.
ResultadosDe los 9.424 recién nacidos en este periodo, 1.425 cumplían los criterios de inclusión del estudio; 53 pacientes precisaron ingreso, la mitad de ellos por sospecha de infección, confirmándose finalmente solo en 7 este diagnóstico. Todos los pacientes presentaron clínica en las primeras 72 h de vida.
ConclusionesLos niños con factores de riesgo infeccioso que desarrollan una infección presentan clínica de forma precoz en las primeras horas tras el nacimiento. Este trabajo apoya la observación clínica estrecha como medida suficiente y segura para la detección de la sepsis neonatal precoz.
Early-onset neonatal sepsis refers to an infection which starts during the first 72hours of birth, and can lead to significant morbidity and mortality. Scientific evidence shows that infected infants present with symptoms during the first hours after delivery. There has been a significant decrease in this condition with the implementation of guidelines for its prevention. However, International guidelines still recommend the evaluation of these infants using painful tests.
Material and methodsA prospective cohort study was conducted on all asymptomatic infants born at>35 weeks gestation with one or more risk factors in a single tertiary care centre from 2011 to 2015. They were periodically observed in newborn nursery from admission until discharge looking for signs of infection.
ResultsOut of the 9,424 babies born during this period, 1425 were included in the study. A total of 53 infants were admitted to the neonatal unit, half of them because of sepsis suspicion. Finally, just 7 were discharged with the diagnosis of sepsis. All these 7 presented with symptoms during their first 72hours of life. No sepsis was reported in asymptomatic infants.
ConclusionsTruly infected infants present with symptoms during their first hours of life. This study supports the observation of infants at risk as a safe practice to detect early-onset sepsis.
De acuerdo con las definiciones adoptadas por el Grupo de Hospitales Castrillo, se denomina síndrome de respuesta inflamatoria sistémica (SIRS) a la presencia de síntomas clínicos (aspecto séptico y/o presencia de 2 o más síntomas o signos de infección) y positividad de parámetros de laboratorio y sepsis neonatal a la presencia de SIRS más evidencia de infección, es decir, aislamiento de un germen patógeno en el hemocultivo. Del mismo modo, adoptando la definición de este grupo de trabajo, se define como sepsis vertical precoz a aquella infección que ocurre en las primeras 72 h tras el nacimiento y en la que se descarta la posibilidad de una infección nosocomial1,2. Esta es una causa importante de morbimortalidad neonatal3-5. Históricamente, el estreptococo del grupo B (SGB) o Streptococcus agalactiae (30-50%) era el principal responsable, seguido por Escherichia coli (E. coli) (26%)6,7. Sin embargo, según los resultados presentados en la reunión del grupo Castrillo de 2016 que hacen referencia a los datos de 2015 y se encuentran pendientes de publicación, el SGB (31,4%) ha sido superado por E. coli (35,7%) como principal responsable de la sepsis vertical precoz. Otros patógenos, como el Staphylococcus aureus, el Enterococcus faecalis y la Listeria monocytogenes, están menos frecuentemente implicados2,5.
La incidencia de la sepsis precoz por SGB sin medidas de prevención alcanzaba el 3 por 1.000 en los años 70. Tras la publicación de las medidas de prevención de la enfermedad perinatal por SGB por parte de los CDC en el año 1996 y sus revisiones en 2002 y 2010, y la administración de profilaxis antibiótica intraparto cuando existen factores de riesgo, se ha asistido a un descenso en la incidencia de sepsis de cualquier etiología, aunque especialmente la causada por SGB1,8. No obstante, sigue siendo una causa frecuente de sepsis en recién nacidos a término y pretérmino tardíos.
Actualmente, la incidencia de sepsis vertical precoz en países en los que se llevan a cabo las medidas de prevención se encuentra en torno a 0,9-1 por cada 1.000 recién nacidos vivos, siendo la incidencia de sepsis vertical confirmada, aquella con cultivos positivos, entre el 0,76 y el 0,9 por 1.0009,10. En España, según datos del grupo Castrillo, el descenso ha sido muy importante desde una incidencia de un 1,25 en el año 1996 hasta incidencias en torno al 0,7 por cada 1.000 recién nacidos vivos desde 2005, con un repunte puntual de 0,96 por 1.000 en 2015 (datos pendientes de publicación)11.
Gracias a las medidas de prevención establecidas, la tasa de mortalidad ha descendido desde un 50% en los años 70 hasta un 4-6% en recién nacidos a término en la actualidad12. La morbilidad asociada a este cuadro clínico es importante, pudiendo presentar los pacientes secuelas neurológicas y/o sensoriales13,14.
Los microorganismos responsables son bacterias comensales del tracto gastrointestinal, que a su vez actúa como reservorio principal y es fuente de paso hacia la cavidad vaginal. La colonización materna es el factor de riesgo principal para desarrollar una sepsis vertical. La presencia de bacteriuria en cualquier momento de la gestación supone mayor riesgo de sepsis al indicar una alta colonización materna. Se estima que de forma global, en torno al 10-30% de las mujeres durante la gestación están colonizadas por el SGB, se desconoce la tasa de colonización por otros gérmenes ya que no se realizan controles de forma habitual7. En España, la tasa de colonización se encuentra entre el 10 y el 18%6. El mecanismo de infección conocido como transmisión vertical se produce como consecuencia de la colonización del recién nacido mediante la exposición a través de la vagina de una mujer colonizada. Esto puede ocurrir bien porque el patógeno ascienda hacia la bolsa amniótica rota con el trabajo del parto, mediante invasión de las membranas amnióticas íntegras, o bien cuando el niño pasa a través del canal del parto15.
A la colonización materna se asocian otros factores de riesgo, como la prematuridad (edad gestacional [EG] inferior a 37 semanas), la rotura de membranas igual o superior a 18 h y la fiebre materna superior a los 38°C, que puede ser secundaria a una corioamnionitis16.
Los signos clínicos de infección en el recién nacido, aunque pueden ser sutiles e inespecíficos, aparecen en el 90% en las primeras 24 h de vida, por lo que es muy importante la observación estrecha durante este periodo9.
Debido al riesgo que supone, tradicionalmente distintos comités y organizaciones de reconocido prestigio han recomendado la realización de exploraciones complementarias dolorosas (analítica sanguínea para el recuento leucocitario y los reactantes de fase aguda) en neonatos con factores de riesgo infeccioso17. Las pruebas de laboratorio realizadas en pacientes de riesgo tienen una sensibilidad y especificidad bajas, lo cual, junto a los infructuosos intentos de poner en marcha scores para identificar de forma precoz los neonatos con factores de riesgo que van a desarrollar una sepsis, condicionan un ingreso innecesario para iniciar tratamiento antibiótico. Esto supone separar el binomio madre-hijo dificultando la instauración de la lactancia materna y además implica la realización de pruebas complementarias molestas y la instauración de tratamientos no exentos de potenciales efectos adversos. La utilización de pruebas complementarias de forma aislada no se recomienda ya que, por ejemplo, el valor predictivo positivo del recuento leucocitario es tan solo del 37% y la sensibilidad que muestra la ratio neutrófilos inmaduros/maduros es del 46%. Diferentes paneles de screening de sepsis han arrojado valores predictivos positivos inferiores al 30%, aunque con valores predictivos negativos > 99% en algunos estudios pequeños17,18. Las determinaciones de reactantes de fase aguda, realizadas de forma seriada, han mostrado valores predictivos negativos elevados en las primeras 12 h de vida superando el 99%12,18.
Tras la aplicación de las medidas preventivas para prevención de sepsis vertical y el descenso en su incidencia, se han propuesto cambios en el manejo. La evidencia científica, pese a las recomendaciones de algunas sociedades científicas, muestra que la mayoría de los neonatos que van desarrollar una sepsis lo hacen en las primeras 48 h. La observación clínica frente a las pruebas de laboratorio no demuestra un inicio más tardío del tratamiento ni supone un aumento de la tasa de morbimortalidad. Por lo cual, parece factible que la vigilancia clínica estrecha sea suficiente para la detección de los recién nacidos con sepsis precoz. Esto supondría además evitar la separación madre-hijo, la alteración de la flora intestinal y de puesta en marcha del sistema inmunitario, que supone la instauración de un tratamiento antibiótico en el caso de que no sea necesario.
Las medidas empleadas para la prevención de la sepsis precoz no se han mostrado eficaces en la sepsis neonatal tardía, cuya incidencia permanece estable en torno al 0,3-0,4 por 1.000 de los recién nacidos vivos. Su mecanismo de trasmisión no está aún muy claro19,20.
Con todos estos datos observados, se decidió poner en marcha un protocolo de observación clínica en recién nacidos con factores de riesgo infeccioso para evitar separación del binomio madre-hijo y disminuir los procedimientos dolorosos y la antibioterapia innecesarios.
Pacientes y métodosEstudio prospectivo realizado desde marzo del 2011 hasta mayo del 2015 en la planta de maternidad de un Hospital Universitario de nivel iii que atiende una media de 2.200 partos anuales.
La planta de maternidad cuenta con 25 habitaciones simples y 3 dobles.
Se incluyó a todos los recién nacidos con factores de riesgo infeccioso, asintomáticos al nacimiento y con EG igual o superior a 35 semanas. Durante la estancia en maternidad se recogieron de forma estandarizada los factores de riesgo infeccioso y las características demográficas de los recién nacidos, las valoraciones clínicas realizadas por el pediatra (a las 2 h de vida, entre las 6 y las 18 h de vida, y diariamente hasta el momento del alta), la necesidad de ingreso, la realización o no de pruebas complementarias y las horas de vida al alta. Como factores de riesgo infeccioso se incluyeron los siguientes: EG inferior a 37 semanas y toma materna de SGB desconocida, toma materna de SGB positiva sin profilaxis antibiótica o con profilaxis incompleta (definida como una dosis antibiótica menos de cuatro horas antes del nacimiento), tiempo de bolsa rota igual o superior a 18 h y fiebre materna superior a 38°C (anexo 1).
Se utilizaron las siguientes definiciones:
- –
«Sepsis vertical comprobada o altamente probable»: aquella con clínica y analítica compatibles que comienza en las primeras 72 h de vida, descartándose la posibilidad de infección nosocomial y con hemocultivo o cultivos periféricos positivos.
- –
«Sepsis vertical clínica»: aquella iniciada en los 3 primeros días de vida con presencia de SIRS neonatal, pero hemocultivo negativo, aunque con datos que indican etiología infecciosa (presencia de factores riesgo de transmisión vertical y/o aislamiento de gérmenes patógenos en canal genital materno o en exudados periféricos tomados al recién nacido en las primeras horas de vida)1.
Se revisaron, además, los datos de los recién nacidos con EG ≥35 semanas ingresados en la Unidad Neonatal durante este periodo con diagnóstico al alta de sepsis vertical precoz confirmada, así como sus factores de riesgo infeccioso.
Los datos fueron analizados utilizando el programa SPSS v22.0 para MAC. La normalidad de las variables cuantitativas se estableció con la prueba de Kolmogorov-Smirnov. Las variables de distribución normal se describieron con media±desviación estándar (DE). Las variables cualitativas se describieron mediante frecuencias absolutas y relativas (porcentaje) de sus categorías. Para estudiar la asociación entre variables cualitativas se utilizó la prueba de la chi al cuadrado.
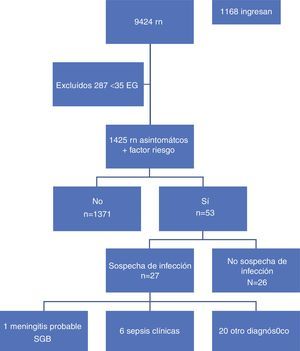
ResultadosDurante el periodo de estudio nacieron un total de 9.424 recién nacidos, de los cuales 9.137 (96%) tenían una EG igual o superior a las 35 semanas. Se incluyó en el estudio a un total de 1.425 recién nacidos (15,6%) asintomáticos al nacimiento que cumplían criterios por presentar uno o varios factores de riesgo. Los datos demográficos se muestran en la tabla 1. La figura 1 muestra el algoritmo de distribución de los niños nacidos durante el periodo de estudio.
El factor de riesgo infeccioso más frecuente por el que fueron incluidos fue el tiempo de bolsa rota prolongada ≥ 18 h (63%, n = 899), seguido por los niños con toma materna para SGB positiva que no habían recibido profilaxis o en los que había sido incompleta (22,9%, n=327), en tercer lugar la fiebre materna ≥ 38°C intraparto (11,3%, n=161) y finalmente la prematuridad con toma de SGB materna desconocida (7%, n=100). Del total de recién nacidos incluidos en el estudio, 61 (4,3%) tenían 2 o más factores de riesgo.
En cuanto a la profilaxis antibiótica intraparto, 958 madres (67,2%) la recibieron. Se utilizaron diferentes pautas antibióticas, siendo la prescripción más frecuente penicilina o ampicilina intravenosas (88,83%, n=851).
Durante el periodo de estudio, 1.372 de los niños incluidos (96,2%) fueron dados de alta desde la planta de maternidad, siendo su estancia media de 72,65 h. Cuatro de ellos fueron dados de alta precoz antes de las 48 h de vida y fueron reevaluados en el hospital en las siguientes 24 h del alta permaneciendo todos ellos asintomáticos. Los 53 restantes (3,8%) presentaron síntomas durante el periodo de observación y, por tanto, ingresaron y se les realizaron pruebas complementarias. El motivo de ingreso en 26 de ellos (1,82%) no fue sospecha de infección, sino otras causas, tales como ictericia, hipoglucemia… Los otros 27 (1,89%) ingresaron con síntomas indicativos de infección y, tras realizar las exploraciones complementarias pertinentes, en 20 (1,4%) se descartó infección y solo 7 (0,49%) fueron diagnosticados de sepsis; 6 clínica sin confirmación bacteriológica y uno de ellos de meningitis por SGB (tabla 2).
Características de pacientes del grupo de estudio ingresados con diagnóstico final de sepsis
| N.° | Sexo | EG (semanas) | Antibiot. parto | FRI | Horas inicio síntomas | Microbiología | Diagnóstico |
|---|---|---|---|---|---|---|---|
| 1 | M | 39+6 | Sí | TBR | 72 | Neg. | S. clínica |
| 2 | V | 40+2 | Sí | Fiebre | 60 | Frotis+E. coli | S. probable E. Coli |
| 3 | M | 39+5 | Sí | Fiebre | 19 | Neg. | S. clínica |
| 4 | V | 38+2 | Sí | TRB | 24 | Neg. | S. clínica |
| 5 | V | 38+1 | No | Fiebre | 20 | Neg. | S. clínica |
| 6 | M | 39+1 | No | SGB+ | 17 | Neg. | S. clínica |
| 7 | M | 35+3 | Sí | SGB+, TBR, fiebre | 12 | Neg. | Meningitis probable SGB |
En el grupo de los 61 niños con 2 o más factores de riesgo infeccioso, 10 (9,8%) ingresaron, 6 de ellos (0,42%) por sospecha de infección. Esto supone que un 13,39% de los niños de este grupo ingresaron finalmente frente al 3,15% de los niños que tenían solo un factor de riesgo, lo cual supone una diferencia estadísticamente significativa (p<0,05).
Durante este intervalo ingresaron en la Unidad Neonatal 1.168 niños, de los cuales 7 (0,59%) fueron diagnosticados de sepsis precoz confirmada, lo que supone una incidencia de sepsis probada de 0,7 por 1.000 recién nacidos vivos. De estos recién nacidos, en 3 casos el germen aislado fue el SGB (0,25%), lo que supone una incidencia de 0,32 por 1.000 recién nacidos vivos. De entre estos pacientes ingresados con sepsis confirmada, 6 no tenían ningún factor de riesgo infeccioso. Las características de los pacientes ingresados por sospecha de infección diagnosticados de sepsis clínica o confirmada están recogidas en la tabla 3.
Características de pacientes con diagnóstico de sepsis que no cumplían criterios del estudio
| N.° | Sexo | EG (semanas) | Antibiot. parto | FRI | Horas inicio síntomas | Microbiología | Diagnóstico |
|---|---|---|---|---|---|---|---|
| 1 | V | 39 | No | No | 20 | Neg. | S. clínica |
| 2 | V | 41+6 | No | No | 26 | Frotis+E. coli | S. probable E. coli |
| 3 | V | 39+2 | Sí | Fiebre | 0 | Frotis+SGB | S. probable SGB |
| 4 | V | 40+5 | No | No | 0 | Frotis+SGB | S. probable SGB |
| 5 | V | 40+2 | No | No | 24 | Hemo+Enterococcus faecalis | Sepsis por enterococo |
| 6 | M | 41 | No | No | 48 | Hemo+ S. viridans | Sepsis por S. viridans |
| 7 | V | 39 | No | No | 8 | Neg. | S. clínica |
La realización del cribado universal de colonización a las madres gestantes y la administración de antibioterapia intraparto en las gestaciones identificadas como de riesgo para el desarrollo de sepsis vertical en el recién nacido ha disminuido drásticamente su incidencia en nuestro medio. De este modo, parece razonable pensar que el manejo de los recién nacidos de riesgo ha de cambiar21. De acuerdo con las guías de manejo publicadas por los CDC y la Academia Americana de Pediatría en 2011, la mayoría de los recién nacidos, pero no todos, podrían ser manejados simplemente con la observación clínica8,17.
Varios estudios han demostrado la ineficacia de las pruebas complementarias frente al valor predictivo negativo tan elevado que supone el permanecer asintomático pese a tener factores de riesgo infeccioso22. Es importante resaltar además, que a pesar de que la mayoría de los recién nacidos que desarrollan una sepsis precoz tienen factores de riesgo infeccioso, hasta un cuarto de los que la desarrollan no los tienen7. En nuestro trabajo se recogieron como factores de riesgo infeccioso los ya publicados en las guías CDC y guías de otros organismos de prestigio internacional como la NICE y que ya han sido reseñados en apartados anteriores.
Durante el periodo de estudio se limitó la recogida de pacientes a aquellos recién nacidos con EG≥35 semanas, al igual que otros trabajos publicados porque estos niños tienen menor riesgo de desarrollar una sepsis grave. Se identificó un 15,6% de recién nacidos con riesgo de sepsis por presentar uno o más factores de riesgo infeccioso, lo que supone un porcentaje muy similar al de otros estudios publicados21. Como se ha reflejado previamente en la literatura, el presentar 2 o más factores de riesgo infeccioso incrementa el riesgo de desarrollar una sepsis, lo que se confirma en este trabajo9.
No obstante, de los niños ingresados con diagnóstico de sepsis un 42% no tenía ningún factor de riesgo, lo que supera el 25% de la literatura7.
La incidencia de sepsis vertical confirmada encontrada en el estudio es de 0,7 por 1.000 recién nacidos vivos, lo que coincide con las cifras publicadas a nivel nacional9,21. Igualmente, el 0,32 por 1.000 de sepsis por SGB coincide con los datos publicados en las guías CDC (0,34-0,37%0) y los datos del Grupo Castrillo (0,31%0)6,12.
De los 14 recién nacidos ingresados por sospecha de sepsis, 12 presentaron clínica en las primeras 48 h de vida (85,7%) y los otros 2 (14,28%), lo hicieron dentro de las primeras 72 h de vida, lo que se corresponde con los porcentajes encontrados en trabajos previos9.
Por todo ello, parece lógico pensar que es necesario alcanzar un equilibrio conociendo, por una parte, el riesgo de no diagnóstico de una patología potencialmente grave como es la sepsis precoz frente a la realización de exámenes complementarios, el ingreso y la administración de antibioterapia intravenosa a recién nacidos por otra parte sanos, que lo único que presentan es una serie de factores de riesgo y que permanecen en todo momento asintomáticos21. El presentar factores de riesgo supone simplemente esto, un riesgo aumentado, lo cual no quiere decir que necesariamente se desarrolle una sepsis. Ninguno de los factores de riesgo ha demostrado consistencia suficiente para la identificación de recién nacidos que van a presentar sepsis10.
En un estudio en el que se recogieron datos de recién nacidos con EG ≥ 35 semanas se muestra que la realización de estudios complementarios en recién nacidos asintomáticos ofrece información poco fiable para el manejo de estos recién nacidos, precisando que es necesaria la mejora de los métodos para la identificación de recién nacidos que realmente se encuentran en riesgo21.
El uso de antibióticos además es algo que ha demostrado efectos secundarios a largo plazo. En un estudio realizado en Suecia se demostró que su uso durante la primera semana de vida estaba relacionado con mayor riesgo de broncoespasmos de repetición durante los primeros 12 meses, extendiéndose este riesgo hasta los 4 años y medio. Así mismo, el uso de antibióticos altera la microbiota intestinal23-25.
Las pruebas de laboratorio de forma individual han demostrado un escaso valor predictivo positivo y negativo para la detección de la sepsis vertical precoz. Así mismo, la clínica es muy sensible aunque con escaso valor predictivo positivo. No obstante, los recién nacidos con sepsis presentan clínica, poco específica, habitualmente dentro de las primeras 48 h del nacimiento a pesar de haber recibido antibioterapia intraparto9.
Existe un acuerdo unánime en la administración de antibioterapia de forma empírica a todos los recién nacidos con o sin factores de riesgo que presenten clínica compatible. No obstante, el dilema se encuentra en qué hacer con los recién nacidos asintomáticos con factores de riesgo infeccioso. En el año 2013 se publicó en Suiza una guía de manejo de recién nacido con factores de riesgo basada en las recomendaciones de la Academia Americana de Pediatría publicadas en 2013, en las que se recomienda la observación clínica estrecha durante las primeras 48 h de vida de los recién nacidos con factores de riesgo ante la evidencia de que más de un 90% de los que van a presentar una sepsis precoz, desarrollan sintomatología en ese periodo.
A la vista de los resultados obtenidos en este estudio y de la literatura existente, parece que la observación clínica estrecha puede ser una medida suficiente y segura para la detección de sepsis neonatal precoz, evitando la separación madre-hijo, la realización de pruebas complementarias y reduciendo el uso de antibioterapia. Es recomendable la realización de nuevos estudios que permitan la revisión de este tipo de protocolos por parte de grupos de trabajo de sociedades científicas, para validar y universalizar estas prácticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa: XXIII Congreso de Neonatología y Medicina Perinatal de la SEN, Oviedo, 5-7 de octubre del 2011; XXIV Memorial Guillermo Arce y Ernesto Sanchez-Villares, Oviedo, 25-26 de noviembre del 2011; XXIV Congreso de Neonatología y Medicina Perinatal y IV Congreso de Enfermería Neonatal, Barcelona, 2-4 de octubre del 2013.