Las insulinas tradicionales como la insulina regular y la insulina neutral protamine Hagedorn (NPH) presentan una eficacia limitada, debido fundamentalmente a su perfil farmacocinético y farmacodinámico. En la última década, gracias a los avances en ingeniería genética, se han realizado modificaciones en la molécula de insulina que han perseguido fundamentalmente alterar su formulación galénica, con el objetivo de hacer mucho más rápida a la insulina regular y mucho más lenta a la insulina NPH. Así, se han comercializado cinco nuevas insulinas conocidas como «análogos»: dos lentas (insulina glargina y detemir) y tres rápidas (insulina lispro, aspart y glulisina). En este artículo revisamos las propiedades de cada una de ellas, analizando las posibles ventajas y desventajas que puede ofrecernos su utilización en niños con diabetes tipo 1.
Standard human insulin preparations such as regular soluble insulin and neutral protamine Hagedorn (NPH) insulin have shortcomings in terms of their pharmacokinetic and pharmacodynamic properties that limit their clinical efficacy. In the last decade, due to advances in genetic engineering, structurally modified insulin molecules have been developed with the aim of changing their galenic properties to make regular soluble insulin faster and NPH insulin slower. Five insulin analog preparations have become commercially available: two long-acting analogs (insulin glargine and detemir) and three rapid or fast-acting analogs (insulin lispro, aspart and glulisine). This article highlights the specific properties of these new insulin analog preparations and focuses on their potential advantages and disadvantages when used in children with diabetes mellitus.
Desde que el estudio DCCT (Diabetes Control and Complication Trial) demostró que el tratamiento intensivo con insulina reducía la frecuencia y la gravedad de las complicaciones crónicas propias de la diabetes, éste se ha convertido en el tratamiento de elección en diabéticos jóvenes con expectativa de vida (dicho estudio no incluía a niños, solo jóvenes con pubertad completa y mayores de 13 años)1. En pediatría no existe un estudio similar, y las recomendaciones de tratamiento intensivo han llegado más tarde, en forma de opiniones de expertos y consenso de sociedades2–6. Muchos autores cuestionaron su indicación en niños debido a que el efecto adverso más frecuente y temido de esta terapia intensiva es la aparición de hipoglucemias graves, potencialmente más nocivas en niños por el riesgo de deterioro neurológico (con especial preocupación por las nocturnas, más difíciles de detectar)7–12. La mayoría de estas hipoglucemias son debidas a que el perfil farmacocinético de las insulinas de las que disponíamos, la insulina neutral protamine Hagedorn (NPH; Humulina NPH® e Insulatard NPH®) y la insulina regular (Humulina Regular® y Actrapid®), no era el más adecuado.
En los últimos 10 años, gracias a los avances en ingeniería genética, hemos sido testigos de la aparición de nuevas insulinas, que de forma progresiva han ido desplazando a aquéllas, modificando, por lo tanto, las pautas de insulinización de los pacientes diabéticos13–17. Aunque los endocrinólogos pediátricos están familiarizados con estas nuevas insulinas, otros muchos pediatras que atienden a niños diabéticos no lo están; la finalidad de este artículo es ayudar a paliar esta situación.
Consideraciones generalesEl páncreas consigue un balance adecuado del metabolismo hidrocarbonado y para ello utiliza una secreción continua de insulina entre comidas y durante la noche, en respuesta a la producción de glucosa por el hígado en ayunas (secreción basal) y una secreción aguda en respuesta a las comidas (picos). La secreción basal, aunque es continua, sufre variaciones a lo largo del día ya que los requerimientos insulínicos no son constantes. Por ejemplo, los lactantes necesitan más insulina al atardecer, mientras que los niños mayores y adolescentes lo hacen al amanecer. El objetivo del tratamiento con insulina subcutánea es intentar imitar, en la medida de lo posible, esta secreción fisiológica; esta estrategia se conoce como régimen basal/bolos.
La insulina ideal para utilizar como insulina basal sería una sin pico de acción, con vida media prolongada y cuya absorción fuera lo más predecible posible, con poca variabilidad. La insulina NPH ha sido y es utilizada con esta finalidad, pero en absoluto cumple con estos requisitos. Es una insulina «demasiado rápida» para ser utilizada como basal, con un pico de acción importante a las 3-4h de su administración (causante de muchas hipoglucemias) y con una vida media demasiado corta, lo que obliga a administrarla, en la mayoría de las ocasiones, en 3 dosis (aun así, la dosis de antes de la cena o de las 24h acaba siendo insuficiente para el control preprandial del desayuno). Además, uno de sus mayores inconvenientes es la gran variabilidad de absorción y acción que presenta (de hasta un 68%, según el individuo), lo que en numerosas ocasiones dificulta su manejo.
De la misma manera, la insulina ideal para utilizar en bolos sería una de inicio de acción muy rápido, con un pico breve y una vida media también muy corta. La insulina regular o rápida tampoco cumple este perfil, ya que su inicio de acción es demasiado lento (30-45min), con un pico tardío (unos 90-120min) y una vida media demasiado larga (5-6h), causante también de bastantes hipoglucemias.
Debido al perfil farmacocinético de ambas insulinas, su utilización conjunta hace que en ocasiones resulte bastante difícil interpretar la causa de algunas hipoglucemias o hiperglucemias, a la vez que complica, en cierta medida, la educación diabetológica que se les da a los padres (sobre todo resulta laborioso hacerles entender que la NPH es una insulina «lenta o basal»).
Para obviar estos inconvenientes los laboratorios han investigado arduamente y consiguieron crear nuevas insulinas, conocidas como análogos. Las modificaciones que se han realizado mediante ingeniería genética en las moléculas de la insulina han perseguido, fundamentalmente, modificar su formulación galénica, con el objetivo de hacer mucho más rápida a la insulina regular y mucho más lenta a la insulina NPH.
Análogos de insulina lentaDos son los análogos de lenta de los que disponemos en la actualidad:
- –
Insulina glargina (Lantus®, Sanofis-Aventis). Fue la primera en aparecer (diciembre de 2003), obtenida al añadir dos argininas en la región C-terminal de la cadena beta y sustituir la asparaginasa por glicina en la posición A21 de la cadena alfa, añadiendo pequeñas cantidades de cinc necesarias para la cristalización y disolución desde el tejido subcutáneo. El resultado es una disolución ácida que, al depositarse en el tejido subcutáneo, precipita en forma de hexámeros, lo que produce una difusión lenta hacía el torrente sanguíneo18,19.
- –
Insulina detemir (Levemir®, Novo-Nordisk). Aparecida en mayo de 2005 es obtenida al añadir a la molécula de insulina un ácido graso, el ácido mirístico (en la lisina de posición B29), y retirar una molécula de treonina de la posición B30. Estas modificaciones facilitan la unión de albúmina en la posición 29. Tras su inyección subcutánea se forman hexámeros, de difusión lenta al torrente circulatorio. Una vez allí, una fracción se une a moléculas de albúmina, tanto en el espacio intersticial como en plasma, que resulta en un equilibrio entre insulina libre y ligada a albúmina. Sólo la fracción libre es activa y la fracción ligada va liberándose progresivamente20,21.
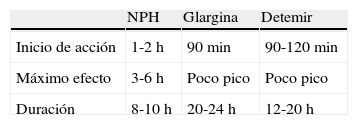
Estos cambios provocados en la molécula de insulina modifican su perfil farmacocinético y, como hemos comentado previamente, vienen a sustituir a la insulina NPH, intentando mantener estables las concentraciones de insulina durante 24 horas. Las características de ambas insulinas y su comparación con la NPH se pueden observar en la tabla 1.
Como vemos, teóricamente ninguna de las dos presenta pico, con una vida media considerablemente más larga, por ello se ajustan mucho más al perfil que reclamábamos para la insulina basal ideal. También presentan menos variabilidad, con un perfil mucho más estable y predecible22. Han sido numerosos los estudios que se han realizado con ambas insulinas23–32, si bien en la edad pediátrica la experiencia es considerablemente mayor con la insulina glargina33–41 que con la detemir42.
Hay algunas diferencias entre ambas. Así la duración de la acción de la insulina detemir parece ser dependiente de la dosis, a menor dosis menor duración43. A dosis de 0,4U/kg/día es de unas 20h, por ello, muchos pacientes requieren dos inyecciones diarias. Esta observación es particularmente importante durante la infancia, ya que estudios farmacodinámicos apuntan a una vida media más corta en niños y adolescentes44. Su potencia de acción es menor, lo que en la práctica clínica se traduce en la utilización de dosis mayores cuando se le compara con las demás insulinas lentas. En cuanto a la insulina glargina, aunque diversos estudios han demostrado que es igualmente eficaz independientemente del momento en que se la administre, en la práctica y debido a que puede tener un pequeño pico a las 6-8h de su administración, puede haber un mayor riesgo de hipoglucemias si se administra en la cena o al acostarse.
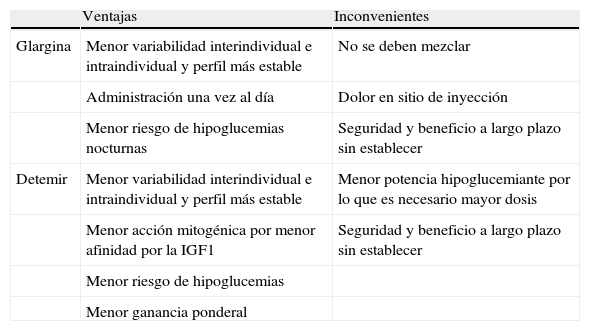
Entre las ventajas clínicas que presentan los análogos de lenta se encuentran: facilitar la aplicación y explicación del régimen bolos/basal; disminuir de forma significativa la frecuencia y la gravedad de las hipoglucemias nocturnas45–54; mejorar el control metabólico y reducir la ganancia de peso observada con los regímenes intensivos. Entre las desventajas: según la ficha técnica, no pueden utilizarse en menores de 6 años, requiere de su «uso compasivo» que incluye consentimiento informado, autorización del centro y del Ministerio (hay publicaciones que muestran su eficacia en este grupo de niños55); no pueden mezclarse en la misma jeringa con otras insulinas, ya sea regular o análogos de rápida (hay autores que lo han hecho sin por ello perder efectividad56), y debido a su reciente aparición, desconocemos su seguridad a largo plazo (tabla 2).
Ventajas e inconvenientes de los análogos de lenta
| Ventajas | Inconvenientes | |
| Glargina | Menor variabilidad interindividual e intraindividual y perfil más estable | No se deben mezclar |
| Administración una vez al día | Dolor en sitio de inyección | |
| Menor riesgo de hipoglucemias nocturnas | Seguridad y beneficio a largo plazo sin establecer | |
| Detemir | Menor variabilidad interindividual e intraindividual y perfil más estable | Menor potencia hipoglucemiante por lo que es necesario mayor dosis |
| Menor acción mitogénica por menor afinidad por la IGF1 | Seguridad y beneficio a largo plazo sin establecer | |
| Menor riesgo de hipoglucemias | ||
| Menor ganancia ponderal |
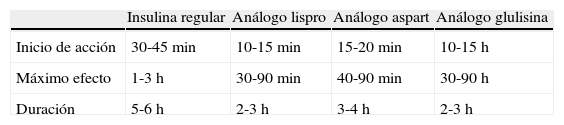
Los análogos de rápida de los que disponemos en la actualidad son tres (tabla 3):
- –
Insulina lispro (Humalog®, Lilly), que se obtiene al cambiar la prolina por lisina en la posición 28 de la cadena B y la lisina por prolina en la posición 29.
- –
Insulina aspart (NovoRapid®, Novo-Nordisk), que se obtiene por sustitución de la prolina por un ácido aspártico en la posición 28 de la cadena B.
- –
Insulina glusilina (Apidra®, Sanofi-Aventis), obtenida por sustitución de la asparragina por lisina en la posición B3 y de la lisina por un ácido glutámico en la posición B29. De reciente aparición está autorizado su uso en niños mayores de 6 años de edad, a diferencia de las dos anteriores que pueden utilizarse en mayores de 2 años.
Cuando la insulina regular es aplicada vía subcutánea las moléculas de insulina se asocian formando hexámeros de alto peso molecular que difunden lentamente hacia la circulación. Las modificaciones realizadas para la obtención de estos análogos disminuyen esta capacidad de asociación, ya que reducen la formación de hexámeros y aumentan la proporción de monómeros de menor peso molecular y absorción mucho más rápida. Esto hace que presenten un inicio de acción mucho más rápido, lo que permite que puedan ser administradas solo 5-10min antes de las comidas, en comparación con los 30-40min que había que esperar con la insulina regular. Incluso en lactantes o niños pequeños, caprichosos a la hora de comer, se pueden administrar tras las comidas, una vez hayamos visto la cantidad de alimentos ingeridos. Esto permite mayor flexibilidad y libertad de movimientos, detalles que mejoran mucho la calidad de vida de los pacientes diabéticos y, por ello, muy valorados. Su vida media más corta reduce la necesidad de ingerir alimentos unas 2-3h después de su administración, hábito necesario con la insulina regular, cuya vida media más larga causaba hipoglucemias tardías posprandiales. Por todo ello, su utilización en edad pediátrica se ha extendido en los últimos años57–64. Como «inconveniente» encontramos la necesidad de administrar insulina en cada toma, lo que conlleva en ocasiones más pinchazos (con la insulina regular y debido a su farmacocinética lenta, alguna ingesta, sobre todo la merienda, en ocasiones estaba cubierta con la dosis anterior administrada) (tabla 4).
Ventajas e inconvenientes de los análogos de rápida
| Ventajas | Inconvenientes |
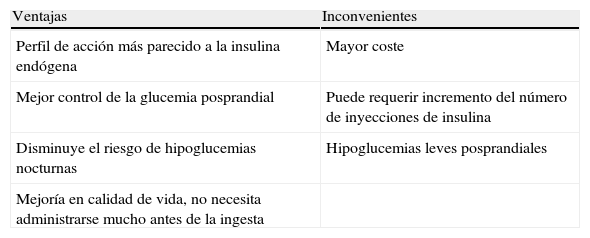
| Perfil de acción más parecido a la insulina endógena | Mayor coste |
| Mejor control de la glucemia posprandial | Puede requerir incremento del número de inyecciones de insulina |
| Disminuye el riesgo de hipoglucemias nocturnas | Hipoglucemias leves posprandiales |
| Mejoría en calidad de vida, no necesita administrarse mucho antes de la ingesta |
Entre las ventajas clínicas que presentan se encuentran: facilitar la aplicación y explicación del régimen bolos/basal; disminuir de forma significativa la frecuencia y la gravedad de las hipoglucemias nocturnas65 y mejorar significativamente la calidad de vida66–68. Entre las desventajas: aumenta la frecuencia de hipoglucemias posprandiales precoces y se desconoce su seguridad a largo plazo.
Pautas de insulinoterapia con análogosEn la diabetes mellitus tipo 1 las pautas de insulina deben individualizarse y adaptarse tanto al perfil glucémico del paciente como a su régimen de vida. En primer lugar será necesario calcular las necesidades diarias de insulina que, según la edad del paciente, su estadio puberal, su peso y los años de evolución de la enfermedad, pueden variar desde 0,7 a 1,5U/kg/día. Si tras valorar todo estos parámetros se opta por la utilización de análogos, una pauta orientativa sería:
- –
El 50% de la insulina necesaria se administrará como análogo de lenta, en una sola dosis en el caso de la insulina glargina (puede administrarse con cualquiera de las comidas, y es importante hacerlo todos los días a la misma hora) y en dos dosis en el caso de la insulina detemir.
- –
El otro 50% se administrará en forma de análogo de rápida a razón de 0,1-0,2U/kg/dosis 10-15min antes de las comidas.
El tratamiento intensivo con una infusión subcutánea continua de insulina (ISCI) mediante una bomba externa, es el método que mejor imita la secreción fisiológica de insulina69. Permite la programación de tantos tramos basales como se desee y además, al ahorrar pinchazos, facilita la administración de bolos ante cualquier ingesta, por pequeña que ésta sea. Los análogos de rápida han demostrado ser seguros y eficaces cuando son utilizados en esta modalidad de tratamiento70–72.
La cetoacidosis es la complicación más grave que puede presentarse en cualquier paciente diabético, también es la forma de inicio de casi un 30% de los niños. Su tratamiento requiere hospitalización, ya que la perfusión continua de insulina intravenosa, junto con una rehidratación enérgica, es el tratamiento de elección. El uso de análogos vía venosa no está aceptado, por lo que se requiere en estos casos utilizar insulina regular. No obstante, cuando por diversos motivos no es posible acceder a una vía venosa, el tratamiento con dosis frecuentes (cada 2-4h) de análogos de rápida ha demostrado ser una terapia segura y eficaz73,74.
Consideraciones finalesComo podemos apreciar consultando la bibliografía, un gran número de estudios recientes han demostrado los beneficios significativos que se obtienen con la utilización de estas nuevas insulinas, en términos de reducir la frecuencia de las temidas hipoglucemias nocturnas, y mejorar tanto los controles posprandiales de glucemia como la calidad de vida de los pacientes cuando se comparan con las insulinas tradicionales. Sólo puntualizar que, en lo referente a conseguir un mejor control metabólico general que debe reflejarse en una disminución en los valores de hemoglobina glicosilada (HbA1C), muchos de estos estudios pediátricos presentan varios inconvenientes. Las evidencias más firmes en cuanto a efectividad de tratamientos se derivan de ensayos clínicos aleatorizados, de los que no hay muchos. Casi todos los estudios realizados en niños son pre-postintervención, que siempre estarán sesgados, como bien comentan García et al, «los resultados beneficiosos sin duda estarán matizados por la mayor ilusión y motivación de los pacientes ante una nueva terapia, mejorando su adherencia a la misma, el aumento del número de autoanálisis necesarios para ajustar las nuevas dosis y la repercusión que la mejora de la calidad de vida pueda tener sobre la adherencia al tratamiento». Además, suelen ser estudios de una duración relativamente corta. Por todo ello, nos parece adecuado concluir que, por el momento, la evidencia actual que sostiene que con los análogos se consigue una reducción significativa a largo plazo de la HbA1C es al menos modesta.