La enfermedad de Castleman es un trastorno linfoproliferativo de etiología desconocida, de escasa frecuencia en Pediatría (sólo hay 100 casos descritos, 7 en España). Suele afectar a adultos jóvenes y se describen 2 formas clínicas: la forma localizada (que suele presentarse como una masa única y asintomática al diagnóstico) y la forma multicéntrica, (generalmente con afectación sistémica y un comportamiento más agresivo). El diagnóstico de confirmación es anatómico y patológico. Histológicamente hay 2 variantes: la forma hialina-vascular, que suele corresponder a las formas localizadas de la enfermedad, y la variante de células plasmáticas, que suele ser multicéntrica. La resección quirúrgica es curativa para las formas localizadas, mientras que se han ensayado una multitud de tratamientos sin éxito para las formas multicéntricas. A continuación se presenta el caso de una preescolar de 3 años con una forma localizada de la enfermedad que, tras 2 años de seguimiento, se mantiene asintomática. Asimismo, se realiza una revisión de la literatura médica disponible al respecto.
Castleman's disease is an unknown etiology lymphoproliferative disorder rare in childhood (only 100 cases described in the literature, 7 of them in Spain). It usually appears in young adults, with no gender-related differences. There are two clinical forms of the disease: the localized variant, the more frequent type, usually presented as a solitary mass (generally in the mediastinum) and asymptomatic at the time of diagnosis, and the multicentric variant, less frequent and usually associated with systemic symptoms and a more aggressive clinical evolution. The diagnosis is confirmed based on the histopathological study. There are two histological variants: the hyaline-vascular type, which usually appears as a localised variant, and the plasma-cell type, which usually appears as multicentric variant and has a worse prognosis. While the best treatment for the localised variant is surgical resection, which is curative, for the multicentric variant many therapeutic strategies have been used without real success. In the present article we report a new case of this disease in a 3-year-old girl with the localised form, who remains asymptomatic after two years of follow-up, and a review of the available literature. This disease should be included in the differential diagnosis of the lymphoproliferative disorders.
La enfermedad de Castleman (EC), descrita en 1956 por Benjamin Castleman1, es un proceso linfoproliferativo2 de escasa frecuencia en Pediatría, de la que sólo hay 100 casos descritos en la literatura médica (7 en España); se presenta con mayor frecuencia en adultos jóvenes3, sin predominio de sexo3,4. Su etiología es incierta pero implica mecanismos autoinmunitarios2,5, procesos inflamatorios crónicos, inmunodeficiencias y coinfecciones producidas por diversos agentes6,7. Hay 2 variantes clínicas: la forma localizada (que se presenta como una masa única y asintomática al diagnóstico) y la forma multicéntrica (de clínica más compleja, afectación multifocal, combinación con otras enfermedades8,2 y pronóstico menos favorable6,9). Puede presentarse en cualquier localización, aunque el lugar más frecuente es el mediastino, seguido del abdomen y de la pelvis, entre otros4.
La historia clínica y la exploración física arrojan pocos datos para el diagnóstico. En cuanto a las pruebas de imagen, la tomografía computarizada (TC) y la resonancia nuclear magnética (RNM) suelen mostrar una imagen bien delimitada que realza con contraste4,10,11. El diagnóstico de certeza se basa en los hallazgos histológicos4,11, según los cuales se distinguen 2 variantes: la forma hialina-vascular (en la que se observan varios centros germinales rodeados de linfocitos pequeños de forma circunferencial [«en bulbo de cebolla»] dentro de cada folículo y un abundante estroma vascular) y la variante plasmocelular (caracterizada por una basta proliferación de células plasmáticas en el espacio interfolicular y menos estroma vascular6,12).
Para las formas localizadas, la resección quirúrgica es curativa4,9. Para minimizar el riesgo de hemorragia con el que se puede asociar, se utiliza la embolización prequirúrgica13,14 con éxito. En cuanto a las formas multicéntricas, los tratamientos ensayados son múltiples, incluidas la cirugía, la radioterapia15,16 y la quimioterapia, aunque ninguna se ha mostrado eficaz15,17,18, de forma que su pronóstico es manifiestamente peor que para las formas localizadas15.
A continuación se presenta un nuevo caso. Se trata de una preescolar de 3 años de edad, con una forma localizada de la enfermedad, en quien se llevó a cabo la escisión completa de la lesión y que, tras 2 años de seguimiento, se mantiene asintomática.
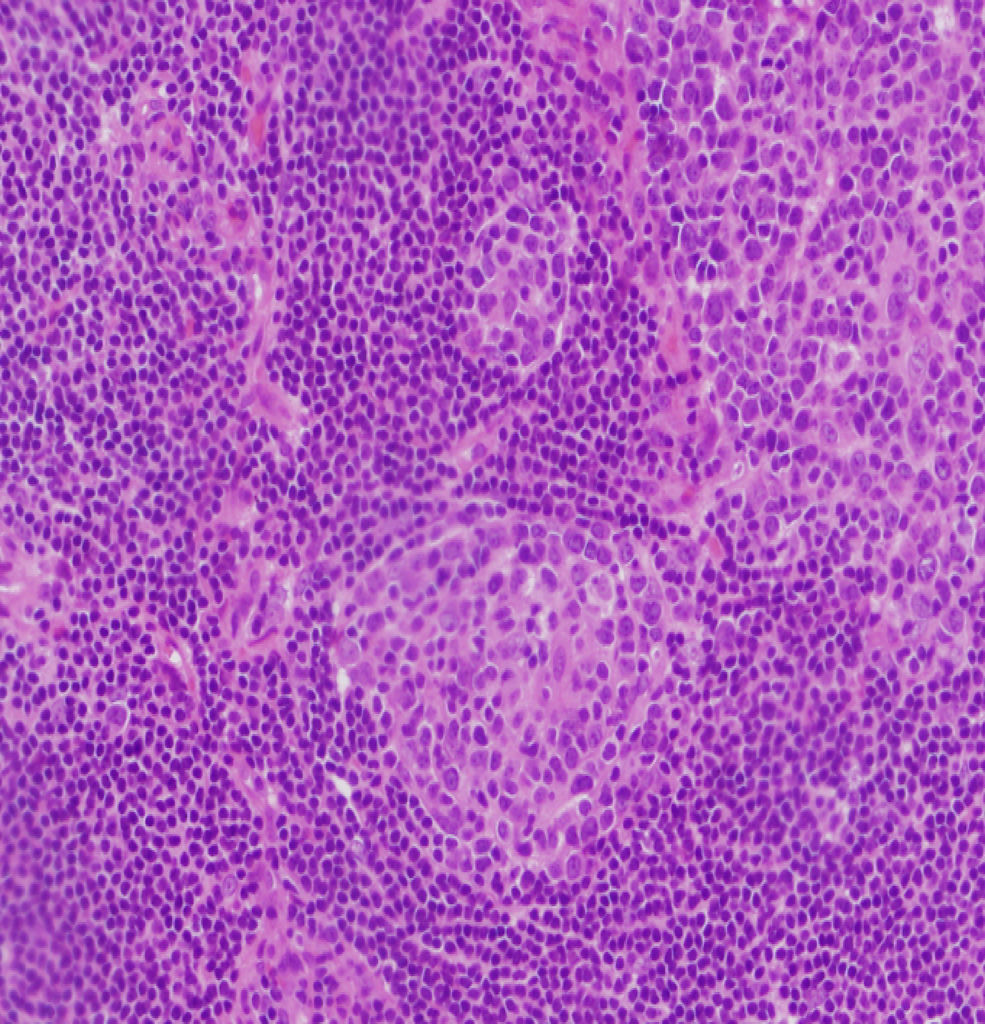
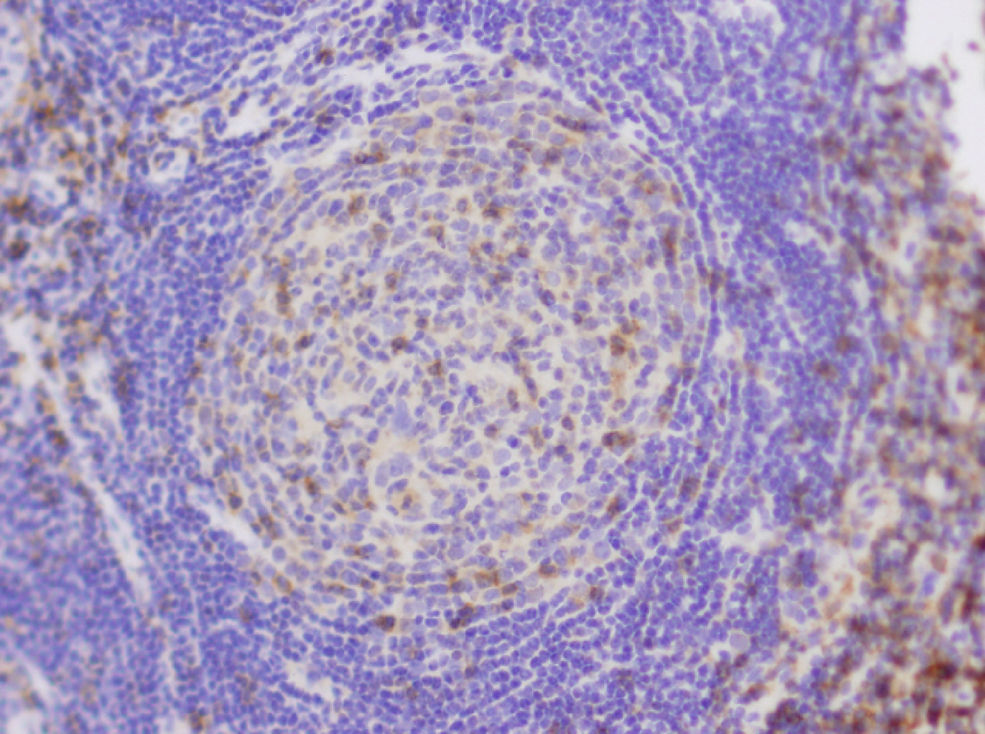
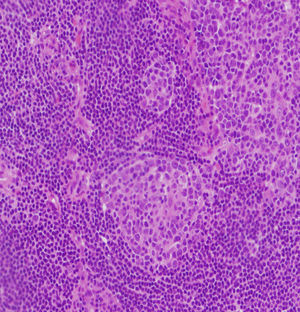
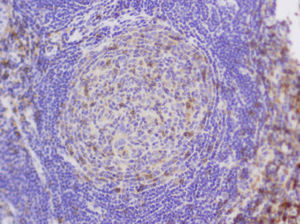
Observación clínicaPaciente de 3 años de edad, mujer, sin antecedentes personales de interés, que presentó una adenopatía laterocervical derecha de un año de evolución, con un incremento manifiesto de tamaño en los 5 meses previos. La anamnesis no arrojó otros datos de interés. En cuanto a la exploración física, destacó la presencia de una adenopatía en la región laterocervical derecha, de 2×2,5cm, de consistencia elástica, no adherida a planos profundos y sin signos inflamatorios. El resto de la exploración física fue normal. Se inició tratamiento antiinflamatorio y antibiótico de forma ambulatoria que no tuvo respuesta, por lo que se realizaron una analítica sanguínea básica (con resultados normales), Mantoux (negativo) y una ecografía cervical (informada como «grupo de adenopatías de gran tamaño, la mayor de 2,5cm de diámetro, que contactan con la glándula parótida. No están abscesificadas»). Tras no responder al tratamiento y debido a la normalidad de las pruebas complementarias efectuadas, se procedió a la exéresis y al estudio anatomopatológico de la lesión (informada como «masa de tejido linfoide anormal que incluye conductos epiteliales dispersos acompañados de tejido fibroso de aspecto capsular. El tejido linfoide está organizado como folículos B anómalos, con gran hiperplasia de células reticulares dendríticas y con frecuentes vasos sanguíneos centrales, en torno a los cuales se observan mantos B organizados en bulbo de cebolla. Diagnóstico: EC de tipo hialino vascular») (figs. 1 y 2). Se realizó un estudio de extensión y cribado de afectación sistémica; en la TC toracoabdominal se encontraron «pequeñas adenopatías retroperitoneales de escaso tamaño y con escasa significación patológica». El resto de las pruebas complementarias realizadas fueron normales. Tras 2 años de seguimiento, la niña continúa asintomática y sin evidencia de afectación sistémica.
Fragmento irregular de tejido de superficie rugosa de 2×1,3cm de diámetro máximo, que parece corresponder a adenopatía, acompañado de múltiples fragmentos milimétricos de tejido. Está compuesto histológicamente por tejido linfoide principalmente formado por linfocitos B de conformación anómala y con una gran hiperplasia de células reticulares dendríticas; hay también frecuentes vasos sanguíneos en torno a éstos. Las células que conforman el manto se disponen en hilera, en varias capas, y conforman la estructura característica de bulbo de cebolla.
La EC, descrita en 1956 por Benjamin Castleman1, constituye una entidad prácticamente excepcional en la edad pediátrica (hay sólo 100 casos descritos en la literatura médica, 7 en España). También se la denomina hiperplasia angiofolicular de nódulos linfáticos2, y es más frecuente en adultos jóvenes (con una edad media de 23 a 35 años para las formas localizadas3 y de 64 años para las multicéntricas19). Este caso constituye uno de los diagnosticados a edad más temprana que describe la literatura médica. No muestra predilección por sexo3,4, aunque algunos autores describen un ligero predominio por el sexo femenino9.
Su etiopatogenia es desconocida2. La base parece ser una alteración de la regulación inmunológica que produciría un aumento en las concentraciones de interleucina-6 (IL-6)20 como respuesta a un estímulo viral o endógeno7, causante de la sobreproducción y proliferación en los nódulos linfáticos de células plasmáticas y linfocitos B2,11,20. Otros mecanismos propuestos son procesos autoinmunitarios2, la implicación de factores de crecimiento11,7, infecciones por diversos agentes (virus del herpes humano tipo 8, Mycobacterium tuberculosis, toxoplasma y virus de Epstein-Barr)6—aunque se discute si el papel de estos gérmenes es causal o como colonizador oportunista20—, procesos inflamatorios crónicos de bajo grado y procesos hamartomatosos o inmunodeficiencias6.
Puede presentarse en cualquier localización, tanto linfática como a nivel extranodal. Destacan como localizaciones de mayor frecuencia el mediastino (entre el 31 y el 70%), el abdomen o la pelvis (entre el 12 y el 54%), el cuello (14%) y el retroperitoneo (11%)3,4,6,11. Otras localizaciones menos frecuentes son19 la axila, la cabeza del páncreas6, el sistema nervioso central o como nódulo pulmonar solitario3.
En 1978 se describieron las dos formas clínicas de EC6. La forma localizada suele presentarse como una masa única, asintomática o con síntomas por compresión de estructuras adyacentes9, y su hallazgo suele ser casual3. Puede estar relacionada con sintomatología general (entre el 42 y el 60% de los casos16,17), con alteraciones en las pruebas de laboratorio (el 25% de los casos3) o con procesos malignos17 (linfomas Hodgkin y no hodgkinianos). Por su parte, la forma multicéntrica se relaciona con la afectación sistémica (fiebre, pérdida de peso, clínica neurológica19 o pénfigo paraneoplásico8,5), alteración de las pruebas de laboratorio (anemia, aumento de la velocidad de sedimentación globular o la hipergammaglobulinemia) y con la coexistencia con otros procesos, ya sean benignos (artritis crónica juvenil, amiloidosis20 y síndrome de polineuropatía, organomegalia, endocrinopatía, banda monoclonal y alteraciones cutáneas2) o malignos (sarcoma de Kaposi o linfomas2,20) hasta en el 32% de los casos17. Puede producir, por último, una inmunodeficiencia derivada de la apoptosis de células T7.
Su escasa frecuencia y la poca especificidad clínica y de las pruebas complementarias la hacen una entidad de difícil diagnóstico6. En la TC se muestra como masas bien delimitadas que realzan con contraste y con un núcleo central hipodenso10,12, hallazgos que diferencian a la EC de otros procesos, como los timomas4, pero que pueden aparecer también en linfomas, en el sarcoma de Kaposi o en la enfermedad de Kimura. En la RNM suele aparecer como masas isointensas o ligeramente hipointensas respecto al tejido muscular normal en T110, datos no específicos de EC11,9.
El diagnóstico de certeza es el anatomopatológico19,4. En 1970 se describieron las 2 variantes histológicas de la enfermedad6,3: la forma hialina-vascular (en el 90% de los casos), que se corresponde con formas localizadas (entre el 76 y el 91% de los casos)6, muestra una hiperplasia de nódulos linfáticos en la que se observan, dentro de cada folículo, varios centros germinales rodeados de linfocitos de forma circunferencial («en bulbo de cebolla») y un abundante estroma vascular9,6. Estos hallazgos pueden aparecer también en otros procesos autoinmunitarios o inmunodeficiencias primarias2. En la variante plasmocelular, que supone aproximadamente el 10% de los casos y se suele corresponder con la forma multicéntrica (el 50% de los casos6), se aprecia una intensa proliferación de células plasmáticas en las regiones interfoliculares, con menos estroma vascular2. Algunos autores consideran una tercera variante: la variante mixta, en la que se aprecian rasgos de las 2 anteriores2,3. Recientemente se ha propuesto que la variante plasmocelular es un estadio más precoz y activo de la enfermedad que la forma hialina vascular17,11.
Para las formas localizadas, el tratamiento de elección es la resección quirúrgica, con tasas de curación próximas al 100%7,16. Esta resección puede asociarse con un riesgo de hemorragia13,14, por lo que recientemente se ha introducido con buenos resultados la arteriografía con embolización selectiva como adyuvante del tratamiento9,13,17. Como complicación, en casos de masas mediastínicas, se puede producir isquemia de médula espinal, descrita entre el 0 y el 6,5% de los casos13. Para aquellos sujetos no aptos para cirugía se ha utilizado con éxito la radioterapia15,16.
Para la forma multicéntrica, las estrategias más utilizadas son el tratamiento farmacológico o el quimioterápico, con múltiples agentes solos o en combinación ensayados (corticosteroides, cimetidina7, anticuerpos monoclonales anti-IL-6, interferon α17, clorambucil más corticosteroides, ciclofosfamida, doxorrubicina, vincristina y dexametasona o ifosfamida, mitoxantrona y etopósido, entre otros) sin resultados satisfactorios16. Se han descrito buenos resultados con rituximab, anticuerpo monoclonal anti-CD202. Se han empleado igualmente el transplante autólogo de médula ósea, la radioterapia y la cirugía, con resultados transitorios17 y poco satisfactorios16.
Las manifestaciones asociadas a la EC desaparecen tras la extirpación del tumor (las alteraciones analíticas regresan en 30 a 60 días17 y las lesiones cutáneas del pénfigo paraneoplásico en 6 a 11 semanas5).
No se han descrito recidivas tras la extirpación del tumor en las formas localizadas4,16,17; incluso con resecciones incompletas se han descrito tasas de recidiva muy bajas17. Se discute si estas formas localizadas de EC podrían progresar a formas multicéntricas, hecho que parece poco probable16. Es preciso, no obstante, un seguimiento a largo plazo de los sujetos, ya que se han descrito recidivas en casos de resección incompleta hasta 9 años después del tratamiento16.
La forma multicéntrica puede evolucionar de forma rápidamente fatal o más larvada. Al parecer, el tratamiento quimioterápico inmediatamente posterior al diagnóstico, se relaciona con mejores respuestas7,17. La supervivencia media tras el diagnóstico es de 2 a 3 años15 (la sepsis es la causa más frecuente de fallecimiento19). El pronóstico de las formas multicéntricas mejora si se corresponden con la variante hialina-vascular17.
Como conclusión, cabe señalar que la variabilidad en la correlación clinicohistológica hace necesario realizar un estudio de extensión en todos los casos para descartar la afectación multicéntrica, dadas las implicaciones terapéuticas y pronósticas que conlleva. La EC es una enfermedad que, a pesar de su escasa frecuencia, conviene incluir dentro del diagnóstico diferencial de los trastornos linfoproliferativos.