El objetivo del estudio fue determinar los niveles séricos y fecales de plomo en niños con distintos trastornos digestivos funcionales (TDF) en comparación con controles sanos.
Pacientes y métodosLa muestra incluyó a 102 niños de 4-18 años con TDF definidos mediante los criterios de Roma IV y a 102 controles sanos emparejados por edad y sexo. Los niños con TDF se dividieron en 3 subgrupos: estreñimiento funcional (EF) (n=36), dolor abdominal funcional (DAF) (n=36) y náuseas funcionales (NF) (n=30). Los niveles de plomo se midieron mediante espectrometría de absorción atómica.
ResultadosEl nivel de plomo en sangre (NPS) mediano fue significativamente mayor en niños con TDF en comparación con controles (5,12 vs. 1,77μg/dl). Los NPS superaron los 5μg/dl en el 51,9% del grupo TDF. Se observó una diferencia estadísticamente significativa en los NPS entre el subgrupo con EF y los otros 2subgrupos (DAF y NF) (p=0,003 y p<0,001, respectivamente). Los niveles de plomo en heces (NPH) fueron significativamente mayores en niños con TDF en comparación con controles (28,08 vs. 0,01μg/g). No hubo diferencias significativas en los NPH entre el subgrupo de EF y los otros subgrupos (p=0,992 y p=0,989). No se encontró una correlación significativa entre los NPS y los NPH en niños con TDF (p=0,123).
ConclusiónEl presente estudio demostró que los niveles séricos y fecales de plomo eran superiores en niños con TDF en comparación con controles y que más de la mitad de los niños con TDF tenían NPS ≥ 5μg/dl, que se consideran tóxicos. A la vista de estos resultados, cabe replantearse si los clínicos han de determinar los NPS de manera rutinaria en niños con TDF.
To investigate the blood lead levels (BLLs) and faecal lead levels (FLLs) in children with various functional gastrointestinal disorders (FGIDs) and compare them with controls.
Patients and methodsOne hundred and 2children with FGIDs defined by the Rome IV criteria, aged 4 -18 years, and one hundred and 2sex matched healthy children were enrolled in the study. Children with FGIDs were divided into 3subgroups as functional constipation (FC) (n=36), functional abdominal pain (FAP) (n=36) and functional náusea (FN) (n=30). The lead levels were measured using atomic absorption spectrometer.
ResultsThe median BLLs in the FGIDs group was significantly higher than in controls (5.12 and 1.77μg/dL, respectively). The BLLs were above 5μg/dL in 51,9% of children with FGIDs. There was statistically significant difference in BLLs between FC subgroup and the other subgroups (FAP and FN) (P=.003, P<.001 respectively). The FLLs in the FGIDs group was significantly higher than in controls (28.08 and 0.01μg/g, respectively). There was no significant difference in FLLs between FC subgroup and the other subgroups (P=.992, P=.989 respectively). No significant relation found between BLLs and FLLs of the FGIDs group (P =.123).
ConclusionThis study revealed that children with FGIDs had higher BLLs and FLLs than controls and also more than half of children with FGIDs had BLLs ≥5μg/dL which is toxic level. These results might revive the question of whether or not clinician need to evaluate routine BLLs in children with FGIDs.
Los trastornos digestivos funcionales (TDF) son un grupo heterogéneo de enfermedades caracterizadas por manifestaciones gastrointestinales (GI) recurrentes y persistentes sin causa orgánica identificada1. Al no haberse identificado biomarcadores evaluables, la Fundación Roma desarrolló criterios clínicos para el diagnóstico de TDF. Los criterios de Roma para los TDF en la edad pediátrica se publicaron a mediados de los noventa, y su última actualización se realizó en 2016 (Roma IV)2. Recientemente, se ha propuesto una prevalencia de TDF según los criterios de Roma IV del 21%3. Aunque se han identificado más de 20 TDF, la clasificación Roma IV los subdivide en 8 categorías, a saber: trastornos esofágicos, trastornos funcionales gastroduodenales, trastornos funcionales intestinales, dolor gastrointestinal de los trastornos mediados centralmente, trastornos del esfínter de Oddi y de la vesícula biliar; trastornos anorrectales, trastornos funcionales GI pediátricos: neonatos/lactantes, y trastornos funcionales GI pediátricos: niños/adolescentes4. Dentro de estas categorías, el subtipo más frecuente de TDF en la edad pediátrica es el estreñimiento funcional (EF)5. El diagnóstico de TDF requiere una anamnesis y una exploración física detalladas y la detección de signos de alarma mediante la aplicación de los criterios de Roma. No obstante, puede ser necesario realizar pruebas complementarias para descartar enfermedades orgánicas o investigar posibles trastornos estructurales6.
La cantidad de plomo presente en el cuerpo humano ha aumentado en paralelo con la industrialización. El plomo se puede encontrar por todo el medio ambiente en suelo, aire o agua contaminados. Cuando el plomo se introduce en el cuerpo mediante la respiración o la deglución, entra rápidamente en la circulación sanguínea y se distribuye a todos los tejidos7. Como la absorción de plomo por el tracto digestivo depende del estado nutricional, la edad y la forma y el tamaño de las partículas de plomo, los neonatos y lactantes, los niños malnutridos con deficiencia de calcio y hierro, las mujeres embarazadas y los individuos expuestos a niveles altos por su ocupación corren un riesgo mayor de presentar los efectos tóxicos del plomo8. Aunque la intoxicación por plomo, tanto en niños como en adultos, tiene efectos dañinos en muchos órganos y sistemas, los síntomas y signos de la exposición al plomo involucran principalmente al sistema nervioso/la cognición y el sistema digestivo9. Las manifestaciones GI de la intoxicación por plomo incluyen el dolor abdominal crónico o recurrente, náuseas, vómitos, estreñimiento, distensión abdominal, anorexia y pérdida de peso10,11. Como el plomo se elimina principalmente en la orina, las heces, la saliva, el sudor, el pelo y las uñas, la intoxicación por plomo puede diagnosticarse fácilmente con análisis de sangre12. Aunque los Centers for Disease Control han establecido el valor límite del nivel de plomo en sangre (NPS) en niños en 5μg/dl, no ha establecido valores de referencia para los niveles de plomo en heces (NPH) u orina13.
Pocos estudios han analizado los NPS en niños con problemas CI. La mayoría se centraron en los NPS en niños con estreñimiento y dolor abdominal que no se definieron mediante los criterios de Roma14,15. Por otro lado, ningún estudio ha analizado los niveles de plomo tanto en sangre como en heces en niños con TDF. Por ello, el objetivo del presente estudio fue determinar los NPS y los NPH de niños con distintos TDF, como EF, dolor abdominal funcional (DAF) y las náuseas funcionales (NF). En nuestro conocimiento, esta es la primera descripción de los NPS y los NPH en niños con distintos tipos de TDF.
Pacientes y métodosEstudio transversal realizado en el Departamento de Gastroenterología Pediátrica del Hospital Universitario de Karabük en Turquía entre enero y septiembre del 2018. Se incluyó a 102 niños de 4 a 18 años con TDF diagnosticado con base en los criterios de Roma. El grupo de control comprendió a 102 niños sanos apareados por edad y sexo que recibieron servicios en la Clínica del Niño Sano. En todos los participantes se descartó la presencia de trastornos orgánicos y metabólicos mediante una anamnesis y una exploración física detalladas, y pruebas complementarias incluyendo hemograma, bioquímica, velocidad de sedimentación globular (VSG) y análisis de heces y orina.
Los niños con TDF se clasificaron en 3 subgrupos. El primero comprendió a 36 niños con EF. El diagnóstico de EF se realizó con base en los criterios de Roma IV, definiéndose como la presencia de al menos 2 de los siguientes síntomas al menos una vez a la semana durante un mínimo de un mes y con criterios insuficientes para el diagnóstico de síndrome de intestino irritable: 1) 2 o menos deposiciones a la semana en el inodoro en un niño con edad de desarrollo de al menos 4 años, y 2) al menos un episodio de incontinencia fecal a la semana; 3) historia de posturas retentivas o excesiva retención fecal voluntaria; 4) historia de deposiciones duras o defecaciones dolorosas; 5) Presencia de gran masa fecal en el recto, y 6) historia de heces de gran tamaño que pueden obstruir el inodoro. El segundo subgrupo comprendió a 36 niños con DAF. El diagnóstico de DAF se realizó con base en los criterios de Roma IV, definiéndose como 4 o más episodios por mes de todos los siguientes: 1) dolor abdominal episódico o continuo que no solamente ocurre con eventos fisiológicos (comida/menstruación), y 2) criterios insuficientes para etiquetarlo de síndrome de intestino irritable, dispepsia o migraña abdominal. El último subgrupo comprendió a 30 niños con NF. El diagnóstico de NF se realizó con base en los criterios de Roma IV, debiéndose cumplir todos los siguientes: 1) náuseas molestas como síntoma predominante; al menos 2veces por semana y generalmente no relacionadas con las comidas, y 2) no se asocian constantemente con vómitos. Para el análisis de los NPS y los NPH en niños de edad prepuberal y de edad pospuberal, se dividieron los grupos de TDF y de control en 2 subgrupos de edad: 4-11 años y 12-18 años.
El protocolo de estudio fue aprobado por el Comité Ético de Investigación Clínica no Invasiva de la Universidad de Karabük, con registro n.° 2018/1.4. Se obtuvo el consentimiento informado por escrito de todos los participantes.
Determinación de niveles de plomo en sangreSe recogieron muestras de sangre periférica en ayunas (3ml) en tubos de plástico con EDTA como anticoagulante y se almacenaron a –20°C hasta su análisis. Tras descongelar las muestras, se añadieron 7ml de ácido nítrico al 65% (Merc 100456) y 2ml de peróxido de hidrógeno al 30% (Merc 108600), agitándose el preparado con un vórtex y digiriéndose en un horno microondas (CEM MARS 5X press) a 160 grados durante 30 min. Los contenidos digeridos se pasaron por un filtro de jeringa Whatman de 0,45μm. Tras el filtrado, cada muestra fue transferida a un tubo Falcon de 15ml Los NPS se determinaron con un espectrofotómetro de absorción atómica con cámara de grafito (THERMO SCIENTIFIC ICE 3400 AA), con un límite de detección de plomo en sangre de 0,1 μg/l.
Determinación de niveles de plomo en hecesSe recogieron muestras de heces de primera mañana (30ml) en botes de plástico, se lavaron con ácido nítrico al 2% y se almacenaron a –70°C hasta su análisis. Tras descongelar las muestras, se añadieron 7ml de ácido nítrico al 65% (Merc 100456, EMSURE Darmstadt, Alemania) y 2ml de peróxido de hidrógeno al 30% (Merc 108600 EMSURE Darmstadt, Alemania), y se digirieron en un horno microondas (CEM MARS 5X press, CEM Corporation Matthews, EE. UU.) a 160 grados durante 30 min. Los contenidos digeridos se pasaron por un filtro de jeringa Whatman (GE Healthcare Buckinghamshire, Reino Unido) de 0,45μm y se transfirieron a tubos de plastico (Thermo Fisher Scientific Waltham, EE. UU.) de 15ml. Los NPH se determinaron con un espectrofotómetro de absorción atómica con cámara de grafito (THERMO SCIENTIFIC ICE 3400 AA. Thermo Fisher Scientific Waltham, EE. UU.), con un límite de detección de plomo en heces de 0,1 μg/l.
Análisis estadísticoEl análisis de datos se realizó con el paquete estadístico SPSS versión 21.0 para Windows. Los resultados se expresaron como media ± desviación estándar o mediana y rango. La normalidad de la distribución se evaluó mediante la prueba de Kolmogorov-Smirnov. Como la distribución de los NPS y los NPH no fue normal (Kolmogorov-Smirnov, p <0,05), se expresaron como mediana y rango intercuartílico, y se empleó la prueba U de Mann-Whitney para comparar los grupos. La edad, la talla, el peso, la hemoglobina (Hb), el hematocrito (Hct) y la VSG mostraron distribuciones normales (p> 0,05) y se compararon mediante la prueba de la t de Student para muestras independientes. Las comparaciones intragrupo se realizaron mediante la prueba de Kruskal-Wallis y las comparaciones post hoc con la prueba T2 de Tamhane. La asociación entre variables se evaluó mediante la correlación de Spearman. El nivel de significación estadística se estableció en p <0,05.
ResultadosEn el grupo de 102 niños con TDF, 51 (50%) eran varones y la edad media fue de 12,69±3,61 años, mientras que en el grupo de 102 controles, 46 (45%) eran varones y la edad media fue de 11,35±3,60 años. No hubo diferencias significativas entre los grupos de TDF y de control en la edad, el sexo, la talla, el peso, el índice de masa corporal (IMC) o los valores de Hb, Hct o VSG. El NPS mediano en el grupo de TDF fue significativamente más elevado en comparación con el de control (5,12 vs. 1,77μg/dl; p <0,001) (tabla 1). El grupo de TDF se subdividió en los subgrupos EF (n=36; 35%), DAF (n=36; 35%) y NF (n=30; 29%).
Características de los niños con trastornos digestivos funcionales y controles
| Grupo TDF (n=102) | Grupo control (n=102) | p valor | |
|---|---|---|---|
| Edad, media ± DE, años | 12,69±3,61 | 11,35±3,60 | > 0,05a |
| Sexo masculino, n (%) | 51 (50) | 46 (45) | > 0,05 |
| Talla, media ± DE, cm | 148,30±17,48 | 144,07±18,67 | > 0,05a |
| Peso, media ± DE, kg | 44,22±12,38 | 40,83±11,29 | > 0,05a |
| IMC (kg/m2), media ± DE | 19,87±3,78 | 17,59±3,97 | > 0,05a |
| Mediana NPS, μg/dl | 5,12 (0-76) | 1,77 (0-46) | |
| Mediana NPH, μg/g | 28,08 (0,28-314,96) | 0,01 (0-23) | 0,001b,* |
| Hb, media ± DE, g/dl | 12,8±1,0 | 12,7±1,1 | |
| Hct, media ± DE), % | 38,5±3,0 | 38,1±3,2 | 0,001b,* |
| VSG, media ± DE, mm/h | 14±3,2 | 13±3,4 | > 0,05a |
| Análisis de orina (tira reactiva) | Valores de referencia | Valores de referencia | > 0,05a |
| Alteraciones en examen físico | Ninguno | Ninguno | > 0,05a |
DE: desviación estándar; Hb: hemoglobina; Hct: hematocrito; IMC: índice de masa corporal; NPH: nivel de plomo en heces; NPS: nivel de plomo en sangre; TDF: trastornos digestivos funcionales; VSG: velocidad de sedimentación globular.
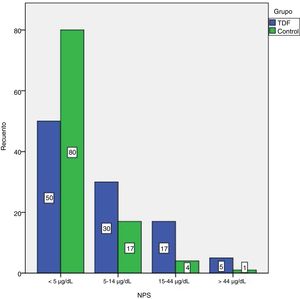
Los NPS de los participantes se clasificaron en 4 categorías: <5μg/dl, 5-14μg/dl, 15-44μg/dl y> 45μg/dl (fig. 1). Los NPS más elevados (76μg/dl) se observaron en el subgrupo de EF. Los NPS fueron superiores a 5μg/dl en el 51,9% de los niños con TDF y en el 21,6% de los controles (tabla 2).
Frecuencia de niveles de plomo en sangre bajos (< 5μg/dl) y altos (≥ 5μg/dl) en los grupos de trastornos digestivos funcionales y de control
| <5μg/dl | ≥ 5μg/dl | p valor | |
|---|---|---|---|
| TDF, n (%)Subgrupo | 50 (49,1) | 52 (51,9) | <0,001a,* |
| EF, n (%) | 6 (16,7) | 30 (83,3) | |
| DAF, n (%) | 20 (55,6) | 16 (44,4) | |
| NF, n (%) | 24 (80) | 6 (20) | |
| Control, n (%) | 80 (78,4) | 22 (21,6) |
DAF: dolor abdominal funcional; EF: estreñimiento funcional; NF: náusea funcional; TDF: trastornos digestivos funcionales.
El NPH mediano en el grupo de TDF fue significativamente mayor en comparación con el grupo de control (28,08 vs. 0,01μg/g; p=0,001) (tabla 1). La tabla 3 presenta los niveles medianos de plomo en sangre y heces en los subgrupos de TDF.
Niveles séricos y fecales de plomo en subtipos de trastornos digestivos funcionales
| EF(n=36) | DAF(n=36) | NF(n=30) | Diferencia media, p | |
|---|---|---|---|---|
| NPS mediano(μg/dl) | 12,29(0,88-76) | 4,05(0,04-25,24) | 2,33(0-12,01) | FC vs. FAPa 12,92, 0,003*FC vs. FN 15,70, 0,001*FAP vs. FN 2,77, NS |
| NPH mediano(μg/g) | 25,23(0,28-220,51) | 3,40(1,33-197,09) | 29,3(2,51-314,96) | FC vs. FAPa –6,73, 0,992FC vs. FN –8,62, 0,989FAP vs. FN –1,88, NS |
DAF: dolor abdominal funcional; EF: estreñimiento funcional; NF: náusea funcional; NPH: nivel de plomo en heces; NPS: nivel de plomo en sangre; NS: no significativo.
Los grupos de TDF y de control se dividieron en 2subgrupos de edad. En el grupo de TDF, 37 participantes tenían de 4 a 11 años (36%) y 65 de 12 a 18 años (63%). No hubo diferencias estadísticamente significativas entre los 2 subgrupos de edad en el grupo de TDF en el NPS mediano (5,30 vs. 4,87μg/dl; p=0,799) o el NPH mediano (26,03 vs. 34,00μg/g; p=0,148). En el grupo de control, 52 niños tenían de 4 a 11 años (53%) y 50 de 12 a 18 años (47%). No hubo diferencias estadísticamente significativas entre los 2 subgrupos de edad en el grupo de TDF en el NPS mediano (2,30 vs. 1,45μg/dl; p=0,348) o el NPH mediano (0,01 vs. 0,01μg/g; p=0,08).
En la comparación del NPS en los 3 subgrupos de TDF, la prueba de Kruskal-Wallis y la prueba post hoc T2 de Tamhane revelaron diferencias significativas entre el subgrupo de EF y los subgrupos de DAF y de NF (p=0,003 y p=0,001, respectivamente). En cuanto al NPH, no se observaron diferencias significativas entre subgrupos (EF vs. DAF: p=0,992; EF vs. NF: p=0,989). No se observó una correlación significativa entre el NPS y el NPH en niños con TDF (p=0,123) ni en ninguno de los subgrupos de TDF (p> 0,05) (tabla 4). Tampoco se detectó una asociación significativa entre el IMC y el NPS en el grupo de TDF (p=0,492) ni en el de control (p=0,732).
DiscusiónEn el presente estudio, los niños con TDF tuvieron NPS y los NPH más elevados que los controles y se encontraron NPS ≥ 5μg/dl en el 51,9% de los niños con TDF y en el 21,3% de los controles.
Los TDF, más recientemente denominados trastornos de la interacción cerebro-intestino, pueden afectar a cualquier parte del tracto digestivo. Aunque la prevalencia de los distintos tipos de TDF varía con el tiempo, el más común en niños es el EF2. Los hallazgos de una anamnesis y un examen físico detallados en combinación con criterios clínicos son suficientes para diagnosticar el EF y no siempre es necesario realizar pruebas complementarias para descartar causas orgánicas de estreñimiento16. En caso de antecedentes atípicos o hallazgos anormales en la exploración física en niños con estreñimiento, el diagnóstico requiere una evaluación con pruebas complementarias exhaustivas17. La patogenia del estreñimiento secundario a la intoxicación por plomo no está bien esclarecida. Se teoriza que el plomo aumenta el tiempo de tránsito intestinal debido a la reducción en el número de neuronas y la disrupción de la coordinación del sistema nervioso autonómico10,18.
Pocos autores han investigado los NPS en niños con estreñimiento. Maleknejad et al.14 realizaron un estudio en 90 niños iraníes con estreñimiento crónico. Los autores reportaron que los NPS en niños con estreñimiento crónico eran significativamente más altos que los de los controles (11,643 vs. 4,924μg/dl)14. Zamani et al.19 analizaron a 100 niños de 4 días a 12 años de edad, y observaron que el 19% de los niños con NPS elevados presentaban estreñimiento. En cambio, en un estudio estadounidense realizado por Raghu et al.20, solo el 1,36% de 441 niños con estreñimiento tenían NPS elevados y no hubo una correlación significativa entre el estreñimiento y el NPS. Ninguno de los autores de estudios previos especificó si se habían incluido s niños con EF en la muestra. En nuestro estudio, se observó un NPS mediano significativamente mayor en el subgrupo de EF en comparación con los subgrupos de DAF y de NF (12,29, 4,06 y 2,33μg/dl, respectivamente). Además, el 83,3% de los 36 niños en el subgrupo de EF tenían NPS ≥ 5μg/dl. Estos hallazgos sugieren que los niveles elevados de plomo en niños con EF podrían deberse a un tránsito intestinal lento. Nuestros resultados discrepan de los de Raghu et al.20, lo que podría explicarse por la muestra de mayor tamaño de su estudio (n=441) y diferencias entre los ambientes en los que residían los participantes.
El dolor abdominal relacionado con el plomo puede desarrollarse con NPS de a partir de 10 a 30μg/dl; no obstante, el cólico suele asociarse a niveles de plomo superiores a 30μg/dl21. Los mecanismos subyacentes al dolor abdominal inducido por el plomo aún no se han esclarecido. Un posible mecanismo consistiría en la sobreproducción de ácido aminolevulínico, alteraciones en el tono de la musculatura lisa visceral y disfunción de la motilidad gastrointestinal22. Algunos estudios han resaltado la asociación entre niveles elevados de plomo en sangre y el dolor abdominal. Ataee et al.23 analizaron NPS en niños afectados de trastornos GI crónicos sin causa orgánica y encontraron que los NPS en niños con dolor abdominal crónico o estreñimiento sin causa orgánica eran superiores a los del grupo de control (4,34 vs. 1,39μg/dl). En un estudio reciente, Zhang et al.24 midieron los NPS en 2.271 niños de 0 a 7 años en Chengdu, concluyendo que la determinación de los niveles de plomo en niños con dolor abdominal podría servir para identificar a niños con NPS elevados24. En nuestro estudio encontramos un NPS mediano de 4,05μg/dl en el subgrupo de DAF (rango, 0,04-25,24), mientras que el 44,4% de los 36 niños en el subgrupo de EF tenían NPS ≥ 5μg/dl. Ninguno de los niños con DAF tuvo un NPS de 30μg/dl o superior o cólico.
Las NF son menos frecuentes que el EF o el DAF. Las causas exactas de las NF, como ocurre con el EF y el DAF, no se conocen. Se cree que es un proceso multifactorial que implica a los órganos viscerales y el sistema nervioso, desencadenantes mecánicos, estrés psicosocial y hábitos alimentarios. Que el plomo puede causar náuseas se sabe desde hace tiempo. Se han propuesto varias teorías sobre cómo lo haría. La mayoría se centra en el efecto paralizador del plomo sobre el tracto digestivo. Según estas teorías, el plomo causaría náuseas al retrasar el vaciamiento gástrico y reducir el tono muscular del estómago10,25. Hasta la fecha, no se han publicado estudios sobre la relación de los NPS y las NF. Por añadidura, el estudio de Begovic et al.10 incluyó un solo caso de NF. Este caso correspondió a un varón de 16 años que presentó náuseas posteriormente atribuidas a la dilatación gástrica secundaria a intoxicación crónica por plomo; el NPS del paciente era de 30μg/dl. En nuestra muestra, el NPS mediano del grupo de NF fue significativamente menor en comparación con el subgrupo de EF (2,33 vs. 12,29μg/dl). Además, el 20% de los 30 niños con NF tenían NPS de 5μg/dl o superiores. Aunque el caso descrito por Begovic et al.10 apoya la hipótesis de que el plomo podría causar náuseas como resultado de paralizar el tracto digestivo, nuestros hallazgos no la corroboran, ya que el 80% de los niños con NF tenía niveles en sangre inferiores a 5μg/dl y ninguno tenía manifestaciones indicativas de dilatación gástrica.
Como el plomo presente en el cuerpo se elimina principalmente en la orina, el pelo, las uñas, el sudor y las heces, muchos estudios han analizado determinaciones de plomo en fluidos corporales, uñas y heces. Schouw et al.26 realizaron un estudio en adultos sanos de 20 a 30 años y encontraron concentraciones de plomo en heces de 0,12 a 0,27g/kg. Yabe et al.27 estudiaron la excreción de cadmio y plomo en heces y orina en niños que residían en municipalidades polucionadas en Zambia. Los autores encontraron concentraciones fecales de plomo de 2,27 a 2.252mg/kg (peso seco) y propusieron que los NPH y orina podrían ser útiles para vigilar la exposición al plomo en niños27. En nuestro estudio, se encontró un NPH mediano de 28,08μg/g en niños con TDF, que equivale a 28,08mg/kg, con un rango de 0,28 a 314,96μg/g (peso seco). No hubo diferencias estadísticamente significativas en el NPH entre los subgrupos de TDF. No encontramos estudios pediátricos que establecieran niveles de referencia para el plomo en heces o que analizaran la excreción de plomo en heces en distintos TDF. Por lo tanto, solo se pudieron comparar los resultados del estudio con los de Yabe et al.27. El rango del NPH en su estudio fue superior en comparación con nuestra muestra. Una posible explicación es que el estudio de Yabe et al.27 se realizó en zonas con contaminación ambiental alta.
Distintos estudios realizados en diversos lugares del mundo demuestran que los NPS son elevados en niños que viven cerca de recintos industriales y en ciudades con una alta contaminación atmosférica. Un estudio realizado en China por Lin et al.28 encontró que el 96% de los niños que residían en pueblos contaminados tenían NPS superiores a 10μg/dl. Recientemente, Dhimal et al.29 reportaron que el 64,4% de los niños en el valle de Katmandú en Nepal tienen NPS elevados por encima del límite establecido de 5μg/dl. En el presente estudio, se observaron NPS ≥ 5μg/dl en el 21,6% de los controles sanos. Consideramos probable que este alto NPS en niños sanos se deba a la presencia de plantas metalúrgicas de hierro y acero, y el nivel de contaminación atmosférica moderado en la provincia de Karabük, que se encuentra rodeada de montañas.
Nuestro estudio no encontró una correlación significativa entre los NPS y los NPH en niños con TDF (r=–0,154; p=0,123). Por el contrario, sí se detectó una correlación positiva fuerte entre los niveles en sangre y heces en el grupo de control (r=0,432; p=0,001). Los estudios que han investigado la asociación entre el NPS y la excreción de plomo en heces en niños son escasos. Hammond et al.30 realizaron un estudio en niños sanos expuestos a plomo en el hogar procedente de pintura y encontraron una correlación positiva entre los NPS y la excreción de plomo en heces. Como se comentó anteriormente, Yabe et al.27 también investigaron la excreción de plomo en heces y reportaron una correlación positiva entre el NPS y la excreción en heces en niños residentes en municipalidades polucionadas. El elemento más importante en ambos estudios fue la evaluación de niños expuestos a contaminantes ambientales. Los hallazgos de estos estudios difirieron con los resultados en nuestra muestra. Esto podría deberse al hecho de que los estudios de estos autores no se realizaron específicamente en niños con TDF.
Nuestro estudio tiene algunas limitaciones. En primer lugar, ningún estudio anterior ha analizado los niveles de plomo tanto en sangre como en heces en niños con TDF, por lo que solo pudimos comparar nuestros hallazgos con un número reducido de estudios en la literatura. En segundo lugar, no fue posible establecer la fuente principal de exposición al plomo en niños con niveles altos de plomo en sangre. En vista de los datos obtenidos, se informó a la agencia local de seguridad y salud ocupacional para que pudieran establecerse las fuentes principales de exposición al plomo. En tercer lugar, no se observó correlación entre la plumbemia y la excreción de plomo en heces en el grupo de TDF, aunque sí se observó correlación entre ambas en el grupo de control. Para comprender esta diferencia, sería útil determinar y comparar niveles de plomo en otros tipos de muestras, como la orina, el sudor y el cabello, pero no nos fue posible hacerlo por falta de financiación.
En conclusión, ningún estudio anterior ha analizado los niveles de plomo tanto en sangre como en heces en niños con TDF. Nuestros datos muestran que los niños con TDF tienen NPS y NPH significativamente más altos en comparación con controles sanos. El estudio también evidenció que la intoxicación por plomo era común en niños y a menudo simulaba trastornos GI. Por lo tanto, los clínicos han de tener presente la posibilidad de la exposición al plomo en el diagnóstico de los TDF.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación a congreso: Sexto Congreso Mundial de Gastroenterología Pediátrica (WCPGHAN, 2020); 3-6 de junio del 2020; Copenhague, Dinamarca.