El objetivo de esta investigación es contribuir al conocimiento de la conducta motora fetal humana espontánea normal durante el 2.° trimestre de gestación. Se focaliza sobre 5 patrones de movimiento fetal: sobresaltos masivos (SM), ritmias axo-rizomélicas (RAR), estiramientos axiales (EA), movimientos generales (MG) y excursiones diafragmáticas (ED).
MétodosSe ha observado la motricidad fetal espontánea, mediante ecografía obstétrica en 2D, en una cohorte de 13 sujetos, en las semanas 12, 16, 20 y 24 de gestación. Constituye criterio de inclusión comprobar posteriormente la normalidad del estado neurológico neonatal a término y del desarrollo motor y cognitivo hasta la edad de 5 años.
ResultadosLos 5 patrones de movimiento citados se observan en todos los fetos durante el 2.° trimestre gestacional, pero su presencia y cualidad varían con la edad. Los movimientos fásicos SM y RAR son prominentes en las semanas 12 y 16 de gestación; en cambio, los movimientos prolongados EA y MG poseen mayor incidencia, duración, extensión y complejidad en las semanas 20 y 24. Las ED aumentan su incidencia a lo largo del 2.° trimestre, generalmente en series de 2-6 excursiones, con amplitud irregular. El ritmo cardiaco se acelera durante los periodos de movimiento fetal, frente al estado de reposo.
ConclusionesLos 5 patrones de conducta estudiados ecográficamente reflejan el progresivo afinamiento de generadores de patrones motores en el sistema nervioso humano normal durante el 2.° trimestre de gestación. Llamamos la atención sobre las RAR, no diferenciadas en otros estudios.
The aim of this research is to contribute to knowledge of the normal spontaneous motor behavior of the human fetus during the second trimester of pregnancy. This study focuses on five patterns of spontaneous fetal movement: startle (S), axo-rhizomelic rhythmia (ARR), axial stretching (AS), general movement (GM), and diaphragmatic contraction (DC).
MethodsA cohort of 13 subjects was followed up using 2D obstetrical ultrasound images at 12, 16, 20, and 24 weeks of gestation. As inclusion criteria, neonatal neurological examination and general movements after eutocic delivery at term were normal in all of the subjects, and their neuromotor and cognitive development until the end of pre-school age were also normal.
ResultsAll these five motor patterns are present at the beginning of the 2nd gestational trimester, but their quantitative and qualitative traits are diverse according to gestational ages. The phasic, isolated or rhythmically repeated movements, S and ARR, are prominent at 12 and 16 weeks of gestation, and then their presence gradually diminishes. By contrast, tonic and complex AS and GM movements increase their presence and quality at 20 and 24 weeks. RAR constitute a particular periodic motor pattern not described in previous literature. Moreover, the incidence of DC is progressive throughout the trimester, in clusters of 2-6 arrhythmic and irregular beats. Fetal heart rate increases during fetal motor active periods.
ConclusionsAll five normal behavioral patterns observed in the ultrasounds reflect the progressive tuning of motor generators in human nervous system during mid-pregnancy.
Desde el final del segundo mes gestacional, el embrión humano realiza movimientos espontáneos que fueron clasificados por Reinold1 en 1979 en 2 grandes tipos: fásicos y tónico-complejos. Otros investigadores2–6 han diferenciado patrones motores, progresivamente más estables y reconocibles desde el final del 1.er trimestre hasta el término de la gestación6,7, facilitando el camino para la construcción de una semiología neurológica prenatal y para el reconocimiento del bienestar fetal, complementando los datos morfológicos y las variables circulatorias7,8. Los patrones cualitativos son similares en fetos de la misma edad gestacional si el estado neurológico es normal4,9–12. La motricidad del 3.er trimestre gestacional ha sido confirmada por observación extraútero en recién nacidos prematuros13.
El propósito del presente trabajo es aportar información adicional acerca de las características evolutivas normales de 5 modalidades prominentes de movimiento espontáneo fetal en el 2.° trimestre de gestación mediante el análisis visual de las imágenes de ecografía obstétrica en 2D.
Sujetos y métodosSujetosEste es un estudio prospectivo de cohorte que incluye 13 fetos cuyas madres, con edades entre 20 y 38 años, y sin factores de riesgo, consultaron consecutivamente en el Departamento de Obstetricia y Ginecología de nuestro centro hospitalario en 2005 para el seguimiento de embarazo normal desde la 8.a semana posmenstrual. El Comité de Ética del hospital autorizó el proyecto y las madres firmaron el consentimiento tras ser informadas de que en el 2.° trimestre se prolongaría la duración de cada ecografía mensual hasta 30 min para hacer posible el análisis de los movimientos fetales, haciendo constar la inocuidad del procedimiento, con arreglo a los criterios de la International Society of Ultrasound in Obstetrics and Gynecology (ISUOG)14,15. Todos los fetos de la cohorte (7 femeninos y 6 masculinos) alcanzaron el nacimiento a término por parto eutócico, con peso, longitud y perímetro craneal en rango normal y test de Apgar entre 9 y 10 en el 1.er y el 5.° min. Al tercer día de vida, estando el bebé despierto y sin llanto, su conducta espontánea contenía movimientos generales de contorsión («writhing movements»)16,17 y también el resto del examen neurológico convencional18–21 fue normal en todos los sujetos. El seguimiento pediátrico regular confirmó la normalidad del desarrollo psicomotor y comunicativo, así como el desempeño escolar, en los 13 sujetos hasta la edad de 5 años.
MétodoPara la ecografía transabdominal se utilizó un aparato Voluson 730 (G.E. Healthcare, Milkwakee, EE. UU.) con sonda convex de 2-5-5MHz. Mediante la modalidad en 4D (3 planos más movimiento) se realizó la exploración morfológica y con la modalidad en 2D (un plano más movimiento) se controlaron los parámetros de bienestar y se analizó la motricidad espontánea fetal en las 12.a, 16.a, 20.a y 24.a semanas gestacionales. El aparato compone 40 cuadros por segundo en 2D, lo que permite observar el movimiento fetal sin discontinuidades. Se adoptaron, como parámetros de seguridad, un índice mecánico de 0,9 y un índice térmico de 0,1, de acuerdo con las recomendaciones de la ISUOG14,15. Todas las exploraciones fueron realizadas 3 h después de la última ingesta de alimentos por la madre, con temperatura ambiental entre 23 y 26°C y en ausencia de ruidos u otras interferencias. Las grabaciones analógicas en U-Matic fueron volcadas a formato digital. Todo el material fue obtenido por el mismo ecografista obstetra (JLA) y el análisis visual de las grabaciones de los movimientos fetales fue completado por 2 neuropediatras (CR y JN).
Se define aquí como tiempo útil de observación (TO) de la actividad fetal al periodo de ecografía 2D durante el cual, sin estimulación externa, un plano parasagital completo de cuerpo fetal está comprendido en la imagen ecográfica (tabla 1). Se anotó la frecuencia cardiaca durante los periodos de motricidad y de quietud del feto. Tras un primer examen del material, se ha optado por limitar el análisis a 5 patrones motores más prominentes:
- –
Sobresaltos masivos (SM): consisten en una extensión abrupta y aislada del eje corporal, con progresión céfalo-caudal, que dura entre 1 y 3 s, sin participación activa de los miembros2,9.
- –
Ritmias axo-rizomélicas (RAR): son excursiones del eje cervicodorsal y simétricas del segmento proximal de los 4 miembros, en series rítmicas.
- –
Estiramientos axiales (EA): adopción pausada de una postura tónica en extensión axial, que se mantiene durante 2 o más segundos; puede limitarse al segmento cervical o ampliarse al resto del eje corporal, sin movimiento destacable de las extremidades4.
- –
Movimientos generales (MG): son patrones motores complejos que asocian flexiones, extensiones y rotaciones, involucrando de forma asíncrona distintos segmentos del eje corporal y de los miembros, con velocidad, amplitud y topografía cambiantes2,7,10. La morfología de los MG es fluida, impredecible; su complejidad y variedad aumentan durante el 2.° y el 3.er trimestres. Los MG siguen luego presentes, en oleadas de mayor duración, complejidad y variabilidad, hasta el 2.° mes postérmino, durante la vigilia tranquila y el sueño REM10,13,16-18.
- –
Excursiones diafragmáticas (ED): series de contracciones del diafragma, irregulares en cuanto a velocidad y ritmo, en grupos de 1 a 10 batidas. Son referidas en otros trabajos como «hipo» y como «movimientos respiratorios»2,5,6,9,10 pero, dado que en el feto no poseen dicha función, aquí se interpretan fenomenológicamente como ensayos de motricidad diafragmática.
Características de los movimientos fetales en cuatro momentos durante el segundo trimestre de gestación (semanas 12, 16, 20 y 24) y en el recién nacido a término: presencia del movimiento; número e incidencia de eventos; tiempo; amplitud del movimiento (corto o amplio); y cadencia del movimiento (único o agrupado)
| Semanas gestación | Recién nacido (RN) | |||||
|---|---|---|---|---|---|---|
| 12a | 16a | 20a | 24a | |||
| TO: tiempo útil de observación en minutos: media (DE) | 22,1 (6,1) | 14,2 (3,5) | 14,9 (4,8) | 13 (1,7) | ||
| TM: tiempo con movimientos, en minutos: media (DE) | 6,4 (2) | 3,2 (0,8) | 2,8 (0,8) | 1,99 (0,8) | ||
| % Tiempo con movimientos (TM) respecto a TO | 29,69% (7,5) | 23,77% (7,3) | 19,69% (4,9) | 15,3% (5,9) | ||
| TMD: tiempo con movimientos-diana en minutos: media (DE) | 2,68 (1,21) | 2,39 (0,8) | 1,58 (0,7) | 1,38 (0,4) | ||
| % Tiempo con movimientos-diana (TMD) respecto a TM | 76,5% (23,5) | 74,1% (32,8) | 59,36% (29,1) | 80,4% (39,7) | ||
| Sobresaltosmasivos-SM- | Presencia: N sujetos | 13 | 10 | 3 | 0 | 0 |
| -total eventos por sujeto: media (DE) | 29 (13,7) | 19 (4,7) | 5,3 (1,5) | --- | ||
| -incidencia eventos por sujeto: media (DE) | 13,8 (6,3) | 14,6 (4,8) | 3,1 (0,6) | --- | ||
| -tiempo por sujeto (segundos): media (DE) | 32,15 (14,98) | 19,21 (5,71) | 7,11 (2,14) | --- | ||
| % tiempo respecto a TO | 2,53% (1,14) | 2,38% (0,9) | 0,86% (0,3) | --- | ||
| % tiempo respecto a TM | 9,31% (5,8) | 10,35% (4,2) | 4,56% (1,9) | --- | ||
| Amplitud: corto/amplio | 2/11 | 2/8 | 1/2 | --- | ||
| Cadencia: único/agrupado | 13/0 | 5/5 | 0/3 | --- | ||
| Ritmiasaxo-rizomélicas-RAR- | Presencia: N sujetos | 11 | 6 | 6 | 3 | 0 |
| -total eventos por sujeto: media (DE) | 2,5 (0,8) | 1,7 (0,5) | 1,5 (0,5) | 1 (0) | ||
| -incidencia eventos por sujeto: media (DE) | 1,2 (0,5) | 1,3 (0,4) | 1,1 (0,5) | 0,8 (0,1) | ||
| -tiempo por sujeto (segundos): media (DE) | 14,54 (8,31) | 4,62 (5,56) | 3,08 (4,35) | 0,92 (1,75) | ||
| % tiempo respecto a TO | 1,15% (0,7) | 0,58% (0,7) | 0,36% (0,6) | 0,12% (0,6) | ||
| % tiempo respecto a TM | 4,17% (2,6) | 2,53% (3,2) | 1,81% (2,7) | 1,09% (2,4) | ||
| Amplitud: corto/amplio | 11/0 | 6/0 | 4/2 | 2/1 | ||
| Cadencia: único/agrupado | 11/0 | 6/0 | 2/4 | 0/3 | ||
| Estiramientosaxiales-EA- | Presencia: N sujetos | 3 | 6 | 11 | 12 | 13 |
| -total eventos por sujeto: media (DE) | 3,3 (1,6) | 5,2 (2,1) | 6,1 (2,6) | 2,2 (0,9) | ||
| -incidencia eventos por sujeto: media (DE) | 3,2 (1) | 4,5 (2,1) | 4,3 (2,1) | 1,7 (0,8) | ||
| -tiempo por sujeto (segundos): media (DE) | 0,77 (2,77) | 14,31 (18,1) | 22,31 (19,11) | 14,54 (8,31) | ||
| % tiempo respecto a TO | 0,05% (0,2) | 2,09% (2,6) | 2,67% (2,4) | 1,9% (0,5) | ||
| % tiempo respecto a TM | 0,12% (0,4) | 7,86% (10,8) | 14,04% (11,7) | 12,5% (3,8) | ||
| Amplitud: cervical / todo el eje | 3/0 | 1/5 | 1/10 | 8/4 | ||
| Cadencia: único / agrupado | 3/0 | 6/0 | 10/1 | 11/1 | ||
| Movimientosgenerales-MG- | Presencia: N sujetos | 10 | 13 | 10 | 10 | 13 |
| -total eventos por sujeto: media (DE) | 5,6 (3,7) | 5,5 (1,5) | 4,9 (2,2) | 2 (0,7) | 1,9 (0,5) | |
| -incidencia eventos por sujeto: media (DE) | 5 (1,8) | 4,4 (1,4) | 3,6 (2,1) | 1,6 (0,5) | 1,3 (0,4) | |
| -tiempo por sujeto (segundos): media (DE) | 113,2 (40,9) | 103,5 (20,5) | 58,8 (26,9) | 32,5 (11,9) | ||
| % tiempo respecto a TO | 13,36% (5) | 12,28% (5,6) | 5,55% (2,9) | 3,56% (2,2) | ||
| % tiempo respecto a TM | 62,9% (19,4) | 52,22% (21,7) | 28,43% (22,8) | 27,78% (22,3) | ||
| Amplitud: corto/amplio | 5/5 | 10/3 | 10/0 | 0/10 | 2/11 | |
| Cadencia: único/agrupado | 7/3 | 11/2 | 10/0 | 10/0 | 13/0 | |
| Excursionesdiafragmáticas-ED- | Presencia: N sujetos | 3 | 11 | 12 | 12 | 13 |
| -total eventos por sujeto: media (DE) | 1 (0) | 1,3 (0,5) | 2,7 (0,9) | 4,3 (1,1) | ||
| -incidencia eventos por sujeto: media (DE) | 0,3 (0,1) | 0,9 (0,5) | 1,9 (0,6) | 3,3 (0,7) | ||
| -tiempo por sujeto (segundos): media (DE) | 0,9 (0,1) | 1,85 (3,51) | 17,23 (7,89) | 36 (12,73) | ||
| % tiempo respecto a TO | --- | 0,26% (0,5) | 2% (1,1) | 4,6% (1,8) | ||
| % tiempo respecto a TM | --- | 1,14% (0,05) | 10,53% (5,6) | 34,94% (10,7) | ||
| Amplitud: corto/amplio | 3/0 | 11/0 | 12/0 | 12/0 | 13/0 | |
| Cadencia: único/agrupado | 1/2 | 0/11 | 0/12 | 0/12 | 13/0 | |
En la hoja de registro se marcó la ocurrencia observada de cada una de estas 5 conductas motrices a las 12.a, 16.a, 20.a y 24.a semanas gestacionales (total de eventos) y se calculó su incidencia (media de eventos por cada 10 min de observación) para toda la serie, en cada uno de los 4 momentos. Se cuantificó el tiempo total durante el que se observaron movimientos fetales, así como el tiempo ocupado por cada tipo de movimiento y por el conjunto de los 5 movimientos-diana. Según su cadencia, los movimientos son aislados o agrupados en salvas, y la extensión del desplazamiento se clasificó en corta o amplia (tabla 1).
Manejo estadísticoSe realizó un estudio longitudinal de medidas repetidas que permite describir, a través de un modelo de análisis lineal mixto, los patrones de motricidad a lo largo de las 4 observaciones durante el 2.° trimestre fetal y el periodo neonatal a término. Con SPSS 15.0 se calcularon los estadísticos descriptivos de las variables cuantitativas de cada patrón motor y ANOVA de medidas repetidas para compararlas en las diferentes edades gestacionales. Las variables nominales que caracterizan los movimientos fetales se analizaron con la prueba de Friedman.
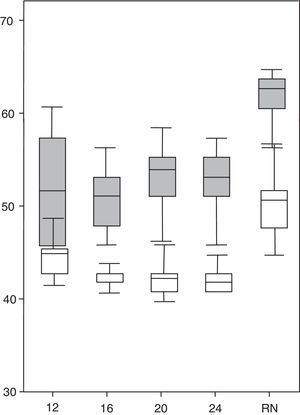
ResultadosSegún se detalla en la tabla 1, el porcentaje del tiempo de observación en el que los fetos mostraban algún tipo de movimiento se redujo significativamente a lo largo de las 4 exploraciones sucesivas desde la semana 12 hasta la 24. Las 5 modalidades de movimiento-diana sobre las que se centra el presente estudio ocuparon una proporción entre el 60 y el 80% del total de actividad motora en cada feto. Las variables de aparición y las características de cada una de las 5 conductas consideradas en este estudio durante el segundo trimestre de gestación y en el periodo neonatal a término se sistematizan en la tabla 1. El percentil de frecuencia cardiaca fetal22 aumentó significativamente en la presente serie durante los periodos de actividad motora respecto a los de quietud (fig. 1).
Percentiles de frecuencia cardiaca (ordenadas) durante el reposo (en blanco) y durante el movimiento (en gris) de los 13 fetos. Se comprueban diferencias significativas (p<0,05) en los 4 momentos de observación del 2.° trimestre de gestación (semanas 12, 16, 20 y 24) y en el periodo neonatal a término (RN), indicados en abscisas.
Se constata movimiento fetal durante una media de 29,7% del TO. Los sobresaltos masivos son los más frecuentes de los 5 patrones-diana de este estudio pues se constataron en todos los fetos, con una tasa de 13,8 sobresaltos en 10 min; suelen aparecer agrupados en series arrítmicas de 2 a 15 sobresaltos sucesivos; en ocasiones, un racimo de SM se sigue de un movimiento general. Las RAR se observan en 11 sujetos y suponen 4,17% del tiempo de movimiento. En 3 fetos se observaron EA aislados y limitados al segmento cervical. Los MG fueron claramente distinguidos en 10 fetos, con incidencia media de 5 eventos cada 10 min y ocupando el 13,3% del TO. Solo en 3 fetos se constató la presencia de excursiones diafragmáticas de breve amplitud, aisladas o en salvas.
Semana 16 de gestaciónSe verifica movimiento fetal durante un periodo medio correspondiente al 23,8% del TO. La conducta motora es más organizada, dado que los movimientos se agrupan, frecuentemente, enlazándose uno con otro; la incidencia y la duración de EA, MG y ED aumenta; estas últimas tienen, por lo general, un recorrido breve y se agrupan en salvas. En cambio, la presencia observada de los movimientos más simples y bruscos, SM y RAR, comienza a disminuir (tabla 1). Los eventos más presentes son los MG, que se observan ahora en todos los fetos y ocupan el 12,3% del TO. La presencia de RAR desciende a la mitad, con muy pocos eventos por sujeto.
Semana 20 de gestaciónLa motricidad se muestra más lenta y compleja, porque los movimientos más simples y abruptos, SM y RAR, disminuyen drásticamente su presencia e incidencia, mientras que, en cambio, persiste la alta presencia de EA y MG, que constituyen ahora la mayor parte de la actividad motora fetal, ocupando un 19,7% del TO. En 8 fetos se observaron tanto EA como MG; 3 sujetos que no exhibieron MG sí presentaban EA durante este momento de observación; por otra parte, 2 fetos en los que no se observaron EA en esta edad, presentaban MG; en un solo feto ninguno de estos 2 patrones de movimiento fue observado a esta edad, pero sí durante las exploraciones precedente y ulterior. Se observa claramente la presencia de salvas de ED en 12 fetos.
Semana 24 de gestaciónLos 5 tipos de movimientos-diana constituyen un 80% del total de la motricidad fetal a esta edad. La incidencia de todos los movimientos disminuye con respecto a las semanas anteriores pero los patrones de conducta aumentan en complejidad y duración. Los SM se encuentran en retirada y las RAR se observan solo en 3 fetos. Los EA y las ED, en cambio, se observan en 12 sujetos y ocupan respectivamente el 1,9 y el 4,6% del TO. En contraste con las anteriores semanas, los movimientos más incidentes ahora son los MG y las ED, que constituyen, respectivamente, el 27,8% y el 35% del total de actividad fetal, con similares características que en las anteriores edades.
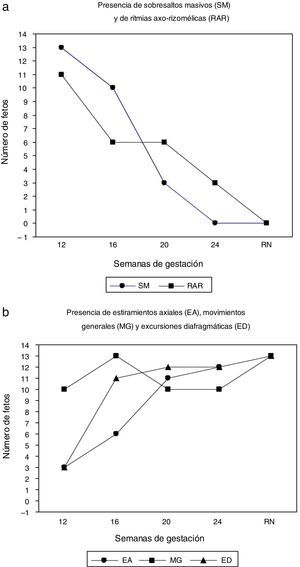
Cronología diferencial de los 5 movimientos-diana estudiadosEn la figura 2 y en las tablas 1 y 2 se pone en evidencia que los movimientos esqueléticos fetales más breves y rápidos (SM y RAR) tienen una alta presencia observable en la semana 12 para ir luego disminuyendo y prácticamente acabar desapareciendo hacia la semana 24. En cambio, los patrones de movimiento que involucran de forma lenta, prolongada y arrítmica al eje corporal aumentan progresivamente su presencia. Así, los EA son observados en un número de fetos cada vez mayor a lo largo de este 2.° trimestre gestacional. Los MG han sido constatados en la mayoría de los fetos en las semanas posmenstruales 12, 20 y 24; durante la semana 16 se observaron en la totalidad de la muestra (fig. 3).
a) Presencia de sobresaltos masivos y de ritmias axo-rizomélicas en los 4 momentos de observación del 2.° trimestre de gestación (12, 16, 20 y 24 semanas) y en el periodo neonatal a término (RN). b) Presencia de estiramientos axiales, movimientos generales y excursiones diafragmáticas en los cuatro momentos de observación del 2.° trimestre de gestación (semanas 12, 16, 20 y 24) y en el periodo neonatal a término (RN).
Diferencias en presencia, incidencia de eventos y tiempo con movimiento durante los 4 momentos de observación
| Movimientos fetales | Presencia | Incidencia de eventos | Tiempo | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 16 | 20 | 24 | 16 | 20 | 24 | 16 | 20 | 24 | |
| Sobresaltos masivos | |||||||||
| 12 | n.s. | ** | ** | n.s. | ** | ** | * | ** | ** |
| 16 | * | ** | ** | ** | * | ** | |||
| 20 | n.s. | n.s. | ** | ||||||
| Ritmias axo-rizomélicas | |||||||||
| 12 | n.s. | n.s. | ** | n.s. | n.s. | ** | * | ** | ** |
| 16 | n.s. | n.s. | n.s. | n.s. | n.s. | n.s. | |||
| 20 | n.s. | n.s. | n.s. | ||||||
| Estiramientos axiales | |||||||||
| 12 | n.s. | ** | ** | n.s. | ** | ** | n.s. | * | ** |
| 16 | n.s. | n.s. | n.s. | n.s. | n.s. | n.s. | |||
| 20 | n.s. | n.s. | n.s. | ||||||
| Movimientos generales | |||||||||
| 12 | n.s. | n.s. | n.s. | n.s. | n.s. | * | * | * | * |
| 16 | n.s. | n.s. | n.s. | * | * | * | |||
| 20 | n.s. | n.s. | n.s. | ||||||
| Excursiones diafragmáticas | |||||||||
| 12 | * | * | * | ** | ** | ** | n.s. | ** | ** |
| 16 | n.s. | n.s. | * | ** | ** | ** | |||
| 20 | n.s. | * | ** | ||||||
Técnica estadística utilizada: ANOVA de medidas repetidas y prueba de Friedman.
n.s.: no diferencias significativas.
a) Incidencia de eventos sobresaltos masivos (en ordenadas) en los 13 fetos en los 4 momentos de observación del 2.° trimestre gestacional (en abscisas: semanas 12, 16, 20 y 24). b) Incidencia de eventos movimientos generales (en ordenadas) en los 13 fetos en los 4 momentos de observación del 2.° trimestre gestacional (en abscisas: semanas 12, 16, 20 y 24).
De forma congruente con lo anterior, el porcentaje de tiempo ocupado por SM y por RAR disminuye desde la semana 12 a lo largo de este segundo trimestre de gestación; en cambio, el tiempo ocupado por los EA aumenta a partir de la semana 20 respecto a la semana 12. Los MG están presentes en la mayor parte de los fetos en los 4 momentos de observación pero, conforme aumentan las semanas gestacionales, los eventos motores poseen menor duración. En cuanto a la incidencia media de eventos motores, esta es menor en la semana 24 respecto a la de las semanas anteriores.
Las excursiones diafragmáticas se han observado raramente en la semana 12, pero a partir de la semana 16 se encuentran en 11 fetos y ocupan un tiempo de observación progresivamente mayor en las semanas sucesivas hasta el final del segundo trimestre. Por lo común, la motricidad diafragmática ocurre en brotes con varias excursiones arrítmicas de breve recorrido; frecuentemente, adquieren el aspecto de flutter diafragmático o de «respiración sollozante».
DiscusiónSegún los presentes resultados, desde el principio del segundo trimestre es prominente la presencia de movimientos extensos y complejos, de tipo EA y MG; estos últimos son la forma más elaborada de movimiento fetal, que, presentes desde el final del primer trimestre según otros trabajos4,6,12, va a conservarse con su expresión más rica durante los 2 primeros meses postérmino10,13,16,17. En el presente estudio, los MG han sido constatados en todos los fetos de la serie a partir de la semana 16 y en 10 de ellos en la semana 12, si bien otros autores9-12 los han señalado como constantemente presentes en sus series desde la semana 9, empleando periodos de observación más prolongados, de hasta 60 min. Por su parte, los movimientos abruptos SM y RAR, con muy alta presencia también en el elenco comportamental de la presente cohorte al principio del 2.° trimestre gestacional, van progresivamente desapareciendo después.
La motricidad fetal humana depende de generadores centrales en el sistema nervioso para las distintas pautas de conducta motora («central pattern generators» [CPG])23–25. La actividad nerviosa oscilatoria generada en diversos niveles de la médula espinal y del troncoencéfalo ha sido objeto de estudios experimentales en vertebrados no humanos (lamprea, pez-cebra, salamandra, pollo, ratón, oveja, mono de Guinea), con diversas modalidades de locomoción y otras actividades rítmicas que permiten la respiración, la ingesta y la deglución23,24. Cada individuo posee un repertorio genético para la formación de redes neuronales; a lo largo de la histogénesis del sistema nervioso actúan también factores quimiotácticos intercelulares, factores de crecimiento dentro del propio entramado neurono-glial y sustancias hormonales procedentes del sistema glandular del feto y de la madre25,26. La retroalimentación propioceptiva originada por la actividad motriz del feto y las influencias moduladoras del tono por las vías reticulares, vestibulares, tectales, y rúbricas sobre la médula espinal, van a afinar la motricidad espontánea actuando sobre los CPG medulares27. Por su parte, los largos axones de la vía corticoespinal, que van a ir poniéndose bajo el control de los ganglios basales y del cerebelo28, inician su desarrollo en la subplaca cortical y lo prolongan hasta el tercer trimestre gestacional: en el humano esta vía corticospinal, aun sin estar mielinizada, alcanza el bulbo inferior a las 8-9 semanas posmenstruales y completa su decusación a las 15 semanas; luego, los axones corticoespinales alcanzan el nivel cervical a las 17, el torácico a las 19 y el lumbosacro a las 29 semanas de gestación29–32. Todas estas influencias suprasegmentarias seleccionan y coordinan progresivamente las distintas estructuras ritmogénicas tronco-medulares imprimiendo al movimiento un carácter cada vez más complejo y finalístico26,27.
Así, los 4 patrones de motricidad esquelética fetal SM, RAR, EA y MG, considerados en esta investigación, al estar presentes con anterioridad a la llegada de las influencias córtico-estriatales, cabe pensar que se originan en los generadores de la médula espinal y del tronco cerebral. Mediante la observación por ecografía obstétrica de una serie de fetos anencéfalos33 se ha descrito la presencia en ellos de SM y MG más abundantes de lo observado en fetos íntegros, siendo esta motricidad cualitativamente anómala por su excesiva amplitud, su brusquedad y su pobre repertorio. Ya que los impulsos rostrales procedentes de la subplaca telencefálica influyen las características de los MG, estos se ven alterados, o están ausentes, también cuando existe patología temprana del control córtico-espinal adquirida durante la gestación o en época perinatal (leucomalacia periventricular, leucomalacia subcortical, etc.)16,17.
Las RAR, observadas predominantemente en las semanas gestacionales 12 y 16 de nuestra cohorte, constituyen un buen ejemplo de actividad rítmica global, síncrona en ambos hemicuerpos. Tanto las RAR como los SM tienden a disminuir su presencia en la segunda mitad de este segundo trimestre. Patrones de movimiento rápidos y globales se han constatado también durante la primera mitad de la gestación en otros mamíferos (ratón, oveja); en estos, los movimientos que se repiten cíclicamente, de forma simultánea en ambos hemicuerpos, o alternando en uno y otro como preludio de locomoción, persisten tras sección medular alta34,35, debido a su generación en centros autónomos de la médula. Los patrones de tipo tónico y amplio, como los EA y los MG, persisten en el humano a lo largo del 2.° y 3.er trimestres de gestación, bajo influencias tronco-espinales27. Impulsos rostrales, procedentes de la subplaca telencefálica, influyen en las características de los MG; estos se ven alterados, o están ausentes, cuando existe patología temprana del control córtico-espinal.
Las excursiones diafragmáticas presentes en el 2.° trimestre de gestación recuerdan al flutter diafragmático en patologías adquiridas de la médula cervical alta36 o a la respiración suspirosa («atáxica») del síndrome de deterioro rostro-caudal avanzado37. En el último trimestre gestacional, las ED se van haciendo cada vez más eficaces para trasegar líquido amniótico2,9 y, tras el contacto con el medio aéreo al nacimiento, adoptan el automatismo cíclico respiratorio generado en los marcapasos vecinos al centro de Bötzinger38,39.
La fiabilidad entre observadores bien entrenados para la interpretación de motricidad espontánea de prematuros, neonatos a término y pequeños lactantes, siguiendo el método observacional de Prechtl, ha demostrado ser alta40. Una limitación de nuestro estudio, compartida por otros trabajos fundamentales, es el escaso número de fetos y el tiempo de observación relativamente breve, teniendo en cuenta la importante variabilidad interindividual de la conducta. La adición de las presentes observaciones a las de otros trabajos con cohorte y metodología similares puede contribuir a afinar el conocimiento de los patrones motores fetales normales durante este periodo medio de la gestación.
FinanciaciónEste trabajo ha sido realizado con ayuda para la investigación en Neurología del Desarrollo de la Fundación Fuentes Dutor-ICT Pamplona.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.