Estudiar la epidemiología, las manifestaciones clínicas, el manejo diagnóstico-terapéutico y la evolución de las linfadenitis por micobacterias no tuberculosas en la población pediátrica de Aragón.
Material y métodosEstudio retrospectivo de pacientes menores de 15 años diagnosticados de linfadenitis por micobacteria no tuberculosa entre 2000 y 2015. Criterios de inclusión: pacientes con linfadenitis y cultivo positivo. Los resultados se expresan como medias, rango y desviación típica para las variables cuantitativas, y porcentajes para las cualitativas.
ResultadosSe detectan 27 casos, edad media de presentación 39,9 meses (rango 10 meses-8 años). El tiempo desde inicio de los síntomas hasta la primera consulta especializada es 1,7±1,1 meses. La localización más frecuente es submaxilar en 17/27 casos (63%), lado derecho en el 59,3%, con tamaño de 2,96±1,26cm. Solo 16/27 presentan fistulización. Prueba de tuberculina superior a 10mm en 7/24 (29,1%). El cultivo es positivo para Mycobacterium avium en 14/27 (51,9%), Mycobacterium intracellulare 3/27 (11,1%), Mycobacterium lentiflavum 3/27 (11,1%). El 92,6% (23/27) es tratado inicialmente con amoxicilina-clavulánico. La combinación de antibióticos y cirugía se aplica en 16/27 casos (59,3%), solo antibioterapia 7/27 (25,9%) y únicamente exéresis 4/27 (14,8%). Dos pacientes precisan reintervención y un caso desarrolla neutropenia grave secundaria a rifabutina. Solo un caso (3,7%) presenta parálisis facial transitoria como secuela.
ConclusionesLa combinación de antibioterapia y cirugía es el tratamiento más frecuente. El retraso en el diagnóstico hace que la exéresis como primera opción terapéutica se realice únicamente en uno de cada 7 pacientes.
To study the epidemiology, clinical features, diagnosis, therapeutic management, and outcome of non-tuberculous mycobacterial lymphadenitis in a paediatric population of Aragón (Spain).
Material and methodsA retrospective study was conducted on patients under 15 years-old diagnosed with non-tuberculous mycobacterial lymphadenitis between the years 2000 and 2015. Inclusion criteria: patients with lymphadenitis and positive culture. Quantitative values are shown as mean, rank, and standard deviation, and qualitative data as frequencies.
ResultsTwenty-seven cases were registered, with a mean age of presentation of 39.9 months (range 10 months–8 years). The mean time between the symptoms onset and first consultation was 1.7±1.1 months. The most frequent location was sub-maxilar in 17/27 cases (63%), on the right side in 59.3%, and size 2.96±1.26cm. Fistulae were observed in 16/27 cases. Tuberculin test was greater than 10mm in 7/24 (29.1%). Microbiological cultures were positive for Mycobacterium avium in 14/27 (51.9%), Mycobacterium intracellulare 3/27 (11.1%), and Mycobacterium lentiflavum 3/27 (11.1%). Combined treatment of antibiotics and surgery was given in 16/27 cases (59.8%), medical treatment only in7/27 (25.9%), and surgical exeresis alone in 4/27 (14.8%). Two patients required a new surgery, and one showed severe neutropenia secondary to rifabutin. Only one case (3.7%) suffered from temporary facial palsy as sequel.
ConclusionsThe most frequent treatment was the combination of antibiotics and surgery. Delay in diagnosis seemed to be responsible for the limited number of exeresis as first option, only one for every seven patients.
La adenitis cervical es la manifestación más frecuente de la infección por micobacterias no tuberculosas (MNT) en el niño inmunocompetente. Supone un 10-20% de las linfadenitis cervicales, submandibulares y preauriculares en la edad preescolar. Afecta a niños entre 1 y 5 años, resultando rara por encima de los 10 años, a diferencia de la adenitis tuberculosa1.
Las MNT están presentes en agua, tierra, leche, animales (principalmente aves) e instrumental sanitario. Tras inhalación, inoculación o ingestión de material contaminado se produce infección de los ganglios cervicales en el 90% de los casos. La aparición de una masa única en la región submaxilar o cervical, unilateral e indolora es el hallazgo clínico más frecuente. De forma natural, existe un aumento progresivo de la adenopatía, coloración violácea de la piel, fistulización en 3-4 meses, y curso crónico e indolente hasta cicatrizar en 12-18 meses2.
En los últimos años se ha observado un incremento de los casos, tanto en nuestro país como a nivel mundial3-5. Hasta mediados de los 90, la frecuencia era de 1,2 casos/año, datos obtenidos de un estudio realizado en un hospital terciario de la Comunidad de Madrid. Actualmente, en ese mismo centro, la frecuencia es de 5,25 casos/año3. En países como Holanda o Australia, la incidencia alcanza 1 caso/100.000 habitantes4,5.
Sin embargo, la mayoría de la información existente en la literatura proviene de series de casos y no existen ensayos clínicos controlados concluyentes que valoren la eficacia y la seguridad de las distintas terapias. Aunque la exéresis completa del ganglio afectado es el tratamiento de elección actualmente, el retraso en el diagnóstico hace difícil llevar a cabo esta primera opción. Sin embargo, otras alternativas como la observación estrecha y el tratamiento médico con o sin cirugía son posibilidades terapéuticas que parecen proporcionar resultados similares6.
Material y métodosSe realiza un estudio observacional retrospectivo multicéntrico desde 2001 hasta 2015 en pacientes menores de 15 años diagnosticados de linfadenitis por MNT (LAMNT) en el registro de la base de datos del Laboratorio de Microbiología del Hospital Universitario Miguel Servet de Zaragoza (HIUMS), referencia en nuestra comunidad autónoma. Los criterios de inclusión en el estudio son:
- a.
Sujeto previamente sano, sin enfermedad crónica de base.
- b.
Clínica compatible con linfadenitis aguda, subaguda o crónica.
- c.
Diagnóstico microbiológico de infección por MNT: cultivo positivo.
Se revisan los datos clínicos, las pruebas complementarias, el tratamiento y la evolución a partir de las historias clínicas. El tamaño de la adenopatía se expresa en centímetros (cm), considerando el diámetro máximo.
Las muestras para microbiología se toman por punción-aspiración por aguja fina (PAAF) o biopsia de la lesión. La baciloscopia se realiza mediante las técnicas habituales: Ziehl-Nelsen y auramina. Los cultivos se llevaron a cabo en medios sólidos y líquidos hasta 2007, a partir de entonces solo en líquidos. La identificación se realiza mediante técnica GenoType CM/AS (Hain Lifescience GMBH Nehren, Alemania), y en 2015 con técnica Matrix Assisted Laser Desorption Ionization Time-of-flight (MALDI-TOF) (Bruker Daltonik GmbH, Bremen, Alemania).
De los 7 centros hospitalarios con atención pediátrica de la comunidad autónoma de Aragón, 6 participan en el estudio. En todos los hospitales se sigue el mismo protocolo para el manejo de las LAMNT. Dichos pacientes son derivados y controlados en Consultas Externas de Cirugía Pediátrica e Infectología Infantil del HIUMS, como centro de referencia.
Se considera curación cuando la adenopatía cumple los siguientes criterios: tamaño menor de 1cm de diámetro, cierre total de la piel suprayacente y ausencia de recurrencia local. Las secuelas que se valoran son: cicatrices antiestéticas y afectación del nervio facial (transitoria o permanente). Solo se registra un caso perdido.
Los resultados se expresan como medias, rango y desviación típica para las variables cuantitativas, mientras que para las cualitativas se utilizan porcentajes.
ResultadosSe incluye a un total de 27 pacientes (14 mujeres, 51,9%), previamente sanos y sin contacto con enfermedad tuberculosa. A excepción de un paciente magrebí y otro subsahariano, ambos con más de 6 meses de residencia en nuestro país, todos son de nacionalidad española. La edad media de presentación es de 39,9 meses (rango 10 meses-8 años) y la frecuencia 1,68 casos/año. El pico máximo de casos se produce en el año 2012, con 5 pacientes.
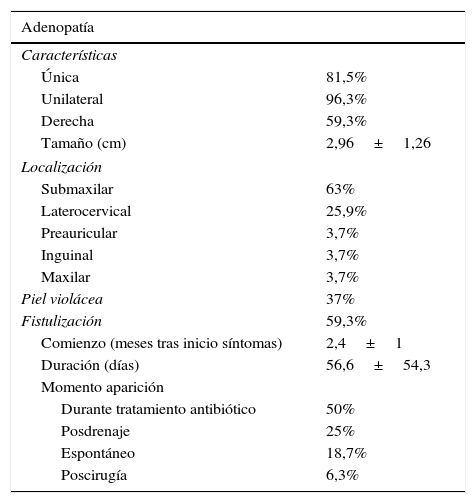
El 96,3%, no refiere síntomas acompañantes. Tan solo un caso presenta fiebre coincidiendo con aparición de adenopatía. El resto de las características clínicas se recogen en la tabla 1. En todos los pacientes se realiza de manera rutinaria hemograma, proteína C reactiva (PCR), velocidad de sedimentación globular, bioquímica general con transaminasas y LDH, y serologías para citomegalovirus, virus de Epstein-Barr y toxoplasmosis, con resultado normal. El resto de las pruebas complementarias se muestran en la tabla 2.
Linfadenitis por micobacterias no tuberculosas: características clínicas
| Adenopatía | |
|---|---|
| Características | |
| Única | 81,5% |
| Unilateral | 96,3% |
| Derecha | 59,3% |
| Tamaño (cm) | 2,96±1,26 |
| Localización | |
| Submaxilar | 63% |
| Laterocervical | 25,9% |
| Preauricular | 3,7% |
| Inguinal | 3,7% |
| Maxilar | 3,7% |
| Piel violácea | 37% |
| Fistulización | 59,3% |
| Comienzo (meses tras inicio síntomas) | 2,4±1 |
| Duración (días) | 56,6±54,3 |
| Momento aparición | |
| Durante tratamiento antibiótico | 50% |
| Posdrenaje | 25% |
| Espontáneo | 18,7% |
| Poscirugía | 6,3% |
Linfadenitis por micobacterias no tuberculosas: exámenes complementarios
| Prueba de tuberculina (n=24) | |
| < 5mm | 50% |
| 5-10mm | 20,8% |
| > 10mm | 29,2% |
| Radiografía de tórax (n=22) | |
| Sin alteraciones significativas | 100% |
| Ecografía cervical (n=26) | |
| Múltiples adenopatías | 61,5% |
| Única adenopatía | 38,5% |
| Anatomía patológica (n=27) | |
| Obtención de muestra | |
| PAAF | 66,7% |
| Drenaje | 22,2% |
| Exéresis | 11,1% |
| Histología | |
| Granuloma necrosante | 81,5% |
| No concluyente | 11,1% |
| Inflamación inespecífica | 7,4% |
| Microbiología (n=27) | |
| Baciloscopia positiva | 33,3% |
| Cultivo | |
| Mycobacterium avium | 51,9% |
| Mycobacterium intracellulare | 11,1% |
| Mycobacterium lentiflavum | 11,1% |
| Mycobacterium malmoense | 7,4% |
| Mycobacterium paraescrofulaceum | 3,7% |
| Mycobacterium scrofulaceum | 3,7% |
| Mycobacterium xenopi | 3,7% |
| Mycobacterium kansasii | 3,7% |
| Mycobacterium triplex | 3,7% |
El tiempo medio hasta la primera consulta en Centro de Salud o Urgencias Hospitalarias es 8,93 días (rango 0-35), mientras que transcurren 1,69±1,09 meses desde el comienzo del cuadro hasta que es visto por un especialista en Infectología o Cirugía Pediátrica en el centro de referencia.
En un primer momento, la mayoría de los pacientes (23/27) reciben amoxicilina-clavulánico por vía oral como tratamiento antibiótico de amplio espectro, administrado 10,91 días de media tras el inicio de los síntomas (rango 0-66) y con una duración de 9,26±2,02 días. El único caso de exéresis inicial es una niña en la que, en el contexto de una intervención de adenoflemón por parte de Cirugía Maxilofacial, se extirpan 2 adenopatías con aislamiento de MNT. Se recomienda antibioterapia, pero la paciente rechaza la medicación, por lo que se controla, periódicamente desapareciendo la lesión. Otro caso inicia directamente tratamiento específico para MNT por alta sospecha clínica, mientras que los 2 restantes reciben, antes de sospechar una LAMNT, tratamiento antituberculoso y drenaje de la adenopatía, respectivamente.
Posteriormente, y en espera de los cultivos recogidos, los pacientes reciben tratamiento específico de LAMNT. La exéresis electiva se realiza en 3 sujetos, mientras que el 85,2% (23/27) de los casos recibe antibióticos por vía oral. Estos se inician a los 2,24±1,44 meses desde el comienzo del cuadro, con una duración de 5,76±1,77 meses. De estos 23 pacientes, 16 precisan exéresis al finalizar el tratamiento, continuándose en 9 de ellos la antibioterapia durante 2,14 meses más de media. En ningún paciente se adopta actitud expectante.
Respecto a los antibióticos utilizados, de los 23 pacientes a los que se administra este tratamiento el 30,4% (7/23) necesita al menos un cambio en el régimen de los fármacos utilizados. El motivo más frecuente es la falta de respuesta clínica (71,4%); los otros motivos son la sensibilidad al antibiograma y la aparición de neutropenia severa secundaria a rifabutina. La combinación de antibióticos más frecuente es claritromicina y rifabutina (33%), seguido de claritromicina y rifampicina (20%) y azitromicina y rifabutina (13,3%).
Por lo tanto, el tratamiento más utilizado es la combinación de antibióticos y cirugía, en un 59,3% (16/27) de nuestra serie. El tratamiento médico aislado se da en el 25,9% (7/27), mientras que la exéresis como tratamiento único y específico se realiza en el 14,8% (4/27).
El seguimiento de estos pacientes tiene una duración de 13,13±4,9 meses. La reintervención es necesaria en 2 pacientes: uno por persistencia de adenopatía a pesar de tratamiento combinado y otro por recidiva de adenitis 12 meses después. En un caso se aconseja exéresis tras completar antibioterapia pero no vuelve a control, mientras que en otro de los niños el tratamiento antibiótico tras la exéresis es rechazado por los padres, observándose resolución completa de la adenitis en controles posteriores. Las secuelas encontradas son: cicatriz hipertrófica significativa en el 18,5% (5/27) y solo un paciente (3%) presenta paresia transitoria de la rama mandibular del nervio facial izquierdo.
DiscusiónLa frecuencia de las infecciones por MNT ha aumentado en los últimos años según varios trabajos publicados recientemente. Sin embargo, los datos de nuestra serie (1,68 casos/año) son inferiores a los obtenidos en un hospital terciario de la Comunidad de Madrid, y de similares características al nuestro, en los últimos años (5,25 casos/año)3. Algunas publicaciones relacionan este hecho con el mejor control de la enfermedad tuberculosa y el descenso en el número de vacunaciones de TB en los países desarrollados. El control de esta patología ha provocado un aumento de la sensibilización a MNT, hecho que en la actualidad parece ser la causa fundamental de las falsamente elevadas prevalencias de infección tuberculosa en algunas regiones de España7. Se estima que el 20-60% de los niños con prueba de tuberculina positiva y sin factores de riesgo para TB estarían infectados por MNT8. La vacunación podría proteger frente a varias especies de MNT, hecho demostrado en animales9-11.
La adenitis cervical es la manifestación clínica más frecuente de las infecciones por MNT en niños inmunocompetentes. La piel suprayacente suele adquirir una coloración violácea cuando alcanza el estadio iii de Penn12. En nuestra serie, el 63% de los casos no presenta dicha alteración en la primera consulta y es difícil valorar si los cambios posteriores encontrados se deben a la evolución natural o a secuelas de las pruebas diagnósticas (drenaje o PAAF). La ausencia de síntomas acompañantes es otra característica, aunque se ha descrito un pequeño número de casos con fiebre aislada en fases iniciales1.
La radiografía de tórax está recomendada en todos los casos, especialmente los recogidos en tabla 3, mientras que la ecografía cervical es de elección por su accesibilidad e inocuidad3. En nuestra serie, el 81,5% de los casos tienen radiografía realizada, a pesar de no cumplir con las indicaciones recomendadas en la literatura. La toma de muestras se puede realizar de 3 maneras: PAAF, drenaje o exéresis; permitiendo estudios anatomopatológico y microbiológico. Se debe destacar que la realización de la PAAF (técnica más frecuentemente en nuestro estudio) se considera una prueba rápida y sencilla para el diagnóstico en centros experimentados3, pero aumenta el riesgo de fistulización si no se da el caso13. El hallazgo histológico más frecuente es la presencia de granulomas14, dato que coincide en nuestro estudio con un 66,67% de los casos. También puede encontrarse necrosis con o sin caseificación, o inflamación inespecífica. La presencia de bacilos ácido-alcohol resistente en nuestra serie es inferior a lo reflejado en la literatura, 50-60%15.
El diagnóstico definitivo requiere el aislamiento1 o la confirmación por detección de PCR de la MNT16. La sensibilidad del cultivo depende del método utilizado para obtener la muestra. La PAAF posee una rentabilidad menor, ya que puede existir escasa densidad de micobacterias17. En general, los cultivos son positivos entre un 20 y un 75%, según diferentes estudios18,19. En nuestro caso, este dato no lo podemos contrastar, ya que solo se ha incluido en el estudio a los pacientes con clínica compatible y cultivo positivo. La realización de PCR en muestra directa, técnica al alcance de pocos centros, permite identificar precozmente la micobacteria y diferenciarla de la adenitis tuberculosa, con una especificidad mayor del 95% y sensibilidad variable en función de la carga en la muestra, entre el 50 y el 100%3. En nuestro centro se realiza en primer lugar PCR para Mycobacterium tuberculosis complex y, si es negativa, se espera al resultado del cultivo para la identificación de la MNT.
El agente etiológico más frecuente es el Mycobacterium avium-intracellulare complex (70-80%) en la mayor parte de Europa, EE. UU. y Australia, seguidos hasta hace pocos años de Mycobacterium scrofulaceum (10-20%) y Mycobacterium kansasii (M. kansasii) (5%)20. Sin embargo, el aislamiento de Mycobacterium lentiflavum (M. lentiflavum) en los últimos 5 años ha aumentado hasta ocupar el segundo puesto en series españolas y australianas1,2. Los datos de nuestra serie coinciden en este aspecto.
La adenitis por micobacteria tuberculosa (AMTB) es el diagnóstico diferencial principal a realizar. Supone un 10-20% de las adenitis por micobacterias en pediatría. Afecta a niños mayores de 10 años, con clínica sistémica y localización cervical posterior o axilar. Por ello es necesario realizar prueba de tuberculina a todo niño con adenitis subaguda/crónica. Sin embargo, el tamaño de la induración no es una condición que nos permita excluir la AMTB, por lo que recomiendan apoyarse en otros datos clínicos y epidemiológicos. Los datos de la prueba de tuberculina de nuestra serie coinciden con estudios de Cavalho et al. y Lindeboom et al., en los que 20-65% presentan induración mayor de 5mm, pero nuestro porcentaje es menor en aquellos por encima de 10mm (29,2 frente a 50%)21,22. La radiografía de tórax puede ser de utilidad, ya que existen alteraciones en un 37-56% de las AMTB y solo en el 8,5% de las LAMNT22. Si no existen factores de riesgo pero sí histología compatible y/o baciloscopia positiva, se asume que es una TB hasta que se demuestre lo contrario y se inicia tratamiento17,23, como ocurre en uno de nuestros casos. No hay que olvidar incluir en el diagnóstico diferencial otras causas de adenitis granulomatosa, como la toxoplasmosis o la enfermedad por arañazo de gato3.
La exéresis quirúrgica precoz es el tratamiento de elección recomendado en la actualidad, preferiblemente durante el primer mes de evolución24. Obtiene mayor tasa de curación, menor número de recurrencias y mejor resultado estético; además, permite disponer de material de mejor calidad para el estudio histológico y microbiológico17. Si no se realiza en este período, la adenitis puede fistulizar espontáneamente, lo que aumenta la morbilidad y la dificultad de la cirugía14. El riesgo de reintervención es mayor y estadísticamente significativo si se opta inicialmente por drenaje o curetaje25. En nuestra serie, encontramos una elevada frecuencia de fistulizaciones, probablemente debidas a este hecho. En cambio, el número de reintervenciones es muy bajo teniendo en cuenta que en un porcentaje considerable de pacientes se realiza drenaje para la obtención de muestras. La secuela posquirúrgica más frecuente es la paresia facial transitoria, en un 2-17% de los casos26. La cicatriz hipertrófica con afectación estética es la secuela más frecuente en nuestros pacientes.
El tratamiento médico y la conducta expectante son las alternativas a la cirugía. Se recomienda la combinación de varios fármacos para evitar resistencias, incluyendo un macrólido (azitro o claritromicina) junto con rifabutina/rifampicina6 o ciprofloxacino o etambutol3,27. Actualmente, no existe consenso sobre la duración, pero se recomienda un mínimo de 3 a 6 meses. En otras especies diferentes de M. avium complex, tales como M. kansasii o M. lentiflavum, es recomendable ampliar cobertura con rifabutina, etambutol, isoniazida y piridoxina debido a las resistencias, mientras que otros como Mycobacterium fortuitum son altamente sensibles a macrólidos de última generación y/o quinolonas28.
La baja incidencia de LAMNT ha impedido el desarrollo de ensayos clínicos controlados en niños que comparen tratamiento médico frente a cirugía. Estudios pequeños, como el de Hazra et al. y Berger et al., demuestran efectividad de los macrólidos con respecto a cirugía29,30. Luong et al. administran antibiótico previo a 45 de 55 niños (81,8%) con LAMNT, el 67% no precisa exéresis y de estos el 77% (23 casos) muestran regresión al 2.° mes31. El estudio más amplio, llevado a cabo por Lindeboom et al., asigna aleatoriamente claritromicina y rifabutina a un grupo, conducta expectante al segundo grupo y cirugía al tercero, en un total de 100 niños afectados. La tasa de curación es del 96% para este último grupo, mientras que con antibioterapia es del 66%. El tiempo medio de resolución no difiere significativamente entre el grupo con antibiótico y el de observación32. Son pocos los estudios observacionales que adopten una conducta expectante. Zeharia et al. concluyen que el 71% a los 6 meses y el 100% a los 9-12 meses de un total de 92 niños israelíes presentaron resolución completa de la AMNT sin ninguna intervención33. Zimmermman et al. han publicado recientemente una revisión sistemática de la literatura en la que comparan estos y otros estudios realizados hasta la fecha6. La conclusión de dicha revisión es que son necesarios ensayos clínicos controlados amplios y bien diseñados que comparen las tres opciones, así como la búsqueda de mejores test diagnósticos que apoyen el estudio sin necesidad de cirugía. Pero, hasta entonces, recomiendan individualizar el tratamiento, valorando riesgos y beneficios para cada caso.
Solo uno de los casos presenta complicaciones secundarias al tratamiento antibiótico. Se trata de un niño de 2 años con neutropenia severa secundaria a rifabutina, resuelta tras cambiar tratamiento34, hecho excepcional pero descrito en ensayos clínicos en sujetos sanos35.
Consideramos importante destacar que, tras analizar la evolución temporal de los casos, resulta difícil ajustarse a los plazos recomendados en la literatura para ofrecer la exéresis como primera opción de tratamiento. Tanto los protocolos de nuestro centro y nacionales, así como las recomendaciones internacionales, aconsejan iniciar antibiótico empírico por vía oral ante una adenopatía unilateral sin signos de alarma y origen inexplicado o postinfeccioso, con observación en las 3-4 semanas posteriores. Si en este tiempo no se ha resuelto, han de realizarse pruebas complementarias36-38. Nuestra experiencia muestra que la exéresis se realiza en la mayoría de los casos tras instauración de tratamiento anti-MNT y la combinación de ambos muestra resolución de la linfadenitis con tasas similares a las encontradas en la literatura, al igual que las secuelas y complicaciones.
Existen limitaciones en nuestro estudio, ya que solo se incluyen los casos con cultivo positivo a MNT. Por ello no se han podido incluir los casos que, a pesar de tener cultivo negativo, presentan clínica compatible y han recibido tratamiento específico, subestimando, por lo tanto, la prevalencia de esta patología en nuestra región.
En conclusión, nuestra experiencia coincide con la encontrada en la literatura, a excepción del tiempo de realización de la exéresis como tratamiento definitivo, obteniendo resultados similares. La escasa disponibilidad de estudios y ensayos clínicos dificulta el seguimiento de una pauta clara de actuación. Consideramos fundamental la colaboración entre las distintas especialidades implicadas (infectólogos pediátricos, microbiólogos, radiólogos y cirujanos), así como una estrecha comunicación con los profesionales de Primaria para ofrecer una atención precoz y eficiente a estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.