La utilización del levamisol en el tratamiento del síndrome nefrótico comienza poco tiempo después del uso reglado de la corticoterapia1. Es un antihelmíntico con actividad inmunomoduladora no bien conocida, sin componente inmunosupresor a diferencia del resto de fármacos utilizados2. Por otra parte, es el medicamento con menos efectos adversos y más barato3. En 2004 es retirado del mercado alegando falta de claridad en la indicación y baja utilización en humanos4. Es eficaz en algunos pacientes con síndrome nefrótico primario corticodependiente, como ahorrador de corticoides4.
Se realiza un estudio descriptivo retrospectivo sobre la población con síndrome nefrótico corticodependiente a dosis altas de corticoides que recibieron levamisol en la unidad de nefrología pediátrica de nuestro hospital, desde el 1 de enero de 2000 hasta el 31 de diciembre de 2017. De 104 casos revisados con síndrome nefrótico, desechamos el 38% por falta de datos. El levamisol se administró a pacientes con síndrome nefrótico corticodependiente a dosis altas de prednisona (>0,5mg/kg/48h). En algunos casos tras el tratamiento con ciclofosfamida oral, y en otros antes de la ciclofosfamida (2.° escalón de tratamiento). No se realizó estudio anatomopatológico previo, puesto que este se indica antes del inicio del 3.° escalón. La respuesta al levamisol se clasificó en 2 grupos: «completa» cuando no hubo brotes durante 2 años de tratamiento, al menos, y «parcial» cuando hubo 2 brotes o menos en un año, permitiendo la interrupción de los corticoides. El fármaco fue preparado, según la dosis indicada, en el servicio de farmacia de nuestro hospital en forma de cápsulas. En todos ellos la dosis fue la estándar: 2,5mg/kg de peso cada 48h vía oral.
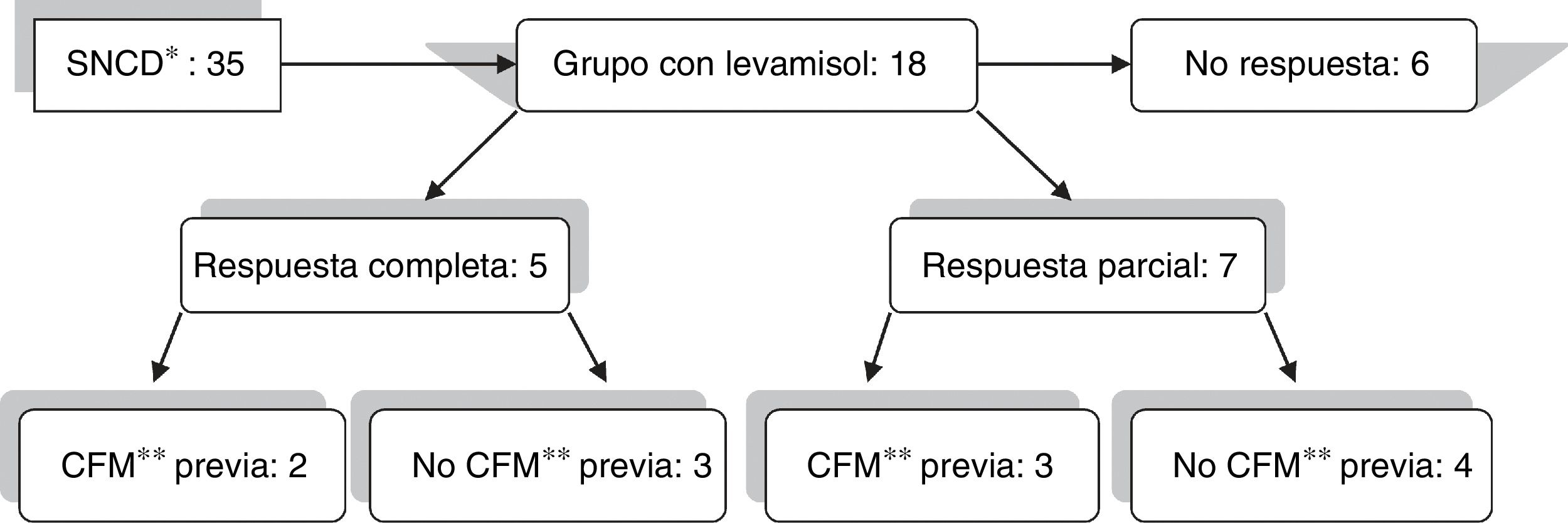
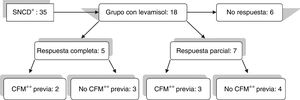
Se administró levamisol a 18 pacientes, 10 niñas y 8 niños, comprendidos entre 2 y 6 años. De los 18 pacientes tratados, 12 pacientes respondieron (66,6%): 5 respondieron completamente (27,7%) y 7 de forma parcial (38,8%) (fig. 1). El tratamiento se suspendió al cabo de 2 años en los pacientes que respondieron, pero fue necesario reintroducirlo en 7 de los 12 porque volvieron a recaer. El tiempo medio de tratamiento fue de 4,3 años. Un caso dependiente de levamisol continuó el tratamiento hasta que pasó a la unidad de adultos. En cuanto a efectos adversos, solo 2 pacientes presentaron sendas urticarias transitorias atribuibles al levamisol, que no precisaron interrumpir el tratamiento.
En años precedentes hay muy pocos trabajos que hayan valorado la eficacia del levamisol. Aún más sorprendente es la no inclusión en la mayoría de guías y protocolos de manejo clínico, salvo en Francia, no asignándole un escalón concreto en el tratamiento, a diferencia del resto del arsenal terapéutico5. Los pocos estudios realizados tienen un periodo de observación máximo de un año, habitualmente no prospectivos salvo el interesante ensayo clínico multicéntrico, publicado en 2018, sobre un periodo de un año3. En este estudio no habían sufrido recaídas el 26% de los tratados con levamisol tras un año, porcentaje similar al nuestro (27,7%) tras 2 años. En otro trabajo se administraron dosis mayores (doble dosis) con buenos resultados, cuando no había respuesta con la dosis convencional6.
En cuanto a efectos adversos, además de la urticaria, también se ha informado sobre neutropenia moderada-leve, que no apareció en nuestra serie3.
El levamisol en España está disponible mediante el protocolo de medicación extranjera. Actualmente los medicamentos autorizados pero empleados con indicaciones diferentes a su ficha técnica, son solicitados siguiendo dicho protocolo y no requieren autorización expresa de la Agencia Española de Medicamentos y Productos Sanitarios (Real Decreto 1015/2009, de 19 de junio).
El levamisol en una opción válida de tratamiento, mal valorada en cuanto a eficacia, y olvidada en los protocolos de tratamiento del síndrome nefrótico. Por ello proponemos realizar ensayos clínicos de calidad con levamisol con periodos de tiempo más prolongados y darle el protagonismo en las guías de tratamiento que, a nuestro juicio, se merece.