Analizar el rendimiento de la escala Sequential Organ Failure Assessme (SOFA) adaptada por edad en niños ingresados en la unidad de cuidados intensivos pediátricos (UCIP) y establecer si la escala SOFA puede competir con el síndrome de respuesta inflamatoria sistémica (SRIS) para el diagnóstico de sepsis, de acuerdo con las recomendaciones del consenso Sepsis-3.
MétodosEstudio prospectivo observacional en 2 centros con 281 niños ingresados en la UCIP. Se calcularon las puntuaciones de las escalas SOFA, Pediatric Risk of Mortality (PRISM) y Pediatric Index of Mortality-2 (PIM2) y se evaluó la presencia de SRIS al ingreso. La variable primaria fue la mortalidad a los 30 días.
ResultadosLa puntuación SOFA fue más alta en los no supervivientes (p<0,001) y la mortalidad se incrementó progresivamente de los subgrupos con las puntuaciones SOFA más bajas a aquellos con las puntuaciones más altas. El análisis de las curvas de las características operativas del receptor (ROC) mostró que el área bajo la curva (AUC) para la predicción de la mortalidad a 30 días con la puntuación SOFA fue de 0,89, comparado con 0,84 y 0,79 con las escalas PRISM y PIM2, respectivamente. La AUC de la puntuación SOFA para la predicción de estancia prolongada en la UCIP fue de 0,67. La escala SOFA se correlacionó con las escalas PRISM (coeficiente de correlación de Spearman rs=0,59) y PIM2 (rs=0,51). En niños con infección, la AUC de la escala SOFA para la predicción de la mortalidad fue de 0,87, mientras que la AUC del SRIS fue de 0,60. El diagnóstico de sepsis definido como una puntuación SOFA de 3 o más predijo la mortalidad mejor que el SRIS y que la escala SOFA con el punto de corte de 2 puntos recomendada en el consenso Sepsis-3.
ConclusionesLa puntuación SOFA al ingreso es útil como predictor de la evolución en la población general de la UCIP y es más apropiada que el SRIS para definir la sepsis pediátrica.
To assess performance of the age-adapted SOFA score in children admitted into Paediatric Intensive Care Units (PICUs) and whether the SOFA score can compete with the systemic inflammatory response syndrome (SIRS) in diagnosing sepsis, as recommended in the Sepsis-3 consensus definitions.
MethodsTwo-centre prospective observational study in 281 children admitted to the PICU. We calculated the SOFA, Pediatric Risk of Mortality (PRISM), and Pediatric Index of Mortality-2 (PIM2) scores and assessed for the presence of SIRS at admission. The primary outcome was 30-day mortality.
ResultsThe SOFA score was higher in nonsurvivors (P<.001) and mortality increased progressively across patient subgroups from lower to higher SOFA scores. The receiver operating characteristic (ROC) curve analysis revealed that the area under the curve (AUC) of the SOFA score for predicting 30-day mortality was 0.89, compared to AUCs of 0.84 and 0.79 for the PRISM and PIM2 scores, respectively. The AUC of the SOFA score for predicting a prolonged stay in the PICU was 0.67. The SOFA score was correlated to the PRISM score (rs=0.59) and the PIM2 score (rs=0.51). In children with infection, the AUC of the SOFA score for predicting mortality was 0.87 compared to an AUC of 0.60 using SIRS. The diagnosis of sepsis applying a SOFA cutoff of 3 points predicted mortality better than both the SIRS and the SOFA cutoff of 2 points recommended by the Sepsis-3 consensus.
ConclusionsThe SOFA score at admission is useful for predicting outcomes in the general PICU population and is more accurate than SIRS for definition of paediatric sepsis.
En niños críticamente enfermos ingresados en la unidad de cuidados intensivos pediátricos (UCIP), el riesgo de morbimortalidad es considerable tanto en países desarrollados como no desarrollados1,2.
Se han desarrollado varias escalas pronósticas con el fin de cuantificar la gravedad de la enfermedad y predecir el riesgo de mortalidad en el momento de ingreso en la UCIP, lo que puede ser de gran utilidad para planear el abordaje. Estas escalas son asimismo esenciales para evaluar la calidad asistencial, pues gran parte de la variación de las tasas de mortalidad entre distintas UCIP se debe a factores independientes del manejo médico, tales como el diagnóstico principal y la gravedad al ingreso3,4.
La escala pronóstica ideal ha de ser precisa, simple, fácil de usar, mínimamente invasiva y económica5. No obstante, actualmente no hay ninguna escala completamente satisfactoria para predecir la mortalidad y, por lo tanto, la comunidad científica continúa dedicando esfuerzos significativos dirigidos a mejorar la precisión de las escalas existentes y a desarrollar escalas nuevas.
La escala riesgo pediátrico de mortalidad (Pediatric Risk of Mortality [PRISM]) y el índice pediátrico de mortalidad (Pediatric Index of Mortality [PIM]), así como sus versiones actualizadas, se usan ampliamente para predecir la mortalidad6,7. Otros instrumentos de medida utilizan la disfunción orgánica como sustituta de la mortalidad. El síndrome de disfunción multiorgánica (SDMO) se asocia a un riesgo significativamente mayor de mortalidad8, lo que lo convierte en un candidato excelente como indicador de gravedad, y un estudio previo reportó una tasa de mortalidad del 1% asociada a la disfunción de un órgano o sistema con un aumento progresivo en la mortalidad hasta alcanzar el 75% en presencia de disfunción de 4 órganos o sistemas9.
Las escalas de disfunción orgánica en pediatría incluyen la Pediatric Logistic Organ Dysfunction Score (PELOD)10, la PELOD-211 y la Pediatric Multiple Organ Dysfunction Score (P-MODS12.
La escala de evaluación de fallo orgánico secuencial o Sequential Organ Failure Assessment (SOFA) anteriormente denominada Sepsis-Related Organ Failure Assessment, es el instrumento actualmente empleado con mayor frecuencia para cuantificar la disfunción orgánica en adultos críticamente enfermos13, habiéndose identificado recientemente como una medida íntimamente asociada al diagnóstico de sepsis en adultos (Tercer Consenso Internacional para Definir la Sepsis y el Shock Séptico [Sepsis-3])14. Esto ha despertado un gran interés en la comunidad científica en su adaptación a la población pediátrica. Últimamente se ha desarrollado una versión pediátrica de la escala SOFA (pSOFA) con validación retrospectiva en niños críticamente enfermos15. Con todo, los datos en la población pediátrica son escasos, y la escala pSOFA todavía no se ha validado mediante estudios prospectivos de cohorte o en países de bajos recursos. El objetivo de nuestro estudio era evaluar la utilidad pronóstica de la escala SOFA en una cohorte heterogénea de niños críticamente enfermos en un país de bajos recursos y determinar si esta escala puede sustituir el concepto largamente sostenido del síndrome de respuesta inflamatoria sistémica (SRIS) como piedra angular del diagnóstico de sepsis en la edad pediátrica.
Pacientes y métodosEstudio prospectivo observacional realizado entre marzo y noviembre de 2018 en las UCIP de 2 hospitales terciarios en Egipto (Hospital Universitario Menufia y Hospital Atfal Misr). El protocolo de estudio fue aprobado por el Comité de Ética en Investigación Médica de la Facultad de Medicina de la Universidad de Menufia, y se obtuvo el consentimiento informado de los padres.
Se reclutaron consecutivamente pacientes críticos de un mes a 18 años de edad. Se excluyeron pacientes menores de un mes o mayores de 18 años. Al ingreso, se realizó un examen físico y anamnesis detallada de cada paciente. Las pruebas de laboratorio realizadas incluyeron hemograma, gasometría, nivel de proteína C reactiva (PCR), glucemia y electrolitos en sangre, coagulación y pruebas de función hepática y renal. Los cultivos de fluidos corporales, incluyendo sangre, orina, líquido cefalorraquídeo o líquido pleural, se realizaron a criterio del médico que estaba a cargo del paciente. Otras pruebas de laboratorio e imagen se indicaron en función de la clínica del paciente.
En todos los pacientes se calculó la puntuación SOFA pediátrica (pSOFA)15 en las primeras 24h del ingreso. Esta escala evalúa 6 órganos o sistemas: respiratorio, hematológico, hepático, cardiovascular, neurológico y renal. Para cada componente se calcula una puntuación de 0 a 4 puntos (contenido suplementario en línea 1). La puntuación total se calculó sumando las puntuaciones más bajas para cada componente en las primeras 24h de ingreso. En caso de faltar datos, se asignó una puntuación de 0 al componente. Además de la puntuación SOFA, se calcularon las puntuaciones de la PRISM6 y el PIM-216.
Al ingreso se determinó el número de criterios de SRIS que cumplía cada paciente y se definió la presencia de SRIS como cumplimiento de 2 de los 4 criterios, siendo uno de ellos alteración en el recuento leucocitario o la temperatura corporal. El diagnóstico clásico de sepsis requiere la presencia de SRIS asociada a infección sospechada o confirmada. Se definió sepsis grave como sepsis asociada a disfunción cardiovascular, síndrome de distrés respiratorio agudo o disfunción en otros 2 órganos o sistemas17. También se aplicaron las recomendaciones de la Sepsis-318, según las que el diagnóstico de sepsis requeriría un incremento agudo en la puntuación SOFA de 2 o más puntos asociado a infección sospechada o confirmada. Se consideró que había sospecha de infección en caso de haberse prescrito antibioterapia o haberse solicitado cultivos. En caso de no haber documentación sobre disfunción orgánica previa, se asignó una puntuación SOFA basal de cero.
Se realizó seguimiento de los pacientes hasta el alta de la UCIP. La medida de resultado principal fue la mortalidad a los 30 días. Una de las medidas de resultado secundarias fue la variable compuesta de mortalidad a los 30 días o tiempo de estancia en la UCIP de 3 o más días. Otra variable secundaria fue el tiempo de estancia en la UCIP en los supervivientes.
Análisis estadísticoSe han expresado las variables categóricas como frecuencias absolutas y porcentajes. Las variables continuas se han expresado como media ± desviación estándar (DE) y comparado por medio de la prueba t de Student en caso de seguir una distribución normal; en caso contrario se han expresado con la mediana y el rango, y comparado mediante la prueba U de Mann-Whitney. Se empleó la prueba χ2 para analizar la asociación entre variables categóricas y el coeficiente de correlación de Spearman para analizar la asociación entre la puntuación SOFA y distintas variables. Se realizó un análisis univariante mediante regresión logística para analizar la asociación entre la puntuación SOFA u otras variables y la evolución de los pacientes, y análisis de regresión logística multivariante para corregir potenciales variables de confusión.
Realizamos análisis de curvas de las características operativas del receptor (ROC) para evaluar la capacidad de la escala SOFA para discriminar entre supervivientes y no supervivientes, calculando el índice de Youden para establecer los puntos de corte óptimos. El área bajo la curva (AUC) oscila entre valores de 0 y 1, y cuanto más se aproxima su valor a 1, mayor es el rendimiento de la variable en cuestión. Evaluamos la calibración de la escala SOFA mediante la prueba de bondad de ajuste de Hosmer-Lemeshow para determinar si las frecuencias esperadas divergían de las frecuencias observadas en supervivientes y no supervivientes. Un valor de p≥0,05 en la prueba de bondad de ajuste indica que el modelo está bien calibrado.
Todos los contrastes se realizaron a 2 colas, considerándose valores de p<0,05 estadísticamente significativos. En este artículo se dan los valores de p exactos, a menos que fueran extremadamente bajos, en cuyo caso se han expresado como p<0,0001. El análisis estadístico se llevó a cabo con el software IBM Statistical Package for the Social Sciences, versión 23 (SPSS® Inc; Chicago, EE. UU.).
ResultadosCaracterísticas de la muestraSe reclutó una muestra de 281 niños críticamente enfermos. La tabla 1 presenta sus características básicas. La mortalidad a los 30 días fue del 28,1%. La razón de mortalidad estandarizada (RMS) fue 3,09 (RMS=mortalidad observada/mortalidad esperada; mortalidad esperada=PRISM mediana).
Características demográficas, clínicas y de laboratorio de los pacientes analizados
| Supervivientes (n = 202) | No supervivientes (n = 79) | Muestra total (n = 281) | Valor de p | |
|---|---|---|---|---|
| Edad, meses | 27,5 (1,3-216) | 11 (1,5-180) | 11 (1-216) | <0,0001a |
| Sexo masculino, (%) | 100 (49,5) | 48 (60,8) | 148 (52,7) | 0,089 |
| Peso, kg | 11 (2-83) | 6,5 (2,5-57) | 9,5 (2-83) | <0,0001a |
| Razón principal del ingreso en la UCIP | ||||
| Digestiva, (%) | 22 (10,9) | 3 (3,8) | 25 (8,9) | <0,0001a |
| Respiratoria, (%) | 40 (19,8) | 24 (30,4) | 64 (22,8) | |
| Cardiovascular, (%) | 16 (7,9) | 15 (19) | 31 (11) | |
| Neurológica, (%) | 24 (11,9) | 9 (11,4) | 33 (11,7) | |
| Hematológica/oncológica, (%) | 15 (7,4) | 4 (5,1) | 19 (6,8) | |
| Infecciónb, (%) | 9 (4,5) | 10 (12,7) | 19 (6,8) | |
| Metabólica (CAD), (%) | 36 (17,8) | 0 (0) | 36 (12,8) | |
| Recuperación postoperatoria, (%) | 20 (9,9) | 4 (5,1) | 24 (8,5) | |
| Trauma, (%) | 7 (3,5) | 1 (1,3) | 8 (2,8) | |
| Otrasc, (%) | 13 (6,4) | 9 (11,4) | 22 (7,8) | |
| Infecciones sospechadas, (%) | 93 (46) | 57 (72,2) | 150 (53,4) | |
| Cultivo positivo, (%) | 27 (29) | 22 (38,6) | 49 (32,7) | 0,48 |
| Cultivo negativo, (%) | 66 (71) | 35 (61,4) | 101 (67,3) | |
| Categoría según SRIS | ||||
| Sepsis, (%) | 46 (22,8) | 50 (63,3) | 96 (34,2) | |
| SRIS no infeccioso, (%) | 77 (38,1) | 17 (21,5) | 94 (33,5) | <0,0001a |
| Sin SRIS, (%) | 79 (39,1) | 12 (15,2) | 91 (32,4) | |
| SDMO, (%) | 44 (21,8) | 64 (81) | 108 (38,4) | <0,0001a |
| Uso de VM, (%) | 47 (23,3) | 70 (88,6) | 117 (41,6) | <0,0001a |
| Puntuación SOFA | 4 (0-12) | 10 (0-21) | 5 (0-21) | <0,0001a |
| PRISM, porcentaje riesgo de mortalidad | 6,2 (0,6-98,9) | 44,1 (1,4-98,9) | 9,1 (0,6-98,9) | <0,0001a |
| PIM2, porcentaje riesgo de mortalidad | 1,6 (0,1-99) | 25 (0,1-99,5) | 2,3 (0,1-99,5) | <0,0001a |
| Leucocitos, 1.000/μl | 11,85 (1,9-31) | 13 (0,6-115) | 12,7 (0,6-115) | 0,93 |
| Hemoglobina, g/dl | 10,7±2,64 | 9,7±2,93 | 10,25±2,84 | 0,13 |
| Plaquetas, 1.000/μl | 300 (2-1.047) | 181 (11-598) | 274 (2-1.047) | <0,0001a |
CAD: cetoacidosis diabética; PIM2: Pediatric Index of Mortality score 2; PRISM: Pediatric Risk of Mortality score; SDMO: síndrome de disfunción multiorgánica (definido como disfunción simultanea de ≥2 órganos o sistemas); SOFA: Sequential Organ Failure Assessment Score; SRIS: síndrome de respuesta inflamatoria sistémica; UCIP: unidad de cuidados intensivos pediátricos; VM: ventilación mecánica invasiva.
Datos expresados como mediana (mínimo-máximo), media ± desviación típica, o n (%).
En la muestra de estudio, se sospechó infección en 150 pacientes, confirmada mediante cultivo en tan solo el 34%. De los pacientes con infección, 96 tenían SRIS y fueron clasificados como casos de sepsis. De los pacientes con sepsis, 40 se clasificaron como casos de sepsis grave. Se encontró SRIS en ausencia de infección en 94 pacientes (SRIS no infeccioso). Otros 91 pacientes no cumplían los criterios de SRIS (sin SRIS).
La razón más frecuente de ingreso en la UCIP fue enfermedad respiratoria, especialmente neumonía. Casi todos los pacientes ingresados para recuperación postoperatoria habían sido intervenidos para corregir cardiopatías congénitas.
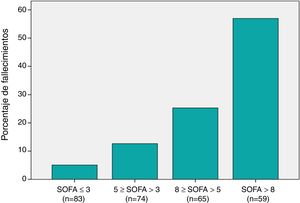
Puntuación SOFA y riesgo de mortalidad a los 30 díasLa puntuación SOFA fue significativamente más alta en no supervivientes en comparación con los supervivientes (tabla 1). Al agrupar a los pacientes en función a los percentiles 25, 50 y 75 de la distribución de puntuaciones en la escala SOFA (fig. 1), se observó que la mortalidad incrementó progresivamente con el aumento en la puntuación SOFA (p<0,001).
Distribución de la mortalidad a los 30 días entre los distintos grupos de puntuaciones SOFA:
El eje horizontal muestra los distintos subgrupos de pacientes categorizados de acuerdo con su puntuación en la escala SOFA. La clasificación se realizó aplicando puntos de corte correspondientes a los percentiles 25, 50 y 75 de la distribución de puntuaciones SOFA. El eje vertical muestra el porcentaje del total de las muertes que correspondió a cada subgrupo.
Primer subgrupo (SOFA≤3): fallecieron 4 (4,8%) de 83 pacientes (5,1% del total de muertes).
Segundo subgrupo (5≥SOFA>3): fallecieron 10 (13,5%) de 74 pacientes (12,6% del total de muertes).
Tercer subgrupo (8≥SOFA>5): 20 (30,8%) de 65 pacientes (25,3% del total de muertes).
Cuarto subgrupo (SOFA>8): 45 (76,3%) de 59 pacientes (57% del total de muertes).
Las diferencias entre los 4 subgrupos fueron estadísticamente significativas (p<0,001).
El análisis univariante de regresión logística (tabla 2) reveló una correlación positiva entre la puntuación SOFA y la mortalidad, así como una correlación negativa entre la puntuación SOFA y tanto el peso como la edad. En el análisis multivariante, la puntuación SOFA fue la única variable que mantuvo la asociación independiente con la mortalidad.
Análisis de regresión logística para la predicción de la mortalidad a los 30 días mediante la escala SOFA y otras variables en la población general de la UCIP
| Análisis univariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| OR | IC 95% | Valor de p | OR ajustada | IC 95% | Valor de p | |
| Edad | 0,990 | 0,985-0,995 | <0,0001a | 1,005 | 0,992-1,019 | 0,43 |
| Peso | 0,957 | 0,933-0,981 | <0,0001a | 0,957 | 0,902-1,015 | 0,14 |
| SOFA | 1,61 | 1,43-1,80 | <0,0001a | 1,59 | 1,42-1,79 | <0,0001* |
IC: intervalo de confianza; OR: odds ratio; SOFA: Sequential Organ Failure Assessment score; UCIP: unidad de cuidados intensivos pediátricos.
El análisis de las curvas ROC (tabla 3) mostró que la AUC de la puntuación SOFA para discriminar entre supervivientes y no supervivientes fue mayor en comparación con las AUC obtenidas mediante la PRISM, el PIM2 y otros marcadores analíticos.
Análisis de curvas ROC para la predicción de la mortalidad a los 30 días con la escala SOFA y otros predictores en la población general de la UCIP
| AUC | IC 95% | Valor de p | Punto de corte | Sensibilidad, % | Especificidad, % | |
|---|---|---|---|---|---|---|
| SOFA | 0,886 | 0,840-0,931 | <0,0001a | >6,5 puntos | 80,9 | 81,8 |
| PRISM | 0,840 | 0,780-0,900 | <0,0001a | >17,2% | 70,6 | 82,3 |
| PIM2 | 0,792 | 0,717-0,867 | <0,0001a | >10,55% | 60,3 | 93,4 |
| Plaquetas | 0,646 | 0,568-0,725 | 0,0004a | <266.500μl | 64,7 | 57,5 |
| Leucocitos | 0,504 | 0,419-0,588 | 0,93 | >21.900μl | 19,1 | 89 |
AUC: área bajo la curva ROC; IC: intervalo de confianza; PIM2: Pediatric Index of Mortality score 2; PRISM: Pediatric Risk of Mortality score; SOFA: Sequential Organ Failure Assessment Score; SRIS: síndrome de respuesta inflamatoria sistémica; UCIP: unidad de cuidados intensivos pediátricos.
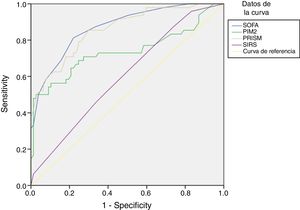
En el subgrupo de pacientes con sospecha de infección, la puntuación SOFA diferenció a supervivientes y no supervivientes mejor que las puntuaciones de la PRISM y el PIM2 y que la presencia de SRIS (fig. 2).
Análisis de curvas ROC para la predicción de la mortalidad a los 30 días en pacientes con infección mediante la escala SOFA y otras variables: en pacientes con infección, la AUC y el IC del 95% para la predicción de la mortalidad fueron de 0,871 (0,808-0,933), con p<0,001, comparado con una AUC de 0,602 empleando el SRIS (IC 95%: 0,502-0,702; p=0,056), una AUC de 0,859 con la escala PRISM (IC 95%: 0,792-0,925; p=0,001) y una AUC de 0,738 con el índice PIM2 (IC 95%: 0,637-0,839; p<0,001). Aplicando un valor de corte de 6,5 puntos, la escala SOFA mostró una sensibilidad del 81,3% y una especificidad del 77,9% para discriminar entre no supervivientes y supervivientes. Aplicando un punto de corte de 2,5 criterios cumplidos, el SRIS mostró una sensibilidad del 45,8% y una especificidad del 66,2%.
El valor de p obtenido en la prueba de bondad de ajuste de Hosmer-Lemeshow fue de 0,65, lo que indica que la escala SOFA está bien calibrada. Los valores de p correspondientes a las puntuaciones de la PRISM y el PIM2 fueron de 0,25 y 0,47, respectivamente.
Correlación entre la puntuación SOFA y otras variablesEncontramos una correlación positiva de la puntuación SOFA con las puntuaciones en la PRISM y el PIM2 y el recuento leucocitario, así como una correlación negativa con la edad, el peso, las plaquetas y la hemoglobina (tabla 4).
Correlación de Spearman entre la puntuación SOFA y otras variables en los pacientes analizados
| SOFA | ||
|---|---|---|
| Coeficiente de correlación de Spearman (rs) | Valor de p | |
| Peso | –0,318 | <0,0001a |
| Edad | –0,332 | <0,0001a |
| PRISM | 0,59 | <0,0001a |
| PIM2 | 0,51 | <0,0001a |
| Estancia UCIP | 0,214 | 0,002a |
| Duración VM | –0,09 | 0,55 |
| Leucocitos | 0,16 | 0,014a |
| Plaquetas | –0,31 | <0,0001a |
| Hemoglobina | –0,24 | 0,0001a |
PIM2: Pediatric Index of Mortality 2; PRISM: Pediatric Risk of Mortality; SOFA: Sequential Organ Failure Assessment Score; UCIP: unidad de cuidados intensivos pediátricos; VM: ventilación mecánica.
La escala SOFA mostró una correlación positiva con el tiempo de estancia en la UCIP (tabla 4). Al dividir a los supervivientes en subgrupos en función al tiempo mediano de estancia en la UCIP (estancia prolongada >5 días, estancia corta ≤5 días), encontramos que la puntuación SOFA era significativamente mayor en el grupo con estancias prolongadas (mediana: 5; rango: 0-12) en comparación con el grupo con estancias cortas (mediana: 4; rango: 0-10) (p<0,001). La AUC de la puntuación SOFA para la predicción de estancia prolongada en la UCIP en supervivientes fue de 0,67 (intervalo de confianza [IC] 95%: 0,59-0,76; p<0,001) en comparación con AUC de tan solo 0,48, 0,52 y 0,52 correspondientes a la PRISM, el PIM2 y el SRIS, respectivamente.
También dividimos la cohorte en función a la variable secundaria compuesta de mortalidad a los 30 días o tiempo de estancia en la UCIP de 3 o más días. La puntuación SOFA fue significativamente más alta en el subgrupo en que se dio la variable secundaria compuesta en comparación con el otro subgrupo (mediana y rango: 5 [0-21] vs. 3 [1-7]; p<0,001). La AUC de la puntuación SOFA para la predicción de la variable secundaria compuesta fue de 0,77 (IC 95%: 0,70-0,84; p<0,001), en comparación con AUC de 0,45, 0,59 y 0,66 correspondientes a la PRISM, el PIM2 y el SRIS, respectivamente.
La escala SOFA, el síndrome de respuesta inflamatoria sistémica y la definición de sepsisEn pacientes con infección confirmada o sospechada, la AUC de la escala SOFA para la predicción de la mortalidad fue mayor en comparación con la AUC del SRIS (fig. 2).
Definiendo la sepsis (de acuerdo con los criterios Sepsis-3) como la presencia de infección asociada a una puntuación SOFA≥2 puntos, el 93,3% de los pacientes tenían sepsis, pero la asociación entre la sepsis y la mortalidad no era significativa (tabla 5). Aplicando este punto de corte en la escala SOFA, la mortalidad era del 40%, la sensibilidad del 100% y la especificidad del 5,2%.
Asociación de distintas definiciones de sepsis con la mortalidad a 30 días
| OR (IC 95%) | Valor de p | |
|---|---|---|
| Sepsis definida como SOFA≥2 puntos | 6,00 (0,74-48,67) | 0,093 |
| Sepsis definida como SOFA≥3 puntos | 8,02 (1,80-35,67) | 0,006a |
| Sepsis definida como SOFA≥7 puntos | 13,73 (6,17-30,56) | <0,0001a |
| Sepsis definida como SRIS | 4,46 (2,06-9,67) | 0,0002a |
IC: intervalo de confianza; NA: no aplicable; OR: odds ratio; SOFA: Sequential Organ Failure Assessment Score; SRIS: síndrome de respuesta inflamatoria sistémica.
Definiendo la sepsis como la presencia de infección asociada a una puntuación SOFA≥3 puntos, el 84,7% de los pacientes con infección tenían sepsis, la sensibilidad era del 100%, la especificidad del 18,2% y la asociación entre la sepsis y la mortalidad era estadísticamente significativa (OR: 8,02; p=0,006).
Definiendo la sepsis como una puntuación SOFA≥7 puntos (el punto de corte óptimo para la predicción de la mortalidad derivado de la curva ROC), el 40% de los pacientes con infección tenían sepsis, que se asociaba a un riesgo mayor de muerte (OR: 13,73; p<0,001).
Definiendo la sepsis como cumplimiento de los criterios de SRIS (al menos 2 criterios, de los que al menos uno ha de ser una temperatura o un recuento leucocitario anormal) en contexto de infección, el odds ratio para la mortalidad fue de 4,46 (p<0,001).
DiscusiónEl desarrollo de una escala pronóstica ideal continúa suponiendo un reto. En nuestro estudio observamos que la puntuación SOFA al ingreso fue un predictor bueno de mortalidad en la población general de la UCIP. La puntuación SOFA mediana fue significativamente más alta en los no supervivientes en comparación con los supervivientes, y la mortalidad aumentó de manera progresiva del grupo de pacientes con las puntuaciones más bajas al grupo con las puntuaciones más altas. Además, la asociación entre la puntuación SOFA y la mortalidad mantuvo la significación estadística en el análisis multivariante, mientras que la asociación de la mortalidad con la edad o el peso no lo hizo. Por añadidura, la escala SOFA dio lugar a un AUC de 0,886 para la predicción de la mortalidad a los 30 días, lo que fue consistente con un estudio retrospectivo en 8.711 niños críticamente enfermos en el que la AUC de la escala SOFA en la predicción de la mortalidad a los 28 días fue prácticamente idéntica (0,88)15.
En función de los datos obtenidos, el punto de corte óptimo de la puntuación SOFA para discriminar entre no supervivientes y supervivientes es de 7 puntos, en comparación con el valor de 8 puntos reportado en un estudio pediátrico previo15 y un valor de 8 puntos reportado en un estudio en adultos19.
También observamos que el rendimiento de la escala SOFA para la predicción de la mortalidad en la población general de la UCIP fue superior comparado al de la escala PRISM y el índice PIM2, mientras que un estudio pediátrico previo encontró AUC iguales para la escala SOFA una versión actualizada de la escala PRISM (PRISM III)15.
Aunque el rendimiento de la escala SOFA fue bueno para predecir la mortalidad, esta escala resultó menos útil en la predicción del tiempo de estancia en la UCIP en supervivientes y la variable secundaria compuesta de mortalidad o estancia en la UCIP de 3 o más días. Estos hallazgos fueron consistentes con los de estudios anteriores20,21.
Además del rendimiento superior observado en nuestro estudio, la escala SOFA podría ofrecer ventajas adicionales en comparación a la escala PRISM. La escala SOFA se encuentra disponible de manera gratuita y no requiere ningún software especial para su cálculo. También requiere medir menos parámetros que la escala PRISM (6 vs. 14). Otra ventaja es que la puntuación SOFA se puede calcular a diario, ofreciendo una evaluación dinámica de la progresión de la enfermedad, mientras que la PRISM solo se calcula al ingreso. Por añadidura, la puntuación SOFA no requiere muestras para gasometría, de difícil obtención en niños, ya que fue adaptada para emplear valores de SPO2 en lugar de valores de PaO2.
Por otro lado, una de las desventajas de la escala SOFA es que no se puede calcular de inmediato al ingreso en la UCIP y que hay que esperar 24h para obtener el peor valor para cada componente. En este sentido, el índice PIM2 es preferible a la escala SOFA, ya que se calcula en la primera hora de ingreso en la UCIP, lo que permite una identificación más temprana de los pacientes de alto riesgo que requieren un manejo más agresivo. Además, la escala SOFA es relativamente compleja, lo que ha llevado a los investigadores a desarrollar una versión rápida (quick SOFA [qSOFA]), aunque esta parece ser menos precisa20,22. Por desgracia, parece que la mejora de un aspecto de una escala suele darse a expensas de otros aspectos. Cabe albergar la esperanza de que en el futuro se descubran biomarcadores más precisos que mejoren o reemplacen las escalas existentes en la actualidad. Aun así, seguirá siendo complicado predecir el curso de la enfermedad en cada paciente debido a la extrema complejidad de los mecanismos inmunológicos, metabólicos y endocrinos subyacentes, así como al efecto de la constitución genética de cada individuo en su respuesta al tratamiento. A lo que hay que sumar la falta de garantías de que pacientes con enfermedad leve no empeoren como resultado de infecciones nosocomiales, reacciones adversas a medicamentos u otros problemas relacionados con la asistencia médica.
Ha habido un interés creciente en adaptar la escala SOFA a la población pediátrica tras el cambio reciente en la definición de sepsis en adultos (Sepsis-3), en la que se abandonó el concepto del SRIS a favor de la escala SOFA14. En nuestro estudio, la puntuación SOFA fue más precisa en la predicción de la mortalidad en pacientes con infección que el SRIS (AUC: 0,87 vs. 0,60). La escala SOFA también demostró ser superior a las escalas PRISM y PIM2. Estos resultados fueron consistentes con los de un estudio multicéntrico reciente en el que la puntuación SOFA adaptada por edad calculada al ingreso correspondió a una AUC de 0,83 para predecir la mortalidad en niños ingresados en la UCIP con infección sospechada o confirmada, en comparación con la AUC de 0,73 obtenida con el SRIS20. De manera similar, otro estudio retrospectivo encontró que la puntuación SOFA era más precisa que el SRIS en la predicción de la mortalidad en niños ingresados por infección en la UCIP21.
Al comparar la escala SOFA específicamente con el SRIS, se observó que el odds ratio para el diagnóstico de sepsis aplicando un valor de corte de 7 puntos en la escala SOFA como predictor de mortalidad fue de 13,73, mientras que el diagnóstico clásico de sepsis basado en el SRIS resultó en la predicción de un riesgo menor de mortalidad (OR=4,46).
Por lo tanto, nuestros hallazgos sugieren que la escala SOFA es superior al SRIS para definir la sepsis pediátrica. De hecho, recientemente se ha cuestionado el concepto del SRIS por haberse demostrado que adolece de una falta excesiva de especificidad. Un estudio encontró que casi la mitad de los pacientes adultos ingresados en planta desarrolló SRIS en algún momento, lo que hace que el uso de los criterios de SRIS para la identificación precoz de la sepsis resulte poco práctico23. Otro estudio describió que el 92% de los niños atendidos en un servicio de urgencias pediátricas con fiebre de más de 38,5oC cumplían los criterios de SRIS, pero la mayoría de ellos fueron dados de alta sin haber necesitado terapia intravenosa o reingreso24. Por otro lado, los científicos han llegado a la conclusión de que el SRIS no puede ser el único parámetro en la definición de sepsis, toda vez que la fisiopatología de la sepsis implica mecanismos adicionales a la inflamación excesiva, tales como la activación de la respuesta anti-inflamatoria y alteraciones en vías no inmunológicas, incluyendo vías hormonales, metabólicas, autonómicas y de coagulación, que también tienen valor pronóstico14.
En cualquier caso, en nuestro estudio encontramos que el valor de corte de 2 puntos en la escala SOFA propuesta en el consenso Sepsis-3 para el diagnóstico de sepsis no estaba asociado de manera significativa con la mortalidad y, además, tenía una especificidad muy baja, lo que sugiere que las recomendaciones del consenso Sepsis-3 no se pueden extrapolar directamente a la población pediátrica, aunque otros estudios en esta población15,20 han corroborado la utilidad de dicho punto de corte en la escala SOFA. Esta discrepancia podría explicarse en función a las diferencias en el tamaño muestral, el ámbito de estudio o la metodología, pero también hay que tener en cuenta que el umbral de 2 puntos en la escala SOFA adoptado en los criterios Sepsis-3 fue seleccionado a priori y no derivado del análisis de curvas ROC. También se ha criticado un aspecto importante en la definición de la Sepsis-3, y es que solo se considera que un paciente tiene sepsis cuando la infección ha alcanzado un nivel alto de gravedad asociado a disfunción orgánica, lo que tiene repercusiones negativas en la evolución25. En otras palabras, la nueva definición de sepsis ha mejorado la especificidad a expensas de la sensibilidad26. Este aspecto ha de tenerse en consideración a la hora de establecer el punto de corte en la escala SOFA a utilizar para el diagnóstico de sepsis en pediatría, y sugiere que no debería utilizarse un valor de corte de 7 puntos en el diagnóstico de sepsis pediátrica, aunque este fuera el punto óptimo para la predicción de la mortalidad. En su lugar, en función de los resultados de nuestro estudio, parecería más prudente aplicar un valor de corte de 3 puntos en la escala SOFA, que se asocia a un mayor riesgo de mortalidad en comparación con el SRIS, y al mismo tiempo permitiría a los clínicos diagnosticar la sepsis de manera relativamente precoz, antes de que la disfunción orgánica haya progresado a un nivel de gravedad mayor. Esto no quiere decir que consideremos que la escala SOFA vaya a resolver la controversia sobre la definición y el diagnóstico de la sepsis pediátrica. De hecho, la escala SOFA debería percibirse como un «paso adelante» más que como una «solución final» al problema.
En general, nuestros hallazgos sugieren que la escala SOFA debería reemplazar al SRIS en el diagnóstico de sepsis, aunque el punto de corte aplicado a la puntuación SOFA habría de ser ligeramente más alto que el propuesto en los criterios para adultos del consenso Sepsis-3.
Entre las limitaciones de nuestro estudio se encuentran su reducido tamaño muestral, aunque esto en parte sería compensado por los valores de p extremadamente pequeños obtenidos en los resultados principales. Otro aspecto es que se emplearon versiones antiguas de las escalas PRISM y PIM2. Además, no se calculó la puntuación SOFA en distintos momentos, a pesar de que estudios previos han reportado que las puntuaciones SOFA seriadas tienen valor pronóstico19. Sería lógico que las puntuaciones SOFA seriadas predijesen la mortalidad con mayor precisión, ya que los cambios en la puntuación reflejarían el aumento progresivo en la gravedad que precede a la muerte. No obstante, nos parece crucial una predicción más temprana de la evolución del paciente antes de que su estado se deteriore de manera irreversible. Por último, la mortalidad en nuestra cohorte fue alta, presumiblemente debido a que la escasez de recursos obstaculizó en muchos casos la implementación de las medidas apropiadas de diagnóstico y tratamiento. A causa de ello, algunos de nuestros hallazgos no serían extrapolables a centros con tasas de mortalidad bajas.
ConclusiónLa escala SOFA pediátrica mostró ser útil para la predicción de la mortalidad a los 30 días en la población general de la UCIP con un desempeño superior en este sentido al de las escalas PRISM y PIM2, aunque su rendimiento solo fue medianamente adecuado para la predicción de estancias prolongadas en la UCIP. Por añadidura, la escala SOFA debería sustituir a los criterios de SRIS para el diagnóstico de sepsis en la población pediátrica, ya que demostró su superioridad en la predicción de la mortalidad a los 30 días en pacientes con infección. No obstante, a diferencia de lo recomendado en la definición del consenso Sepsis-3, el punto de corte óptimo en la puntuación SOFA para la definición de la sepsis pediátrica fue de 3 puntos, y no de 2. Son necesarios estudios prospectivos multicéntricos para realizar una evaluación más rigurosa de la escala SOFA pediátrica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.