La intolerancia hereditaria a la fructosa (IHF, MIM #229600) es una enfermedad autosómica recesiva debida a la deficiencia de la aldolasa B, enzima encargada del metabolismo de la fructosa, en el hígado principalmente. El consumo de fructosa, sacarosa, sorbitol o tagatosa1 en pacientes con IHF provoca síntomas graves que pueden llevar a alteraciones analíticas, neurológicas, hepáticas, renales, hipoglucemias e incluso a la muerte2.
Las presentaciones líquidas orales de medicamentos se elaboraban clásicamente con sacarosa (jarabe simple) pero está aumentado el uso de otros edulcorantes, como los jarabes hidrogenados (polialcoholes) o, en menor medida, jarabes de glucosa. Los polialcoholes se obtienen por hidrogenación catalítica de azúcares, obteniéndose productos con bajo poder calórico (maltitol, sorbitol, lactitol, etc.). Por el contrario, los jarabes de glucosa son más calóricos, al ser menor su poder edulcorante, aunque se puede aumentar transformando parte de las glucosas en fructosas (isomerización). En la industria alimentaria, si la cantidad de fructosa es mayor del 5%, debe indicarse en la definición del ingrediente3. En la industria farmacéutica es obligatorio poner una advertencia en el prospecto y la ficha técnica para pacientes con IHF si el medicamento contiene fructosa, sacarosa, azúcar invertido, sorbitol, maltitol, isomaltitol y lactitol, por ser edulcorantes contraindicados en la IHF4 (tabla 1). Se han detectado errores en fichas técnicas en la denominación de jarabes de glucosa potencialmente perjudiciales para pacientes con IHF.
Características de excipientes/edulcorantes y su tolerancia en IHF
| Excipiente | Composición | Sinónimos | Obtención | ¿Apto en IHF? |
|---|---|---|---|---|
| Monosacáridos | ||||
| Sorbitol | Sorbitol | D-glucitol, D-sorbitol | Hidrogenación de glucosa | No |
| Disacáridos | ||||
| Sacarosa | Glucosa-fructosa | Azúcar de mesa, azúcar común | A partir de la caña de azúcar | No |
| Isomaltitol | Mezcla de maltitol y glucosa-manitol | Isomalta, isomaltol, isomalt, isomaltulosa hidrogenada, palatalinosa hidrogenada | Hidrogenación de isomaltulosa | Noa |
| Lactitol | Galactosa-sorbitol | Lactita, lactositol, lactoblosita | Hidrogenación de lactosa | Noa |
| Maltitol | Glucosa-sorbitol | Maltosa hidrogenada | Hidrogenación de hidrolizado de almidón | Noa |
| Jarabes | ||||
| Azúcar invertido | Mezcla de glucosa y fructosa | Azúcar líquido invertido, jarabe de azúcar invertido | Hidrólisis de sacarosa | No |
| Jarabe de glucosa | Mezcla de glucosa, maltosa y oligosacáridos | Jarabe de maíz | Hidrólisis de almidón | Síb |
| Jarabe de maltitol | Mezcla de sorbitol, maltitol y polisacáridos hidrogenados | Jarabe de glucosa hidrogenada, jarabe de glucosa hidrogenada con alto contenido en maltosa, hidrolizado de almidón hidrogenado | Hidrogenación de jarabe de glucosa o hidrolizado de almidón | Noa |
| Jarabe de maíz con alto contenido en fructosa | Glucosa y fructosa | Isoglucosa, jarabe de maíz de alta fructosa | Hidrólisis de almidón de maíz e isomerización de parte de las glucosas a fructosa (42-55%) | No |
Para determinar su alcance, se han revisado las fichas técnicas de medicamentos que contienen jarabe de glucosa entre mayo del 2013 y julio del 2016 con la herramienta Nomenclator de prescripción de la Agencia Española del Medicamento y Productos Sanitarios (www.aemps.gob.es) y la información se ha confirmado con cada laboratorio fabricante.
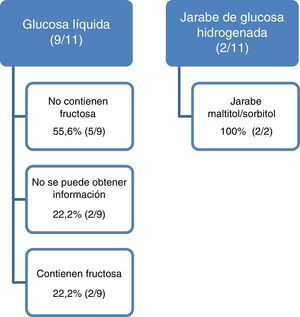
Se detectaron 42 presentaciones comercializadas con jarabe de glucosa. Se excluyeron 4 presentaciones tópicas y 27 que contenían además sacarosa, sorbitol, maltitol, isomaltitol o jarabe de maíz con alto contenido en fructosa (no apareciendo alerta para IHF en 3 presentaciones [11%]). Se analizaron 11 presentaciones: 9 con glucosa líquida y 2 con jarabe de glucosa hidrogenada.
En las 2 presentaciones con glucosa líquida y en las 2 con jarabe de glucosa hidrogenada el laboratorio confirma que contienen fructosa y maltitol/sorbitol, respectivamente. La formulación de estas 4 presentaciones es en forma de jarabe o solución oral, el resto son comprimidos, cápsulas o viales. En una presentación se indica que el jarabe de glucosa contiene un 40% de fructosa. En 2 presentaciones de un mismo laboratorio no se pudo obtener información sobre la composición de la glucosa líquida y en otras 3 (27,7%) la primera respuesta obtenida fue imprecisa o contenía errores que requirieron una segunda consulta (fig. 1). En algún caso la demora en la contestación ha sido de 4 meses.
En conclusión, se han detectado errores muy graves en la información sobre excipientes en las fichas técnicas que conllevan un problema de seguridad grave para pacientes con IHF. Los 2 errores más graves han sido:
- –
Indicar en la ficha técnica «jarabe de glucosa o glucosa líquida» cuando en realidad es «jarabe de glucosa-fructosa».
- –
Indicar en la ficha técnica «jarabe de glucosa hidrogenado» como sinónimo de «jarabe de glucosa», cuando en realidad es «jarabe de maltitol o jarabe de sorbitol».
Además, se ha observado que no todos los medicamentos que contienen fructosa, sacarosa, sorbitol, maltitol, isomaltitol o lactitol contienen la alerta/contraindicación que corresponde para pacientes con IHF en el material de acondicionamiento o el cartonaje, la ficha técnica y el prospecto (según la legislación sobre el etiquetado).
La revisión se ha hecho a través de una aplicación que filtra los medicamentos según excipientes. A pesar de ello, no se puede asegurar que se hayan revisado todos los medicamentos con jarabe de glucosa. Por ello, dichos errores se han notificado al Programa de Seguridad del Paciente y Errores de medicación de la Consejería de Sanidad de la Comunidad de Madrid y a la AEMPS (errores.etiquetado@aemps.es), para que realicen las notificaciones oportunas a la industria farmacéutica y a los profesionales sanitarios.
A pesar del tamaño de la muestra, son muy llamativos tanto los errores en la ficha técnica como la dificultad para obtener una información fiable y precisa por parte del laboratorio fabricante, habiéndose requerido, en varios casos, aclaraciones posteriores, que han llevado a rectificaciones con respecto a la información emitida con anterioridad. En alguno de los casos, si se hubiese considerado correcta la primera información del fabricante, la consecuencia de la administración del medicamento en cuestión en un paciente con IHF podría haber tenido consecuencias graves en su salud. Creemos necesario un proceso de revisión del contenido de la ficha técnica de forma coordinada entre las agencias reguladoras y las compañías fabricantes y/o comercializadoras de estos medicamentos.