Introducción
Desde la publicación del estudio DCCT (Diabetes Control and Complication Trial), el tratamiento intensivo se ha convertido en el de primera elección en jóvenes con diabetes mellitus tipo 1, pues demostró que la mejora del control metabólico se traducía en reducción en la frecuencia y gravedad de las complicaciones crónicas. El efecto secundario asociado a la optimización del control fue el aumento del número de hipoglucemias1.
En el intento de mejorar el control glucémico minimizando el riesgo de hipoglucemia aparece el análogo de insulina glargina, que se obtiene de sustituir un aminoácido en la cadena alfa y añadir dos en la beta, consiguiendo un punto isoeléctrico en 5,4 y añadiendo pequeñas cantidades de cinc necesarias para la cristalización y disolución desde el tejido subcutáneo. Al ser una disolución ácida precipita en este tejido a pH fisiológico y forma hexámeros que confieren una acción prolongada y uniforme con la que se pretende mejorar el control glucémico basal minimizando el riesgo de hipoglucemia, al estar exenta de picos de hiperinsulinismo, como ocurre con la insulina de acción intermedia (NPH)2.
Un gran número de estudios en diabéticos tipo 1 adultos demuestra la mayor eficacia de glargina sobre la NPH para mejorar la glucemia basal3 y el nivel de hemoglobina glucosilada (HbA1c) alrededor de un 0,5 %4, disminuir el número de hipoglucemias, la dosis diaria de insulina y la ganancia ponderal5. Los resultados son equivalentes si se administra la glargina en una única dosis, ya sea por la mañana o por la noche, o en 2 dosis, con el inconveniente de una mayor ganancia ponderal al dividir en dos6.
En los últimos años están apareciendo publicaciones sobre el uso de este análogo en niños y adolescentes7-17, alguna de ellas en nuestro entorno18.
Los objetivos de nuestro estudio son evaluar el tratamiento con una pauta insulínica con glargina en niños y adolescentes y valorar el grado de satisfacción de los pacientes y sus padres con esta nueva pauta.
Pacientes y métodos
Se trata de un estudio prospectivo "pre-post" sin grupo control. Se ha realizado en la Unidad de Endocrinología Pediátrica de un hospital de segundo nivel que atiende a 200 niños y adolescentes con diabetes mellitus tipo 1 diagnosticados antes de los 14 años de edad de toda la provincia. El período de inclusión fue de 3 meses (de diciembre de 2003, fecha de comercialización de glargina [Lantus®, Aventis Pharma] en España, a marzo de 2004).
Se ofreció a participar en el estudio a los 42 pacientes con diabetes mellitus tipo 1 de la unidad que cumplían las siguientes condiciones de inclusión, y todos aceptaron: tratamiento intensivo previo, evolución de la diabetes mayor de 2 años, seguimiento con buen cumplimiento de las visitas, autoanálisis glucémico al menos cuatro veces al día de forma regular, buena relación y comunicación con el equipo asistencial, interés por mejorar el control, indicación de cambio de pauta insulínica y firma del consentimiento informado por parte de los padres y niños mayores de 12 años. El tratamiento previo consistía en 3 o 4 administraciones al día de insulina NPH y análogo lispro en desayuno, comida y cena (en algunos casos la NPH nocturna era administrada por separado a la hora de acostarse), realizando el paciente o sus padres modificaciones de dosis según la cantidad de hidratos de carbono de la ingesta, glucemia capilar, grado de actividad física y circunstancias intercurrentes. Las indicaciones del cambio de pauta insulínica fueron mal control metabólico en 35 casos (HbA1c > 7,5 % en púberes o > 8 % en prepúberes) y excesivas hipoglucemias con mal reconocimiento de las mismas en 7 casos.
Se incluyeron 27 mujeres y 15 varones, 11 prepúberes, 21 púberes y 10 pospúberes, con edad al inicio de 6,81 ± 3,30 años (rango: 1,16-13,24), edad al inicio del tratamiento con glargina 12,77 ± 2,64 años (rango: 7,00-17,75) y tiempo de evolución de la diabetes 6,10 ± 2,88 años (rango: 2,00-11,92).
La dosis inicial de glargina se calculó como el 50 % de la dosis de insulina total diaria previa reducida en un 10 % y se indicó administrar a la hora de la cena. Se completó el tratamiento con 3 administraciones de insulina regular o análogos rápidos (lispro o aspart) en desayuno, comida y cena, según el paciente hiciera o no tomas intermedias de hidratos de carbono, respectivamente (a los prepúberes y púberes se les recomendaba hacerlas). En una hoja informativa se indicaba a los pacientes la forma de ajustar la dosis, primero la rápida y luego la glargina según las glucemias posprandiales y basales, respectivamente. Las recomendaciones sobre autoanálisis glucémicos fueron las mismas que con el tratamiento previo, un mínimo de cuatro al día (antes de las 3 comidas y al acostarse) y siete diarios al menos dos veces por semana. También lo fue el grado de atención médica y enfermera: revisión cada 3 meses y llamadas telefónicas a demanda en horas de consulta, salvo una visita adicional opcional a los 7-10 días del cambio de tratamiento.
Entre el momento cero o visita inicial (en la que se inicia la pauta con glargina) y las visitas en consulta 6, 12 y 18 meses después, comparamos las siguientes variables: nivel plasmático de HbA1c determinada por cromatografía líquida de alta presión, índice de masa corporal (kg/m2) expresado en escala de desviación estándar (EDE) según las referencias del estudio "enKid"19, dosis de insulina (U/kg/día) y porcentaje de insulina basal (NPH o glargina) sobre el total diario. También se interrogó a los padres si habían sufrido algún episodio de hipoglucemia grave (con convulsión o pérdida de consciencia), de cetosis o cetoacidosis (definiendo cetosis como hiperglucemia acompañada de clínica sugerente y cetonuria intensa en orina y cetoacidosis si además el nivel de bicarbonato plasmático es < 15 mEq/l). No se recogieron variables de las visitas trimestrales intermedias. Se definieron como "respondedores al tratamiento" aquellos pacientes en los que la HbA1c disminuyó más de 0,5 % desde el inicio al final del estudio.
En la visita inicial y en la del sexto mes del estudio los pacientes y sus padres contestaron a la "Subescala de Satisfacción con el Tratamiento" de la "Escala de Calidad de Vida específica de Diabetes"20. Ésta comprende 64 ítems, de los cuales 10 forman la Subescala de Satisfacción: 10 objetivos del tratamiento son calificados en 6 grados de satisfacción y ponderados según 6 grados de importancia.
Análisis de datos
Los resultados se expresan como media ± desviación estándar. Las variables se compararon con análisis de la varianza para medidas repetidas y test de la t de Student para muestras apareadas. Las comparaciones de variables entre los pacientes "respondedores" al tratamiento y los "no respondedores" se hicieron con test no paramétricos para muestras independientes (U de Mann-Whitney) para las variables cuantitativas y test exacto de Fisher para las cualitativas. Un valor de alfa de 0,05 se usó como umbral de significación estadística. Se utilizó el programa SPSS versión 11,0 para Windows.
Se contó con la aprobación de los Comités Ético y de Investigación de nuestro centro.Resultados
El período de tratamiento con glargina fue de 18 meses en todos los casos, sin producirse ningún abandono. En 3 pacientes prepúberes se cambió el horario de administración al desayuno por sufrir hipoglucemias nocturnas, el resto mantuvo la administración en la cena. Los pospúberes, que ingerían sólo 3 tomas de hidratos de carbono al día y se les pautó análogos rápidos en desayuno, comida y cena, requirieron una cuarta administración a media tarde por hiperglucemia en las últimas horas de efecto teórico de glargina.
Durante el período de estudio no ha ocurrido ninguna hipoglucemia grave, habiendo ocurrido cuatro en los 18 meses previos. Los episodios de cetoacidosis fueron dos en el período con glargina, los mismos que en el previo.
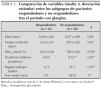
En la tabla 1 se comparan las variables al inicio, durante y al final del período de tratamiento con la nueva pauta, con mejoría significativa de los niveles de HbA1c y de las puntuaciones en la Escala de Satisfacción.
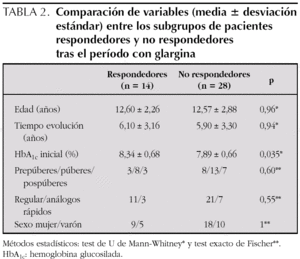
En la tabla 2 se comparan las variables entre los 2 subgrupos de pacientes: "respondedores" (12 casos) y "no respondedores". Sólo el nivel de HbA1c previo fue significativamente diferente, mayor, en los primeros. Ninguna otra variable se relacionó con la buena respuesta, incluido el tipo de insulina rápida utilizado junto a glargina (regular o análogos).
Discusión
La principal limitación de nuestro estudio es que no es controlado ni aleatorizado y los resultados se comparan con los del tratamiento previo en los mismos sujetos. En este diseño los resultados beneficiosos sin duda estarán mediatizados por la mayor motivación e ilusión de los pacientes ante una nueva terapia, mejorando su adherencia a la misma, el aumento del número de autoanálisis glucémicos necesarios para ajustar las nuevas dosis y la repercusión que la mejora de la calidad de vida pueda tener sobre la adherencia al tratamiento.
La mayoría de los trabajos hasta ahora publicados con pacientes pediátricos tienen el mismo diseño que el nuestro, pero con períodos de tratamiento más cortos, de 6 a 12 meses7-12,18 y obtienen similares beneficios metabólicos (descensos del nivel de HbA1c entre 0,3 y 1 %). En un seguimiento de 18 meses vemos cómo la mejoría constatada en el primer semestre se mantiene. Aun así los resultados no son extrapolables a períodos más largos en los que se puede perder motivación. De hecho, en los escasos estudios aleatorizados disponibles con glargina no se aprecia mejora significativa en el control metabólico13-15. Quedaría por analizar en estudios a largo plazo qué repercusión clínica tendría la diferencia de nivel de HbA1c en la incidencia y gravedad de las complicaciones crónicas de la hiperglucemia y en el gasto sanitario. A la hora de definir pacientes más o menos respondedores, todos los autores coinciden con nosotros en que la mejora de la HbA1c es mayor en aquellos que parten de un nivel más alto9.
Otra limitación de nuestro estudio es la de contar con un grupo heterogéneo de pacientes en distintas edades pediátricas. La pubertad supone un período fisiológico de resistencia a la acción de la insulina con aumento de su requerimiento y empeoramiento del control metabólico, dificultando la interpretación de los resultados. Durante el período de tratamiento en nuestra serie, al haber tanto individuos que inician como otros que terminan la pubertad, el efecto de la misma en las variables estudiadas está en alguna medida minimizado.
Clásicamente se ha relacionado el tratamiento insulínico intensivo con importantes efectos adversos, tales como el aumento del riesgo de hipoglucemia (siendo la población infantil especialmente vulnerable a sus consecuencias) y la ganancia ponderal. Sin embargo, con glargina el beneficio metabólico obtenido no se acompaña de cambios del índice de masa corporal ni del requerimiento insulínico, coincidiendo con los resultados de la mayoría de autores7,8,10-12,14,18. Estudios aleatorizados demuestran también disminución de la glucemia basal13,14,18 y del riesgo de hipoglucemia grave y grave nocturna con glargina8,10-12,14,16-18. Al igual que en nuestro grupo, los pacientes de otras series transferidos a este análogo no suelen volver a la pauta anterior, se manifiestan satisfechos en general, sobre todo al tener más flexibilidad para comer, realizar ejercicio y cambiar horarios8,9.
Podemos concluir que la pauta insulínica con glargina mejora el control metabólico en niños y adolescentes con diabetes mellitus tipo 1 en terapia intensiva, así como el grado de satisfacción de pacientes y padres con el tratamiento de la diabetes.
Correspondencia: Dr. E. García-García.
Servicio de Pediatría. Complejo Hospitalario Torrecárdenas.
Prof. Tercedor Díaz, 2, 3.º A. 18003 Granada. España.
Correo electrónico: ggej@hotmail.com
Recibido en noviembre de 2005.
Aceptado para su publicación en octubre de 2006.