La leucemia congénita (LC) se define como aquella que inicia en el período neonatal y supone menos del 1% de las leucemias infantiles. Contrariamente a lo que ocurre durante el resto de la infancia, 2/3 de los casos se tratan de leucemias mieloides agudas (LMA). La presentación clínica habitual incluye citopenias, hiperleucocitosis, hepatoesplenomegalia, coagulopatía y, hasta en el 60% de los pacientes, puede observarse infiltración cutánea1. Se presentan a continuación 2casos de LC tratados en nuestro centro.
Lactante de 2 meses que inicia con fiebre y mal estado general. Desde el primer mes presenta tumoración cutánea violácea de consistencia elástica en fontanela mayor, con aparición posterior de nuevas tumoraciones generalizadas. Asocia palidez cutáneo-mucosa, hepatoesplenomegalia, insuficiencia respiratoria e hipertonía generalizada. Analíticamente, destaca anemia (4,4g/dl), trombocitopenia (66.000/mm3), leucocitosis (38.440/mm3) con células atípicas, así como aumento de LDH (2.357 U/l) e hiperuricemia (7,49mg/dl). Los reactantes de fase aguda son negativos. El aspirado medular confirma el diagnóstico de leucemia linfoblástica aguda (LLA) B precursora CD10–. Se detecta por FISH reordenamiento MLL (11q23) con t(10;11), siendo el cariotipo 46 XX normal. El estudio de líquido cefalorraquídeo (LCR) así como el fondo de ojo y la ecografía transfontanelar son normales. Recibe tratamiento quimioterápico según protocolo Interfant-99 grupo de alto riesgo, alcanzando remisión completa tras la fase de inducción con persistencia de MLL+. Tras completar el ciclo de consolidación, se realiza evaluación pretrasplante objetivándose infiltración medular por un 80% de blastos mieloides (M0-M1), infiltración del LCR y nuevas lesiones cutáneas. El estudio de biología molecular muestra nuevamente t(10:11). Tras quimioterapia citorreductora (hidroxiurea, citarabina y tioguanina), recibe fludarabina por vía intravenosa y quimioterapia intratecal, alcanzando segunda remisión completa. Posteriormente, se realiza trasplante de progenitores hematopoyéticos (TPH) de sangre periférica de cordón umbilical de donante no emparentado idéntico, previo acondicionamiento con busulfán, ciclofosfamida, tiotepa y timoglobulina. Dos meses después, sin alcanzar quimera completa, presenta una segunda recaída medular con inmunofenotipo mieloide, tratada con quimioterapia tipo IDAFLAG (idarrubicina, fludarabina y citarabina). Durante la recuperación hematológica reaparece infiltración medular masiva por blastos linfoides, falleciendo a los 12 meses de vida.
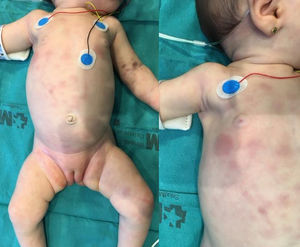
Lactante de 7 semanas de edad que presenta desde los 20 días de vida lesiones cutáneas nodulares induradas generalizadas de aspecto violáceo (fig. 1), además de palidez cutáneo-mucosa y esplenomegalia. En la analítica de sangre destaca leucocitosis (32.910/mm3) con células atípicas, anemia (8,7g/dl), trombocitopenia (100.000/mm3), elevación de LDH (661 U/l) y coagulopatía. El aspirado medular muestra infiltración por un 90% de blastos con inmunofenotipo compatible con LMA-M0 y reordenamiento MLL+en FISH sin detectarse translocación. No presenta infiltración del sistema nervioso central. Recibe tratamiento quimioterápico según protocolo St Jude AML 02, con desaparición de las lesiones cutáneas en el día+8 y alcanzando remisión completa con enfermedad mínima residual<0,1% tras el primer ciclo ADE (citarabina, etopósido, daunorrubicina). Tras un segundo ciclo ADE se realiza, en situación de primera remisión completa, un TPH de sangre periférica de donante haploidéntico (madre) con depleción alfa-beta/CD19. Alcanza quimerismo completo en el día+30 postrasplante, presentando como única complicación enfermedad injerto contra huésped aguda cutánea grado 3, resuelta en la actualidad. La paciente se encuentra en remisión completa a los 15 meses del diagnóstico.
La LC tiene una incidencia estimada de 1 a 5 casos por millón de recién nacidos vivos. En torno al 65% de los casos se tratan de LMA frente a un 35% de LLA1. Debido a la inmadurez del precursor hematopoyético, es frecuente la coexpresión de marcadores mieloides y linfoides en el período neonatal, así como el cambio de linaje, tal y como ilustra el primer caso. El diagnóstico de LC exige, además de la presencia de blastos en sangre/médula ósea y órganos hematopoyéticos extramedulares, descartar otros cuadros como reacciones leucemoides o el síndrome mieloproliferativo transitorio asociado al síndrome de Down1,2.
Como muestran los casos presentados, la infiltración cutánea de la LC se caracteriza por la presencia de pápulas, placas o nódulos eritematoso-violáceos, habitualmente generalizados. Su apariencia ha sido descrita como «blueberry muffin rash», término aplicable a lesiones de etiología variada como las metástasis de neuroblastoma, histiocitosis de células de Langerhans o reacciones leucemoides por infecciones congénitas o anemias hemolíticas que deben ser consideradas en el diagnóstico diferencial1,2. Hasta en el 10% de los casos la leucemia cutis es la manifestación única de la enfermedad, sin infiltración medular asociada2,3. Aunque existen casos descritos de LC con remisión espontánea4,5, la infiltración cutánea no condiciona la evolución clínica de la enfermedad. En términos generales, la supervivencia de los pacientes con LC es muy desfavorable, alcanzándose según las series más representativas tasas de supervivencia del 25% en LMA y hasta del 17% en LLA6.