Evaluar el efecto de un protocolo de cribado y tratamiento del bajo flujo sistémico (BFS) durante el periodo transicional en la aparición de hemorragia intraventricular (HIV) grave y/o muerte en prematuros.
MétodosEstudio cuasi-experimental con controles retrospectivos. En la fase de intervención se incluyeron los prematuros de menos de 30semanas de edad gestacional (enero 2016-julio 2017). Los controles (enero de 2013-diciembre de 2015) fueron pareados por edad gestacional, peso al nacimiento y sexo con una relación 1:2. Los casos diagnosticados de BFS por ecocardiografía funcional durante el protocolo recibieron tratamiento con dobutamina (DB) entre 5-10μg/kg/min durante 48h.
ResultadosSe incluyeron 29 casos en la fase de intervención (aplicación del protocolo) y 54 controles (fase preintervención). Diez de 29 (34,5%) casos durante el protocolo recibieron DB por BFS con 3/29 (10,3%) casos de HIV grave y/o muerte comparado con 17/54 (31,5%) en la fase pre-protocolo (p=0,032). El protocolo se asoció de forma independiente a una reducción en la HIV grave y/o muerte tanto en la regresión logística (OR: 0,11 [IC95%: 0,01-0,65], p=0,015] como en el análisis de ponderación por la probabilidad inversa de tratamiento (OR: 0,23 [IC95%: 0,09-0,56]; p=0,001].
ConclusionesEn un estudio con controles retrospectivos, la aplicación de un protocolo de cribado y tratamiento del BFS en prematuros se asoció a una reducción en la HIV grave y/o muerte. Son necesarios ensayos clínicos de suficiente potencia para determinar si las intervenciones posnatales sobre el BFS pueden mejorar el pronóstico neurológico.
To assess the effect of a protocolised intervention for low systemic blood flow (SBF) in the occurrence of severe intraventricular haemorrhage (IVH) or death in pre-term infants.
MethodsA study with a quasi-experimental design with retrospective controls was conducted on pre-term infants of less than 30weeks of gestational age, born between January 2016 and July 2017, who were consecutively included in the intervention period. The control cohort included pre-term infants (born between January 2013 and December 2015) matched by gestational age, birth weight, and gender (two controls for each case). The cases of low SBF diagnosed according to functional echocardiography during the study period received dobutamine (5-10μg/kg/min) for 48hours.
ResultsThe study included 29 cases (intervention period) and 54 controls (pre-intervention period). Ten out of 29 (34.5%) infants received dobutamine for low SBF during the intervention period, with 3/29 (10.3%) cases of severe IVH and/or death compared to 17/54 (31.5%) in the control cohort (p=.032). There was an independent association between the intervention and a decreased occurrence of severe IVH/death after adjusting for confounding factors both in the logistic regression model [OR 0.11 (95%CI: 0.01-0.65), p=.015], as well as in the sensitivity analysis using inverse probability of treatment weighting [OR 0.23 (95%CI: 0.09-0.56); p=.001].
ConclusionsIn this study with retrospective controls, a protocolised screening, and treatment for low SBF was associated with a decreased occurrence of severe IVH or death in preterm infants. Large, adequately powered trials, are needed in order to determine whether postnatal interventions directed at low SBF can improve neurological outcomes.
Durante el periodo transicional el prematuro puede experimentar una insuficiencia circulatoria transitoria caracterizada por un bajo flujo sistémico (BFS)1,2. El BFS está favorecido por la inmadurez del miocardio del prematuro, además de otros factores como la inflamación (corioamnionitis, sepsis), la hipoxemia o los cambios en la precarga ventricular (insuflación pulmonar, ductus, etc.). Técnicas como la ecocardiografía funcional o la saturación regional de oxígeno permiten detectar alteraciones a nivel del flujo sistémico y cerebral que de otra forma pasarían inadvertidas3-5. Los parámetros clínicos habituales (frecuencia cardiaca, presión arterial, etc.) no son suficientemente sensibles ni específicos para detectar cambios en el flujo sistémico2,5-8. Además, otros indicadores indirectos de perfusión tisular, como el lactato o la diuresis, son de escasa utilidad en el prematuro extremo en el periodo transicional9. El BFS suele ser transitorio y se recupera en las primeras 24-48h aunque no se realice ninguna intervención10. Sin embargo, este periodo de hipoperfusión relativa se ha involucrado en la patogenia del daño neurológico con una relación demostrada entre un flujo en vena cava superior (fVCS) inferior a los 41ml/kg/min y la hemorragia intraventricular (HIV), lesiones isquémicas de sustancia blanca, afectación del desarrollo neurológico a largo plazo y mortalidad1,3,11-15.
Algunas intervenciones, como el retraso del pinzamiento del cordón o el milking, pueden disminuir el riesgo de HIV1,16-19. Se ha propuesto el uso de inotrópicos en la prevención y tratamiento del BFS durante el periodo transicional, sin haberse demostrado efectos claros sobre la mortalidad o el desarrollo a largo plazo. Desafortunadamente, ninguno de los estudios realizados se ha diseñado con la suficiente potencia, por lo que no existe una recomendación en este aspecto20-22.
Existen referencias acerca del uso de ecocardiografía funcional en algunas unidades neonatales en nuestro país, pero se desconoce si la introducción de esta práctica en nuestra labor diaria puede influir en los resultados clínicos23.
El objetivo de este estudio es evaluar el efecto de la aplicación de un protocolo de cribado y tratamiento selectivo del BFS con dobutamina (DB) durante el periodo transicional en la HIV grave y/o muerte en recién nacidos prematuros de bajo peso.
MétodosDiseño y sujetosEstudio cuasi-experimental (pre-post intervención) tras la introducción de un protocolo de cribado y tratamiento del BFS. Se incluyeron de forma consecutiva todos los recién nacidos prematuros de menos de 30semanas de edad gestacional (EG) nacidos tras la instauración del protocolo (del 1 enero de 2016 hasta el 1 de julio de 2017). El grupo control fue una cohorte retrospectiva de prematuros nacidos en la fase previa al inicio del protocolo (1 de enero de 2013 a 31 de diciembre de 2015) pareados por EG (±3,5días), peso al nacimiento (±100g) y sexo con una relación 1:2. Se excluyeron los pacientes con malformaciones mayores, cardiopatías congénitas o datos clínicos incompletos. Los pacientes con HIV detectada en las primeras 6horas de vida fueron excluidos de forma prospectiva.
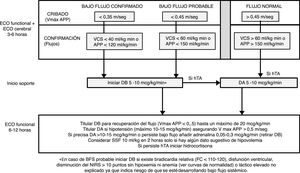
Protocolo en la fase de intervenciónA las 3-6horas de vida se realizó una ecocardiografía funcional para valoración del flujo sistémico junto con la primera ecografía cerebral (ver abajo) para detectar HIV precoz. Las ecocardiografías fueron realizadas por dos neonatólogos con formación en ecocardiografía funcional y un cardiólogo infantil. La valoración del BFS incluyó en todos los casos la medición de la velocidad máxima de la arteria pulmonar principal con Doppler pulsado (VmáxAPP) y de forma complementaria el flujo en la APP (fAPP) y en la vena cava superior (fVCS). Se diagnosticó de BFS confirmado si presentaba una VmáxAPP ≤0,35m/s, un flujo APP ≤120ml/kg/min o un flujo en VCS ≤40ml/kg/min. Se diagnosticó de BFS probable si los valores de VmáxAPP, fAPP y fVCS estaban entre 0,35-0,45m/s, 121-150ml/kg/min y 41-60ml/kg/min, respectivamente. Según protocolo se indicó tratamiento con DB a una dosis inicial entre 5-10μg/kg/min en caso de BFS confirmado o BFS probable si concurrían otras circunstancias de riesgo (fig. 1). El tratamiento se mantuvo durante las primeras 48h. La titulación del efecto de la DB se realizó con una segunda ecocardiografía funcional en las siguientes 6-12h.
El protocolo local de manejo de la hipotensión arterial (hTA) fue el mismo en ambas fases del estudio. Se diagnosticó hTA si la presión arterial media (PAM) era <p5 para la EG y horas de vida24. El fármaco de elección fue la dopamina (DA). En caso de precisar DA a >10-15μg/kg/min se añadió adrenalina a dosis entre 0,05-0,3μg/kg/min. Se utilizaron bolos de SSF 10cc/kg en caso de hTA persistente solo si existían datos de hipovolemia a criterio del médico responsable. Se utilizó hidrocortisona (1mg/kg/6-8h) en caso de hTA refractaria a las medidas anteriores25-28. En nuestro centro no se realizó retraso en el pinzamiento del cordón umbilical ni milking en los partos prematuros durante el periodo de estudio. Durante la fase de intervención se introdujeron algunos cambios en la práctica clínica, como la administración de probióticos para la prevención de enterocolitis, la actualización del protocolo de administración de surfactante en base al consenso europeo de 201629, el protocolo de administración de hidrocortisona para la prevención de la displasia broncopulmonar30, la generalización del uso de sulfato de magnesio y el aumento de las tasas de maduración pulmonar completa en la amenaza de parto prematuro.
MedidasSe registraron los datos clínicos y las morbilidades asociadas en todos los pacientes hasta el alta de la unidad. En todos los pacientes se realizaron ecografías cerebrales a las 3-6h, 3, 7 y 28 días de vida y al alta, según el protocolo vigente en la unidad. La variable resultado principal del estudio fue la presencia combinada de HIV grave (gradoiii-iv de Papile) o muerte al tratarse de eventos competitivos entre sí.
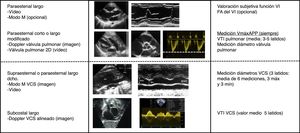
Metodología de la medición del flujo sistémicoEl flujo sistémico se midió de acuerdo a las recomendaciones publicadas31. Para la medición de la VmáxAPP se utilizó un corte paraesternal eje corto o paraesternal eje largo. Se obtuvo un Doppler pulsado a nivel de la válvula pulmonar. Se midió la velocidad máxima (metros/segundo) como la media de 3-5latidos (fig. 2). Para el cálculo del flujo pulmonar se midió la integral velocidad-tiempo (VTI) de 3-5latidos mediante el trazo del contorno de la onda Doppler. Se calculó el flujo pulmonar a partir de la medición del diámetro del anillo pulmonar en sístole mediante la fórmula (D/2)2 ×VTIm ×Pi ×FC/peso, donde D es el diámetro valvular, VTIm es la media de VTI de 3-5latidos y FC es la frecuencia cardiaca. El resultado se expresa ml/kg/min. La medición del fVCS se obtuvo en base a los mismos principios. La medición del diámetro de la vena cava se obtuvo del modo M en plano supraesternal modificado o paraesternal modificado. Debido a la importante variación respiratoria en el diámetro de la vena cava superior (VCS) se obtuvo la media de 3 medidas máximas y 3 medidas mínimas para el cálculo del flujo. El VTI de la onda Doppler de VCS se obtuvo desde un plano subcostal haciendo una media de 5 latidos (fig. 2).
Protocolo de ecocardiografía funcional durante el periodo de estudio. Se indican las ventanas ecocardiográficas y los parámetros a registrar en cada una de ellas.
FA: fracción de acortamiento; VCS: vena cava superior; VTI: integral de la velocidad-tiempo de la curva Doppler; 2D: dos dimensiones.
Los datos cuantitativos se resumen en mediana (rango intercuartil) y media (desviación estándar) y los datos categóricos como número (porcentaje). Se utilizaron test no paramétricos (U de Mann-Whitney, McNemar, Wilcoxon), χ cuadrado, test de Fisher y t de Student según resultase apropiado. Se utilizó regresión logística multivariante para estudiar la asociación entre el protocolo y el desarrollo de HIVIII-IV y/o muerte (tabla 1). Debido al riesgo de sobreajuste en la regresión logística, se realizó un análisis de sensibilidad utilizando ponderación por la probabilidad inversa de tratamiento basada en las puntuaciones de propensión (propensity scores). Para la estimación de la puntuación de propensión se incluyeron las covariables con una posible influencia en el desarrollo de HIV (EG, peso, sexo, CRIB 12 horas, coriamnionitis, corticoides antenatales, vía del parto, Apgar a los 5min, hipotensión arterial, score inotrópico, transfusión, días de ventilación mecánica, ductus hemodinámicamente significativo y sepsis).32 El balance de covariables entre los grupos se analizó mediante el cálculo de las diferencias estandarizadas, considerando un balance adecuado una diferencia estandarizada menor al 10%33. El efecto de la intervención se analizó por el método de ecuaciones de estimación generalizada (generalized estimating equations).
Características y evolución clínica de los pacientes
| Pre-protocolo (n=54) | Post-protocolo (n=29) | p | |
|---|---|---|---|
| Características clínicas | |||
| Sexo (varón) | 35/54 (64,8%) | 19/29 (65,5%) | 0,949 |
| Edad gestacional (semanas) | 27,6 (26,2-29,2) | 27,4 (26,3-29,1) | 0,583 |
| Peso nacimiento (gramos) | 990 (800-1.185) | 985 (745-1.175) | 0,886 |
| Gemelar | 12/54 (22,2%) | 9/29 (31%) | 0,379 |
| Apgar 5min | 8 (7-9) | 8 (6-9) | 0,465 |
| Sulfato de magnesio | 5/52 (9,6%) | 15/29 (51,7%) | 0,000 |
| Preeclampsia | 10/54 (18,5%) | 2/29 (6,8%) | 0,151 |
| Fecundación in vitro | 4/54 (7,4%) | 7/29 (24,1%) | 0,032 |
| Corioamnionitis materna | 9/54 (16,6%) | 4/29 (13,7%) | 0,731 |
| Corticoides antenatales | |||
| No | 6/54 (11,1%) | 2/29 (6,8%) | |
| Incompleto | 15/54 (27,7%) | 4/29 (13,7%) | 0,236 |
| Completo | 33/54 (61%) | 23/29 (79,3%) | |
| Cesárea | 38/54 (70,3%) | 17/29 (58,6%) | 0,280 |
| SDR | 38/54 (70,3%) | 22/29 (75,8%) | 0,584 |
| Número de dosis surfactante | 2 (1-3) | 1 (1-2) | 0,078 |
| Días de intubación | 2,2 (0-9) | 3 (0-8) | 0,950 |
| CRIB 12 h | 2 (1-4,2) | 4 (1-7) | 0,232 |
| Transfusión | 39/54 (72,2%) | 16/29 (55%) | 0,117 |
| Número transfusiones | 1 (1-2) | 2 (1,2-2,7) | 0,021 |
| Sepsis precoz | 4/54 (7,4%) | 2/29 (6,8%) | 0,932 |
| Hipotensión precoz (< 5 días) | 10/54 (18,5%) | 7/29 (24%) | 0,574 |
| Score inotrópico | 190 (65-296) | 180 (100-220) | 0,962 |
| Hidrocortisona | 8/54 (14,8%) | 3/29 (10,3%) | 0,546 |
| Sepsis tardíaa | 16/54 (29,6%) | 11/28 (39,2%) | 0,478 |
| DAP-Hs (tratamiento) | 23/54 (42,5%) | 10/29 (34,4%) | 0,472 |
| Enterocolitis | 7/47 (14,8%) | 1/26 (3,8%) | 0,245 |
| Retinopatía | 5/45 (11%) | 1/26 (3,8%) | 0,404 |
| DBP mod-grave | 12/45 (26,6%) | 8/26 (30,7%) | 0,711 |
| Variables resultado | |||
| HIV cualquier grado | 21/53 (39,6%) | 8/29 (27,5%) | 0,157 |
| HIV III-IV | 11/53 (20,7%) | 3/29 (10,3) | 0,100 |
| Muerte | 10/54 (18,5%) | 3/29 (10,3%) | 0,360 |
| HIV III-IV y/o muerte | 17/54 (31,5%) | 3/29 (10,3%) | 0,032 |
El score inotrópico se calcula como: 10 × dopamina+ 10 × dobutamina + 100 × adrenalina + 100 noradrenalina y se refiere al valor máximo durante los primeros 5 días de vida en los pacientes que recibieron soporte con drogas vasoactivas.
Se evaluó la correlación lineal entre la VmáxAPP y el fVCS mediante el coeficiente de Pearson. Antes del estudio, se evaluó la concordancia interobservador (coeficiente de correlación intraclase) entre los ecocardiografistas participantes para la medición de la VmáxAPP en 25 estudios en 15 neonatos (EG 27-32semanas) no incluidos en la fase del protocolo.
ÉticaEl protocolo de estudio fue aprobado por el Comité de Ética e Investigación Clínica de referencia. Se obtuvo consentimiento informado de los pacientes incluidos en la de intervención (aplicación del protocolo). Los controles fueron retrospectivos, por lo que el Comité de Ética e Investigación Clínica eximió de la necesidad de consentimiento informado.
ResultadosDurante estos primeros 18 meses tras la instauración del protocolo, este se aplicó a 30 pacientes que se parearon con 60 controles. Un caso y 6 controles fueron excluidos por diversas razonas: 3 pacientes (1 caso y 2 controles) se excluyeron de forma prospectiva al haberse diagnosticado de HIV en las primeras 6h de vida, mientras que 4 controles se excluyeron por falta de datos clínicos. Por tanto, completaron el análisis 29 casos y 54 controles.
La EG y el peso en la cohorte completa fueron 27,5 (26,2-29,1) y 990gramos (800-1.180), respectivamente. Las características de los pacientes se comparan en la tabla 1. No hubo diferencias significativas entre los grupos en la mayoría de las variables estudiadas salvo en la administración de sulfato de magnesio prenatal, en la proporción de embarazos por fecundación in vitro y en el número de transfusiones recibidas.
Durante el periodo de aplicación del protocolo ocurrieron 3/29 (10,2%) HIV graves o muerte en comparación con 17/54 (31,5%) en la fase previa (p=0,032). Hubo una tendencia a la reducción en las HIV graves (3/29 [10,3%] vs 11/53 [20,7%], p=0,100) sin diferencias significativas en el global de HIV de cualquier grado. Fallecieron 13 pacientes (3 en la fase del protocolo y 10 en la fase previa). En 3 pacientes (2 casos y 1 control) la causa del fallecimiento fue la adecuación del esfuerzo terapéutico por HIV grave.
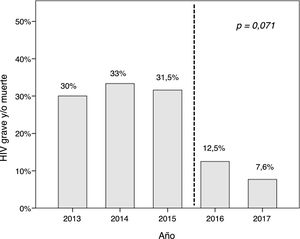
Hubo una tendencia lineal a la reducción de la HIV grave y/o muerte coincidiendo con el inicio del protocolo (p=0,071) (fig. 3). No se observó esta tendencia en la incidencia de retinopatía, ductus hemodinámicamente significativo, displasia broncopulmonar moderada-grave y sepsis nosocomial, aunque sí en la incidencia de enterocolitis (p=0,093).
En la regresión logística multivariante el protocolo se asoció a una reducción significativa de la HIV grave y/o muerte (OR: 0,11 [IC95%: 0,01-0,65], p=0,015) tras ajuste por factores de confusión (tabla 2). En el análisis de ponderación por la probabilidad inversa de tratamiento se generó una muestra con un balance adecuado de todas las covariables introducidas (rango de las diferencias estandarizadas: −8,6% a +8%). En la muestra ponderada el protocolo de BFS se asoció a una reducción de la HIV grave y/o muerte (OR: 0,23 [IC95%: 0,09-0,56]; p=0,001).
Modelo de regresión logística multivariante (variable dependiente: HIV grave y/o muerte)
| Análisis univariante | Análisis multivariante (modelo final) | ||||
|---|---|---|---|---|---|
| Predictores | OR (IC 95%) | p | Predictores | OR (IC 95%) | p |
| Protocolo BFS | 0,25 (0,06-0,94) | 0,041 | Protocolo BFS | 0,11 (0,01-0,65) | 0,015 |
| Peso nacimiento (z) | 0,39 (0,19-0,76 | 0,006 | Peso nacimiento (z) | 0,19 (0,04-0,70) | 0,022 |
| Peso nacimiento (kg) | 0,034 (0,00-0,38) | Peso nacimiento (kg) | 0,03 (0,0-0,43) | ||
| EG (z) | 0,48 (0,27-0,86) | Corioamnionitis | |||
| EG (semanas) | 0,65 (0,46-0,91) | 0,014 | 9,48 (1,39-64,5) | 0,021 | |
| Corioamnionitis | 3,42 (0,99-11,8) | 0,051 | SDR | 16,5 (1,42-188) | 0,024 |
| CRIB 12 h (z) | 1,75 (1,06-2,87) | 0,026 | Hipotensión arterial | 6 (1,06-33,7) | 0,042 |
| SDR | 10,19 (1,27-81,2) | 0,028 | |||
| Número dosis surfactante | 2,54 (1,43-4,51) | 0,001 | |||
| Hipotensión arterial | 4,36 (1,37-13,81) | 0,012 | |||
| Score inotrópico (z) | 3,1 (1,64-5,8) | < 0,001 | |||
| Transfusión | 3,72 (0,98-14,05) | 0,052 | |||
Variables consideradas en el análisis univariante: grupo de estudio (Protocolo BFS), EG, peso al nacimiento, sexo, FIV, parto gemelar, corticoides antenatales, vía del parto, corioamnionitis materna, sulfato de magnesio prenatal, preeclampsia materna, Apgar 5min, CRIB 12h, días de ventilación mecánica, SDR, dosis de surfactante, hipotensión arterial (<7días de vida), score inotrópico (<7días), DAP-hemodinámicamente significativo, transfusión, número de transfusiones, sepsis precoz. Las variables con una p<0,1 en el análisis univariante se consideraron para la regresión multivariante. Otras variables con potencial relación con la HIV grave (DAP-Hs, sulfato de magnesio prenatal, corticoides prenatales, modo del parto, fecundación in vitro) se forzaron en el modelo de forma individual. Los pares de variables peso-EG, la hipotensión-score inotrópico y SDR-dosis de surfactante se introdujeron de forma separada en los modelos dada su estrecha relación para evitar colinealidad. Las variables continuas se normalizaron usando z scores (z) para facilitar la interpretación de la OR. En el modelo final solo se incluyen las variables que permanecieron estadísticamente significativas.
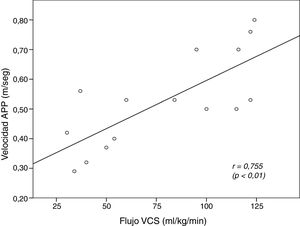
El coeficiente de correlación intraclase entre los ecografistas para la medición de la VmáxAPP fue 0,992 (IC95%: 0,988-0,996, p<0,001). Durante la aplicación del protocolo se evalúo el flujo sistémico mediante la VmáxAPP en todos los pacientes y en 15 y 9 casos se evaluó además el fVCS y el fAPP, respectivamente. La figura 4 muestra la correlación lineal entre la VmáxAPP y el fVCS.
En la fase post-protocolo, 10/29 (34,5%) niños fueron diagnosticados de BFS a una mediana de 4h de vida (rango: 2-10) y tratados con DB a una dosis inicial de 6 (5-10) μg/kg/min (tabla 3). Estos pacientes no difirieron en EG, peso al nacimiento, Apgar a los 5min, desarrollo de síndrome de distrés respiratorio (SDR) o días de ventilación mecánica respecto a los que no recibieron DB; en cambio, presentaron una puntuación CRIB a las 12h significativamente mayor (7 [4-9,2] vs 1 [1-5], p=0,03). Tras el inicio de la DB se produjo un aumento significativo del flujo sistémico (VmáxAPP pre-DB 0,40m/s [0,32-0,42] vs post-DB 0,60m/s [0,53-0,60], p=0,018]. Ningún paciente tratado con DB tuvo una HIV grave o falleció. Por el contrario, 3 pacientes en el grupo no tratado con DB tuvo una HIV grave. La VmáxAPP en estos pacientes osciló entre 0,47 y 0,53m/s comparado con una mediana 0,60m/s (rango: 0,52-0,80) en los que no sangraron. En los pacientes no tratados con DB solo se evaluó la evolución del flujo sistémico por ecocardiografía funcional en 10 pacientes (dato no disponible en los 3 pacientes con HIV grave).
Valores de la ecocardiografía funcional en los pacientes del grupo de protocolo
| 1.a ecografía funcional | Dobutamina (n=10) | No dobutamina (n=19) | p |
|---|---|---|---|
| VmáxAPP (m/s) | 0,39 (0,07) 0,40 (0,32-0,43) | 0,59 (0,11) 0,53 (0,51-0,70) | < 0,001 |
| Flujo VCS (ml/kg/min) | 40,8 (9,2) 38,5 (33-51) | 104,2 (21,6) 115 (89-122) | < 0,001 |
| Flujo pulmonar (ml/kg/min) | 209 (162) 148 (124-324) | 298 (36) 309 (260-326) | 0,190 |
| 2.a ecografía funcional | Dobutamina (n=10) | No dobutamina (n=10) | p |
| VmáxAPP (m/s) | 0,57 (0,04) 0,60 (0,53-0,60)* | 0,65 (0,01) 0,69 (0,61-0,72)** | 0,267 |
| Flujo VCS (ml/kg/min) | 81 (22) 81 (65-100) | 107 (41) 107 (78-119) | 0,429 |
| Flujo pulmonar (ml/kg/min) | 297 (95) 260 (217-395) | 345 (156) 345 (235-401) | 0,857 |
Los datos de la ecocardiografía siguen una distribución normal y se facilitan como media (DE) y mediana (RIQ). Las comparaciones entre grupos se realizaron con el test U de Mann-Whitney.
En este estudio hemos evaluado los resultados durante los primeros 18meses de la aplicación de un protocolo de cribado del BFS con ecocardiografía funcional y tratamiento selectivo con DB. Hemos observado una reducción en la ocurrencia de HIV grave y/o muerte sin haber detectado efectos adversos.
El patrón de referencia en el diagnóstico del BFS es la medición del flujo en vena cava superior por ecocardiografía4,34,35. Sin embargo esta medición es técnicamente compleja, por lo que puede ser difícil de implementar en la práctica clínica. La principal fuente de errores está en la medición del diámetro de la vena cava, ya que este valor debe elevarse al cuadrado para obtener el flujo y algunos autores han puesto en duda la validez de este método para la toma de decisiones clínicas31,35-38. Como alternativa, se ha propuesto estimar el flujo sistémico mediante la VmáxAPP. La VmáxAPP es proporcional al gasto pulmonar y se relaciona de forma estrecha con el flujo sistémico durante los primeros días de vida cuando el cortocircuito por el foramen oval es escaso. Es mucho más fácil de obtener que el fVCS, y no precisa realizar cálculos o medir dimensiones que están sujetas a error. Una velocidad inferior a 0,35m/s se corresponde a una situación de bajo flujo en la mayoría de los pacientes, y por debajo de 0,45m/s más de la mitad de los pacientes están en riesgo39.
Pese a la evidencia acumulada de que el BFS se asocia con el daño neurológico y la mortalidad, la prevención y el tratamiento mediante el uso de inotrópicos es controvertida. En 2007 Osborn et al.13 mostraron que el tratamiento con DB es más eficaz para aumentar el flujo sistémico y puede reducir la incidencia de HIV en comparación con la dopamina, mientras que en otro ensayo clínico la milrinona no incrementó eficazmente el flujo sistémico21. Sin embargo, no se ha demostrado una mejoría del pronóstico neurológico a largo plazo con el uso de inotrópicos. Lamentablemente, ningún estudio se ha diseñado con la suficiente potencia como para detectar diferencias en morbimortalidad20. En 2015 Bravo et al.40 realizaron un ensayo clínico exploratorio en el que se asignó a prematuros con BFS (fVCS <41ml/kg/min) a DB (n=16) frente a placebo (n=12). También se incluyó un grupo de 98 prematuros con fVCS normal. Se observó que el BFS se asoció a mayor mortalidad y lesiones isquémicas cerebrales. Hubo un 12% de HIV en el grupo de DB comparado con un 33% en el grupo de placebo. Aunque las diferencias no fueron significativas debido a la falta de potencia estadística, los datos son muy similares a los observados en nuestro estudio. Pensamos que es plausible que un estudio más amplio pueda mostrar diferencias significativas en este importante evento clínico.
Nuestros resultados han sido positivos pero deben ser interpretados en el contexto de las limitaciones de nuestro estudio. En primer lugar se trata de un estudio en un solo centro con controles retrospectivos. Es imposible asegurar que la reducción en la incidencia de HIV grave sea debida únicamente al protocolo de tratamiento del BFS. Otras mejoras en la práctica clínica durante el estudio, así como una mayor atención o cuidado a los pacientes objeto de la intervención (efecto Hawthorne), han podido influir en los resultados. Hemos tratado de minimizar estos sesgos inherentes al diseño seleccionando controles pareados y mediante la evaluación de posibles factores de confusión. No hemos observado diferencias significativas en la mayoría de las características clínicas basales ni en morbilidades entre los grupos, lo cual sugiere que ambas cohortes son comparables. La ocurrencia de otras morbilidades, que podrían indicar una mejora general en los cuidados, no disminuyó durante el periodo de estudio, mientras que sí se observó una tendencia a la reducción de la HIV coincidente con el inicio del protocolo. Finalmente, los modelos de regresión multivariante y ponderación por la probabilidad inversa de tratamiento mostraron una asociación independiente entre el protocolo y la reducción de HIV grave y/o muerte tras el ajuste por factores de confusión.
El diagnóstico de BFS e indicación de DB se basó fundamentalmente en la medición de la VmáxAPP. No existen estudios de validación con el fVCS, considerado el patrón oro para el diagnóstico. No obstante, nosotros hemos observado una buena correlación lineal entre la VmáxAPP y el fVCS, que debe ser confirmada en estudios específicos, además de una excelente concordancia interobservador. Nuestro protocolo no incluyó una monitorización evolutiva del flujo en los pacientes no tratados con DB. De hecho, los tres eventos de HIV se produjeron en el grupo que no recibió DB. Estos niños tenían unos valores iniciales de VmáxAPP entre 0,47 y 0,53m/s, solo discretamente por encima de nuestro punto de corte para la indicación de DB. Nos queda la duda de si estos pacientes pudieron experimentar BFS de forma inadvertida. Por ello, consideramos muy importante la monitorización evolutiva con ecocardiografía funcional, especialmente cuando los valores iniciales se encuentran en valores límite.
Son necesarios estudios prospectivos multicéntricos, idealmente ensayos clínicos con suficiente potencia como para determinar si intervenciones sobre el BFS como la administración de inotrópicos tienen un impacto positivo en la prevención de la HIV y en la evolución neurológica a largo plazo.
ConclusionesEn este estudio con controles retrospectivos, la aplicación de un protocolo de detección del BFS y tratamiento selectivo con DB en el periodo transicional se asoció a una reducción en la incidencia de HIV grave y/o muerte en prematuros menores de 30semanas. Debido al diseño del estudio no es posible descartar que otros factores hayan influido en la mejora observada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa en el XXVI Congreso de Neonatología y Medicina Perinatal, Zaragoza, 27-29 de septiembre de 2017.