Los tumores miofibroblásticos inflamatorios (TMI) son tumores de los tejidos blandos infrecuentes en pediatría. Su diagnóstico histológico es arduo. La mitad de los TMI, aproximadamente, son positivos para la quinasa del linfoma anaplásico (ALK) en el estudio inmunohistoquímico. El pronóstico suele ser favorable, aunque la Organización Mundial de la Salud le asigna una malignidad intermedia (probabilidad de diseminación de 7% y de recurrencia de 15%)1. Históricamente, la resección quirúrgica ha sido la única opción terapéutica, habiéndose documentado una baja eficiencia de los abordajes tradicionales de quimioterapia y radioterapia. Por este motivo, el desarrollo del tratamiento dirigido con inhibidores de ALK, como el crizotinib, parece prometedor1–5. No obstante, la duración óptima del tratamiento no está bien establecida, y suele ser prolongada si la respuesta del paciente se mantiene y no hay efectos adversos significativos. De hecho, su duración media es de unos dos años, algo que la comunidad científica debe replantearse dados sus efectos secundarios (emesis, diarrea, neutropenia, trastornos de visión, neuropatía), su alto coste y el riesgo de desarrollar resistencia.
Presentamos el caso de una niña de seis años con antecedente de dolor abdominal, fatiga, pirexia y pérdida de peso de dos meses de duración. Se encontró una masa en la resonancia magnética (RM). La masa se encontraba en el lado derecho dentro del mesenterio del intestino delgado, medía 6 x 4 x 6 cm, visualizándose con señal homogénea, difusión restringida y realce tras la administración de gadolinio. Parecía obstaculizar el drenaje venoso del ciego y el íleon terminal, ya que había vasos dilatados alrededor del ciego y la flexura cólica derecha. No se observó linfadenopatía u otras alteraciones. La morfología era la de un tumor de células fusiformes de bajo grado. La inmunohistoquímica fue positiva para SMA, CD117 (citoplásmica), ALK (citoplásmica), desmina (irregular), MNF116 (irregular) y vimentina. Expresión preservada de INI-1.
Los resultados eran sugestivos de TMILa cirugía, que por lo general es el tratamiento de elección para los TMI localizados, podía dar lugar a síndrome de intestino corto, haciendo que la paciente dependiese de la nutrición parenteral de por vida, por lo que se exploraron tratamientos alternativos. Teniendo en consideración los resultados prometedores de la terapia dirigida en comparación con los regímenes de quimioterapia convencional, se inició tratamiento con crizotinib (200 mg/día) en espera de los resultados de las pruebas moleculares.
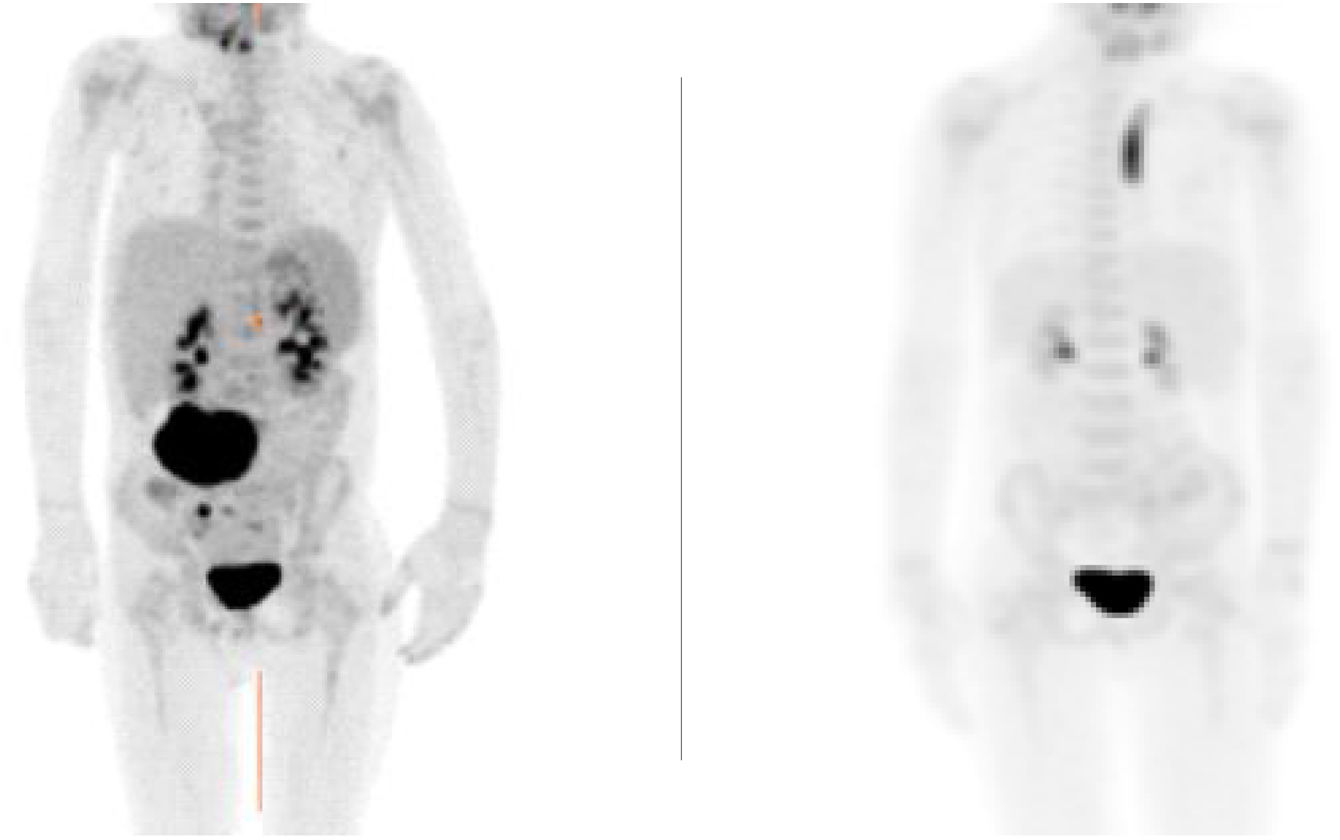
La paciente reportó mejoría progresiva de los síntomas. La resonancia magnética (RM) y la tomografía por emisión de positrones (PET-TC) evidenciaron una lesión residual pequeña al mes de tratamiento y resolución completa de la lesión a los cuatro meses (fig. 1).
A los cinco meses de tratamiento, los cuidadores reportaron un patrón de movimiento anormal al correr y la paciente empezó a sentir dolor intermitente, localizado y unilateral en la pierna. Se realizó una RM del abdomen y pelvis en la que no hubo indicios de recurrencia tumoral, pero sí una señal alterada en la región superior de los fémures. La analítica descartó la presencia de inflamación o infección. La neuropatía se ha identificado previamente como un efecto secundario común (25%), y también se ha descrito una disminución en la formación ósea (infrecuente). Los síntomas no mejoraron, y se atribuyeron al crizotinib. Un mes después se suspendió el tratamiento (duración total del tratamiento de seis meses). La alteración de la marcha y el dolor articular se resolvieron con la retirada del crizotinib. Se mantuvo un seguimiento estrecho de la paciente. Actualmente, cuatro años después de terminar el tratamiento, no hay indicio alguno de recurrencia, y la paciente no ha requerido ningún tratamiento adicional.
La secuenciación del genoma completo llevó a la detección de una translocación de ALK y PTRH2/CLTC: t(2;17) (p23.2;q23.1).
La revisión bibliográfica nos permitió apreciar el importante papel que desempeña la biología molecular en pacientes pediátricos con TMI. En primer lugar, facilita el diagnóstico, que suele ser inicialmente erróneo en hasta 20% de los casos. Pire et al. utilizaron la hibridación in situ fluorescente (FISH) o secuenciación de ARN para detectar fusiones específicas de ALK, ROS1 o NTRK. Estas técnicas detectaron reordenamientos en el gen de la tirosina quinasa en hasta 86% de los pacientes con TMI, mientras que históricamente se han reportado variantes de ALK en aproximadamente 50% de los pacientes2.
En cuanto al pronóstico, publicaciones recientes proponen que entre los TMI-ALK+ podría haber algunos subtipos con pronóstico desfavorable dependiendo de los reordenamientos genéticos detectados. Por ejemplo, los tumores con fusión de RANBP2-ALK por reordenamiento no responderían adecuadamente al crizotinib y podrían requerir tratamiento con inhibidores de ALK de segunda generación3.
En cuanto a su manejo, estudios recientes han concluido que el tratamiento quirúrgico agresivo no se asocia a un pronóstico más favorable1. El tratamiento de primera línea en casos inoperables es objeto de debate. Algunos pacientes han respondido a la quimioterapia a bajas dosis, pero no se ha establecido un régimen de quimioterapia estándar y sus efectos secundarios se han documentado extensamente. Por añadidura, el Grupo Europeo de Estudio de Sarcoma de Tejidos Blandos y el Grupo de Oncología Pediátrica publicaron recientemente resultados prometedores del tratamiento dirigido con inhibidores de ALK4,5.
Tras el caso de nuestra paciente, que solo recibió tratamiento durante seis meses con una respuesta excelente, y teniendo en consideración los efectos adversos de los inhibidores de ALK4,5, ponemos en cuestión la necesidad de continuar el tratamiento una vez alcanzada la remisión, independientemente del tiempo que tarde en obtenerse. En este sentido, cabe asimismo resaltar la eficacia a largo plazo de estos tratamientos. Nuestra paciente lleva cuatro años sin tratamiento, sin indicio alguno de recurrencia. En consecuencia, parece evidente que urge realizar estudios prospectivos en cohortes grandes con objeto de determinar el abordaje más seguro para el tratamiento de estos pacientes. Ensayos futuros deberán establecer la duración del tratamiento y la seguridad de su interrupción tras alcanzar la respuesta completa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.