Introducción
El ductus arterioso es una estructura fetal que comunica la arteria pulmonar con la aorta y que tras el nacimiento habitualmente se cierra. Sin embargo, en determinadas ocasiones, sobre todo en los recién nacidos prematuros con patología respiratoria, permanece abierto; es a lo que se denomina ductus arterioso persistente (DAP), y se puede producir a través de él un cortocircuito de izquierda a derecha significativo que incrementa el riesgo de hemorragia intraventricular (HIV), enterocolitis necrotizante (ECN) y displasia broncopulmonar (DBP) en este grupo de pacientes. Por todo ello está indicado intentar el cierre del DAP. El fármaco utilizado tradicionalmente para su cierre ha sido la indometacina; sin embargo, su administración se ha asociado a complicaciones debidas a la disminución en la perfusión cerebral, renal y mesentérica1-7 que provoca. Estos efectos secundarios han motivado la búsqueda de un fármaco alternativo para cerrar el DAP. Recientemente se ha desarrollado para administrar por vía intravenosa otro inhibidor de la ciclooxigenasa, el ibuprofeno, que ha demostrado ser también eficaz y podría tener menores efectos hemodinámicos8-13. Múltiples ensayos clínicos han sido publicados comparando la eficacia y la seguridad de ambos fármacos. El objetivo del presente trabajo es realizar una revisión de la literatura disponible y elaborar un metaanálisis para determinar si existe alguna ventaja del uso de ibuprofeno frente a indometacina en el cierre del DAP del prematuro.
Material y métodos
Se han identificado ensayos controlados aleatorios que compararan ibuprofeno con indometacina para el tratamiento del DAP en prematuros mediante la búsqueda sistemática en el registro Cochrane de Ensayos Controlados (2006), MEDLINE (1995-2006), EMBASE (1980-2006) y resúmenes publicados en Pediatric Research (1991-2006). No se practicó ninguna restricción de idioma. Los términos utilizados para la búsqueda fueron "patent ductus arteriosus"[Text Word] OR "ductus arteriosus, patent"[MeSH Terms] OR "ductus arteriosus, patent"[Text Word]) AND ("indomethacin"[MeSH Terms] OR "indomethacin"[Text Word]) AND ("ibuprofen"[MeSH Terms] OR "ibuprofen"[Text Word].
Los estudios fueron revisados siguiendo los siguientes criterios de inclusión:
1.Diseño: ensayos prospectivos, controlados y aleatorios.
2.Población: prematuros por debajo de las 35 semanas de edad gestacional (EG) o neonatos de muy bajo peso al nacimiento (PN) (< 1.500 g), con DAP hemodinámicamente significativo confirmado mediante ecocardiografía.
3.Intervención: administración de ibuprofeno intravenoso comparado con indometacina intravenosa como tratamiento del DAP.
4.Resultados incluidos (al menos uno de los siguientes): cierre del DAP, mortalidad, necesidad de ligadura quirúrgica, tasa de reaperturas, hemorragia intraventricular (HIV) distintos grados según la clasificación clásica de Papile, leucomalacia periventricular (LPV), enterocolitis necrotizante (ECN) diagnosticada ante la presencia de hallazgos clínicos y radiológicos compatibles, hemorragia gastrointestinal, displasia broncopulmonar (DBP) definida como necesidad de oxígeno suplementario a los 28 días de vida o a las 36 semanas de edad posconcepcional, días de oxígeno suplementario, oliguria (diuresis < 1 cc/kg/h), sepsis, retinopatía de la prematuridad (ROP) o días necesarios para alcanzar nutrición enteral completa.
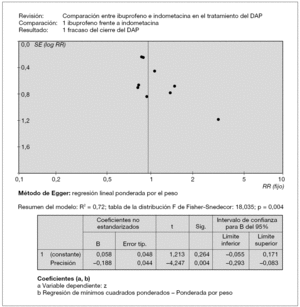
La calidad metodológica de los estudios elegibles se evaluó de acuerdo con el enmascaramiento de la asignación aleatoria, de la intervención y de la evaluación de los resultados; también se tuvo en cuenta si el seguimiento fue completo. Para los análisis se utilizó el programa Revman 4.2 de la Biblioteca Cochrane. Se incluyeron el riesgo relativo (RR), la diferencia de riesgo (DR), el número necesario que tratar (NNT) o para dañar (NND) y la diferencia de medias ponderada (DMP), todos con intervalos de confianza (IC) del 95 %. Se realizaron pruebas de heterogeneidad, incluido el I2, para evaluar si el agrupamiento de los datos era adecuado. Cuando la heterogeneidad no fue estadísticamente significativa (p > 0,1) se utilizó para los metaanálisis un modelo de efectos fijos; en caso contrario, se realizó el análisis con un modelo de efectos aleatorios. El sesgo de publicación se analizó con el funnel-plot y el método de regresión de Egger: un análisis de regresión lineal simple entre el valor z de cada estudio (cociente entre el lnRR y su error estándar) como variable independiente, frente a la precisión de cada estudio, el inverso del error estándar, ponderado por el inverso de la varianza. Si la significación de la constante del modelo no era significativa, se excluía sesgo de publicación. Este método es una medida de la asimetría de la representación en embudo.
Resultados
Descripción de los estudios
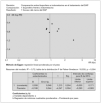
Tras realizar la búsqueda sistemática se encontraron 51 citas, de las cuales 18 eran ensayos clínicos aleatorizados. Dos estudios, no identificados a través de la búsqueda en las bases de datos, fueron recuperados desde las listas de referencias bibliográficas y los resúmenes publicados en Pediatric Research. Se analizaron finalmente 20 citas de acuerdo con los criterios de inclusión. Nueve estudios fueron excluidos por no cumplir dichos criterios: 1. no coincidían las características de la población sobre la que se realizaba el estudio; 2. se analizaban otros resultados diferentes y no los previstos en nuestros criterios de inclusión, y 3. la intervención que se realizaba era diferente (administración del fármaco de forma profiláctica y no como tratamiento). En la figura 1 se representa el gráfico "de embudo" (funnel-plot) para valorar la presencia de un posible sesgo de publicación, el sesgo de selección más importante de un metaanálisis. La figura no es simétrica, pero la causa no parece ser el sesgo de publicación, sino el pequeño número de estudios que forman la nube de puntos. Para comprobarlo, se utilizó el método de Egger: la ordenada en el origen (0,058) no es significativa (IC 95 % incluye el cero), lo cual sugiere ausencia de sesgo de publicación.
Figura 1. Gráfica de embudo para evaluar el sesgo de publicación.
Calidad metodológica
La media de puntuación en calidad metodológica de los ensayos incluidos, utilizando la escala de Jadad14, fue de 2,1 de un máximo de puntuación de 5, y se consideraba de alta calidad cuando la valoración fue superior a 2 (36,3 % de los estudios). Todos los ensayos fueron controlados aleatoriamente, pero no siempre estuvo claro si se ocultó la asignación aleatoria. En todos los estudios los pacientes desconocían el fármaco administrado por las propias características de la población. Sólo en un ensayo los investigadores también desconocían la intervención realizada al administrarse una inyección adicional (fármaco activo o placebo) en los mismos puntos temporales; en la mayoría de estudios no siempre coincidió el momento de administración de las dosis de ibuprofeno y de indometacina, por lo que se supone que los cuidadores estaban al tanto de la asignación a los grupos; en otros, aunque el intervalo de dosificación coincidía, no se especifica en el ensayo si la intervención estaba enmascarada o no. En algunos estudios, los encargados de evaluar el cierre del DAP (el ecografista) desconocían cuál había sido el tratamiento recibido (información recogida de los datos publicados o directamente de los autores).
Descripción de los ensayos
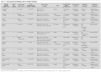
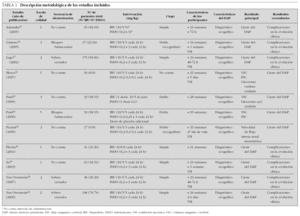
Los 11 ensayos10-13,15-21 (tabla 1) fueron llevados a cabo entre los años 1995 y 2005, en un único centro o en varios (máximo cinco centros), todos europeos excepto un ensayo realizado en Taiwán19. El número de pacientes reclutado en cada ensayo fue muy variable pero, en general las muestras fueron pequeñas. En todos los casos el diagnóstico del DAP se confirmó mediante ecocardiografía y, en la mayoría, los pacientes precisaban soporte ventilatorio en el momento de la intervención. La administración de los fármacos se realizó generalmente en las primeras 96 h de vida, y las pautas de dosificación fueron similares entre los distintos ensayos. En algunos trabajos, si el DAP permanecía abierto tras esta primera tanda de tratamiento, seguía siendo significativo y no existían contraindicaciones, se administraba una segunda tanda del mismo fármaco16-18 o de indometacina como rescate20,21. El objetivo principal de la mayoría de los estudios fue evaluar la tasa de cierre ductal tras el tratamiento farmacológico recibido, excepto cuatro estudios10-13 que valoraron principalmente los efectos hemodinámicos de las dos intervenciones e informaron secundariamente del cierre del DAP. Otros resultados evaluados de forma secundaria fueron la mortalidad, la necesidad de ligadura quirúrgica, la tasa de reapertura tras el tratamiento farmacológico, las complicaciones y la evolución clínica (tabla 2).
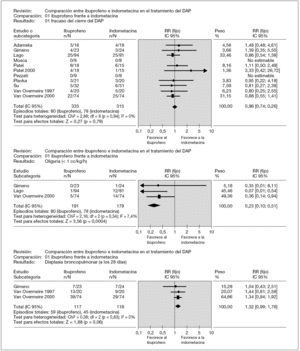
Medida de resultado primaria (fig. 2)
Figura 2. Análisis de los resultados.
Las tasas de cierre del DAP se dieron a conocer después de una o tres dosis de ibuprofeno o indometacina en la mayoría de los estudios y éste es el resultado principal publicado en esta revisión sistemática.
Fracaso del cierre del DAP después de una o tres dosis de ibuprofeno o indometacina
Todos los estudios10-13,15-21 (n = 648) informaron este resultado. Ninguno encontró diferencias estadísticamente significativas en el fracaso del cierre del DAP ni el metaanálisis tampoco (RR típico: 0,96 [IC 95 %: de 0,74 a 1,26]).
Medidas de resultado secundarias
Mortalidad por todas las causas durante la estancia hospitalaria inicial
Cuatro estudios16,17,19,20 (n = 325) informaron de la mortalidad ocurrida en un momento no especificado durante la estancia hospitalaria y, al igual que el metaanálisis, ninguno encontró diferencias estadísticamente significativas (RR fijo: 0,86 [IC 95 %: de 0,44 a 1,69]).
Mortalidad neonatal (primeros 28-30 días de vida)
Un solo estudio21 (n = 148) dio este resultado y no hubo diferencias estadísticamente significativas entre los grupos (RR: 1,17 [IC 95 %: de 0,41 a 3,31].
Reapertura del DAP
Se informó de él en ocho estudios10,12,13,16,18-21 (n = 405). Ninguno encontró diferencias estadísticamente significativas entre los grupos; el metaanálisis, tampoco (RR fijo: 1,17 [IC 95 %: de 0,51 a 2,70]).
Necesidad de cierre quirúrgico del DAP
Se informó sobre él en ocho estudios10,12,16-21 (n = 563). Ninguno encontró diferencias estadísticamente significativas; el metaanálisis, tampoco (RR típico: 1,06 [IC 95 %: de 0,67 a 1,68]).
HIV (grados I a IV)
Tres estudios informaron este resultado19-21 (n = 251). Ninguno encontró diferencias estadísticamente significativas en la incidencia de HIV; el metaanálisis, tampoco (RR fijo: 0,68 [IC 95 %: de 0,33 a 1,41]).
HIV grave (grados III y IV)
Apareció en tres estudios16,17,19 (n = 285). No hubo diferencias estadísticamente significativas entre los grupos, como en el metaanálisis (RR: 1,17 [IC 95 %: de 0,53 a 2,57]).
LPV
Tres estudios informaron sobre este resultado17,19,21 (n = 386). Ninguno de ellos encontró diferencias estadísticamente significativas en la incidencia de LPV. En el metaanálisis tampoco las hubo entre los grupos (RR fijo: 1,15 [IC 95 %: de 0,53 a 2,47]).
ECN
Se informó de ella en cinco estudios16, 17, 19-21 (n = 473). Ninguno encontró diferencias significativas; y el metaanálisis, tampoco (RR fijo: 0,60 [IC 95 %: de 0,27 a 1,31]).
Tiempo hasta alcanzar la alimentación enteral completa (edad posnatal en el momento de lograrla)
Se informó sobre él en tres estudios17,19-21 (n = 386). No hubo diferencias significativas entre los grupos ni el metaanálisis tampoco las encontró (DMP 1,14 [IC 95 %: de 1,50 a 3,77]).
Oliguria (fig. 2)
Se informó de ella en tres estudios16,17,21 (n = 370). Dos de ellos17,21 encontraron una menor proporción de neonatos con oliguria en el grupo de ibuprofeno estadísticamente significativa, que se confirmó en el metaanálisis (RR fijo: 0,23 [IC 95 %: de 0,10 a 0,51]; DR: 0,12 [IC 95 %: de 0,18 a 0,06]; NNT: 8 [IC 95 %: 5,17]).
ROP
Apareció en dos estudios19,20 (n = 103) y no hubo diferencias significativas entre los grupos ni en el metaanálisis (RR fijo: 0,72 [IC 95 %: de 0,39 a 1,32]).
DBP a los 28 días (fig. 2)
Tres estudios16,20,21 (n = 235) informaron sobre este resultado y ninguno encontró diferencias significativas. En el metaanálisis hubo una tendencia a un aumento de la incidencia de DBP a los 28 días de vida en el grupo de ibuprofeno comparado con el grupo de indometacina, pero no fue estadísticamente significativo (RR fijo: 1,32 [IC 95 %: de 0,99 a 1,76]).
DBP a las 36 semanas de edad posconcepcional
Dos estudios17,19 (n = 238) informaron de este resultado y no hubo diferencias estadísticamente significativas entre los grupos. El metaanálisis tampoco mostró diferencias (RR fijo: 1,28 [IC 95 %: de 0,77 a 2,10]).
Duración de la asistencia ventiladora
Cuatro estudios16,17,19,20 (n = 325) informaron sobre este resultado y no encontraron una diferencia estadísticamente significativa. En el metaanálisis tampoco las hubo (DMP 1,30 días [IC 95 %: de 4,31 a 1,72]).
Días con oxígeno suplementario
Este resultado se dio como media y desviación estándar en tres estudios16,17,20 (n = 262). En dos de ellos17,20, los datos estaban disponibles en el artículo, y en el tercero16 se obtuvieron directamente de los autores (datos no publicados). Ningún ensayo encontró un efecto estadísticamente significativo. En el metaanálisis no hubo tampoco diferencias estadísticamente significativas entre los grupos (DMP 3,14 días [IC 95 %: 5,14 a 11,43]).
Duración de la hospitalización
Se informó sobre ella en dos estudios17,19 (n = 238) y no hubo diferencias estadísticamente significativas entre los grupos. El metaanálisis tampoco las encontró (DM 3,52 [IC 95 %: de 9,87 a 2,83]).
Análisis de sensibilidad
Fracaso del cierre del DAP después de tres dosis de ibuprofeno o de indometacina
Se excluyeron los resúmenes15,18, un estudio que utilizó una dosis única11 y un estudio que ofrece el resultado del cierre del DAP tras dos tandas de tratamiento16. Siete estudios informaron de este resultado10,12,13,17,19-21 (n = 492) y no se encontraron diferencias estadísticamente significativas entre los dos grupos (RR fijo: 0,90 [IC 95 %: de 0,67 a 1,22]).
Fracaso del cierre del DAP después de tres dosis de ibuprofeno o de indometacina
Se excluyeron los estudios con puntuación en la escala de calidad metodológica de Jadad0 2. Se realizó el metaanálisis con los resultados de cuatro estudios11-13,16 (n = 130) y no se encontraron diferencias estadísticamente significativas entre los dos grupos (RR fijo: 1,42 [IC 95 %: de 0,73 a 2,77]).
Discusión
El objetivo de esta revisión fue determinar si el ibuprofeno administrado como tratamiento del ductus hemodinámicamente significativo en recién nacidos prematuros era igual de efectivo que la indometacina y si ofrecía alguna ventaja en relación con la evolución clínica posterior e incidencia de complicaciones. Con anterioridad ya se han realizado varios metaanálisis al respecto22-24, incluidas dos revisiones de la Biblioteca Cochrane, y todos concluyen que no existen diferencias entre el ibuprofeno y la indometacina en la eficacia de cierre del DAP. En nuestra revisión hemos seleccionado nuevos estudios, publicados más recientemente y hemos aplicado otros criterios de inclusión. No se han incluido los trabajos realizados con ibuprofeno administrado por vía oral por considerar que las poblaciones seleccionadas y la intervención realizada no son comparables con el resto de estudios en los que el ibuprofeno se administra por vía intravenosa por las siguientes razones: no constar confirmación ecocardiográfica en el diagnóstico del DAP; tener las poblaciones sobre las que se realiza el estudio un peso y edad gestacional medios mayores, o por ser la edad de comienzo del tratamiento también mayor.
Los resultados de esta revisión nos permiten afirmar que no hay diferencias entre las tasas de cierre de DAP entre ibuprofeno e indometacina con un poder del 99,5 % (asumiendo que una diferencia de tasas de cierre es clínicamente importante cuando es superior al 10 %, y si la tasa de fracaso de cierre del DAP con indometacina es un 0,247, para un riesgo alfa de 0,05). La incidencia de oliguria (< 1 cc/kg/h) fue menor en el grupo de ibuprofeno comparado con el grupo de indometacina y éste, que fue el único hallazgo clínico estadísticamente significativo, favorece al ibuprofeno (RR fijo 0,23 [IC 95 %: de 0,10 a 0,51]; DR 0,12 [IC 95 %: 0,18 a 0,06]; NNT 8 [IC 95 %: 5;17]). En nuestro análisis no se encontraron diferencias estadísticamente significativas entre los dos grupos en la incidencia de displasia broncopulmonar, definida como necesidad de oxígeno suplementario a los 28 días o a las 36 semanas de edad posconcepcional. Esto supone un cambio con respecto al metaanálisis del año 2005 de la Biblioteca Cochrane22, en el que sí se objetiva una incidencia significativamente mayor de displasia a los 28 días de vida en el grupo de ibuprofeno. La diferencia se debe a que en la presente revisión se incluyen los datos de otro estudio16 posterior al trabajo de la Biblioteca Cochrane. De todas formas, el análisis se basa en los datos únicamente de tres estudios y esto hay que tenerlo en cuenta, ya que el tamaño de la muestra puede ser pequeño para detectar una diferencia significativa, y las estimaciones ser imprecisas. Así, si asumimos que una diferencia de tasas de DBP es clínicamente importante cuando es superior al 10 %, tomando como tasa de DBP con indometacina la obtenida en la presente revisión (0,38), para un riesgo alfa de 0,05, con los datos disponibles sólo tenemos un poder del 56 % para afirmar que no hay diferencias entre las tasas de DBP de ambos fármacos. Por ello, no podemos afirmar ni tampoco negar que la diferencia de DBP entre ibuprofeno e indometacina no sea estadísticamente significativa. Se necesitaría mayor tamaño muestral para definirse mejor en este aspecto: aproximadamente un total de 400 niños para obtener un poder del 80 %.
Hay que reseñar también que no se ha observado una heterogeneidad estadísticamente significativa entre los estudios para todos los resultados, y en la mayoría de ellos la I2 es del 0 %.
En ninguno de los pacientes de los ensayos incluidos se produjeron episodios de hipoxemia sugestivos de hipertensión pulmonar tras la administración del ibuprofeno como se describe en dos trabajos previos25,26. La causa de esta complicación se desconoce y se ha relacionado con la precocidad en la administración del fármaco, que impidió la disminución normal de la resistencia vascular pulmonar, la acidificación de la solución de ibuprofeno administrada (IBU-tris-hydroxyamino-methane), lo que causó precipitación y microembolismo en los pulmones, o también a un efecto específico del ibuprofeno.
No se han podido incluir en el metaanálisis los resultados sobre los efectos de ambos tratamientos sobre el flujo y el volumen sanguíneo cerebrales debido a la variación en los puntos temporales de recogida de los datos y a las diferencias en las técnicas utilizadas, aunque dichos estudios10-12 concluyen que el ibuprofeno causa significativamente menos efectos sobre la perfusión y oxigenación cerebral que la indometacina. Tampoco se han incluido los datos de un único estudio13, que analiza los efectos de ambos fármacos sobre la perfusión renal y mesentérica mediante medición de las velocidades del flujo sanguíneo. Dicho ensayo encuentra que el tratamiento con indometacina, y no con ibuprofeno, reduce significativamente la velocidad del flujo sanguíneo mesentérico y renal a los 30 min de su administración y, aunque aumenta con posterioridad, ya no vuelve a los valores que presentaba antes del tratamiento después de esperar 120 min.
No fue posible encontrar datos sobre el seguimiento a largo plazo, lo cual sería muy interesante para próximas revisiones ya que experimentalmente se ha observado que la indometacina reduce el flujo sanguíneo cerebral en un recién nacido prematuro con DAP27, que el ibuprofeno tiene menor efecto sobre la perfusión y la oxigenación cerebral10-12 y, en estudios animales, el ibuprofeno ha mostrado efectos neuroprotectores28,29, con los beneficios que eso podría tener sobre el neurodesarrollo.
Tras esta revisión se puede concluir que el ibuprofeno es igual de eficaz que la indometacina en el cierre del DAP. Esta afirmación tiene un poder estadístico muy elevado (99,5 %), lo que haría innecesario seguir estudiando este resultado desde este punto de vista en el futuro. No se encontraron diferencias significativas en la incidencia de complicaciones entre ambos fármacos, excepto una reducción del riesgo de oliguria con el ibuprofeno. No se confirma en este metaanálisis un mayor riesgo de displasia broncopulmonar en el grupo de ibuprofeno ni aparecen nuevos casos que relacionen la administración de este fármaco con la aparición de hipertensión pulmonar. A partir de la información actualmente disponible, el ibuprofeno es igual de efectivo que la indometacina con menores efectos secundarios renales.
Existen todavía ciertos puntos en los que deben producirse aportaciones en el futuro con la realización de nuevos estudios en los que se haga seguimiento neurológico a largo plazo (al menos hasta los 18 meses y, si fuera posible, hasta la edad escolar) y se aclaren los efectos sobre la evolución pulmonar.
Correspondencia: Dra. A. Gimeno Navarro.
Servicio de Neonatología (1.ª planta edificio H. Maternal).
Hospital Universitario La Fe.
Avda. Campanar, 21. 46009 Valencia. España.
Correo electrónico: annagim@terra.es.
Recibido en febrero de 2007.
Aceptado para su publicación en septiembre de 2007.