Evaluación de parámetros clínicos y analíticos que actúen como predictivos de respuesta al tratamiento con hormona de crecimiento (rhGH) a largo plazo en pacientes con síndrome de Turner.
Material y métodosEstudio retrospectivo de 25 niñas diagnosticadas de síndrome de Turner, de las cuales 17 recibieron tratamiento con rhGH y fueron controladas hasta alcanzar la talla adulta. Se determinaron diferentes variables auxológicas, analíticas, genéticas y farmacológicas a lo largo de su seguimiento en dichas consultas. Se realizó un estudio descriptivo y analítico mediante regresión lineal, con valoración de la respuesta al tratamiento a corto (12 meses) y a largo plazo.
ResultadosSe observó una respuesta favorable a corto plazo valorada en ganancia de velocidad de crecimiento en el 66,6% de los casos (velocidad de crecimiento>3cm/año a los 12 meses de tratamiento respecto a la previa). También se evidenció una respuesta favorable a largo plazo, valorada en una ganancia de talla total de 42,82±21,23cm (1,25±0,76 SDS). Las pacientes ganaron una media de 9,59±5,39cm (1,68±1,51 SDS) respecto a su pronóstico de crecimiento previo al tratamiento.
ConclusionesEl presente estudio evidencia como factores predictivos de buena respuesta al tratamiento con rhGH a largo plazo en orden de importancia: A) dosis de rhGH al inicio del tratamiento, B) tiempo de tratamiento con rhGH hasta inicio de terapia estrogénica, C) incremento en los niveles de IGF1 e IGFBP-3 durante el primer año de tratamiento y D) velocidad de crecimiento en el primer año de tratamiento.
The evaluation of clinical and analytical parameters as predictors of the final growth response in Turner syndrome patients treated with growth hormone.
Material and methodsA retrospective study was performed on 25 girls with Turner syndrome (17 treated with growth hormone), followed-up until adult height. Auxological, analytical, genetic and pharmacological parameters were collected. A descriptive and analytical study was conducted to evaluate short (12 months) and long term response to treatment with growth hormone.
ResultsA favourable treatment response was shown during the first year of treatment in terms of height velocity gain in 66.6% of cases (height-gain velocity >3cm/year). A favourable long-term treatment response was also observed in terms of adult height, which increased by 42.82±21.23cm (1.25±0.76 SDS), with an adult height gain of 9.59±5.39cm (1.68±1.51 SDS).
ConclusionsPredictors of good response to growth hormone treatment are: A) initial growth hormone dose, B) time on growth hormone treatment until starting oestrogen therapy, C) increased IGF1 and IGFBP-3 levels in the first year of treatment, and D) height gain velocity in the first year of treatment.
El síndrome de Turner es un trastorno cromosómico que afecta a una de cada 2.500 nacidas vivas, caracterizado por la presencia de una monosomía completa o parcial del cromosoma X (constituyen la monosomía completa, 45X0, más del 50% de los casos)1,2, si bien es cierto que algunos estudios evidencian un alto porcentaje de mosaicismos3. Se asocia a unas características fenotípicas entre las que destacan talla baja, disgenesia gonadal, linfedema de manos y pies, pterigium colli, disminución del ángulo cubital y alteraciones cardíacas, entre otras manifestaciones2.
Dado que la talla baja es una característica común y la única manifestación clínica en la mayor parte de los casos1–3, diferentes estudios han demostrado la eficacia del tratamiento con hormona de crecimiento (rhGH), con ganancias de aproximadamente 7-10cm respecto a la talla final4–6.
El tratamiento con rhGH debe iniciarse cuando la talla se sitúe por debajo de −2 desviaciones estándar (SDS) con respecto a la población general o la velocidad de crecimiento (VC) sea inferior al percentil 10 para su edad ósea. No debería demorarse más allá de los 4 años de edad ni instaurarse antes de los 2 años de vida1,4.
Diferentes estudios han establecido algunas variables predictivas de talla adulta, como talla al inicio del tratamiento con rhGH, respuesta en el primer año, talla genética, edad al inicio del tratamiento o dosis media semanal de rhGH4,6,7.
Se presenta un estudio realizado en una cohorte española de pacientes afectas de síndrome de Turner en el que se pretende analizar la asociación entre diferentes factores y la respuesta al tratamiento con rhGH.
Material y métodosSe ha realizado un estudio retrospectivo de 25 pacientes diagnosticadas de síndrome de Turner, en las cuales 17 recibieron tratamiento con rhGH y fueron controladas en la Unidad de Endocrinología Pediátrica de un hospital de tercer nivel hasta alcanzar la talla adulta. Las pacientes tratadas con rhGH han sido controladas desde el año 1995 hasta la actualidad; era criterio de inclusión el haber alcanzado la talla adulta. Además, se han recuperado casos más antiguos no tratados, siendo los motivos el presentar una edad tardía al diagnóstico o el rechazo de tratamiento por parte de los familiares.
Se revisaron historias clínicas de las pacientes diagnosticadas de las que se obtuvo la revisión de datos auxológicos, analíticos, cariotípicos y farmacológicos a lo largo de su seguimiento en dichas consultas. Se ha informado a las pacientes de la finalidad del estudio y se ha recogido su consentimiento informado.
La respuesta al tratamiento con rhGH a corto plazo (12 meses) fue valorada en función de la variación en la VC. Se utilizaron como criterios de respuesta el incremento de VC>3cm/año respecto a la previa o el incremento de 3 SDS a los 12 meses de tratamiento. Para la evaluación de la respuesta al tratamiento a largo plazo (hasta alcanzar la talla adulta), se utilizaron las siguientes 5 posibles variables dependientes de respuesta: 1) ganancia de talla SDS respecto a la talla inicial SDS: delta HtSDS (T adulta SDS−T inicio rhGH)3; 2) ganancia de talla SDS respecto al pronóstico de crecimiento inicial SDS (T adulto SDS−PC0 en SDS); 3) ganancia de talla SDS respecto a la talla de inicio de tratamiento con estrógenos como variable dependiente de respuesta (T adulta SDS−T inicio estrógenos); 4) ganancia de talla SDS respecto a la diferencia de talla entre el inicio de tratamiento con rhGH y la talla al inicio de terapia estrogénica (T inicio estrógenos SDS−T inicio rhGH SDS); 5) ganancia de talla SDS respecto al intervalo de tiempo de tratamiento con rhGH antes de iniciar tratamiento con estrógenos.
Se realizó un estudio descriptivo y analítico utilizando el programa SPSS 18.0 para Windows mediante tests no paramétricos: test de Wilcoxon para variables cuantitativas; test de correlación de Spearman para el análisis de correlación lineal entre variables cuantitativas; test de regresión lineal en los casos de variables cuantitativas con correlación lineal y para variables cuantitativa y cualitativa; test de U-Mann Whitney para comparar variables cualitativas dicotómicas con cuantitativas y test de Kruskal–Wallis para comparar variables cualitativas nominales con variables cuantitativas. En todos los casos se consideró significación estadística cuando se obtuvo p<0,05.
ResultadosDe las 25 pacientes analizadas, 17 de ellas recibieron tratamiento con rhGH (68%), mientras que 8 pacientes no recibieron tratamiento.
La fórmula cromosómica más frecuente en estas pacientes fue 45X0 (42,9%) seguida por la presencia de isocromosoma 46 Xi (Xq) (17,8%) y mosaicismos 46 Xi (Xq)/45X0 (14,3%). Otras fórmulas cromosómicas encontradas con menor frecuencia en la muestra fueron mosaicismos como 46XX(r)/45X0, 47XXX/45X0/46XX, 45X0/46X+der(X) y 45X0/47XXX, 46Xi/45X0/46XX.
Respecto al fenotipo se evidenció que el hábito turneriano (talla baja, pterigium colli, cubitus valgus, mamilas separadas etc.) constituye el fenotipo más frecuente (50%); no encontramos rasgos fenotípicos en 6 pacientes (27,3%), que fueron diagnosticadas por estudio de talla baja.
La edad media al inicio del tratamiento con rhGH fue de 7,90±4,13 años (rango 1,82-16,45 años) con una talla media de −2,49±0,63 SDS.
La dosis media inicial de rhGH utilizada durante el tratamiento fue 0,048±0,01mg/kg/día durante un periodo medio de tratamiento de 7,36±3,88 años. Las pacientes presentaron una edad media al final del tratamiento de 14,52±1,69 años y una talla adulta media final de 156,15±3,66cm (−1,23±0,62 SDS).
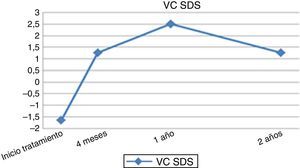
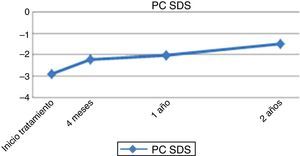
A los 12 meses de iniciar el tratamiento con rhGH se observó un incremento de la VC de 8,21±2,22cm/año (2,5 ± 2,55 SDS) (fig. 1). En este momento, el pronóstico de crecimiento de las pacientes presentó una ganancia de 4,39±3,14cm (144,98±7,99 vs. 149,37±5,92cm) y de 0,67±1,06 SDS (−2,92±1,21 vs. −2,24±0,91 SDS) (fig. 2). Al segundo año de tratamiento se produce una mejoría del pronóstico de crecimiento a 150,56±5,17cm, con un ligero descenso a 6,73±1,63cm/año de la VC.
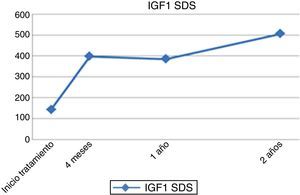
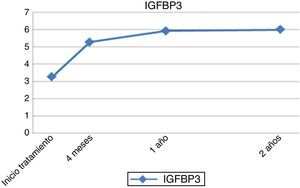
Respecto a los parámetros analíticos, se produjo un incremento progresivo de los niveles de IGF1 e IGFBP-3 hasta el final de tratamiento, que llegaron a triplicar su valor inicial pero manteniéndose siempre dentro de los límites de la normalidad (figs. 3 y 4).
La ganancia media de talla final con respecto a la talla al inicio del tratamiento fue de 42,82±21,23cm (ganancia total de 1,25±0,76 SDS). Respecto a su pronóstico de crecimiento previo al tratamiento, las pacientes ganaron una media de 9,59±5,39cm (1,68±1,51 SDS) (tabla 1).
Estudio descriptivo de respuesta a largo plazo al tratamiento con rhGH
| Inicio de tratamiento | 2 años tratamiento | Edad adulta | Incremento total | |
|---|---|---|---|---|
| Talla (cm) | 113,32±22,98 | 124,18±17,74 | 156,15±3,66 | 42,82±21,23 |
| Talla SDS | −2,49±0,63 | −1,93±0,85 | − 1,23±0,62 | 1,25±0,76 |
| Pronóstico de crecimiento (cm) | 144,9±7,89 | 150,57±5,17 | 9,59± 5,39 | |
| Pronóstico de crecimiento SDS | −2,92±1,21 | −2,05±0,81 | 1,68±1,51 |
Tras 12 meses de tratamiento, las pacientes presentaron mejoría en la talla (p=0,011), VC (p=0,004) e IGF1 (p=0,043) (tabla 2) y al alcanzar su talla adulta se observó, asimismo, mejoría en cuanto a la talla final (p=0,028).
Estudio de cambios en parámetros pretratamiento y un año después del inicio de tratamiento con rhGH
| Inicio de tratamiento Media ± SDS | Un año desde inicio de tratamiento media ± SDS | Significación p | |
|---|---|---|---|
| Talla SDS | −2,49±0,63 | −2,09±0,80 | 0,028 |
| Velocidad de crecimiento SDS | −1,64±2,58 | 2,50±2,55 | 0,004 |
| Pronóstico de crecimiento SDS | −2,92±1,21 | − 2,24±0,90 | 0,075 |
| IGF1 | 143,12±101,02 | 384,83±111,47 | 0,043 |
| IGFBP-3 | 3,25±1,36 | 5,77±1,47 | 0,068 |
Respecto a la respuesta a corto plazo valorada en incremento de la VC, un 66,6% la aumentó por encima de 3cm/año a los 12 meses de tratamiento respecto a la previa. Con relación a la respuesta al tratamiento, la dosis de rhGH presentó una correlación positiva (p=0,037; β = 69,95), así como el aumento de niveles de IGF1 e IGFBP-3 (p=0,000; r2 [IGF1] = 0,846, r2 [IGFBP-3]=0,809). Al analizar la ganancia de talla respecto al intervalo de tiempo entre el inicio de tratamiento con rhGH y el inicio de la terapia estrogénica se observa una correlación positiva en parámetros auxológicos como la ganancia de talla y la VC tanto en cm como en SDS a los 4 meses y al año de tratamiento (tabla 3).
Correlaciones entre la ganancia de talla respecto al intervalo entre el inicio de tratamiento con rhGH y terapia estrogénica
| p | R2 | R | Coeficiente β | |
|---|---|---|---|---|
| Aumento velocidad crecimiento primer año (cm) | 0,094 | 0,75 | 0,86 | 0,134 |
| Aumento velocidad crecimiento primer año SDS | 0,014 | 0,813 | 0,91 | 0,189 |
| Pronóstico de crecimiento inicio rhGH | 0,000 | 0,546 | 0,74 | 0,628 |
| Ganancia de talla a los 4 meses SDS | 0,050 | 0,372 | 0,61 | 0,685 |
| Dosis de rhGH | 0,037 | 0,795 | 0,891 | 69,52 |
Existe una diferencia media de talla final entre pacientes tratadas con rhGH y no tratadas de 10,69±2,63 (p=0,031) (156,15±3,66 vs. 145,44 ± 3,69cm, respectivamente).
Asimismo, se han realizado curvas de regresión lineal respecto a los factores predictivos de buena respuesta hallados, pero, al tratarse de un tamaño muestral reducido, los resultados obtenidos no parecen ser extrapolables.
No se han encontrado diferencias al analizar la respuesta al tratamiento según el cariotipo (p=0,147).
DiscusiónLa talla baja en el síndrome de Turner constituye el hallazgo fundamental y puede estar presente en ausencia de otras manifestaciones clínicas3. La desaceleración del crecimiento lineal comienza en la lactancia y primera infancia, y se vuelve más acusada en la infancia tardía y en la adolescencia, hasta producir una talla significativamente baja en la edad adulta2. El uso de rhGH para incrementar la VC y la talla final en pacientes con síndrome de Turner es una indicación aceptada y avalada por diferentes estudios1,2,4. Se ha objetivado que se obtienen ganancias de 5-10cm respecto a la talla final4,5. Debe iniciarse cuando la talla se sitúe por debajo de −2 SDS con respecto a la media poblacional o cuando la VC sea inferior al percentil 10 para su edad ósea4,8.
Diversos estudios como el realizado por el Comité Asesor de Hormona de Crecimiento de Canadá9,10 y algunos estudios españoles han demostrado la importancia del tratamiento con rhGH en estas pacientes, ya que evidencian incrementos de 4,1 a 8,15cm en la VC a los 12 meses de iniciado el tratamiento11–13. Existe mucha variabilidad en la literatura respecto a este incremento de VC, con variaciones que van desde −1,69 hasta 1,97 SDS. El incremento es mayor durante el primer año de tratamiento y no tan significativo en años posteriores14. El estudio que se presenta encuentra a los 12 meses de iniciado el tratamiento un incremento de la VC de 8,21±2,22cm/año (2,5 ± 2,55 SDS) con una diferencia respecto a la inicial de 3,22cm, lo que representa una buena ganancia inicial de VC, en comparación con lo descrito previamente11–14.
Además, en los últimos años se ha intentado determinar tanto la respuesta al tratamiento como aquellos factores que favorecen una buena respuesta. Así, para valorar la respuesta a corto plazo, Quigley et al.15 señalan la presencia de una ganancia en VC de aproximadamente 2cm/año. Los resultados de la respuesta del tratamiento con rhGH en nuestro estudio han sido valorados utilizando como punto de corte un aumento de VC mayor a 3cm/año a los 12 meses tras iniciar el tratamiento, que superan el 66,6% de las pacientes estudiadas. Otros autores16 destacan un incremento medio de talla en SDS en el primer año de tratamiento de +0,50±0,03 SDS: estos parámetros actúan a corto plazo como predictores de buena respuesta del tratamiento a largo plazo, aunque existen controversias al respecto17. En el estudio que se presenta, respecto a la evolución longitudinal de los principales parámetros auxológicos, se puede observar que los mayores cambiosen la talla, VC y pronóstico de crecimiento se producen en el primer año (4-12 meses después del inicio), con un incremento posterior menos significativo hasta permanecer constante, salvo en el caso de la VC.
Respecto a los resultados de la respuesta al tratamiento a largo plazo, Radetti et al. muestran una ganancia de talla final de hasta 9,2cm y lo mismo corroboran estudios más recientes donde la ganancia de talla final es de aproximadamente de 7 cm18 y superior a 1 SDS19,20. En el presente trabajo se muestran igualmente datos similares, con una ganancia media de talla final con respecto a la talla inicial de 9,59±5,39cm (1,68±1,51 SDS).
Existe discrepancia sobre la correlación existente entre la dosis de rhGH administrada y un efecto positivo en la respuesta clínica por aumento de los factores de crecimiento; algunos autores la encuentran16,20–22, mientras otros como García et al.23 o Wetterau et al.24 consideran que no tiene relación con la respuesta final. En nuestra experiencia, se han obtenido correlaciones positivas respecto al incremento de los factores de crecimiento (IGF1 e IGFBP-3) al año de tratamiento, muy relacionados con la dosis empleada de rhGH y con una mejor respuesta clínica14,25. Además, en los últimos años se han llevado a cabo estudios que intentan relacionar los genes implicados en una respuesta precoz al tratamiento con rhGH en estas pacientes, algunos de ellos han identificado polimorfismos en el gen CDK4 que interferirían en los niveles de IGF-1 y, por tanto, en la respuesta al tratamiento con rhGH26. Ranke et al.4,25,27 establecen correlaciones positivas respecto a dosis (>0,27mg/kg/día), frecuencia (>número de días a la semana) y edad de inicio (a partir de los 2 años y previo a los 4 algunos autores afirman que podría normalizar la talla adulta6,19), sin que exista un consenso al respecto28.
Además, el tiempo de tratamiento con rhGH también parece influir en la ganancia de talla final; Chernausek et al.19,22,27 definieron este intervalo de tiempo como un factor predictivo importante de talla adulta, e incluso llegaron a formular una ecuación para calcular de manera aproximada la ganancia de talla: ganancia de talla (cm)=2,1×años de tratamiento con rhGH antes del inicio de terapia estrogénica.
El inicio de la terapia estrogénica continúa siendo motivo de controversia; algunos autores27–29 evidencian una mejor ganancia de talla al retrasar el comienzo de la terapia estrogénica a los 14 años; otros estudios señalan que pequeñas dosis de estrógenos administradas a edades más precoces producen una ganancia de +0,37 SDS en la talla final respecto aquellas pacientes en las que se ha retrasado dicho tratamiento29. Desde nuestro punto de vista, el inicio de terapia estrogénica debe ser consensuado con la paciente y la familia, valorando, además de los datos auxológicos de talla o edad ósea, la adecuada calcificación esquelética y el deseo que exprese la paciente en cuanto al inicio y desarrollo puberal.
Otro aspecto que genera controversia es el uso de esteroides anabólicos como la oxandrolona, ya que parece incrementar la talla final cuando se combina con rhGH. Gault et al.28 encuentran un incremento de talla media final de +4,6cm (rango 1,9-7,2cm) en un grupo tratado con oxandrolona respecto a otro con placebo. Sin embargo, en este estudio no encontraron un efecto aditivo positivo estadísticamente significativo del uso conjunto de oxandrolona e inducción tardía de la pubertad.
Al establecerse una comparación entre pacientes tratadas con rhGH y aquellas no tratadas, nuestro estudio coincide con lo descrito por Paschino et al.30 y Rosenfeld et al.31, con una diferencia media de talla entre ambos grupos de 10,69±2,63cm (p=0,031), lo que evidencia la importancia del tratamiento precoz en estas pacientes. Ranke et al.18 valoraron la posibilidad de que determinados cariotipos presentaran una mejor respuesta al tratamiento con rhGH, pero no se encontraron diferencias, tal como se ha descrito previamente en este trabajo.
Según los resultados obtenidos en el presente estudio, se puede determinar que los factores predictivos de buena respuesta a largo plazo y por orden de importancia son: A) dosis de rhGH al inicio del tratamiento, B) tiempo de tratamiento con rhGH hasta el inicio de la terapia estrogénica, C) incremento en los niveles de IGF1 e IGFBP-3 durante el primer año de tratamiento y D) VC en el primer año de tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.