La hipotermia cerebral moderada ha probado ser una intervención eficaz para reducir la mortalidad y la discapacidad mayor en los neonatos con encefalopatía hipóxico-isquémica (EHI) moderada-grave.
ObjetivosDescribir la experiencia en el primer año de su utilización y valorar la factibilidad y seguridad de esta intervención.
MétodosRevisión de los 20 pacientes con EHI moderada-grave tratados con hipotermia corporal total en la Agrupación Sanitaria Hospital Sant Joan de Déu-Hospital Clínic, entre enero de 2009 y junio de 2010.
ResultadosDurante este periodo ingresaron 50 neonatos con EHI perinatal, en 26 de ellos moderada-grave. Un total de 20 neonatos recibieron hipotermia (13 con EHI grave y 7 moderada). En todos ellos se encontró un antecedente de riesgo de hipoxia-isquemia perinatal y algún signo clínico de EHI. Quince neonatos presentaron convulsiones clínicas y/o en el registro electroencefalográfico. La temperatura rectal se mantuvo en 33,5±0,5°C en el 76,5% de las determinaciones para los neonatos con control manual de la temperatura y en el 93,6% para los manejados con servocontrol (p<0,0001). El recalentamiento se realizó en una mediana de 10,5 horas. No se produjo ninguna complicación potencialmente grave relacionada con la hipotermia. Fallecieron 7 neonatos (35%), todos ellos con EHI grave.
ConclusionesNo se han apreciado dificultades en ninguna de las fases de esta intervención terapéutica ni se ha registrado ninguna complicación potencialmente grave relacionada con ella. Tanto el control manual de la temperatura como su servocontrol son eficaces para mantener la temperatura diana, pero esta muestra una menor variabilidad con el equipo servocontrolado.
Moderate cerebral hypothermia has been shown to be an effective intervention in decreasing mortality and major disabilities in infants with moderate-severe hypoxic-ischaemic encephalopathy (HIE).
ObjectivesTo describe our experience within the first year of implementation, and to evaluate the feasibility and safety of this intervention.
MethodsRetrospective study of 20 patients with moderate-severe HIE treated with whole body hypothermia in the Agrupación Sanitaria Hospital Sant Joan de Déu-Hospital Clínic, between January 2009 and June 2010.
ResultsDuring this period, 50 patients with perinatal HIE, 26 of them moderate- severe, were admitted to our units. Twenty patients received hypothermia (13 with severe and 7 with moderate HIE). All of them had at least one risk factor for perinatal hypoxia-ischaemia, and clinical signs of HIE. Fifteen had clinical and/or EEG seizures. Core temperature was maintained at 33.5±0.5°C in 76.5% of determinations for infants cooled with a manual control device, and in 93.6% for those cooled with a servo-controlled device (P<.0001). Re-warming took a median time of 10.5hours. No potentially severe complications related to hypothermia were observed. Seven patients (35%) died, all of them with severe HIE.
ConclusionsThere were no difficulties in any of the steps of this intervention, and no potentially severe complications related to it were recorded. Both manual and servo-control methods are equally effective on maintaining the target temperature, although temperature shows less variability using the servo-controlled equipment.
La encefalopatía hipóxico-isquémica (EHI) perinatal es una importante causa de morbimortalidad neonatal y de discapacidad ulterior en el recién nacido (RN) a término o casi a término. Su incidencia en países desarrollados parece haber disminuido a lo largo de los últimos 30 años, estimándose alrededor del 1,5 por cada 1000 RN vivos1. En el Hospital Universitario La Paz de Madrid, la incidencia global de EHI en la última década fue de 1 por 1.000 RN vivos, pero la incidencia de EHI moderada o grave fue de 0,5 por 1.0002. Sin embargo, las importantes implicaciones médicas, sociales y legales que asocia esta devastadora entidad condicionan que constituya un problema socio-sanitario relevante.
Hasta hace poco, el manejo de estos pacientes estaba limitado al tratamiento de soporte y anticomicial. Sin embargo, desde el 2005 se han publicado varios ensayos clínicos que han evaluado el efecto de la reducción de la temperatura cerebral de 3-4°C (hipotermia moderada), iniciada antes de las 6 h de vida y mantenida durante 72 h, sobre la mortalidad y la discapacidad significativa en los supervivientes en RN ≥35-36 semanas con EHI moderada/grave3-8. La eficacia y la seguridad de este tratamiento han sido ratificadas en distintos metanálisis independientes6,9-13 (nivel de evidencia 1A), por lo que diferentes comités de expertos apoyan su uso como práctica estándar. Esto ha hecho que numerosas unidades neonatales alrededor del mundo hayan iniciado el empleo de la hipotermia como arma terapéutica en la práctica clínica. La implantación de esta nueva terapia supone un reto asistencial para las unidades neonatales.
Los centros de la Agrupación Sanitaria Hospital Clínic-Hospital Sant Joan de Déu iniciaron en enero y abril de 2009, respectivamente, sus programas de hipotermia terapéutica para pacientes con EHI moderada o grave. Los objetivos de este estudio fueron examinar: a) nuestra experiencia en la implementación de un programa de hipotermia terapéutica; b) la seguridad de esta intervención, y c) comparar la facilidad para mantener la temperatura diana entre un equipo de enfriamiento ajustado manualmente y un equipo servocontrolado.
Material y métodosTipo de estudio y pacientesRetrospectivo observacional de una cohorte constituida por todos los pacientes con EHI en los que se realizó hipotermia terapéutica desde enero del año 2009 hasta el 30 de junio de 2010.
Ámbito del estudioDos hospitales terciarios y universitarios de Cataluña que comparten el mismo programa de atención al RN con EHI.
Protocolo de actuación, recogida de datos y definicionesEn ambos centros, la implantación del programa fue un proceso en etapas que incluyó, entre otras acciones, la creación de un grupo multidisciplinario, la elaboración de un protocolo escrito consensuado entre ambos centros con esquemas de evaluación clínica y un cronograma específico de estudios complementarios, la dotación del equipamiento técnico y el establecimiento de un programa de formación continuada para médicos y enfermeras.
El método para realizar hipotermia inducida difirió entre los dos centros. En el Hospital Clínic (sede Maternitat) inicialmente se realizó hipotermia corporal total mediante enfriamiento pasivo (fuentes de calor apagadas; bolsa de hielo próxima al neonato, en caso necesario). Posteriormente se introdujo el sistema Techotherm TS med 200N Olympic®. En el Hospital Sant Joan de Déu se empleó inicialmente el sistema de enfriamiento corporal total de control manual Techotherm TS med 200N Olympic® y posteriormente el sistema con servo-control CritiCool y CureWrap MTRE®. La temperatura rectal se redujo a 33,5±0,5°C, en las primeras 6 horas de vida, y se mantuvo esta temperatura diana durante 72 h, con posterior recalentamiento lento, a razón de ≤0,5°C a la hora.
Los criterios de aplicación de hipotermia terapéutica fueron:
- A)
RN≥35 semanas de gestación con al menos uno de los siguientes antecedentes:
- •
Apgar ≤5 a los 5 min.
- •
Reanimación mantenida a los 10 min de vida (incluyendo ventilación con presión positiva intermitente asociada o no a masaje cardiaco).
- •
pH≤7,00 en sangre de cordón umbilical o en cualquier muestra (arterial, venosa o capilar) dentro de los primeros 60 min de vida, o déficit de bases ≥16mmol/l en sangre de cordón umbilical o de cualquier muestra (arterial, venosa o capilar) dentro de los primeros 60 minutos de vida.
- •
- B)
Presencia de encefalopatía significativa (moderada-grave) en las primeras 6 h de vida.
Los criterios de exclusión fueron: peso <1.800 g, malformaciones congénitas graves, ecografías prenatales con lesiones estructurales intraútero, estado moribundo al ingreso, y ausencia de hipotermia moderada (temperatura<34,1°C) antes de las 6 h de vida.
En ambos centros, la presencia y la gravedad de la EHI significativa antes de la inclusión en los programas de hipotermia fue establecida según una escala semicuantitativa14,15 (tabla 1) y desde el ingreso y durante el periodo de hipotermia se monitorizó la actividad electrocortical de forma continua mediante el electroencefalograma integrado por amplitud (EEGa) (MFC 6000 Olympic®). A todos los pacientes incluidos en el programa de hipotermia terapéutica se les realizaron pruebas de neuroimagen: ecografía cerebral transfontanelar en las primeras 24 h de vida con controles periódicos posteriores, y resonancia magnética (RM) cerebral con un equipo de 1.5 tesla (General Electrics Medical Systems, Milwaukee, EE: UU.) con secuencias potenciadas en T1, T2, difusión y espectroscopia en al menos una ocasión a partir de la semana de vida.
Graduación de la gravedad de la EHI
| Severidad | Manifestaciones clínicas |
| Leve | |
| Capacidad para despertar | Normal |
| Tono muscular | Hipotonía global, preferentemente proximal superior |
| Respuestas motoras | Normales o ligeramente disminuidas |
| Reactividad | Normal o hiperexcitabilidad: ROT aumentados, tremor y/o mioclonus |
| Moderada | A |
| Capacidad para despertar | Letargia o estupor moderado |
| Tono muscular | Hipotonía global, preferentemente proximal superior |
| Respuestas motoras | Disminuidas, pero de calidad normal |
| Reactividad | ROT disminuidos, reflejos primitivos débiles |
| B | |
| Convulsiones | Aisladas o repetitivas |
| Grave | A |
| Capacidad para despertar | Coma o estupor intenso |
| Tono muscular | Hipotonía global |
| Respuestas motoras | Ausentes o estereotipadas. Convulsiones o estado epiléptico |
| Reactividad | Reflejos primitivos ausentes |
| B | |
| Signos de disfunción del tronco cerebral | Presentes |
ROT: reflejos osteotendinosos.
Para este estudio, se revisaron las historias clínicas de todos los pacientes, incluyendo la información antenatal, perinatal y neonatal disponible, así como los informes del hospital emisor y hojas de traslado para los RN extramuros. Las gráficas de temperatura para cada paciente fueron analizadas conjuntamente y según el método de enfriamiento. Además, se evaluaron el registro de aEEG de cada uno de los pacientes, así como los resultados de neuroimagen y otras pruebas complementarias realizadas durante el ingreso. El patrón de trazado de fondo del aEEG fue clasificado de acuerdo al esquema de gravedad creciente propuesto por Hellström-Westas16: continuo de voltaje normal (CVN) cuando el margen superior está por encima de 10μV y el inferior por encima de 5μV; discontinuo con voltaje normal (DVN) cuando el margen superior está por encima de 10μV pero el inferior por debajo de 5μV; brote supresión (BS) si el margen inferior están por debajo de 5μV y existen brotes con amplitud superior 25μV; continuo de bajo voltaje (BV) si ambos los márgenes superior e inferior están por debajo de 10μV y 5μV, respectivamente; y trazado plano (P) o isoeléctrico cuando ambos márgenes están por debajo de 5mV. Se consideraron como gravemente alterados los trazados BS, BV y P. Se recogió también la presencia de crisis eléctricas y la presencia o ausencia de ciclos sueño-vigilia. Todos los registros fueron revisados, registrándose el peor trazado mantenido durante al menos una hora y el momento de inicio de los ciclos de sueño-vigilia.
La ecografía transfontanelar fue considerada patológica cuando se encontraron los siguientes hallazgos: signos de edema cerebral (ventrículos colapsados, pérdida de la diferenciación córtico-subcortical) hiperecogenicidad difusa o parcheada de la sustancia blanca; ecogenicidad de ganglios basales o tálamo; alteración ecogenicidad cortical, o índice de resistencia<0,55 en la ecografía Doppler. Las lesiones de RM fueron clasificadas en tres grandes grupos: a) lesiones de predominio en ganglios de la base/tálamo; b) lesiones de predominio en territorios de perfusión limítrofe de sustancia blanca; y c) patrón de afectación global con lesiones de los dos grupos anteriores.
Se consideraron complicaciones atribuibles a la hipotermia: la aparición durante la misma de trastornos del ritmo cardiaco (arritmias) que no fuesen una bradicardia sinusal, o el desarrollo de una trombocitopenia (plaquetas <100×103/mm3) no asociada a coagulación intravascular diseminada (CID). Se consideraron factores de comorbilidad asociados a la hipotermia: hipocapnia (pCO2<35mmHg), hipoglucemia (glucosa<40mg/dl) e hipomagnesemia (magnesio<1,6mmol/l).
Análisis estadísticoSe realizó un análisis estadístico descriptivo en el que las variables numéricas se expresan en forma de mediana y rango y las categóricas en forma de número y porcentaje, a no ser que se especifique de otro modo. La comparación entre la eficacia para mantener la temperatura baja entre los métodos de control manual o servocontrol de la misma se llevó a cabo con el test exacto de Fisher. Los resultados se procesaron con el programa estadístico SPSS 18.0 para Windows.
ResultadosCaracterísticas generales de los pacientesEntre el 1 de enero del año 2009 y el 30 de junio de 2010 nacieron en la agrupación sanitaria un total de 12.382 RN vivos, de los cuales 11.504 tuvieron una edad gestacional ≥35 semanas. De estos, 637 ingresaron en las unidades neonatales de los dos hospitales miembros, a los que se sumaron 353 ingresos externos. Hubo 50 casos de EHI perinatal, 26 de ellos moderados o graves. Seis de estos pacientes no se trataron con hipotermia por los siguientes motivos: dos por ingresar en el Hospital Sant Joan de Déu antes de la implantación del programa de hipotermia terapéutica (mayo de 2009), tres por ingresar pasadas 6 h de vida con temperatura corporal superior a 34°C, y uno por fallecer en las primeras horas de vida. Un total de 20 pacientes recibieron hipotermia durante este periodo, de los cuales 4 nacieron intramuros (2 con EHI moderada y 2 con EHI grave) y 16 (80%) fueron trasladados desde otros centros (5 con EHI moderada y 11 con EHI grave).
Las características generales de los pacientes y sus datos perinatales son expresados en la tabla 2. La mediana de edad gestacional de los pacientes fue 39 semanas (rango 35-42 semanas) y la mediana de peso 2.965g (rango 2.200-4.280g). Entre los antecedentes perinatales de riesgo, 7 (35%) presentaron un evento centinela, y el resto un estado fetal no tranquilizador (11) o distocia (2). El parto fue por cesárea urgente en 17 pacientes (85%) y la mitad presentó un test de Apgar <5 a los 5 min. Un pH <7,00 en sangre de cordón se observó en un 57,8% y un déficit de bases ≥16mmol/l en un 87,5% de aquellos pacientes en los que dichos parámetros fueron recogidos (N=19 y 16, respectivamente). Dieciocho pacientes (90%) precisaron reanimación durante al menos 10 min.
Características generales y datos perinatales de 20 pacientes con EHI tratados con hipotermia cerebral
| Variable | Según grado de encefalopatía | |
| EHI moderada (n=7) | EHI grave (n=13) | |
| Características generales | ||
| Sexo varón, n (%) | 3 (43) | 7 (53,8) |
| EG, mediana (rango) | 39 (35-41,1) | 39 (35-42) |
| Peso (g) mediana (rango) | 2.810 (2.500-3.950) | 3.120 (2.200-4.280) |
| Procedencia externa, n (%) | 5 (71,4) | 11 (84,9) |
| Datos perinatales | ||
| Antecedentes intraparto | ||
| Alteración RCTG, n (%) | 4 (57,1) | 7 (53,8) |
| Abruptio placentae, n (%) | 2 (28,6) | 4 (30,7) |
| Prolapso cordón, n (%) | 0 | 1 (7,6) |
| Distocia, n (%) | 1 (14,2) | 1 (7,6) |
| LA meconial, n (%) | 2 (28,5) | 7 (53,8) |
| No antecedentes, n (%) | 0 | 0 |
| Modo de parto | ||
| Eutócico, n (%) | 2 (28,6) | 1 (7,6) |
| Cesárea urgente, n (%) | 5 (71,4) | 12 (92,3) |
| Instrumentado, n (%) | 0 | 0 |
| Puntuación Apgar 5min <5, n (%) | 4 (57,1) | 6 (46,1) |
| pH arteria umbilical <7,00 (n=19), n (%) | 4 (57,1) | 7/12 (58,3) |
| EB≥16 (N=14), n (%) | 5 (71,4) | 9/9 (100) |
| RCP >10min, n (%) | 6 (85,7) | 12 (92,3) |
EB: exceso de bases; EG: edad gestacional; LA: líquido amniótico; RCP, reanimación cardiopulmonar; RCTG: registro cardio-tocográfico.
Diez de los 16 pacientes nacidos extramuros recibieron hipotermia pasiva durante el transporte, dos de los cuales presentaron hipotermia profunda (<32°C) al ingreso. La mediana de edad a la llegada fue de 3,25h (rango: 2-7h). Un paciente llegó a las 7 horas de vida, pero se había mantenido hipotérmico en las horas previas evitando medidas activas de calentamiento y presentó una temperatura central de 33,9°C a su ingreso. La temperatura mediana en el momento de la decisión definitiva de inclusión en el programa de hipotermia terapéutica fue de 34,5°C (rango 31-37,3°C). Solo un paciente nacido intramuros presentó hipertermia (>37°C) antes del inicio de la hipotermia terapéutica.
Antes del inicio de la hipotermia, el estado neurológico caracterizó la gravedad de la EHI en 19 pacientes (alteración en la capacidad para despertar junto con alteración en el tono muscular, las respuestas motoras o los reflejos osteotendinosos). La alteración de la capacidad para despertar fue caracterizada como letargia o estupor moderado en 8 y como estupor grave o coma en 11, 6 de los cuales tenían signos de disfunción del tronco del encéfalo. Solo en un paciente con hipertensión pulmonar persistente (HTPP) grave, que fue sedado y paralizado tempranamente en el hospital emisor, el examen neurológico no fue valorable, siendo el trazado del EEGa el criterio para iniciar la hipotermia.
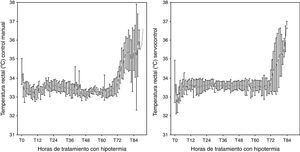
Inducción, mantenimiento de la hipotermia y recalentamientoLos datos del control de la temperatura antes y durante la hipotermia quedan reflejados en la tabla 3. La variación horaria de la temperatura durante la fase de mantenimiento según el método utilizado se muestra en la figura 1. La temperatura central diana de 34°C se alcanzó a una edad mediana de 4,5 horas (rango 1-8h). En 2 pacientes externos dicha temperatura se alcanzó a las 7 y 8 h, respectivamente. Ambos casos habían estado en hipotermia leve (34,7 y 35,3°C, respectivamente), desde las 5 h de vida. En un paciente manejado con control manual se produjo sobreenfriamiento puntual a 31,8°C durante la fase de inducción de la hipotermia. Ocho pacientes enfriados sin servocontrol recibieron hipotermia corporal total mediante hipotermia pasiva.
Temperatura central en 20 pacientes con EHI tratados con hipotermia corporal total
| Pacientes internos (n=4) | Pacientes externos (n=16) | |
| Temperatura central a su llegada a la UCI, mediana (rango) | 36,0 (33,2-37,3) | 34,35 (31-35,8) |
| Temperatura central mínima durante hipotermia, mediana (rango) | 32,5 (32,2-32,6) | 32,55 (31,7-33,2) |
| Temperatura central máxima durante hipotermia, mediana (rango) | 34,25 (33,9-35,5) | 34,6 (33,7-37,3) |
Durante la fase de mantenimiento (72 h de duración), la temperatura rectal se mantuvo dentro del rango deseado (33,5±0,5°C) en el 93,6% de las determinaciones para los neonatos con servocontrol y en el 76,5% de las mediciones para aquellos manejados con control manual (p<0,0001), sin observarse diferencias significativas entre los pacientes de hipotermia pasiva y los de equipo de hipotermia sin servocontrol. Como se puede ver en la figura 1, la temperatura mostró una menor variación con este último método. Sin embargo, no se registraron dificultades en mantener la temperatura en el rango establecido con ninguno de los dos métodos.
La duración mediana del recalentamiento fue de 10,5h (rango 6-15h). Durante dicha fase un paciente con encefalopatía grave y actividad epiléptica repetida presentó convulsiones, lo que obligó a parar el proceso hasta tener controladas las crisis.
Monitorización de la función cerebralLas características del EEGa en los 16 registros del EEGa practicados durante el ingreso se representan en la tabla 4, comparando los casos que fueron fallecimientos hospitalarios con los que sobrevivieron al alta. A las 24h de vida, 6 pacientes persistían con un trazado intensamente suprimido. Todos presentaban clínica de EHI grave. En un caso se observó un cambio a trazado DVN antes de las 48h. Esta paciente sobrevivió y mostró una lesión moderada en núcleos grises centrales en la RM cerebral. Cuatro de los 5 pacientes en los que persistió un trazado muy alterado a las 48h de edad, fallecieron por EHI grave. El paciente restante sobrevivió con una grave lesión de núcleos grises centrales en la RM. A las 36 horas, 5/16 pacientes presentaban ciclos vigilia-sueño y, aunque 2 de ellos presentaron inicialmente clínica de EHI grave, a las 24h de vida el trazado de EEGa ya mostraba un patrón de base CVN o DVN. Ninguno de ellos falleció ni presentó lesiones graves en la neuroimagen. En 14 neonatos se observaron convulsiones clínicas y en 15 en el aEEG. Un paciente presentó una crisis eléctrica aislada y no recibió tratamiento anticomicial. El resto precisaron medicación: 5 pacientes recibieron solo fenobarbital, 3 necesitaron un segundo fármaco y 6 precisaron tres o más fármacos para controlar las crisis.
Características del EEGa en 16 RN con EHI tratados con hipotermia y en los que se realizó monitorización continua de la función cerebral
| EEGa | Vivo | Muerte |
| Peor trazado de base | ||
| Grave (plano, brote-supresión, continuo hipovoltado) | 4 | 7 |
| Moderado (DVN) | 3 | 0 |
| Normal (CVN) | 2 | 0 |
| Convulsiones eléctricas | 8 | 7 |
Todos los pacientes presentaron signos de disfunción multiorgánica17: se observó disfunción hepática en 11 casos, insuficiencia renal aguda en 7 casos y coagulopatía en 6. Cinco pacientes presentaron síndrome de aspiración meconial, 2 pacientes sepsis precoz y 7 pacientes HTPP. En el manejo clínico de los pacientes, un 60% recibió sedoanalgesia con mórficos durante la fase de mantenimiento de la hipotermia, siendo esto más frecuente en la EHI moderada (71%) que en la grave (46,1%). Todos los pacientes excepto uno precisaron soporte ventilatorio. Este fue un paciente con EHI moderada que presentó una crisis eléctrica aislada, sin traducción clínica, y que no recibió tratamiento anticomicial. En 4 casos se requirió el uso de ventilación de alta frecuencia y en tres casos óxido nítrico inhalado, debido a HTPP. Un 80% de los casos requirió soporte inotrópico por hipotensión arterial. En cuanto a los factores de comorbilidad antes y durante la hipotermia, un 65% de los pacientes presentaron hipocapnia durante las primeras horas de vida, un 25% hipoglucemia y un 27% hipomagnesemia.
Seguridad de la hipotermiaNo se registró ninguna complicación relevante atribuible a la hipotermia terapéutica: ningún paciente presentó una arritmia grave durante la hipotermia, aunque la bradicardia sinusal, <120 latidos por minuto, se observó en un 80% de los pacientes. Ocho pacientes (40%) presentaron trombocitopenia, 5 en el contexto de CID atribuible a la hipoxia-isquemia perinatal per se. Los 3 casos con trombocitopenia sin CID no presentaron sangrados ni requirieron transfusiones. El enfriamiento hubo de suspenderse en 2 pacientes por problemas presentes desde antes del inicio de la hipotermia; uno a las 30h de vida por coagulopatía refractaria (falleció a las 76h de vida por EHI grave y afectación multiorgánica), y otro a las 44h por HTPP grave. En este último paciente fue necesario iniciar soporte con ECMO, siendo su evolución posterior favorable, tanto desde el punto de vista respiratorio como neurológico, con mejoría clínica y electroencefalográfica y estudio por RM cerebral normal.
Estudios de neuroimagenLa ecografía cerebral transfontanelar se realizó en todos los pacientes en al menos una ocasión. Esta fue considerada patológica en estudios sucesivos en 11 casos. Se realizó RM cerebral en 18 pacientes, ya que 2 fallecieron antes de poderla practicar. En 4 pacientes con EHI grave que finalmente murieron se realizó RM precoz, entre el tercer y el cuarto día de vida. En los restantes 14 pacientes (incluidos dos en los que se realizó también estudio precoz, a los 4 y 6 días, respectivamente) la RM se practicó a una edad mediana de 14 días (rango 6-38 días). Los hallazgos de las imágenes de RM de nuestros pacientes, en función de si fallecieron o no, se resumen en la tabla 5.
Hallazgos de la RM cerebral en 18 RN con EHI tratados con hipotermia
| Patrón predominante de daño en las imágenes | Vivo | Muerte |
| Normal o hallazgos no relacionados con hipoxia-isquemia | 8a | 0 |
| Afectación de ganglios basales y tálamos | 4 | 4 |
| Afectación de corteza y sustancia blanca en áreas de vascularización limítrofe | 1 | 0 |
| Patrón de afectación global | 0 | 1 |
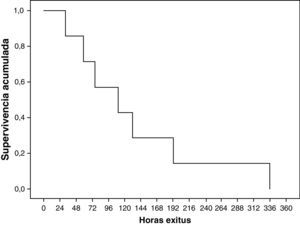
Siete (35%) pacientes fallecieron, todos ellos mediante adecuación del esfuerzo terapéutico. Todos presentaban EHI grave. La muerte ocurrió a una edad mediana de 111h (rango 134h). La supervivencia acumulada se refleja en la figura 2.
DiscusiónEste estudio refleja la experiencia en el primer año de la puesta en marcha de un programa de hipotermia terapéutica común en dos unidades neonatales de tercer nivel. En este programa, además de los RN a término, se decidió incluir también a RN pretérmino con edad gestacional igual o superior a 35 semanas. Esta edad gestacional es una semana menor de la que habitualmente se ha utilizado como frontera en la mayoría de los ensayos clínicos que han examinado la eficacia y la seguridad de la hipotermia. Las razones que sustentan nuestra decisión son: a) que a partir de esta edad gestacional es factible establecer la presencia de encefalopatía atribuible a hipoxia perinatal de forma independiente a los problemas relacionados con la prematuridad18 y b) que no se ha apreciado una mayor incidencia de complicaciones asociadas a la hipotermia en dos ensayos clínicos que han utilizado esta edad gestacional como punto de corte19,20. Además, en un estudio piloto realizado en RN muy prematuros, la hipotermia inducida a 34°C durante y después de la laparotomía por perforación intestinal secundaria a enterocolitis necrosante no mostró efectos adversos en comparación con el grupo normotérmico21.
Aunque ninguno de los pacientes incluidos presentó anomalías congénitas mayores, estas actualmente no constituyen un criterio mayor de exclusión en nuestro programa. Al igual que otros autores22, consideramos que este criterio procedente de los ensayos clínicos debería ser revisado al aplicarlo a la práctica clínica y ser restringido a aquellos pacientes con anomalías del desarrollo del SNC que impactan de forma notable en el neurodesarrollo ulterior.
La mayoría de los pacientes incluidos en este estudio fueron trasladados desde otros centros. Dos pacientes con EHI significativa llegaron al hospital pasado el periodo de oportunidad de tratamiento. Ambos fueron dos neonatos trasladados por inestabilidad cardiorrespiratoria y en los cuales la clínica de encefalopatía fue infravalorada al nacimiento. De los pacientes trasladados específicamente para hipotermia terapéutica, solo uno llegó con más de 6 h de vida (7h), pero la hipotermia se había iniciado durante el transporte. Por otro lado, en 2 de los pacientes trasladados, el transporte, las valoraciones y las acciones necesarias para la puesta en marcha del equipo técnico retrasaron la consecución de la temperatura diana (≤34°C) hasta las 7 y 8h de edad, respectivamente. La existencia de una terapia neuroprotectora, cuya eficacia depende de su pronta aplicación en el RN asfíctico, condiciona la importancia de una adecuada atención en el hospital emisor, así como un sistema de transporte correctamente organizado y con personal entrenado para que estos pacientes lleguen al centro de referencia lo antes posible y en condiciones óptimas23,24. Sin embargo, hay que tener en cuenta que el criterio de inclusión de 6h como ventana terapéutica fuera de ensayos clínicos pudiera prolongarse y que probablemente como medicina compasiva puede ofertarse iniciar el tratamiento más allá de las 6h establecidas en los estudios de investigación25. El riesgo de hipotermia profunda en pacientes asfícticos enfriados pasivamente en el hospital de nacimiento o durante el transporte interhospitalario, observado tanto en este estudio como por otros autores26,27, hace recomendable establecer protocolos estrictos de control de la temperatura.
Considerando solo los RN intramuros, nuestros centros muestran una incidencia conjunta de EHI moderada y grave (5 casos) de 0,4 por cada 1.000 RN vivos, dato significativamente inferior a lo descrito por otros autores1 pero similar a lo hallado en una revisión realizada en población más parecida epidemiológicamente a la nuestra2. Este dato apuntaría hacia la disminución en la incidencia de EHI significativa en nuestro entorno. Del total de 1.646 neonatos ingresados, los 50 con EHI (cualquier grado) suponen una prevalencia global de 30,3 por cada 1.000 pacientes ingresados, mientras que la prevalencia de EHI significativa (26 RN) fue de 15,79 por cada 1.000 pacientes ingresados. Esta marcada diferencia entre incidencia y prevalencia se debe a que la mayoría de los casos de EHI fueron derivados de otros centros, lo que lleva a enfatizar la importancia de disponer de un adecuado sistema de transporte neonatal, con personal debidamente entrenado para manejar a estos pacientes y realizar hipotermia pasiva hasta su llegada al centro emisor.
La cifra de 20 pacientes tratados en este periodo inicial de 18 meses supera el número propuesto de 1 paciente por mes para que un programa sea funcional y tenga una adecuada calidad asistencial28. Es de esperar que esta cifra aumente a medida que la información acerca de la disponibilidad de este tratamiento sea mayor en los hospitales emisores. Por otro lado, destaca una mayor frecuencia de pacientes tratados con EHI grave frente a moderada (13 frente a 7). Esta diferencia es mayor en los nacidos extramuros, lo cual indica un sesgo o preferencia a derivar los pacientes más graves. De ser así, los neonatos con EHI moderada que nacen en hospitales sin este recurso probablemente no estén recibiendo hipotermia. Entre las diversas razones que pudieran justificar este sesgo están: a) una escasa información acerca de los pacientes tributarios de esta terapia, y b) la dificultad para establecer, en las primeras horas de vida, la presencia y gravedad de la EHI, particularmente en aquellos casos que no convulsionan y no están en coma. Conseguir que los pacientes con EHI moderada sean referidos para ser incluidos en programas de hipotermia terapéutica es muy importante, pues según algunos estudios estos son los pacientes que se benefician en mayor medida de este tratamiento3,19.
A diferencia de otros trabajos6,7,19, el EEGa no se utilizó como criterio independiente de aplicación o no de hipotermia, sino como una herramienta coadyuvante a la clínica para valorar el grado de EHI. Esto explica que 2 casos con EHI clínicamente moderada, en los que se practicó hipotermia, presentaran un trazado normal. En la era prehipotermia, la capacidad del EEGa precoz para predecir la evolución neurológica en el RN a término con asfixia perinatal EHI fue bien establecida29-32. Sin embargo, Sarkar et al. han observado una sensibilidad y un valor predictivo negativo limitados del EEGa para predecir una evolución adversa a corto plazo (definida como muerte temprana o alteraciones de origen hipóxico-isquémico en la RM craneal) en neonatos con EHI evaluados para protección con hipotermia33. Aunque nuestro estudio no está diseñado para evaluar este aspecto, los datos apoyan que aquellos neonatos con trazados EEGa marcadamente alterados a las 48h asocian daño cerebral significativo27,34. Debe tenerse en cuenta que la hipotermia parece retrasar la recuperación del trazado de EEGa en neonatos asfícticos27,34. Mientras que en neonatos con EHI mantenidos en normotermia la no recuperación del trazado de EEGa a las 24h de vida predecía inequívocamente una evolución desfavorable32,34, el enfriamiento del paciente parece retrasar la «recuperación» del EEGa, demorando su capacidad predictiva de pronóstico adverso a después de las 36h de vida27,34.
El control de la temperatura se realizó con dos métodos distintos. Al igual que en un trabajo reciente con un mayor número de casos35, el enfriamiento con el equipo dotado de servocontrol de la temperatura central conllevó menos fluctuaciones de la temperatura que cuando el enfriamiento fue realizado con un equipo sin servocontrol. No obstante, a diferencia de lo descrito por otros autores36, el rango de temperatura se mantuvo dentro de lo establecido con ambos sistemas, incluyendo pacientes en hipotermia pasiva. Este hecho apoya la seguridad del uso de la hipotermia pasiva en el hospital emisor y durante el transporte, tal y como apunta la guía de estándares de la SEN25. No obstante, en nuestro medio, el objetivo debe ser el uso de sistemas de enfriamiento que aportan seguridad y disminuyen la carga de trabajo notablemente. Solo de este modo se podrá garantizar los cuidados óptimos que deben ser el estándar en el tratamiento de estos pacientes.
En nuestro estudio no todos los pacientes recibieron sedación. Esta dependió de la consideración subjetiva de disconfort o de la presencia de una frecuencia cardiaca mayor de 120 lpm. Esto puede explicar el que la mayoría de los pacientes con sedación presentaban EHI moderada. Debido a la dificultad para determinar el grado de dolor o disconfort en un paciente con EHI significativa sometido a hipotermia y a que los opioides parecen potenciar el efecto neuroprotector de la misma7,37, podría ser recomendable incorporar una sedoanalgesia sistemática con opioides administrados en dosis bajas, debido a la reducción de su metabolismo hepático en RN asfícticos sometidos a hipotermia.
En ningún caso se administró nutrición enteral durante la hipotermia, siguiendo los protocolos de los ensayos clínicos aleatorizados publicados3,6,19 y sobre la base de que la hipotermia podría aumentar el riesgo de enterocolitis necrosante (ECN) secundaria a la hipoxia-isquemia intestinal. No obstante, en dichos trabajos se ha observado una baja incidencia de complicaciones digestivas, similar entre pacientes en hipotermia y normotermia. En los protocolos escandinavos se administra nutrición enteral trófica con leche materna, sin que se haya descrito un mayor riesgo de ECN asociado a esta práctica.
No se constataron complicaciones o efectos secundarios graves imputables a la hipotermia per se en la población estudiada. Como en todos los estudios, la mayoría de los pacientes presentaron bradicardia sinusal, pero ninguno manifestó un episodio de arritmia grave. La HTPP llevó en algunos casos a situaciones de manejo muy complicadas con requerimientos de soporte respiratorio agresivo, óxido nítrico inhalado o incluso ECMO. Aunque no se ha demostrado que la hipotermia asocie un mayor riesgo de hipertensión pulmonar38, en el paciente con HTPP más grave la temperatura se mantuvo en torno a los 34°C y se decidió suspender la hipotermia a las 44h de vida. A pesar de normalizar la temperatura, persistió la HPPN y el neonato entró en ECMO, lo cual sugiere que la hipotermia tuvo poco que ver con la HPPN. Del mismo modo, la terapia se suspendió precozmente en una paciente con CID y sangrado refractario, ante la posibilidad de que la hipotermia pudiese agravar la coagulopatía secundaria a su asfixia perinatal grave. Al margen de los pacientes con CID atribuible a la hipoxia-isquemia, 3 pacientes presentaron plaquetopenia moderada. Estos resultados están en concordancia con los de otros estudios3,6,7,12,14,19,39,40. Por último, casi todos los pacientes presentaron patología típicamente asociada a la EHI, la mayoría relacionada con el efecto sistémico de la hipoxia-isquemia, como es el caso del daño renal y hepático.
En conclusión, la implementación de un programa de hipotermia terapéutica para neonatos a término con asfixia perinatal no ofrece dificultades en nuestro entorno si se han seguido una serie de etapas dirigidas a establecer y hacer operativo el programa. El éxito de estos pasos previos es ilustrado por el hecho de que durante el periodo de estudio no se apreciaron dificultades en ninguna de las fases de esta intervención terapéutica: enfriamiento, mantenimiento ni recalentamiento, ni se registró ninguna complicación potencialmente grave relacionada con la hipotermia. La hipotermia terapéutica es factible en una unidad neonatal de tercer nivel de nuestro país con un número suficiente de pacientes tratados por año. Los dos métodos de enfriamiento utilizados en nuestros centros fueron eficaces para mantener la temperatura diana, si bien ésta mostró menor variabilidad con el equipo servocontrolado.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.