El síndrome aórtico medio (SAM) también denominado coartación abdominal o síndrome displásico medioaórtico, esta caracterizado por un estrechamiento segmentario de aorta torácica distal y/o abdominal que puede ir asociado a estenosis de arterias renales (82%) y viscerales (22%) y representa el 0,5–2% de las coartaciones1.
La etiología puede ser congénita o adquiridas2,3. La primera se debe a errores en el proceso embriológico de la formación de la aorta. Las causas adquiridas son múltiples siendo la más frecuente la arteritis de Takayasu1–3.
Los síntomas ocurren en las tres primeras décadas de la vida y son debidos a hipertensión arterial (HTA) severa de difícil control. El pronóstico es malo sin tratamiento quirúrgico o percutáneo, con una esperanza media de vida de 30 años, siendo la muerte debida a complicaciones hipertensivas.
Presentamos el caso de un varón de 17 años visitado por primera vez 3 años antes por HTA. Desarrollo físico normal con tensión arterial en extremidades superiores de 180/100, pulsos femorales débil y soplo sistólico en epigastrio.
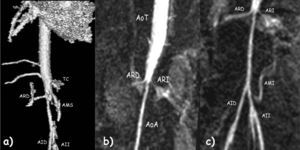
Ecocardiografía con hipertrofia concéntrica del ventrículo izquierdo con función conservada. Angiorresonancia magnética: coartación severa por encima de ambas arterias renales con arterias mesentéricas y tronco celíaco normales (fig. 1). Se inició tratamiento antihipertensivo con tres fármacos y se indicó cirugía que rechazó por sus posibles complicaciones.
Angio resonancia magnética: a) Hipoplasia de aorta abdominal por debajo de arteria mesentérica superior (AMS) y tronco celíaco (TC) y que afecta la salida de ambas arterias renales (ARD, arteria renal derecha). Disminución del tamaño de ambas arterias iliacas, derecha (AID) e izquierda (AII). b y c) Aorta torácica (AoT) normal con severa coartación inframesentérica que afecta la salida de ambas arterias renales. Aorta abdominal (AoA). La arteria mesentérica (AMI) inferior normal.
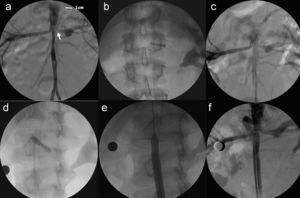
Tratado médicamente durante tres años con mal control presentó múltiples crisis hipertensivas a las que se añadió claudicación, por lo que se propuso tratamiento percutáneo. Se realizó cateterismo por acceso arterial femoral donde se visualizó una hipoplasia severa y difusa de aorta abdominal que se iniciaba inmediatamente por encima de la salida de ambas arterias renales con una longitud de 50mm y con un diámetro mínimo de 4mm. El gradiente hemodinámico a lo largo de este segmento era de 30mmHg. Además había una severa estenosis de arteria renal izquierda (ARI) con un diámetro mímimo de 2mm y una longitud de 16mm con dilatación sacular postestenosis (fig. 2). No había afectación de la arteria renal derecha. Se implantó un palmaz blue stent (Cordis®) 4×18mm premontado con sistema monorraíl, consiguiendo una importante reducción de la TA. En un segundo cateterismo, 2 meses más tarde, se redilató el stent renal con balón de dilatación Sterling (Boston®) 5×30mm al observar un gradiente entre ARI y aorta de 40mmHg con desaparición total del mismo.
Angiografía: a) Estenosis severa de arteria renal izquierda (flecha blanca) e hipoplasia larga de aorta abdominal. Círculo indica medida de calibración que representa 1cm. b y c) Stent situado en ARI. d) Redilatación del stent en ARI. e) Balón de angioplastia en aorta abdominal. f) Angiografía final con stent en ARI y aorta abdominal.
Posteriormente se realizó angioplastia primaria con balón de dilatación OPTA Pro (Cordis®) 7×40mm a nivel de aorta abdominal hipodesarrollada salvando en todo momento el ostium de acceso y el stent renal de ARI previamente implantado. Esta angioplastia fue realizada a baja presión con la idea de comprobar la distensibilidad de la pared y para tomar medidas previa implantación del stent en aorta abdominal. Se implantó un Valeo Vascular Stent (Bard®) 8×56mm premontado con sistema coaxial por debajo del ostium de ARI, salvando en su expansión el origen de ambas arterias renales, adaptándose adecuadamente al nuevo diámetro de la aorta abdominal que fue al doble de su tamaño de origen y con desaparición del gradiente hemodinámico (fig. 2). Actualmente el paciente esta asintomático sin HTA (TA de 90/60 en extremidades superiores e inferiores) ni claudicación de extremidades. Se antiagregó con acido acetil salicílico y clopidogrel, que continua tomando tras haber pasado 4 meses desde la implantación del stent en aorta abdominal.
El tratamiento del SAM depende de la longitud y de la afectación renal y/o visceral1. La cirugía de revascularización ha sido el tratamiento de elección y el bypass aortoaórtico con parche de Dacron tiene su papel preponderante en lesiones de segmentos largos que asocien estenosis de arterias renales y/o viscerales, en cuyo caso debe ir acompañado del bypass de estos vasos o, en algunos casos de estenosis renal de autotransplante. La aortoplastia con parche de material sintético o de pericardio se utiliza en lesiones focales1. En niños debe ser retrasada, si es posible, hasta acabar el crecimiento1,4, ya que estas técnicas son más difíciles y complicadas pudiendo en un futuro ser necesario el reemplazo del injerto2. La experiencia en pediatría es pequeña. Las 2 series mas amplias, en la que se analizan los resultados de 22 (2 días–17 años) y 53 pacientes (edad media 11,9 años) obtienen una tasa de éxito de hasta el 90% de los pacientes utilizando en la mayoría bypass toracaoabdominal (con material sintético o autólogo) o parche de aortoplastia con reconstrucciones renales4,5.
La alternativa a la cirugía es la angioplastia percutánea y/o colocación de stent. Los stent dan soporte al vaso, previenen el recoil elástico y limita la extensión de la lesión intimal disminuyendo las complicaciones como ruptura, disección, perforación y aneurismas1,6,7.
En coartaciones segmentarias, es una alternativa aceptable y efectiva, pero los resultados parecen ser menos satisfactorios en formas complejas3,8.
La implantación de stent en segmentos largos está asociada a buenos resultados a corto e intermedio plazo, y en algunos centros puede ser el tratamiento primario del SAM6,9,10. La problemática ocurre en las formas complejas con estenosis de arterias renales donde el tratamiento sobre la aorta debe combinarse con el tratamiento de arteria renal, que convencionalmente va desde la angioplastia renal en estenosis discretas hasta el autotransplante en estenosis difusas3. La preocupación ocurre cuando la implantación de stent en aorta puede incluir las arterias viscerales por el peligro de su oclusión. Un trabajo reciente analiza 5 pacientes adultos con SAM por enfermedad arteriosclerótica a los que se implantó stent autoexpandibles largos, mayores o iguales de 60mm. En el seguimiento medio de 2 años no hubo reestenosis del stent ni estenosis de ramas de aorta. El stent cubrió la salida de arterias renales y/o viscerales en todos sin demostrarse oclusión o estrechamiento de esas arterias11. Además en este tipo de CoAo la formación de aneurismas puede ser más frecuentes que en coartaciones típicas, de hasta el 22%12.
En nuestro caso no se realizó la implantación de los dos stent, renal y aorta abdominal, en el mismo procedimiento, porque al quedar el extremo proximal del stent renal ligeramente incluido en la aorta había la posibilidad de que al realizar la predilatación con balón de angioplastia y la implantación del stent en aorta abdominal, al expandir este pudiera migrar el stent renal. Se creyó más oportuno esperar unos meses para que el stent renal quedase más adherido a la pared.
En conclusión el tratamiento endovascular con stent en el SAM es un tratamiento seguro y una buena alternativa en lesiones focales que no afectan a arterias viscerales y renales, pero se ha de tener precaución en lesiones cercanas o en las que estas estén involucradas. No hay experiencia en lesiones complejas con afectación visceral ya que no existen series publicadas, pero como hemos demostrado en nuestro caso puede ser una alternativa valida y a pesar del buen resultado inmediato es necesario un seguimiento cuidadoso ya que se desconoce su evolución a largo plazo.