Tratamiento farmacológico del asma
Antes de pasar a describir el tratamiento farmacológico del asma en pediatría, queremos realizar dos matizaciones:
- La guía original recoge la descripción del tratamiento en niños y adultos. En general las evidencias son más sólidas en adultos que en niños, especialmente en el grupo de menor edad (≤ 5 años). La clasificación de las recomendaciones tiene en cuenta este aspecto, y a menudo le asigna una graduación menor que la del adulto, por tratarse de una recomendación extrapolada de la población adulta. Por ejemplo, una recomendación de grado B puede indicar que está basada en una revisión sistemática que agrupa niños y adultos en la que analiza los resultados en el subgrupos de niños; una recomendación D o (√) en el niño pequeño nos puede indicar que no hay datos en esta población y la recomendación es de consenso, extrapolada de los beneficios observados en el adulto o en el niño mayor.
- Nuevas publicaciones relevantes. En la publicación original de la guía mencionábamos que una de las recomendaciones podía cambiar en función de los resultados de un estudio en marcha. Dicho ensayo acaba de publicarse e incorporamos sus resultados en el presente artículo (referencia 13). En lo que se refiere al uso de β-adrenérgicos de larga duración (BALD), señalar que se han publicado nuevos estudios no incluidos en la evaluación de la evidencia en la presente guía, y que se incorporarán en futuras actualizaciones.
- En esta publicación no recogemos los capítulos de educación, organización y anexos, de la guía original, que puede consultarse en la intranet de Osakidetza y en http://www.respirar.org/iniciativas/gpc_paisvasco.htm y http://www.avpap.org
Consideraciones generales
Los objetivos del tratamiento farmacológico del asma son el control de síntomas, incluidos los nocturnos y el asma inducida por el ejercicio, la prevención de las crisis y alcanzar la mejor función pulmonar posible, con mínimos efectos adversos 1.
En términos generales, el control del asma se evalúa con los siguientes estándares 1.
- Síntomas diurnos y nocturnos mínimos.
- Necesidad de medicación de rescate mínima.
- Ausencia de crisis.
- Ausencia de limitaciones en la actividad física.
- Función pulmonar normal (volumen espiratorio forzado en el primer segundo [FEV1] y/o flujo espiratorio máximo [FEM] > 80 % del teórico o del mejor valor).
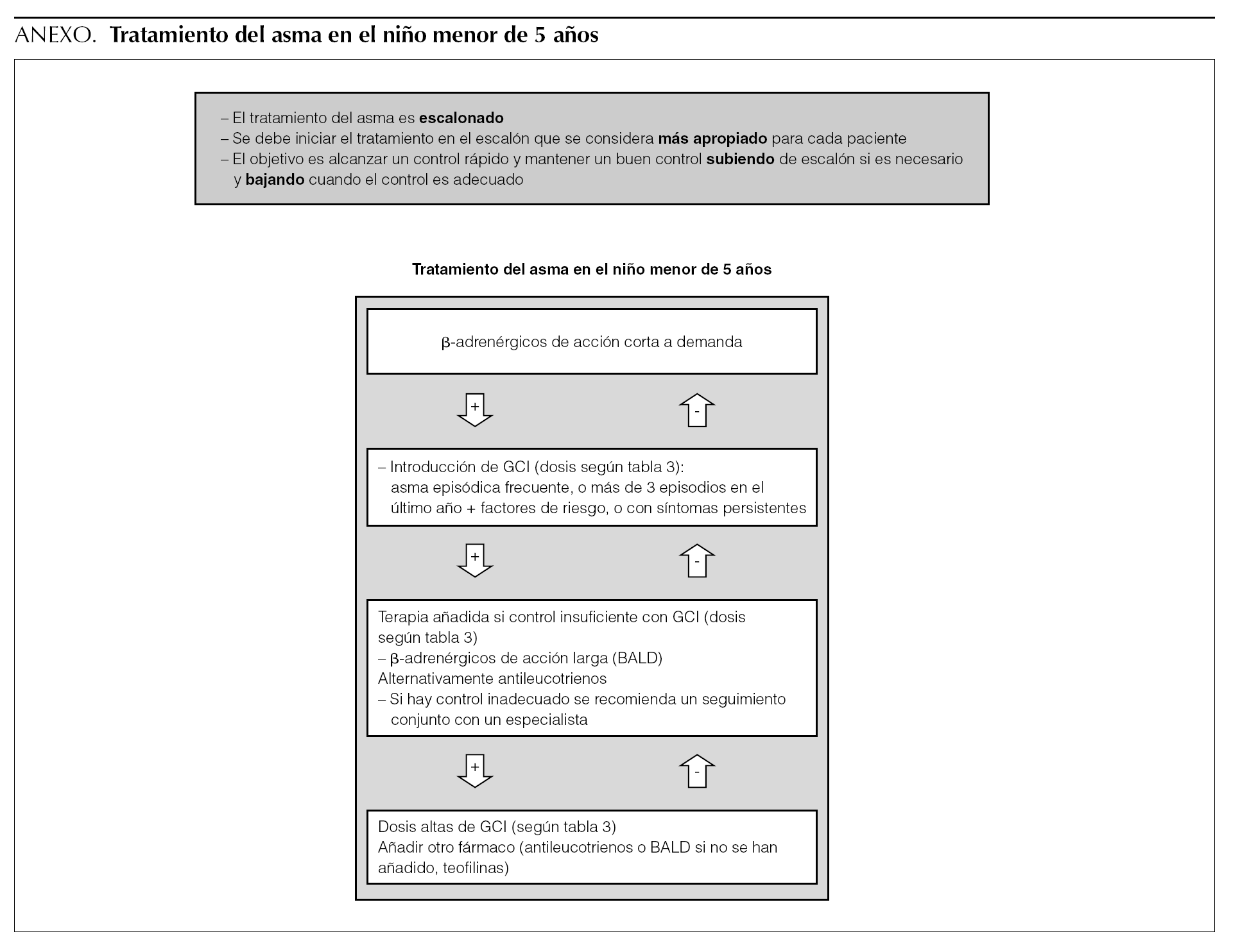
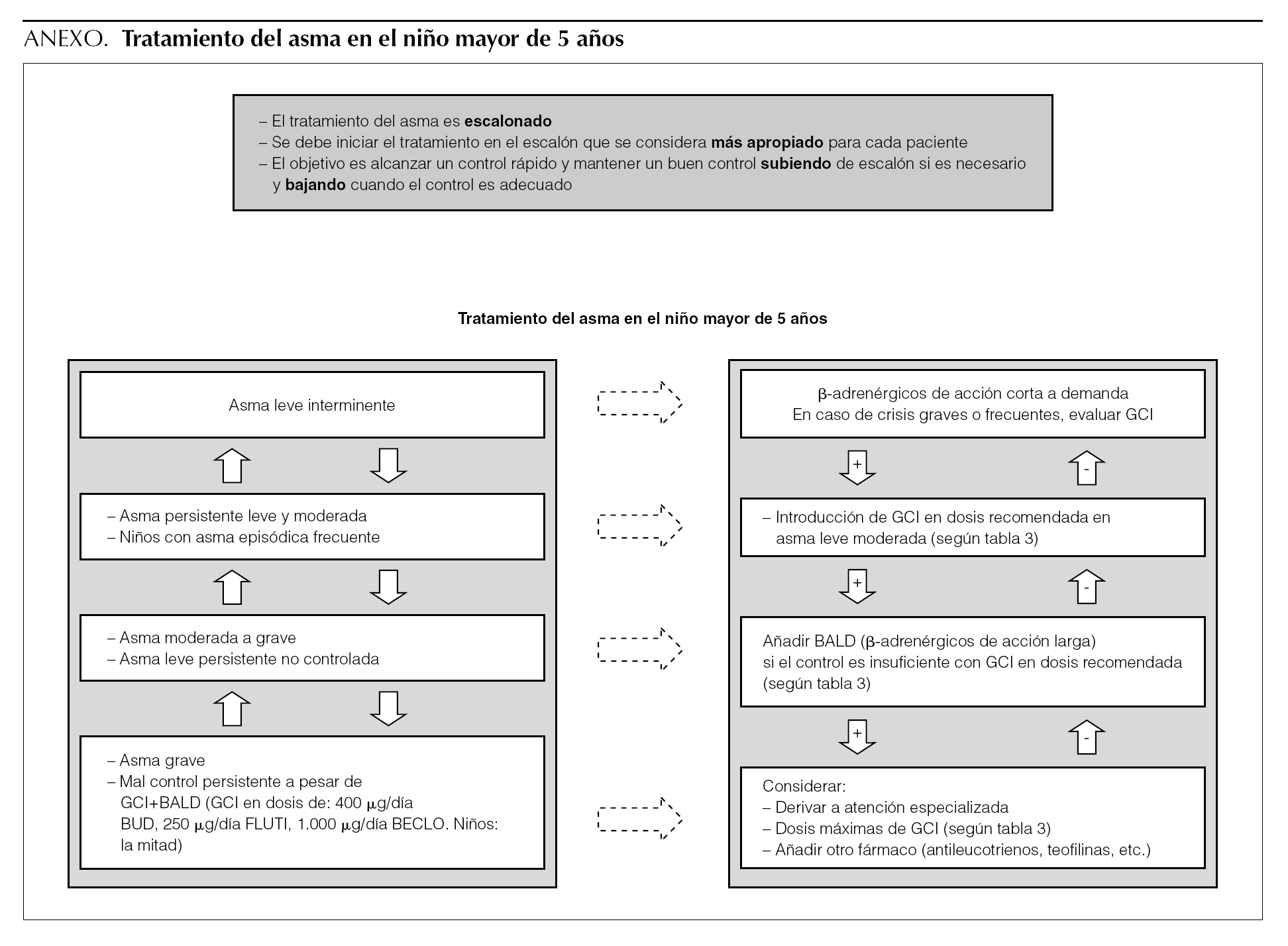
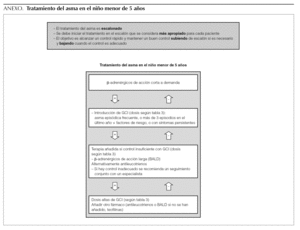
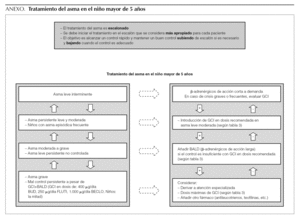
El tratamiento del asma es escalonado. Se debe iniciar en el escalón que se considera más apropiado para cada paciente. El objetivo es alcanzar un control rápido y mantener un buen control subiendo de escalón si es necesario y bajando cuando el control es adecuado.
Antes de cambiar el tratamiento se debe analizar el cumplimiento del tratamiento instaurado, la técnica de inhalación y los factores desencadenantes.
Asma leve intermitente
Cuestiones a responder
- ¿Cómo se debe tratar el asma leve intermitente?
Los β-adrenérgicos de corta duración (salbutamol, terbutalina) son los fármacos de elección como medicación de rescate, ya que actúan con más rapidez y/o con menos efectos adversos que otras alternativas 1.
Habitualmente, el asma leve intermitente puede ser controlada sólo con β-adrenérgicos a demanda 1-3. No obstante, en pacientes que presentan crisis graves (p. ej., crisis que requieren hospitalización) o frecuentes (niños que presentan crisis frecuentes y que permanecen asintomáticos entre ellas) 4,5 se debería considerar la introducción del glucocorticoide inhalado (GCI).
A pesar de que el asma leve intermitente se caracteriza por síntomas poco frecuentes y función pulmonar normal, los estudios fisiopatológicos indican que persiste la inflamación de la vía aérea 6.
Resumen de la evidencia
1++ Los β-adrenérgicos de corta duración son los fármacos de elección como medicación de rescate 1.
4 Habitualmente el asma leve intermitente puede ser controlada de forma adecuada sólo con β-adrenérgicos a demanda 1-3.
Recomendación
D Se recomienda tratar el asma leve intermitente con β-adrenérgicos de corta duración a demanda.
D Los pacientes con asma intermitente pero con exacerbaciones graves o frecuentes pueden requerir tratamiento crónico con GCI.
(√) Son necesarios estudios que evalúen el impacto a largo plazo del tratamiento de fondo con GCI sobre el pronóstico de los pacientes con asma leve intermitente.
Introducción de la terapia preventiva con GCI
Cuestiones a responder
- Los GCI: ¿son el tratamiento preventivo de elección en el asma persistente de cualquier tipo de gravedad?
- Los GCI: ¿son eficaces en el tratamiento de los lactantes y niños preescolares con asma?
- ¿Cuándo se debe iniciar el tratamiento con GCI? ¿Son los GCI efectivos en el tratamiento del asma leve persistente?
- ¿Cuál es la efectividad de beclometasona, budesonida y fluticasona con relación a la dosis? ¿A qué dosis se deberían emplear los distintos corticoides inhalados en el tratamiento de mantenimiento del asma?
- ¿Se debe comenzar con dosis altas de GCI para disminuir progresivamente o con dosis habituales?
- ¿Los GCI utilizados una vez al día son efectivos en el tratamiento del asma leve y moderada en comparación con la misma dosis utilizada dos veces al día?
- ¿Cuáles son los efectos adversos de los GCI sobre la densidad mineral ósea, el crecimiento en niños, la toxicidad ocular y la supresión del eje hipotálamo-hipófisis-suprarrenal?
- ¿Qué papel tienen otros tratamientos preventivos (antileucotrienos, cromonas, inmunoterapia, otros)?
Eficacia de los GCI
Los GCI mejoran los síntomas y la función pulmonar y previenen las exacerbaciones de asma con un perfil aceptable de seguridad. Son el tratamiento preventivo más efectivo del asma de distintos grados de gravedad 1.
Consideraciones en lactantes y niños preescolares
En este grupo de edad es importante diferenciar los niños con sibilancias y factores de riesgo para desarrollar un asma persistente atópica, de los que presentan sibilancias leves sólo en el curso de infecciones virales y sin factores de riesgo. En estos últimos, no hay evidencia a favor de mantener un tratamiento crónico con GCI 7 mientras que los lactantes con síntomas fuera de episodios virales o aquellos con factores de riesgo de desarrollar asma podrían beneficiarse del tratamiento con GCI.
Hasta hace poco, la recomendación de utilizar GCI en el niño menor de 5 años se basaba fundamentalmente en la extrapolación de datos de estudios en niños mayores. Recientemente se han publicado una revisión sistemática 8 y diversos ensayos clínicos 9,10 realizados exclusivamente en esta población y que confirman los beneficios de los GCI en la mejora de síntomas y reducción de exacerbaciones. La revisión sistemática 8 incluye niños de 0 a 6 años con diagnóstico médico de asma y excluye los ensayos con pautas intermitentes de GCI con el objeto de evitar la inclusión de niños con sibilancias por virus en vez de asma. Estos trabajos confirman la eficacia de GCI en niños pequeños con diagnóstico médico de asma. La definición de asma entre los distintos estudios incluidos en la revisión es muy variable (niños con episodios de sibilancias en los meses o semanas previas al estudio, sibilancias persistentes y tendencia atópica, niños con una crisis mensual en los previos 3 meses o síntomas la mayor parte de los días, etc.) y se demuestra la eficacia del GCI en este grupo de edad tan heterogéneo.
En niños de 2-5 años, los GCI mejoraron la hiperreactividad bronquial (HRB) y la función pulmonar en un pequeño ensayo a corto plazo 10. Sin embargo, no hay estudios que comparen el impacto a largo plazo del tratamiento con GCI en la función pulmonar en el niño pequeño. Las evidencias proceden de estudios que incluyen niños desde los 6 años; y favorecen el tratamiento precoz (< 2 años de evolución de la enfermedad) con GCI 11, mientras que si la introducción del tratamiento con GCI se demora, la función pulmonar a largo plazo no mejora a pesar del tratamiento 12.
Recientemente, el ensayo PEAK 13 ha estudiado la eficacia de utilizar fluticasona frente a placebo en niños de 2-3 años con el índice de Castro modificado, positivo (tabla 6 del capítulo pronóstico del asma), con el objeto de evaluar si el tratamiento precoz con GCI en el niño pequeño puede modificar el curso de la enfermedad. Los niños recibieron 176 μg diarios de fluticasona (en 2 tomas) o placebo durante 2 años; los resultados se evaluaron al tercer año (año de observación sin recibir tratamiento). Durante el período de tratamiento (2 años) los GCI aumentaron la proporción de días sin síntomas y disminuyeron la frecuencia de exacerbaciones y el uso de medicación de rescate. Sin embargo, al tercer año no se observaron diferencias significativas entre el grupo tratado y no tratado con GCI. En el grupo tratado, el crecimiento fue 1,1 cm menor a los 24 meses, y 0,7 cm al final del estudio (a los 3 años). Del estudio se concluye que el tratamiento precoz con GCI en niños de 2-3 años con más de 3 episodios de sibilancias y factores de riesgo de asma mejora los síntomas y disminuye los episodios de sibilancias mientras dura el tratamiento, pero no modifica el pronóstico del asma. El riesgo de sibilancias persiste al finalizar el tratamiento, con independencia de si ha recibido o no GCI en los 2 años previos.
Cuándo iniciar el tratamiento con GCI. Papel de los GCI en el asma leve persistente
Hasta ahora, el umbral de cuándo introducir el tratamiento con GCI no estaba del todo claro. En los últimos años se han publicado varios ensayos clínicos que abordan esta cuestión, particularmente en el asma leve persistente 11,12,14.
El estudio Steroid Treatment as Regular Therapy (START) 11 evaluó la eficacia del tratamiento precoz (asma < 2 años de evolución) con budesonida (400 μg/día en >11 años y 200 μg/día en menores) frente a placebo en 7.165 adultos y niños (a partir de 6 años) con asma leve persistente definida como aquellos pacientes con síntomas (sibilancias, tos, disnea tirantez, despertar nocturno por síntomas) al menos una vez por semana pero no diariamente, y con función pulmonar normal. El tratamiento precoz con budesonida redujo la frecuencia de reagudizaciones graves (hazard ratio [HR] 0,56; intervalo de confianza del 95 % [IC 95 %]: 0,45-0,71; número de pacientes necesario a tratar [NNT] a 3 años = 43), mejoró el control de los síntomas y produjo una mejora a largo plazo en la función pulmonar. El tratamiento fue bien tolerado; en niños la velocidad de crecimiento fue ligeramente inferior con budesonida (0,43 cm/año) en los primeros 2 años, pero no al tercer año 11. Debido a la relevancia de este estudio, hemos considerado como umbral de cuándo introducir el tratamiento con GCI los criterios de inclusión del mismo 15.
El estudio Childhood Asthma Management Program (CAMP) 12 analizó la eficacia de los GCI durante 4-6 años en niños de 5 a 12 años con asma leve y moderada de varios años de evolución. En este último estudio también se observó un mejor control del asma en los niños tratados con GCI (con reducción de la frecuencia de hospitalizaciones y visitas a urgencias), pero a diferencia del estudio START no se produjo mejora en la función pulmonar (FEV1 posbroncodilatación) a largo plazo, parámetro propuesto como indicador de crecimiento pulmonar. Esta diferencia podría atribuirse a que los pacientes del estudio CAMP tienen asma de varios años de evolución. En un análisis estratificado del estudio CAMP, los pacientes que continuaron con una pérdida de función pulmonar, mostraron en el análisis multivariante que el factor predictivo único era la eosinofilia periférica. Todos estos datos apuntan a la importancia de introducir el tratamiento con GCI de forma precoz.
Algunas guías 4,5 recomiendan tratar a los niños de cualquier edad que presentan episodios frecuentes de sibilancias y que no presentan síntomas entre las crisis. Esta recomendación requiere confirmación a través de ensayos clínicos aleatorizados (ECA) ya que actualmente, en el asma infantil que no presenta síntomas entre las crisis, no es posible establecer un umbral claro de cuándo (a partir de cuántas crisis) se debería introducir el tratamiento con GCI. En el niño de 2-3 años con síntomas frecuentes de asma (más de 3 episodios de sibilancias en el último año y factores de riesgo de asma) el tratamiento con GCI mejora los parámetros clínicos pero no cambia la historia natural de la enfermedad 13.
Resumen de la evidencia
1++ Los GCI son el tratamiento preventivo más efectivo del asma de distintos niveles de gravedad, incluyendo el asma leve persistente, en niños de todas las edades 11,12,14.
1++ En lactantes y niños preescolares con diagnóstico médico de asma los GCI mejoran el control del asma en lo que se refiere a síntomas, disminución del riesgo de exacerbaciones y el uso de medicación de rescate 8-10. En niños de 2-5 años, los GCI mejoraron la HRB y la función pulmonar en un ensayo a corto plazo 10. La definición de asma entre los distintos estudios es muy variable, y se demostró la eficacia del GCI en este grupo de edad tan heterogéneo.
1++ En niños de 2-3 años con más de 3 episodios de sibilancias en el último año y factores de riesgo de asma, el tratamiento con GCI mejora los síntomas y disminuye los episodios de sibilancias mientras dura el tratamiento, pero no modifica la historia natural de la enfermedad a los 3 años 13.
1++ El tratamiento precoz con GCI en el asma leve persistente en adultos y niños a partir de los 6 años reduce las reagudizaciones graves, mejora el control de los síntomas y mejora la función pulmonar a largo plazo 11.
1++ En niños entre 5 y 12 años con asma de varios años de evolución los GCI mejoran la función pulmonar a corto plazo pero no a largo plazo 12.
Recomendación
A Los GCI son los fármacos preventivos de elección.
A Los GCI son el tratamiento de elección en lactantes y niños preescolares con diagnóstico médico de asma*.
A Todos los adultos y niños (a partir de los 6 años) con asma leve persistente** deben recibir GCI.
A Se recomienda la introducción precoz (< 2 años de evolución) del tratamiento con GCI en el asma leve persistente**, tanto en adultos como en niños a partir de los 6 años de edad.
B En el niño pequeño con episodios frecuentes de sibilancias (> 4 en el último año) y factores de riesgo de asma*** puede recomendarse el tratamiento con GCI con el objetivo de mejorar los síntomas, aunque no hay evidencia de que modifique el pronóstico de la enfermedad.
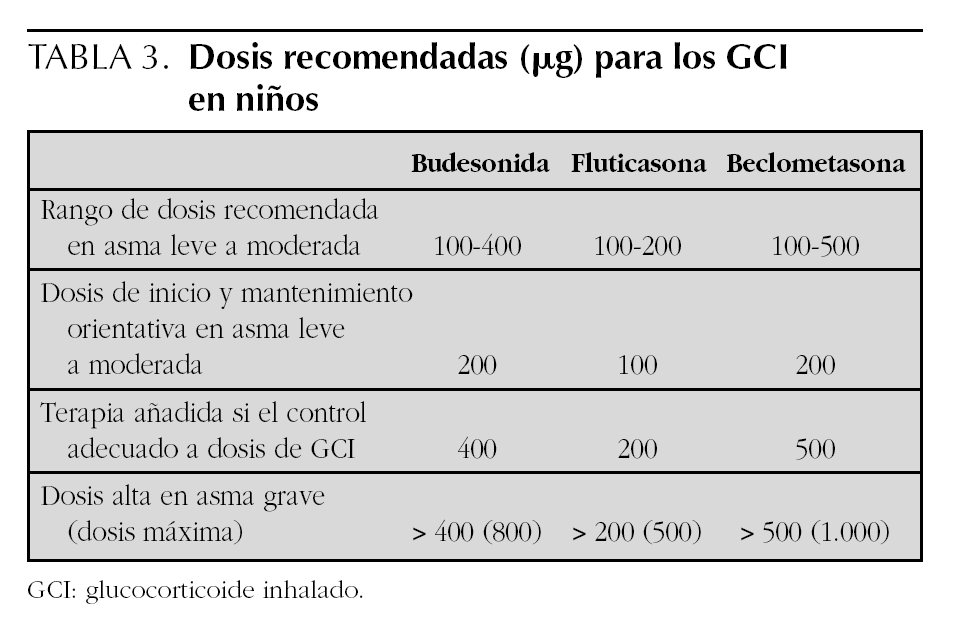
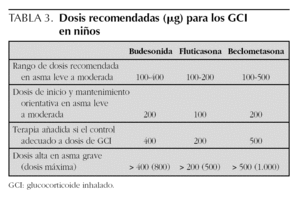
Dosis de inicio y de mantenimiento de GCI. Equivalencia (tabla 1)
Las preguntas relacionadas con la dosis de los GCI han sido abordadas en varias revisiones sistemáticas que analizan la curva de dosis-respuesta para beclometasona, budesonida y fluticasona 17-22, así como comparaciones entre éstas 23. Hay gran concordancia en recomendar la dosis mínima efectiva de GCI.
Los GCI tienen una curva de dosis-respuesta relativamente plana para la eficacia; sin embargo, los efectos adversos como disfonía o candidiasis orofaríngea son más frecuentes en dosis más altas.
Para budesonida, el 80 % del beneficio se logra en dosis de 400 μg/día y el 90 % en dosis de 300-600 μg/día 22.
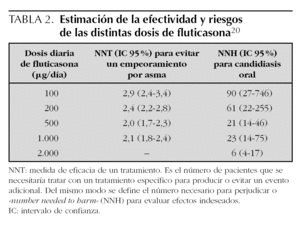
Con fluticasona el pasar de 200 a 500 μg/día apenas produce beneficio adicional y, sin embargo, se asocia a una frecuencia más elevada de candidiasis 20,21. Powell, partiendo de datos procedentes de revisiones Cochrane, ha estimado el número de pacientes necesario a tratar (NNT) para evitar un empeoramiento de asma y los NNH (número de pacientes necesario a perjudicar) para producir candidiasis oral para distintos rangos de dosis de fluticasona en asma leve y moderada (véase tabla 2) 20.
En cuanto a la eficacia y seguridad comparativa entre los distintos GCI disponibles en el mercado, está claramente establecido que tanto la eficacia como los efectos adversos de los GCI son un efecto de clase y son, por tanto, comunes a los distintos GCI disponibles en el mercado. La equivalencia entre los distintos GCI parece clara con fluticasona ya que requiere la mitad de la dosis que con budesonida o beclometasona debido a su mayor potencia 23. Fluticasona, en comparación con budesonida y beclometasona en dosis 1:2 produce ligeras mejoras en la función pulmonar, pero se asocia a más efectos adversos locales (faringitis) 23. Estos datos apoyan el utilizar fluticasona a la mitad de la dosis que beclometasona y budesonida.
La mayor parte de los ensayos clínicos a largo plazo están realizados con budesonida o fluticasona y, en menor medida con beclometasona.
Existen otros CGI no comercializados en nuestro país como mometasona, que al igual que fluticasona, a mitad de la dosis tiene un efecto equivalente a beclometasona y budesonida, pero su seguridad relativa no está establecida 1. Ciclesonida es otro GCI nuevo aún no comercializado, cuyos datos sobre eficacia y seguridad son muy limitados 24.
En cuanto a las dosis de inicio, una reciente revisión Cochrane 16 concluye que en asma leve y moderada se alcanza un control similar de los síntomas y de la función pulmonar comenzando con las dosis bajas o moderadas, respecto a la estrategia de comenzar con dosis altas para reducirlas gradualmente «step-down» (dosis referida a adultos). Las dosis de inicio moderadas (≥ 400 a < 800 μg) fueron ligeramente más eficaces que las bajas (< 400 μg/día) en la mejora del FEM (diferencia de medias 11,14 l/min [IC 95 %: 1,34-20,93]) y de los síntomas nocturnos. No se observaron beneficios con dosis más altas (salvo una tendencia en mejorar la HRB). Los resultados fueron consistentes para los distintos dispositivos de inhalación y GCI, tanto en niños como en adultos.
Otro aspecto que hay que tener en cuenta es la posibilidad de utilizar los GCI en dosis única diaria. Este aspecto ha sido estudiado en varios ensayos que comparan la pauta de una administración diaria frente a dos, tanto en niños como en adultos 25-31. Además, el estudio START utilizó la pauta de budesonida una vez al día en el asma leve persistente 11. En general los datos que apoyan el uso de la dosis única diaria son más consistentes con budesonida que con fluticasona (en el caso de beclometasona no hay datos suficientes como para recomendar esta pauta). También son más consistentes en asma leve que en moderada.
Resumen de la evidencia
1++ La mayor parte de los pacientes con asma leve o moderada pueden ser tratados adecuadamente con dosis bajas o moderadas de GCI 17-22. Los datos no son aplicables al asma grave y algunos pacientes podrían beneficiarse de dosis altas.
Fluticasona, en comparación con budesonida o beclometasona en dosis 1:2 produce ligeras mejoras en la función pulmonar, pero se asocia a más efectos adversos locales (faringitis). Estos datos apoyan utilizar fluticasona a la mitad de la dosis que beclometasona y budesonida.
1++ Dosis de inicio: en asma leve o moderada se alcanza un control similar de los síntomas y de la función pulmonar comenzando con las dosis bajas o moderadas, respecto a la estrategia de comenzar con dosis altas para reducirlas gradualmente. Las dosis de inicio moderadas son ligeramente más eficaces que las bajas en la mejora del FEM y de los síntomas nocturnos. A dosis más altas no se observan beneficios 16.
1+ En adultos y niños mayores de 4-5 años con asma leve estable que requieren GCI, la administración del GCI en una única toma diaria tiene una eficacia similar a la misma dosis dividida en 2 tomas 25-31. Los estudios son más consistentes para budesonida.
En pacientes con asma moderada, la administración con fluticasona Accuhaler® en una única dosis diaria presenta una eficacia ligeramente menor que en 2 tomas 25-28, aunque es clínicamente similar en el asma leve. Los datos son insuficientes como para recomendar beclometasona en una única administración diaria.
Recomendación
A La mayor parte de los pacientes con asma leve o moderada pueden ser tratados adecuadamente con dosis bajas o moderadas de GCI.
A Se asume equivalencia 1:1 entre budesonida y beclometasona y 1:2 con fluticasona.
A Dosis de inicio: en niños que requieren GCI no se recomienda comenzar con dosis altas para reducirlas gradualmente, sino iniciar el tratamiento con GCI con dosis adecuada a la gravedad (habitualmente dosis bajas o moderadas).
A Frecuencia de dosis: los niños mayores de 4-5 años con asma leve estable pueden ser tratados con un GCI en una dosis diaria. Los datos son más sólidos con budesonida. En pacientes con asma moderada hay más incertidumbre.
() Al pasar de dos administraciones diarias a una única, es necesario vigilar la respuesta para asegurarse de que el paciente sigue bien controlado.
Seguridad de los GCI: efectos adversos a nivel sistémico
Resumen de la evidencia
Crecimiento en niños:
1+ Las evidencias muestran de forma consistente una reducción en la velocidad de crecimiento de aproximadamente 1 cm o menor durante el primer año de tratamiento en niños con asma leve o moderada. Sin embargo, este efecto es de pequeña magnitud y no parece mantenerse en el tiempo 11,12,32-35.
2+ Las evidencias sobre la repercusión de los GCI en talla adulta son consistentes: parecen tener poca repercusión en la talla adulta 32,33,35.
Osteoporosis y densidad mineral ósea (DMO):
1+ En niños el uso de GCI en dosis bajas o moderadas no tiene efectos sobre la DMO 3,11,34,36.
2+ En estudios observacionales no se ha visto asociación entre consumo de GCI en niños y adolescentes y aumento del riesgo de fracturas 37.
1+ En adultos con asma, dosis de GCI hasta 1.000 μg/ día durante 2-3 años no se han asociado a efectos sobre la DMO o las fracturas vertebrales. Dosis más altas se asociaron con marcadores bioquímicos de aumento en el recambio óseo 38,39.
Toxicidad ocular:
2+ En niños y adultos jóvenes, las dosis bajas y moderadas no tienen efectos significativos en la incidencia de cataratas subcapsulares o glaucoma, pero hay que tener en cuenta que en esta población el riesgo basal es prácticamente nulo 11,12,33.
Supresión del eje hipotálamo-hipófisis-suprarrenal:
4 En general, los niños tratados con dosis bajas o medias de GCI pueden experimentar efectos clínicamente insignificantes sobre el eje 33,34.
Sin embargo, en raras ocasiones se han descrito casos de crisis adrenales asociadas al uso de dosis altas de fluticasona (> 500 μg/día, hasta 1.500 μg/día) 40.
Recomendación
A En niños que requieren GCI se deben utilizar dosis bajas o moderadas. A estas dosis recomendadas los GCI son seguros, y el equilibrio entre el beneficio y el riesgo es favorable. Utilizar dosis elevadas confiere muy poco beneficio adicional, exponiendo a un riesgo innecesario de efectos adversos locales y sistémicos.
(√) Los médicos y personal de enfermería que realizan educación sanitaria a pacientes asmáticos deberían informar a los pacientes acerca del buen perfil de seguridad de los GCI y de la necesidad de utilizarlos en las dosis adecuadas y sin interrumpir el tratamiento.
Otros tratamientos preventivos en monoterapia
Cromonas. Una revisión Cochrane 41 recoge estudios realizados con cromoglicato (la mayoría de diseño cruzado) sobre un total de 1.074 niños. No se observaron diferencias significativas entre cromoglicato y placebo sobre la proporción de días sin síntomas; tampoco para otras variables; además sugiere posible sesgo de publicación. En cuanto a nedocromilo, el estudio CAMP 12 mostró una eficacia inferior a los GCI.
Antileucotrienos. Las evidencias sobre la eficacia comparativa de antileucotrienos en comparación con GCI se derivan de una revisión sistemática Cochrane 42. Concluye que con dosis de 400 μg de beclometasona o equivalente (200 μg de fluticasona), los GCI son claramente superiores a montelukast 10 mg/día o zafirlukast 20 mg/12 h en prevenir exacerbaciones, así como en parámetros de función pulmonar, control de síntomas y necesidad de medicación de rescate. La superioridad de GCI se evidencia a las 4-6 semanas y se mantiene durante más de 37 semanas. En niños, con un único ensayo clínico abierto de 24 semanas de duración incluida en la revisión sistemática, se requiere cautela a la hora de extrapolar los resultados. Dicho estudio 43 está realizado en niños de 6 a 11 años con asma leve: no se observaron diferencias entre montelukast y beclometasona, pero el ensayo no cumplía los criterios de equivalencia previamente definidos.
Inmunoterapia. En una revisión Cochrane 44 con 3.506 pacientes se analizó la eficacia de la inmunoterapia específica (ácaro doméstico, polen, pelo de animales, moho, alérgenos múltiples) frente a placebo en el asma. Se observó una reducción significativa en los síntomas y en el uso de medicación, mejoría de la HRB específica y no específica. No se observó ningún efecto sobre la función pulmonar. Sólo se encontró un único estudio que comparaba la inmunoterapia frente a GCI, y los datos son insuficientes para establecer conclusiones. En estudios prospectivos y retrospectivos se han descrito reacciones adversas sistémicas con la inmunoterapia, con una frecuencia estimada de 1 x 1.250-2.206 inyecciones. La mayoría de las reacciones fueron leves. Las muertes por inmunoterapia fueron muy raras (con estimaciones que varían de 1 x 1 millón a 1 x 2 millones de inyecciones). La dosis y duración óptimas de la inmunoterapia no están bien establecidas. Se requieren más estudios para determinar si determinados subgrupos de pacientes podrían beneficiarse más del tratamiento.
Terapias alternativas
En nuestro medio la homeopatía es probablemente la terapia alternativa más utilizada en el asma, sobre todo en niños. Por esta razón el profesional sanitario debe tener en cuenta esta posibilidad y conocer en qué evidencias se sustentan las terapias alternativas, de cara a proporcionar una información adecuada.
Homeopatía: en una revisión Cochrane 45 se analizaron los datos de 6 ensayos, de calidad variable, con un total de 556 pacientes. Utilizaron tratamientos homeopáticos diferentes, lo que impidió la combinación de resultados. Ningún ensayo informó de diferencias significativas en escalas validadas de síntomas, y los resultados sobre la función pulmonar fueron contradictorios.
Acupuntura: en una revisión Cochrane 46 se analizaron los datos de 11 estudios con 324 pacientes. La información de los ensayos fue deficiente y la calidad inadecuada. Hubo variación en el tipo de acupuntura y en los resultados medidos. No se encontraron diferencias significativas o clínicamente relevantes para la acupuntura comparada con la acupuntura simulada. Por otro lado, en una revisión de casos 47 se encontraron casos aislados de neumotórax u otros efectos adversos graves.
Terapia manual (incluyendo quiropráctica y masajes): existe una revisión Cochrane 48 con 5 ensayos clínicos, la mayoría de ellos de calidad deficiente. No se encontraron diferencias significativas entre la manipulación espinal quiropráctica y una maniobra simulada. No es posible obtener conclusiones sobre otras terapias manuales (fisioterapia, etc.).
Resumen de la evidencia
1+ Las cromonas son poco efectivas cuando se utilizan como tratamiento preventivo del asma en niños o adultos 12,41.
1+ En comparación con placebo, los antileucotrienos tienen una eficacia modesta en la mejora de síntomas y de la función pulmonar 1.
1++ En adultos con asma leve o moderada los GCI son claramente superiores a los antileucotrienos en la prevención de exacerbaciones, en la mejora de la función pulmonar y el control de síntomas. Los antileucotrienos son bien tolerados a largo plazo, pero los abandonos de tratamiento por mal control del asma son más frecuentes en comparación con los que toman GCI 42.
En niños, incluyendo niños menores de 5 años 49 montelukast es seguro a corto plazo y produce modesta mejora clínica frente a placebo, pero no hay suficientes estudios comparativos con otras terapias 42.
1+ La inmunoterapia es más eficaz que el placebo para mejorar los síntomas y disminuir las necesidades de medicación pero no está establecida su eficacia frente a GCI. Además, debe considerarse la posibilidad de efectos adversos sistémicos graves 44.
1+ No hay evidencia suficiente como para evaluar de forma fiable el papel de la homeopatía en el asma 5.
Recomendación
A Los GCI continúan siendo el tratamiento preventivo de elección, ya que son más eficaces que las cromonas y los antileucotrienos.
A Por su menor eficacia en comparación con los GCI, no se recomienda el uso de antileucotrienos en monoterapia de mantenimiento en niños y adultos.
A No se recomienda el uso de cromonas en el asma, ya que tienen una eficacia muy limitada.
A La inmunoterapia es más eficaz que el placebo en mejorar los síntomas y disminuir las necesidades de medicación. No está establecida su eficacia frente a GCI y puede producir efectos adversos, por lo que no se recomienda su uso en monoterapia.
A No se recomienda el uso de terapias alternativas, como la homeopatía, acupuntura o las terapias manuales.
Terapia añadida a GCI
¿Son los b -adrenérgicos de larga duración (BALD) los fármacos de elección como terapia añadida?
En el asma leve persistente no controlada con GCI, ¿es preferible añadir un BALD a aumentar la dosis de GCI?
¿Existen diferencias entre administrar los GCI y los BALD en un único dispositivo de inhalación y utilizarlos por separado?
¿Cuál es el papel de las teofilinas, antileucotrienos u otros tratamientos como terapia añadida?
¿Cuál es el papel de los BALD administrados a demanda frente a utilizarlos en dosis fijas?
Consideraciones generales. BALD como terapia añadida a GCI
Antes de añadir un nuevo fármaco a la terapia preventiva con GCI es necesario revisar el cumplimiento del tratamiento y la técnica de inhalación, evaluar los factores desencadenantes y la continuidad de cuidados 1.
Entre las posibles opciones terapéuticas, los BALD (salmeterol y formoterol) continúan siendo los fármacos de elección como terapia añadida 1-3,50,51. En el adulto, añadir un BALD al tratamiento con GCI mejora la función pulmonar, los síntomas y la frecuencia de exacerbaciones aumentando ligeramente los efectos adversos 33,52. El beneficio de añadir un BALD es superior a aumentar la dosis de GCI.
No obstante, la dosis exacta de GCI a partir de la cual se recomienda introducir la terapia añadida con BALD antes de aumentar la dosis de GCI no está de todo clara. En general las distintas guías recomiendan introducir un BALD cuando el control no es adecuado a dosis de 200-400 μg/día de GCI en los niños 1,2,51.
La dosis exacta de GCI a partir de la cual se recomienda introducir la terapia añadida con BALD antes de aumentar la dosis de GCI no está del todo clara. En general, las distintas guías recomiendan introducir un BALD cuando el control no es adecuado en dosis de 200-400 μg/día de GCI en los niños 1,2,51.
En cuanto a la seguridad de los BALD, en general la tolerancia es buena. En la revisión sistemática de Walters 52 se observó mayor riesgo de reacciones adversas en comparación a placebo (OR: 1,35; IC 95 %: 1,03-1,77). El dolor de cabeza fue más frecuente con los BALD y no se observaron diferencias en el temblor o en las palpitaciones. En niños se observó una tendencia no significativa a presentar más exacerbaciones con BALD que con placebo, por lo que analizamos con detalle el papel de los BALD en niños. Finalmente, el ensayo clínico SMART (población > 12 años) fue paralizado debido a que en un análisis intermedio 53 se encontró un incremento pequeño pero significativo en las muertes relacionadas con asma con salmeterol, especialmente en pacientes afroamericanos y en los que no recibían GCI. Por ello, en países como Estados Unidos la ficha técnica de los BALD incluye una advertencia en este sentido.
BALD en niños
En los estudios realizados exclusivamente en niños 33,54-57 y en el análisis de subgrupos realizado en una revisión sistemática 52, los BALD han demostrado mejorar los síntomas y la función pulmonar. Los datos sobre las exacerbaciones son más inciertos y se requieren más estudios sobre este último aspecto. Recientemente se ha publicado un ensayo clínico con la asociación de formoterol y budesonida, que además de adultos incluye a niños a partir de 4 años; en dicho estudio se observó una disminución en la frecuencia de exacerbaciones consistente en todas las edades 58, pero no proporciona los datos en el subgrupo de niños. En una revisión Cochrane 59 publicada después de redactar esta guía, pero que por su importancia comentamos en esta publicación, y que incluye pacientes con asma moderada, mal controlados, la adición de BALD a GCI (mediana de la dosis 400 μg/día) frente a duplicar la dosis de GCI (800-1.000 μg/día) mejoró la función pulmonar, disminuyó los síntomas y la medicación de rescate, pero no encontró diferencias estadísticamente significativas en la frecuencia de crisis. No se observó heterogeneidad entre los ensayos, a pesar de la inclusión de participantes de diferentes edades. La metarregresión sugiere que el beneficio de los BALD sobre las exacerbaciones podría disminuir con la duración del tratamiento y con la mayor dosis de GCI en la combinación. Incluye pocos estudios en niños. Por otro lado, hay que tener en cuenta que en nuestro medio, según la ficha técnica, formoterol no está recomendado en niños menores a 6 años, y salmeterol tampoco está recomendado en menores de 4 años.
BALD en asma leve persistente
Uno de los aspectos que se ha modificado respecto a las guías anteriores es el papel de los BALD en el asma leve persistente 59. Así el ensayo OPTIMA 14, evaluó la eficacia de budesonida en dosis bajas frente a budesonida más formoterol en asma leve persistente en pacientes mayores de 12 años, tratados o no previamente con GCI. En el grupo de pacientes que no recibían GCI previamente, budesonida en dosis de 200 μg/día más formoterol fue igual de eficaz que budesonida sola en prevenir la tasa de exacerbaciones graves; sin embargo, ambos tratamientos fueron superiores al placebo, riesgo relativo (RR) de exacerbaciones graves de budesonida frente a placebo 0,40 (IC 95 %: 0,27-0,59). En el grupo de pacientes que recibía previamente GCI se compararon 4 tratamientos: budesonida 200 μg/día, budesonida 200 μg/día + formoterol, budesonida 400 μg/día y budesonida + formoterol 400 μg/día. En este grupo de pacientes, añadir formoterol a 200 o 400 μg de budesonida redujo a la mitad el riesgo de exacerbaciones graves por paciente-año, RR 0,57 (IC 95 %: 0,46- 0,72). La dosis de 400 μg/día fue ligeramente más eficaz que la de 200 en la mejora de síntomas y función pulmonar, pero sin diferencias en las exacerbaciones. En comparación con budesonida 400 μg/día, la asociación de budesonida 200 μg/día con formoterol fue más eficaz en la reducción de la tasa de exacerbaciones, RR 0,71 (IC 95 %: 0,52-0,96). Los resultados de este estudio son útiles para clarificar la estrategia que se va a seguir en el asma leve persistente, ya que muestran que muchos pacientes con asma leve se pueden beneficiar de GCI en dosis bajas y, si el control sigue siendo inadecuado, la opción más favorable es añadir un BALD.
Combinaciones de GCI y BALD en un único dispositivo
No hay diferencias en eficacia entre dar la combinación de un GCI con un BALD en el mismo dispositivo frente a utilizar 2 dispositivos diferentes. Para la asociación de fluticasona y salmeterol se han publicado 4 ensayos clínicos (12-28 semanas de duración) en un total 1.375 pacientes (niños y adultos), y ambas pautas fueron similares en términos de función pulmonar, síntomas y medicación de rescate; tampoco se observaron diferencias en cuanto a efectos adversos 60-63. El metaanálisis de los 4 ensayos se asoció con una mejora estadísticamente significativa a favor de la asociación, aunque el beneficio observado (5,4 l/min) era clínicamente irrelevante 64.
No hay evidencia directa que sugiera que las combinaciones mejoren el cumplimiento del tratamiento. Las asociaciones pueden ser útiles en pacientes con asma estable, siempre que el inhalador combinado se ajuste con las necesidades de cada medicamento por separado. Como posibles ventajas hay que señalar que pueden facilitar el que no se discontinúe el corticoide inhalado, y que no son más caros. Las posibles desventajas serían que puede favorecer el mantenimiento de los pacientes con más medicación que la estrictamente necesaria y que el ajuste de la dosis puede ser más difícil.
Teofilina, antileucotrienos y otros tratamientos como terapia añadida a GCI
Teofilina. Como terapia añadida mejora la función pulmonar y los síntomas, pero los efectos adversos son frecuentes 1. Una revisión Cochrane 65 recoge los ensayos realizados en niños y adultos, compara la eficacia de teofilina frente a los BALD y concluye que estos son similares o algo superiores a teofilina en el FEV1 y en el porcentaje de noches sin síntomas. Los efectos adversos son menos frecuentes con BALD (RR: 0,44 [IC 95 %: 0,30-0,63]; NNT: 9 [IC 95 %: 8-50]). Se describieron menos episodios del sistema nervioso central y gastrointestinales.
β-adrenérgicos orales. Como terapia añadida mejoran la función pulmonar y los síntomas, pero los efectos adversos son frecuentes 1.
Antileucotrienos. La efectividad de los antileucotrienos como terapia añadida a GCI ha sido objeto de estudio bajo distintas comparaciones: frente a placebo, frente a duplicar la dosis de GCI y frente a BALD. La comparación que más interés práctico tiene es frente a BALD. Destaca la escasez de ensayos clínicos en niños como terapia añadida.
Antileucotrienos frente a placebo en pacientes sintomáticos a pesar del tratamiento con GCI: añadir montelukast manteniendo la misma dosis de GCI produce una mejora en los síntomas y en el control del asma 66-68.
Antileucotrienos frente a duplicar la dosis de GCI: montelukast añadido a 800 μg/día de budesonida presentó una eficacia similar a 1.600 μg/día de budesonida en un ensayo realizado en adultos 67,68. No obstante, la dosis de GCI está en la parte "plana" de la curva dosis- respuesta.
Frente a BALD: recientemente, una revisión Cochrane ha comparado ambos tratamientos en adultos inadecuadamente controlados con dosis bajas de GCI 69. Añadir un BALD es más efectivo que añadir un antileucotrieno, en cuanto al riesgo de exacerbaciones que requieren corticoides orales, RR 0,83 (IC 95 %: 0,71-0,97), NNT a 48 semanas 38 (IC 95 %: 23-247), y también fue superior en la mejora de la función pulmonar, síntomas y medicación de rescate. En niños se requieren más estudios que comparen la eficacia de antileucotrienos frente a BALD como terapia añadida a GCI.
No hemos encontrado ningún ensayo que analice la efectividad de los antileucotrienos como terapia añadida a GCI más BALD.
Áreas de reciente investigación
Asociación de budesonida-formoterol: pauta fija frente a pauta flexible. Recientemente se han publicado varios ensayos sobre la utilización de la combinación de budesonida-formoterol en dosis fijas frente a utilizarla en dosis flexible 70-75 que demuestran que la pauta flexible permite reducir medicación en comparación con la pauta fija. Además, en otros 2 estudios se observa un beneficio en la disminución de exacerbaciones 71-73. Estos estudios son todos en adultos, tienen problemas metodológicos y aplicabilidad limitada (requieren un plan de acción y un considerable adiestramiento para modificar la dosis en función de los síntomas y monitorización del FEM en algunos estudios 73), todo lo cual dificulta la formulación de recomendaciones concretas en niños. Además, es posible que los que reciben pauta fija estén sobretratados, lo que puede explicar en parte que la necesidad de medicación sea menor en el grupo de pauta flexible.
Asociación de budesonida-formoterol como tratamiento de mantenimiento y de rescate. Un ensayo clínico reciente a doble ciego 58 ha comparado la efectividad de la asociación budesonida/formoterol 80/4,5 como tratamiento de manteni miento y de rescate, frente a la misma asociación como tratamiento de mantenimiento más un β-adrenérgico de corta duración como rescate y frente a budesonida 320 μg de mantenimiento más un β-adrenérgico de corta duración como rescate durante un año en 2.760 asmáticos con asma leve o moderada, niños y adultos (4-80 años). Como medida de resultado principal utilizaban las exacerbaciones graves. El grupo asignado a budesonida/formoterol como mantenimiento y rescate presentó un menor riesgo de exacerbaciones graves frente a la asociación más un β-adrenérgico de corta duración como rescate (HR: 0,50; IC 95 %: 0,40-0,64) y también en comparación con budesonida más un β-adrenérgico de acción corta como rescate. Si se excluyen las exacerbaciones por caída del FEM y se consideran únicamente las que requieren intervención médica, el resultado seguía siendo favorable a budesonida-formoterol como mantenimiento y rescate (NNT = 10). La velocidad de crecimiento en niños tratados con dosis más alta de budesonida fue menor que en las otras dos ramas. No se observó sobreutilización de la asociación budesonida-formoterol como rescate. A juzgar por los resultados de este estudio y por la magnitud de las diferencias, parece que la precocidad del tratamiento más que la dosis del GCI o del formoterol es lo que condiciona la buena respuesta al tratamiento.
Control total y buen control del asma con la asociación fluticasona-salmeterol: estudio GOAL. Recientemente, se han publicado los resultados del ensayo clínico GOAL 76, a doble ciego y de un año de duración, realizado con 3.421 asmáticos mayores de 12 años con asma no controlada con distintos grados de tratamiento (hay tres estratos: sin GCI, dosis ≤ 500 μg de beclometasona o equivalente y dosis entre 500 y 1.000 de beclometasona o equivalente). El objetivo del estudio fue averiguar qué porcentaje de pacientes alcanzaba el "control total" o "buen control" con la asociación fluticasona salmeterol frente a fluticasona sola. La primera fase del estudio, de 12 semanas, es de subida gradual de dosis hasta alcanzar un "control total" o la dosis máxima. En la segunda fase del estudio, hasta completar el año, los pacientes permanecen con estas dosis, sin bajada gradual. Lo más novedoso de este estudio es probablemente la variable de resultado, compuesta por varios criterios clínicos y funcionales tomados en conjunto. En cada uno de los estratos la asociación de fluticasona con salmeterol fue superior a fluticasona sola en cuanto al porcentaje de pacientes que alcanzaron un control total y un buen control. Este estudio pone de manifiesto que es posible alcanzar el control del asma en un porcentaje elevado de pacientes. El 41 % de los pacientes con la asociación consiguieron un control total al año de tratamiento, frente al 28 % con fluticasona sola. El buen control se consiguió en el 71 % de los pacientes tratados con la asociación y en el 59 % con fluticasona sola. No obstante, hay que destacar que al final del estudio el 68 % en el grupo de la asociación y el 76 % en el de fluticasona sola estaban con la dosis más alta permitida. En ambos grupos la frecuencia de nasofaringitis fue alta (13-14 %), y la de candidiasis oral, del 2-3 %. Se observaron reducciones en los niveles de cortisol. Por otro lado, las condiciones del ensayo no son las de la práctica habitual, ya que el cumplimiento es cercano al 90 %, lo que condiciona la efectividad real de esta pauta en la práctica clínica en nuestro medio (aplicabilidad).
Resumen de la evidencia
1++ En el adulto, añadir un b2 de larga al tratamiento con GCI mejora la función pulmonar, los síntomas y la frecuencia de exacerbaciones, aumentando ligeramente los efectos adversos 52. El beneficio es superior a aumentar las dosis de GCI 13,33,59,76.
1+ En niños a partir de 4-5 años, añadir un BALD mejora la función pulmonar y los síntomas 33,52,54-57. Se requieren más estudios para evaluar el efecto de los BALD sobre las exacerbaciones en niños.
1++ En adultos y niños mayores de 12 años clasificados como con asma leve persistente y mal controlados con dosis bajas de GCI, añadir un BALD en dosis bajas de GCI (200-400 μg/día de budesonida) reduce las exacerbaciones, los días con síntomas y mejora la función pulmonar y otras variables; el beneficio es superior al alcanzado al duplicar la dosis de GCI. En pacientes no tratados previamente con GCI, añadir budesonida en dosis bajas reduce a la mitad las exacerbaciones; en estos pacientes no se obtienen beneficios adicionales con el BALD 14.
1+ No hay diferencias en eficacia entre utilizar la combinación de un GCI con un BALD en un dispositivo frente a utilizar 2 dispositivos 60-64.
1+ En adultos inadecuadamente controlados con GCI, los BALD son superiores a los antileucotrienos en la reducción de exacerbaciones y en la mejoría de síntomas y de la función pulmonar 69.
Recomendación
B La terapia añadida de elección son los BALD.
B En niños mal controlados a dosis moderadas de GCI, se recomienda añadir un BALD.
(√) Considerar el uso de antileucotrienos en niños menores de 4 años insuficientemente controlados con GCI, ya que los BALD no tienen indicación aprobada en estos niños. No obstante, tampoco hay estudios con antileucotrienos como terapia añadida en niños pequeños.
(√) Se requieren estudios para establecer si los antileucotrienos proporcionan beneficio adicional como terapia añadida a GCI más BALD.
Control inadecuado a pesar del tratamiento con dosis moderadas de GCI y BALD
Cuestiones a responder
¿Cuál es la mejor opción de tratamiento en pacientes no controlados con dosis moderadas de GCI y BALD?
En una pequeña proporción de pacientes el asma no se controla adecuadamente con dosis moderadas-altas de GCI (> 400 μg/día en niños) más un BALD. En estos pacientes, una vez revisado el cumplimiento del tratamiento, la técnica de inhalación, los factores desencadenantes y la continuidad de cuidados, es necesario añadir otro fármaco o utilizar dosis elevadas de GCI. No obstante, apenas existen estudios que evalúen esta situación, por lo que las recomendaciones para este grupo de pacientes se basan en consenso 1.
Como no hay ensayos comparativos entre las distintas opciones, la elección de uno u otro deberá basarse en los efectos adversos, las preferencias del paciente o el coste, y será necesario evaluar su efectividad individualmente. La duración de la "prueba terapéutica" dependerá del resultado que se vaya a evaluar. Por ejemplo, la prevención de despertares nocturnos requiere un período relativamente corto de tiempo (de días a semanas), mientras que para evaluar exacerbaciones o consumo de corticoides orales se requerirá más tiempo (semanas a meses). Si no hay respuesta al tratamiento, éste se debería interrumpir y probar otro.
Recomendación
(√) Si el control es inadecuado a pesar de recibir GCI más BALD (dosis de GCI de 400 μg/día), hay que considerar alguna las siguientes intervenciones:
Aumentar la dosis de GCI hasta 800 μg/día.
Añadir teofilinas.
Añadir antileucotrienos.
(√) Considerar la derivación a atención especializada.
Cómo bajar de escalón en el tratamiento
Las guías de práctica clínica están de acuerdo en que el tratamiento del asma es escalonado y que se debe subir o bajar de escalón en función del control de la enfermedad. Como ya hemos visto, existe amplia literatura médica sobre la efectividad de distintos fármacos para subir de escalón y también ensayos que evalúan el efecto ahorrador de corticoide a través de la introducción de otros fármacos (BALD, antileucotrienos). Sin embargo, los ensayos clínicos que evalúan cómo bajar de escalón son muy escasos.
Recientemente se ha publicado un ensayo clínico relevante que estudia los efectos de la reducción de la dosis de GCI en pacientes con asma moderada-grave estable durante un año frente a mantener la dosis inicial. Dicho estudio concluyó que es posible reducir la dosis de GCI a la mitad en el 49 % de los pacientes con asma moderada-grave77. Los pacientes eran incluidos en el estudio si estaban bien controlados (buen control definido por el grado de síntomas y medicación de rescate) en el último mes, ausencia de visitas médicas u hospitalizaciones desde el último control y FEM > 80 % en 8 de los 14 días previos a la inclusión en el estudio. Los controles se establecían trimestralmente.
Otra posible estrategia en el asma leve-moderada podría ser la reducción de dosis de GCI, pasando de 2 administraciones a una diaria; un ensayo de 12 semanas de duración78 concluyó que la calidad de vida no se alteraba al pasar de una pauta de budesonida de 200 μg dos veces al día a 200 μg una vez al día, pero no no tiene en cuenta los efectos sobre otros resultados (exacerbaciones, etc.).
En un pequeño ensayo de 2 años de duración con 37 pacientes con asma leve se puso de manifiesto que era posible reducir la dosis, si bien la interrupción del tratamiento se asoció a un empeoramiento del asma 79. Otros trabajos 12,80,81 también han descrito deterioro del asma y de la HRB al interrumpir el tratamiento. Todo ello indica que en pacientes con asma en remisión clínica o con síntomas intermitentes persiste la inflamación de la vía aérea.
Resumen de la evidencia
1++ En pacientes con asma bien controlada de distintos grados de gravedad, es posible reducir la dosis de GCI a la mitad sin comprometer el control de la enfermedad. Este objetivo se alcanza en el 49 % de los pacientes 77.
2+ El cese del tratamiento con GCI se asocia con el empeoramiento del control del asma en bastantes pacientes 12,79,80.
Recomendación
A En pacientes con asma estable tratados con dosis moderadas-altas de GCI se recomienda intentar reducir la dosis hasta la mínima efectiva.
C El cese del tratamiento con GCI se asocia a empeoramiento del control del asma en bastantes pacientes.
(√) El tratamiento del asma es escalonado. Al igual que se sube de escalón cuando el control es insuficiente, es también importante bajar de escalón para mantener un control adecuado con la mínima medicación efectiva.
(√) Para la reducción gradual del tratamiento se recomienda un período de estabilidad al menos de 3 meses.
(√) Durante la reducción se debe evaluar periódicamente (p. ej., cada 3 meses) el control de la enfermedad.
Elección del dispositivo de inhalación
En una reciente revisión sistemática sobre la eficacia de los distintos tipos de dispositivos de inhalación en la administración de GCI y β-adrenérgicos de corta duración para el asma y la enfermedad pulmonar obstructiva crónica (EPOC) en adultos y pediatría se observó que no existían diferencias en la eficacia clínica entre los distintos tipos de dispositivos de inhalación, siempre y cuando la técnica de administración fuera correcta 82. Una revisión sistemática posterior realizada en niños de 5 a 15 años corroboró los resultados anteriores 83.
En el caso de niños de 0 a 5 años no hay evidencia científica para concluir que un tipo de dispositivo sea más eficaz que otro en el tratamiento del asma crónica.
La elección del dispositivo de inhalación en el tratamiento de fondo del asma debe realizarse en función de las evidencias disponibles y de la edad del paciente, teniendo en cuenta las preferencias de éste y el coste.
Resumen de la evidencia
1++ En niños de 5-12 años con asma estable, inhaladores de dosis presurizados (pMDI) con cámara espaciadora es tan eficaz como cualquier otro método de inhalación 83.
4 En niños de 0 a 5 años no hay evidencia para concluir que un tipo de dispositivo sea más eficaz que otro en el manejo del asma crónico.
Recomendación
D En el niño de 5 a 12 años, pMDI con cámara es tan eficaz como cualquier otro método de inhalación. La elección del dispositivo de inhalación se debe basar en la preferencia y habilidad de uso del paciente.
D Para niños de 0-5 años, pMDI con cámara espaciadora es el método de elección, con mascarilla en menores de 3 años.
(√) Los profesionales sanitarios deben enseñar a los pacientes a utilizar correctamente los inhaladores. Además, la técnica de inhalación debe ser evaluada periódicamente.
*En el niño menor de 5 años la definición de asma entre los distintos estudios es muy variable; a pesar de ello el tratamiento con GCI mostró ser eficaz en este grupo de edad tan heterogéneo: incluyen niños en función de que presenten síntomas persistentes, episodios frecuentes de sibilancias o en función del número de crisis; en algunos estudios la tendencia atópica se tenía en cuenta como criterio de inclusión. Se excluyen los ensayos con pautas intermitentes de GCI.
**La definición de asma leve persistente en el estudio Steroid Treatment as Regular Therapy (START) 11 es: sibilancias, tos, disnea, tirantez, despertar nocturno por síntomas al menos una vez por semana pero no diariamente y con función pulmonar normal.
***Niños con índice de Castro modificado positivo: más de 3 episodios de sibilancias durante el año anterior (episodios > 24 h de duración, al menos uno confirmado por un médico) y un criterio mayor (historia de asma en alguno de los progenitores, dermatitis atópica diagnosticada por un médico, sensibilización alérgica a al menos un aeroalérgeno) o dos menores (sibilancias no relacionadas con resfriados, eosinófilos en sangre > 4 %, sensibilización alérgica a proteínas de leche, huevo o frutos secos).
© Osakidetza-Servicio Vasco de Salud.
Correspondencia: Dra. M. Callén Blecua.
Bera-bera, 78, 2º. 20009 San Sebastián. España.
Correo electrónico: mcallen@apge.osakidetza.net