Los niños con asma de control difícil (ACD) requieren frecuentes consultas, reciben complejos regímenes de tratamiento y, a menudo, requieren ingresos en el hospital. Su frecuencia es escasa, y abarca no más del 5% de la población asmática. El ACD requiere un diagnóstico de certeza, por lo que se tendrán que descartar causas de falso ACD, y es necesario hacer un diagnóstico diferencial con factores de enfermedad sobreañadida, medioambientales, psicológicos, y analizar causas que determinen una baja adherencia al tratamiento. Ante un verdadero ACD, el estudio de la inflamación (óxido nítrico exhalado, esputo inducido, lavado broncoalveolar y biopsia bronquial), la función pulmonar y la clínica nos pueden permitir clasificar el ACD en diversos fenotipos que nos facilitarán la toma de decisiones terapéuticas.
Children suffering from difficult-to-control asthma (DCA) require frequent appointments with their physician, complex treatment regimes and often admissions to hospital. Less than 5% of the asthmatic population suffer this condition. DCA must be correctly characterised to rule out false causes of DCA and requires making a differential diagnosis from pathologies that mimic asthma, comorbidity, environmental and psychological factors, and analysing the factors to determine poor treatment compliance. In true DCA cases, inflammation studies (exhaled nitric oxide, induced sputum, broncho-alveolar lavage and bronchial biopsy), pulmonary function and other clinical aspects can classify DCA into different phenotypes which could make therapeutic decision-making easier.
Las actuales guías de buena práctica clínica1–3 establecen que el asma está bien controlada cuando no existen síntomas de la enfermedad, exacerbaciones, necesidad de empleo de medicación de rescate, restricciones de la actividad física habitual, la función pulmonar es normal y el tratamiento no ocasiona efectos adversos.
Afortunadamente, el asma de control difícil (ACD) es muy infrecuente en la edad pediátrica. La mayoría de los niños con asma se controlan bien con los tratamientos actuales y cuando esto no ocurre se debe sospechar que el diagnóstico no es correcto o que no se está realizando adecuadamente el tratamiento o las medidas de control ambiental.
La definición de ACD en niños mayores y adultos está aceptablemente establecida4. Se considera que un niño tiene ACD cuando su enfermedad no está suficientemente controlada, a pesar de realizar correctamente el tratamiento del nivel 4 del Global Initiative for Astma (GINA) o la Guía Española para el Manejo del Asma (GEMA), incluída una dosis de 800μg de budesonida al día o dosis equivalente de otros corticoides (1.000μg de beclometasona o 500μg de fluticasona) junto con broncodilatadores de acción prolongada. Se define como asma no controlada cuando se precisa tomar broncodilatadores de acción corta más de 3 veces por semana, se pierde colegio más de 5 días por trimestre o existe un episodio o más de sibilancias por mes5.
La normativa de la Sociedad Española de Neumología y Cirugía Torácica 20056 discrimina 2 subgrupos de ACD: el verdadero y el falso (evidencia D). El falso ACD agrupa a otras causas, habitualmente ajenas a la enfermedad, que conllevan una escasa respuesta terapéutica y, por tanto, un aparente ACD. En consecuencia, para aceptar que un niño tiene ACD debe haberse excluido otras enfermedades, debe asegurarse de que exista un buen cumplimiento del tratamiento y la situación de mal control debe mantenerse, al menos, durante 6 meses. Los criterios diagnósticos6 vienen definidos en la tabla 1.
Criterios diagnósticos de asma de control difícil
|
Normativa SEPAR: normativa para el asma de control difícil,2005. Se establece cuando, tras haber descartado la falsa asma de control difícil, se constatan 2 criterios mayores o uno de éstos junto con 2 menores.
FEM: flujo espiratorio máximo; FEV1: volumen espiratorio forzado en el primer segundo.
El verdadero ACD se trata de una entidad muy heterogénea, por lo que, una vez llegados a un diagnóstico de certeza, sería de gran utilidad la determinación del fenotipo característico de cada paciente en aras de tomar decisiones terapéuticas más acertadas y con ello reducir la gran morbilidad de estos pacientes y los elevados costos del tratamiento.
Características del asma de control difícil en la infancia1. Rasgos clínicos
En general, los niños con ACD presentan síntomas persistentes y empeoramiento con el ejercicio, con obstrucción al flujo aéreo e hiperinsuflación pulmonar entre los ataques de asma. Otro patrón puede ser el de pacientes que presentan períodos asintomáticos intercalados con crisis graves. Se ha relacionado la precocidad en el inicio de la sintomatología o la alteración temprana de la función pulmonar con la persistencia de los síntomas y con la mayor frecuencia de recaídas en la etapa de la adolescencia. Existen diversos fenotipos asmáticos bien catalogados de ACD, cuyas características diferenciales se definirán sobre la base de la presencia de clínica, el funcionalismo respiratorio, las características inflamatorias y la respuesta al tratamiento.
2. Patogenia
La patogenia de la enfermedad no está del todo establecida. Parece constante el remodelado de la vía aérea con engrosamiento de la membrana basal, la hipertrofia del músculo liso y la hiperplasia glandular. También se ha evidenciado la afectación de la vía aérea distal con inflamación del bronquiolo terminal6.
Existen estudios que evidencian una elevación de la fracción exhalada de óxido nítrico (FENO) en niños con ACD, que disminuye después del tratamiento con esteroides. Sin embargo, en un pequeño subgrupo, los niveles de FENO se mantienen elevados a pesar del tratamiento, lo que indica la posibilidad de la existencia de una inflamación que no responde a corticoides o de una inflamación de la vía aérea diferente a la que se asocia con el asma7. En el estudio realizado por Payne se evaluaron los niveles de FENO en 23 niños con ACD, y se encontró que los niveles de ésta eran mayores en estos pacientes con respecto a los controles. Además, la concentración de FENO cayó tras la administración de prednisolona, y se acompañó de un aumento del pico de flujo matinal. Se encontró un subgrupo de pacientes en los que la concentración de FENO permaneció elevada a pesar del tratamiento con prednisolona. Otro subgrupo tenía niveles normales de FENO antes y después del tratamiento. Las conclusiones de este estudio apoyan la evidencia de la existencia de diferentes fenotipos de ACD7.
En biopsias bronquiales en niños con ACD, a pesar del tratamiento con glucocorticoides inhalados (GCI), se encuentran niveles elevados de eosinófilos y neutrófilos8. Parece que la inflamación asmática en el niño mayor está mediada por el linfocito Th2 y conducida por el eosinófilo, pero con estudios sobre resultados de lavado broncoalveolar (LBA), esputo inducido y biopsia bronquial se demuestra que esto no es así hasta en un 50% de los casos8.
El remodelado de la vía aérea ocurre en adultos con asma y el engrosamiento de la membrana basal reticular es patognomónico. Un estudio de Payne9 analizó mediante microscopio electrónico el engrosamiento de la membrana basal para comparar lo que sucedía en niños y adultos con ACD a los que se había tratado con esteroides. Se demostró que este engrosamiento era igual en niños con asma grave que en adultos asmáticos, y mayor que en controles sanos. Además, se vio que este engrosamiento no estaba asociado con la edad, la presencia o duración de la sintomatología, la función pulmonar o la inflamación eosinofílica de la vía aérea9.
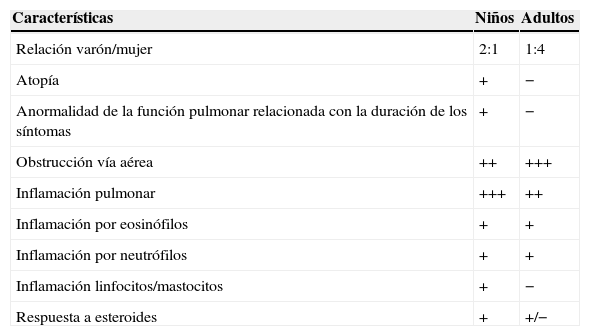
Hay importantes diferencias entre el asma grave de los niños y el asma grave en los adultos (tabla 2)10,11.
Comparación de asma grave en niños y adultos
| Características | Niños | Adultos |
| Relación varón/mujer | 2:1 | 1:4 |
| Atopía | + | − |
| Anormalidad de la función pulmonar relacionada con la duración de los síntomas | + | − |
| Obstrucción vía aérea | ++ | +++ |
| Inflamación pulmonar | +++ | ++ |
| Inflamación por eosinófilos | + | + |
| Inflamación por neutrófilos | + | + |
| Inflamación linfocitos/mastocitos | + | − |
| Respuesta a esteroides | + | +/− |
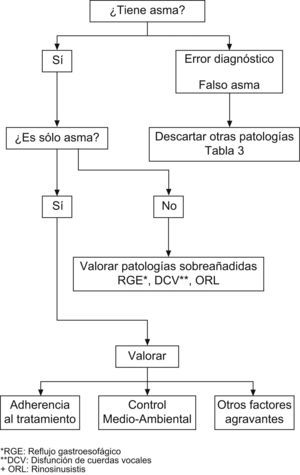
En la aproximación diagnóstica al ACD será importante responder inicialmente una serie de preguntas. ¿Se está realmente delante de un asma? ¿La dosis, la vía y el cumplimiento del tratamiento son adecuados? ¿Existen otras enfermedades añadidas que pueden agravar el asma y explicar la mala respuesta al tratamiento? ¿Hay factores medioambientales no controlados? ¿Existen aspectos psicológicos no valorados?6,12.
En un niño con clínica indicativa de asma que no responda adecuadamente al tratamiento se debe, en primer lugar, hacer un diagnóstico diferencial exhaustivo13, que permita descartar las enfermedades referidas en la tabla 3. Los estudios necesarios se indicarán de acuerdo con la clínica del paciente o del diagnóstico de sospecha.
Enfermedades que pueden cursar con sibilancias o diagnosticarse como asma en el niño
| Alteraciones de la vías aéreas superiores |
|
| Obstrucción de las grandes vías aéreas |
|
| Obstrucción de las pequeñas vías aéreas |
|
| Otras |
|
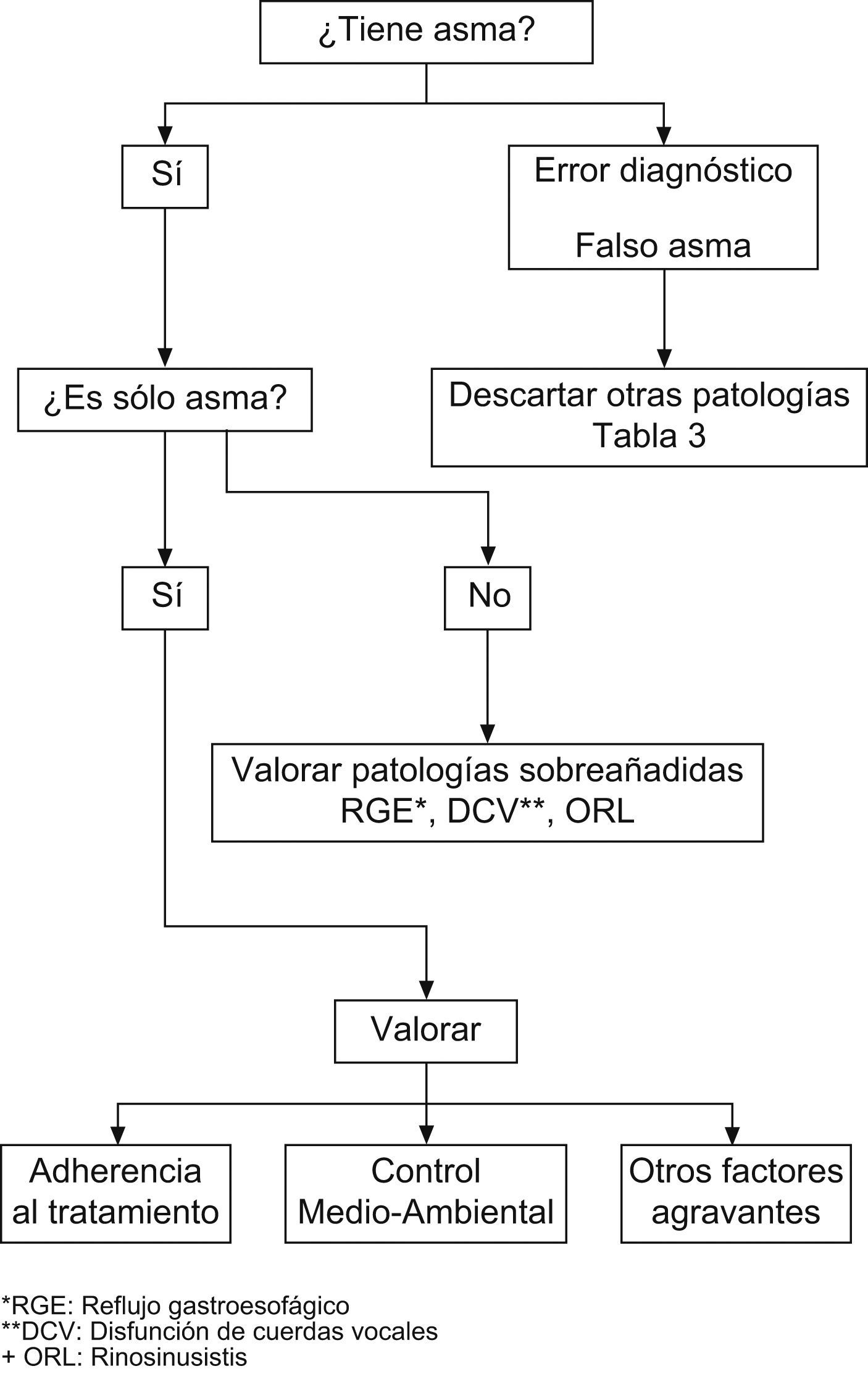
Una vez confirmado el diagnóstico de asma por exclusión de otras enfermedades será necesario comprobar que las medidas de control ambiental y el tratamiento se están siguiendo adecuadamente (fig. 1).
1. Diagnóstico incorrecto
Lo primero que se debe pensar ante un niño con sintomatología asmática grave y mala respuesta al tratamiento es si se trata de una verdadera asma. El diagnóstico de asma en el niño se basa en la historia clínica y la evidencia de variabilidad y reversibilidad de la obstrucción bronquial3. Además, se debe hacer un diagnóstico diferencial con otras enfermedades que presentan los mismos síntomas, y es un gran reto distinguirlas14–16 (tabla 3). Ese diagnóstico diferencial debe realizarse según la zona geográfica en la que nos movamos; por ejemplo, en zonas de baja incidencia de tuberculosis, pensar en ésta como causa de sibilancias persistentes de mala evolución no será el primer diagnóstico diferencial para considerar17.
Las malformaciones congénitas que provocan una obstrucción de la vía aérea, superior (p. ej., estenosis subglótica) o inferior (p. ej., broncomalacia o anillos vasculares), tienen síntomas similares, como aparición precoz de sibilancias, estridor, dificultad para la deglución y crisis de sofocación con la alimentación. Aunque la incidencia de traqueomalacia y broncomalacia es relativamente baja, la forma más frecuente de presentación es con tos, disnea, infecciones recurrentes de la vía aérea inferior y sibilancias, muy compatibles con el diagnóstico de asma17–20. De hecho, el 40% de los niños de una serie con traqueobroncomalacia estaban diagnosticados de asma19.
Las sibilancias asociadas con infecciones frecuentes de la vía aérea inferior pueden indicar fibrosis quística o inmunodeficiencia. La discinesia ciliar primaria puede presentarse con un historial de disnea sin causa aparente y obstrucción nasal desde el nacimiento.
La disfunción de las cuerdas vocales se define como una aducción paradójica de las cuerdas vocales durante la inspiración, la espiración o ambas, lo que produce una obstrucción de la vía respiratoria. De forma característica, aparece en mujeres entre 20 y 40 años, pero puede aparecer en la infancia, sobre todo en niños mayores y adolescentes. El síntoma predominante es estridor con disnea, opresión torácica, tos y, a veces, sibilancias. Los síntomas pueden confundirse con asma, en concreto con asma inducida por ejercicio, o pueden coexistir con el asma21. Se han descrito 2 fenotipos de disfunción de cuerdas vocales22. El primero ocurre espontáneamente con disnea y estridor inspiratorio (a veces descrito como sibilancias) de forma súbita, y suele ser un cuadro aparatoso, que induce acudir a urgencias. El segundo fenotipo ocurre sólo ante el ejercicio (se confunde con un asma de esfuerzo).
El diagnóstico de disfunción de las cuerdas vocales debe sospecharse por el cuadro clínico y la falta de respuesta al tratamiento habitual. La espirometría forzada puede ser normal en la fase asintomática, pero en el momento de la crisis tiene una morfología característica: aplanamiento de la curva inspiratoria de flujo volumen, que evidencia la obstrucción al flujo aéreo extratorácico, con limitación adicional al flujo espiratorio. El diagnóstico definitivo se realizará mediante la laringoscopia22.
Otras causas que pueden confundirse con el ACD son los casos de aspiración de cuerpos extraños23,24.
2. Enfermedad sobreañadida
Se debe investigar la posible existencia de factores que estén agravando la sintomatología (tabla 4). Hay muy pocos estudios que han relacionado de forma sistemática si determinada enfermedad añadida puede ser causa de un ACD. Sin embargo, hasta en un 32% de los casos de ACD se ha encontrado enfermedad sobreañadida25. Este es un campo algo controvertido y varios son los problemas para considerar: el reflujo gastroesofágico (RGE), la enfermedad de la vía aérea superior, la rinitis alérgica, el síndrome de apneas-hipopneas obstructivas del sueño (SAHOS), la obesidad y la alergia alimentaria.
Factores y enfermedades que pueden contribuir a un control insuficiente del asma (falsa asma de controldifícil)
| Enfermedad sobreañadida: factores asociados al asma que lo agravan (comorbilidad) |
|
| Factores ambientales |
|
| Cumplimiento inadecuado del tratamiento (más frecuente) |
|
| Resistencia a corticoides |
| Otros |
|
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos; CO: monóxido de carbono; NO2: óxido de nitrógeno; RGE: reflujo gastroesofágico SAHOS: síndrome de apnea obstructiva del sueño; SO2: dióxido de azufre.
El RGE provoca aspiración de fluidos en la vía aérea, causa tos y sibilancias; puede diagnosticarse falsamente como asma o puede agravar el asma, con episodios de tos y dificultad respiratoria especialmente nocturnos. Las cifras de prevalencia de RGE en niños asmáticos pueden llegar al 60%26. La investigación de la presencia de esta enfermedad en los niños asmáticos mal controlados debe tenerse en cuenta, y si bien los pacientes con asma y RGE muestran un peor control del asma, no está del todo claro que el tratamiento del reflujo mejore el asma27,28.
La relación entre RGE y sibilancias es compleja y puede obedecer a los siguientes factores:
- •
El RGE puede causar sibilancias, como resultado directo de la aspiración a pulmón o de forma secundaria a la acidificación del esófago inferior que provoca un empeoramiento del reflejo de la hiperrespuesta bronquial.
- •
El RGE puede ser transitorio y aparecer sólo en el momento de la exacerbación asmática y agravarla.
- •
La propia asma puede condicionar un RGE a consecuencia de los cambios en la presión intratorácica.
- •
El RGE puede ser asintomático, sin relación alguna con el asma.
Recientemente, se ha puesto de manifiesto que las infecciones del área otorrinolaringológica (ORL) son más frecuentes entre los niños asmáticos que en los controles29, y que la hiperreactividad bronquial mejora ostensiblemente en los niños asmáticos cuya sinusitis es tratada30. Parece, por tanto, que en los niños asmáticos existe una mucosa nasal más susceptible de infectarse y que —a su vez— esta infección puede empeorar el asma subyacente, con independencia de la existencia o no de un “reflejo nasosinubronquial”.
Igualmente, en los pacientes con asma y rinitis, estacional o perenne, su adecuado tratamiento mejora los síntomas de asma31. La rinitis alérgica es un proceso que coexiste habitualmente con el asma. No está claro si el tratamiento de la rinitis mejora el asma, aunque parece razonable tratar la rinitis alérgica por ella misma, y si se obtiene el beneficio adicional de una disminución de la gravedad del asma, mucho mejor17.
La relación entre ACD y SAHOS se conoce mal. Puede que contribuya a la inflamación de la vía aérea17 de tipo neutrofílica32, pero el papel del SAHOS en el ACD no está claro en la actualidad.
La obesidad y su relación con el asma es cada vez más interesante. Los aumentos en el índice de masa corporal se han asociado con un aumento en la incidencia de asma, aunque los mecanismos no son claros33. La primera limita las inspiraciones profundas y el niño obeso probablemente experimenta más disnea con el ejercicio, independientemente de la situación basal de su asma. De todas formas, la pérdida de peso siempre es aconsejable en estos casos y puede condicionar una mejoría de los síntomas17, así como de la función pulmonar, la morbilidad y el estado de salud34.
El papel de la alergia alimentaria es muy debatido. La alergia a alimentos es muy común en niños con asma grave, pero no está claro si esa alergia tiene un papel causal en la gravedad del asma o simplemente es un marcador más de una predisposición genética subyacente de gravedad de su alergia35,36. También conviene constatar que en algunos casos la alergia alimentaria se ha asociado con el ACD, especialmente en edades tempranas de la vida37,38.
No debemos olvidar las infecciones por gérmenes atípicos (Mycoplasma pneumoniae, Chlamydia pneumoniae, Chlamydia trachomatis, etc.) que pueden agravar un asma y simular un ACD39. El médico debe sospechar estas infecciones y tratarlas.
3. Factores ambientales. Entorno adverso
La presencia de agentes alergénicos desconocidos a los que el niño es sensible, polución del aire, tanto del aire libre como doméstico, el humo del tabaco y estrés psicosocial pueden, individualmente o en combinación, hacer al asma difícil de controlar.
La exposición repetida a agentes alergénicos en individuos sensibles incrementa la reactividad bronquial, disminuye la afinidad de los receptores de los glucocorticoides y puede, por lo tanto, incrementar la vulnerabilidad a los ataques de asma y reducir la respuesta a los esteroides40,41. La peor evolución del asma de los niños alérgicos expuestos a mayores dosis de alérgenos, incluyendo ingresos hospitalarios, visitas a urgencias y días de colegio perdidos es un hallazgo evidente en diversos estudios42. Aunque las medidas de control de ácaros no parecen tener un gran impacto sobre la evolución de los niños con asma, la importancia de los hongos en las viviendas o los alérgenos dependientes de las mascotas se ha puesto de manifiesto en varios estudios43.
La polución del aire puede influir en la gravedad del asma de 2 formas: por efecto irritante directo, que causa inflamación de la vía respiratoria y aumento de la respuesta bronquial, o por alteración de la respuesta inmunitaria a los alérgenos del entorno. Los niños que viven en zonas con mucha polución tienen ataques de asma más asiduamente que aquellos que viven en zonas de baja polución44.
Es fundamental considerar el tabaquismo en casos de ACD1,44. Fumar se asocia con una reducción de las probabilidades de control completo del asma, dado que reduce la eficacia clínica de los GCI u orales45 al condicionar una resistencia secundaria a éstos46–50. En diversos estudios en los que se compararon 2 grupos de niños asmáticos, uno bien controlado y el otro no, y en los que no había diferencias en cuanto al número de alérgicos, el único factor que fue significativamente diferente entre ambos grupos fue el hábito de fumar dentro del hogar de alguno de los miembros de la familia46–49. Otros factores diferentes entre ambos grupos, pero que no llegaron a ser significativos, fueron la presencia de mascotas de pelo o pluma y la existencia de manchas de humedad en las casas de los niños peor controlados. El humo del tabaco es uno de los factores de riesgo de asma mal controlada más importante, y se ha comprobado que los niños cuyos padres fuman tienen síntomas más graves44. Este riesgo se ve aun más incrementado en los adolescentes asmáticos que adquieren el hábito de fumar.
Los contaminantes tanto extradomiciliarios como intradomiciliarios son también un factor que puede hacer que un asma sea más difícil de controlar. Por ejemplo, el óxido de nitrógeno (NO2), el dióxido de azufre (SO2), el monóxido de carbono (CO) y el ozono se han relacionado tanto con la mortalidad por asma como con los ingresos hospitalarios51.
Las alteraciones psicológicas, tanto a nivel familiar como individual, conllevan un empeoramiento de los síntomas y un incremento en la necesidad de medicación, y suponen también una barrera para la educación sobre asma y la adherencia al tratamiento. Existen factores psicosociales que pueden afectar a la percepción del control del asma e influir negativamente en la actitud hacia el tratamiento y el autotratamiento. Hay que considerar que un asma que mejora los fines de semana y empeora el domingo por la tarde indica la posibilidad de problemas escolares importantes17.
La tos psicógena se trata frecuentemente como un asma. Suele presentarse en niños escolares y adolescentes, generalmente tras un proceso infeccioso, a veces banal. La tos suele desaparecer durante el sueño, dura semanas (a veces meses) y es refractaria a todo tipo de tratamiento y debe siempre incluirse en el diagnóstico diferencial del ACD16,52.
También se ha descrito el diagnóstico de asma en niños con hiperventilación y con ansiedad53,54.
4. Cumplimiento inadecuado del tratamiento
Los estudios de seguimiento de cumplimentación tanto objetivos como “a ciegas” revelan unos valores muy bajos de adherencia55. En un estudio se puso de manifiesto que los niños que tenían una exacerbación candidata de una tanda de corticoides orales difirieron ostensiblemente del grupo de niños que no lo requirió, en lo que se refiere a la adherencia al tratamiento seguida por dispositivos electrónicos: la mediana de adherencia a los GCI fue del 13,7% en los que experimentaron una exacerbación, y fue del 68,2% en los que no la experimentaron. En el mismo estudio se puso de manifiesto que la media de uso de GCI recogida en un diario fue del 95%, pero sólo fue del 58% cuando se controló con un inhalador de dosis medida (MDI) con monitorización electrónica56. Estudios posteriores confirman estos hallazgos57,58. La falta de adherencia a los regímenes terapéuticos es muy frecuente en los pacientes asmáticos, aunque su relación con el control del asma es compleja58, y está relacionada con la duración del tratamiento, la edad del niño, etc58,59. Sabemos que la cumplimentación del tratamiento se asocia a un mejor control del asma58.
5. Otros factores intercurrentes
Entre los factores intercurrentes que pueden agravar el asma y dificultan su control está el consumo de determinados fármacos desencadenantes, aunque este aspecto es más relevante en el adulto1,2 que en el niño; debe interrogarse al paciente asmático acerca de los medicamentos que consume, con especial hincapié en: a) betabloqueantes, que tanto por vía oral como tópica (conjuntival) pueden originar broncoespasmo o aumentarlo en pacientes con asma, y b) ácido acetilsalicílico y otros antiinflamatorios no esteroideos que están contraindicados en asmáticos que presentaron episodios previos de intolerancia y se recomienda evitarlos en los asmáticos, puesto que son susceptibles de tener exacerbaciones en relación con estos fármacos.
Estrategia diagnóstica en el asma de control difícil. Protocolo de actuaciónHablaremos de verdadera ACD cuando una vez confirmado el diagnóstico de asma y descartados otros posibles diagnósticos, ésta haya recibido un adecuado tratamiento para su grado de gravedad (dosis y vías de administración) y su control no sea el adecuado60,61.
Esta enfermedad no supone más de un 5% de la población asmática general62,63, y la frecuencia de ACD en niños no se conoce con precisión. En un estudio64 se estima una incidencia de alrededor del 5% en niños con asma de control deficiente o crisis graves. Esta enfermedad, a pesar de su baja frecuencia, supone un gran impacto sanitario con una elevada utilización de recursos, que precisa el uso de complejos regímenes de tratamiento, gran número de consultas al especialista y frecuentes ingresos hospitalarios.
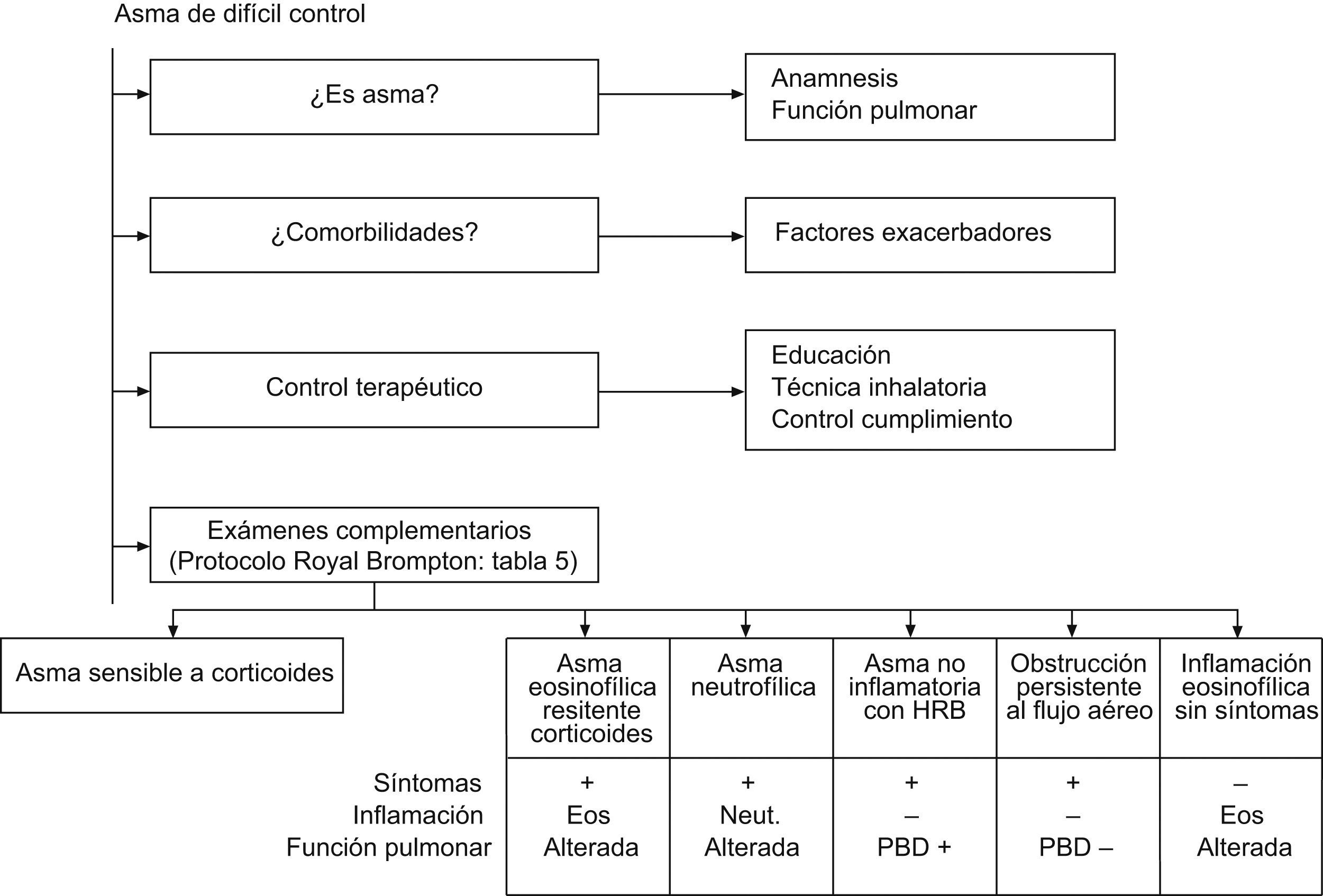
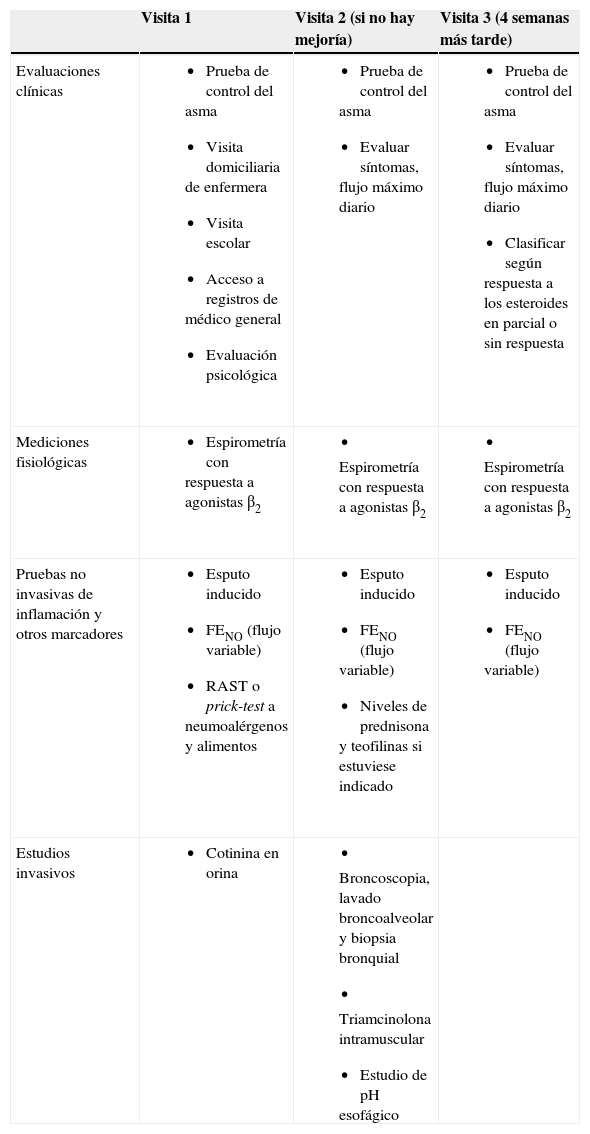
Para el estudio del ACD, una vez descartados otros diagnósticos y factores agravadores se proponen diferentes aproximaciones; una de las más aceptadas es el protocolo de estudio recomendado por el Royal Brompton Hospital para niños mayores de 5 años sobre la base de la respuesta a los corticoides sistémicos durante 2-4 semanas (por vía oral con controles de niveles de cortisol que aseguren el cumplimiento5, o más recientemente por vía intramuscular con triamcinolona acetónido17,65). En éste se comprobaría la respuesta clínica del funcionalismo respiratorio y de los biomarcadores de inflamación bronquial (FENO, eosinófilos en esputo inducido, biopsia bronquial, LBA) previamente analizados y tras las 4 semanas de tratamiento.
Según este protocolo, se incluiría al paciente tras una extensa revisión del diagnóstico (asma grave) y del grado de cumplimiento del tratamiento (adecuado) y si se comprueba la falta de control de los síntomas, para lo que se programarían, a continuación, 3 visitas (tabla 5).
Protocolo de estudio del asma de control difícil
| Visita 1 | Visita 2 (si no hay mejoría) | Visita 3 (4 semanas más tarde) | |
| Evaluaciones clínicas |
|
|
|
| Mediciones fisiológicas |
|
|
|
| Pruebas no invasivas de inflamación y otros marcadores |
|
|
|
| Estudios invasivos |
|
|
Tomado y modificado de Bush A. Asma grave en niños. En: Cobos N, Pérez-Yarza E.G., editores. Tratado de Neumología Infantil. Majadahonda (Madrid): Ergon; 2009. p. 715–30. (Autorizada su reproducción).
FENO: fracción exhalada de óxido nítrico; RAST; radioallergosorbent.
En esta visita se valorarían de nuevo los síntomas y, de ser persistentes (puntuación de control de asma), se podría realizar una visita a la escuela y al domicilio (para valorar cumplimiento de la medicación, factores agravantes ambientales, trastornos psicosociales, grado de absentismo escolar, etc.); se realizaría una espirometría, una prueba broncodilatadora y la determinación de biomarcadores no invasivos de inflamación, como la determinación de la FENO y la celularidad del esputo inducido. Si no se han hecho recientemente, se realizan test radioalergosorbente (RAST) o pruebas cutáneas a aeroalérgenos y alimentos. Se toma muestra de saliva para medir cotinina y se insiste en la necesidad de cumplir el tratamiento ajustándolo a la gravedad y grado de no control de la enfermedad.
Segunda visitaA las 2-4 semanas, si no hay mejoría, ya con el paciente ingresado se volvería a revisar el diario de síntomas, la función pulmonar y los biomarcadores de inflamación. En esta fase se realizaría también broncoscopia, biopsia bronquial y LBA. Se toman muestras de sangre para pruebas de función inmunitaria si no se han realizado con anterioridad, y cuantificación de niveles de prednisolona y teofilina si el niño está tomando estos farmacos. A continuación, se administra una sola inyección intramuscular de triamcinolona (40–80mg) y finalmente se realiza pH-metría esofágica. Si es preciso, se completa el estudio aprovechando el ingreso con tomografía computarizada de alta resolución (TCAR).
Tercera visitaA las 4 semanas se valora la respuesta a la triamcinolona, y se aplican puntuaciones de control de síntomas, respuesta de la función pulmonar (limitación persistente al flujo aéreo, respuesta a la prueba broncodilatadora) y la respuesta de los biomarcadores de la inflamación (celularidad del esputo inducido y determinación de la FENO). Según la respuesta clínica, funcional e inflamatoria se definen los diferentes fenotipos de ACD.
Este protocolo se ha validado éticamente y desde el punto de vista de la seguridad en anteriores estudios5.
Fenotipos de asma de control difícilHablaremos de fenotipo frente a aquel conjunto de características clínicas o anatomopatológicas que tienden a ir asociadas y que son útiles en algún sentido para entender la fisiopatología o mejorar la respuesta al tratamiento de una enfermedad.
Los componentes básicos que pueden caracterizar un fenotipo de asma son la extensión y naturaleza de la inflamación, el grado de hiperreactividad bronquial y la extensión de la obstrucción al flujo aéreo, su irreversibilidad y persistencia.
Hay muchos mecanismos de inflamación de la vía aérea, potencialmente diferentes. Asumir que sibilancias es igual a inflamación eosinófila de la vía aérea o incluso necesariamente inflamación de cualquier tipo, puede ser un error. Aunque tradicionalmente, y especialmente en el asma del niño mayor, la inflamación asmática se ha considerado como mediada por el linfocito Th2 y conducida por el eosinófilo, estudios sobre resultados de LBA, biopsia bronquial y esputo inducido demuestran que hasta en un 50% de los casos puede ser asma no predominantemente eosinofílico. Los niños con ACD son un grupo muy heterogéneo de pacientes, con caracterización, tratamiento y seguimiento difíciles, pero puede orientarse de forma aproximada con marcadores no invasivos de la inflamación66,67. Si para el tratamiento del ACD sería mejor utilizar valores de referencia o los perfiles personales, aún se está por aclarar68. No siempre en este grupo de pacientes niveles elevados de FENO son buenos predictores de eosinofilia en esputo9,66.
La hiperreactividad bronquial (HRB) en el modelo tradicional se considera como otra de las características definitorias de asma secundaria a la inflamación y causante de los síntomas. Pero es conocido que no siempre hay buena correlación individual entre la gravedad y la HRB. Las diferentes pruebas de hiperreactividad (ejercicio, provocación con alérgenos, metacolina, etc.) pueden tener diferentes correlaciones con los síntomas y la inflamación. Se observa poca correlación con la eosinofilia, y más habitualmente es un fenómeno de superposición.
La limitación persistente al flujo aéreo puede deberse a la reducción anatómica del calibre de la vía aérea por sucesos ocurridos antenatalmente o posnatalmente. Antenatalmente, parecen tener importancia el hábito de fumar materno, la atopía materna y la hipertensión materna durante el embarazo. En un estudio se indica que las anomalías en la circulación fetoplacentaria que ocurren en embarazadas hipertensas y diabéticas pueden dañar la vía aérea fetal. Otra posible explicación es que la hipertensión en el embarazo puede condicionar una restricción en el crecimiento fetal y, por lo tanto, una disminución de la vía aérea69. Posnatalmente, la bronquiolitis obliterante secundaria a infecciones virales, RGE o aspiraciones repetidas son las causas más frecuentes de limitación persistente al flujo aéreo.
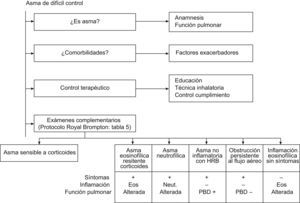
Una vez aplicado el protocolo de estudio del Royal Bronton Hospital y según la respuesta clínica, funcional e inflamatoria, se definen los diferentes fenotipos de ACD que a continuación se detallan (fig. 2).
- •
Asma de control difícil sensible a los corticoides
Probablemente el fenotipo más frecuente. El paciente tras el tratamiento con corticoides está asintomático, con función pulmonar normal y sin signos de inflamación de la vía aérea ni en los biomarcadores ni en la biopsia bronquial.
- •
Asma de control difícil eosinofílico resistente a corticoides
Pacientes sintomáticos después de asegurar el tratamiento corticoideo y que presentan inflamación predominantemente eosinofílica. Es en este grupo donde se encuentran anormalidades en la unión con el receptor de los corticoides y translocaciones del receptor citoplasmático al núcleo.
Las posibles causas de resistencia son controvertidas, aunque se cree que la falta de adherencia al tratamiento la puede favorecer. La deficiencia congénita de receptores, con un descenso del número de éstos, es muy rara. La resistencia secundaria es mucho más común. En ésta observamos un número normal o aumentado de receptores, pero con una reducida afinidad por los corticoides. Una de las posibles causas, como se ha comentado con anterioridad, puede ser la persistente y a veces inadvertida exposición a alérgenos en pacientes sensibilizados, lo que causaría a partir de los linfocitos T una liberación de interleucinas 2 (IL-2) e interleucinas 4 (IL-4), que modularían esta resistencia40,41.
Otra causa de resistencia secundaria a los esteroides es la exposición pasiva al humo del tabaco. Una serie de estudios en adultos asmáticos fumadores ha demostrado beneficios inferiores del tratamiento con GCI y orales frente a un grupo de asmáticos no fumadores70,71. El mecanismo puede radicar en la inducción de liberación de citoquinas proinflamatorias por activación del factor de transcripción nuclear kappa B (NF-k B)72. Los datos en niños son mucho más escasos, pero parece probable que la exposición pasiva al humo del tabaco induzca resistencia a los esteroides.
Otra posible causa de resistencia, y no necesariamente excluyente de las anteriores, es el cambio en el fenotipo de una subunidad del receptor para los corticoides que podría condicionar una disminución en su afinidad por éstos. El papel que pueden desempeñar algunas infecciones latentes aún se está por dilucidar.
- •
Asma de control difícil con inflamación eosinofílica sin síntomas
Este fenotipo se ha descrito mejor en adolescentes no cumplidores, que tienen un estilo de vida prácticamente normal y se les podría dar el alta en cualquier consulta externa. Sin embargo, una investigación más detallada demuestra una inflamación eosinofílica persistente en la biopsia bronquial5. La interpretación de estos hallazgos, en general, es una conjetura y las recomendaciones terapéuticas son difíciles de realizar. Es posible que los eosinófilos provoquen una inflamación subclínica que pueda ser causa de remodelado precoz o de posterior evolución a la limitación persistente del flujo aéreo5.
- •
Asma de control difícil resistente a corticoides con inflamación neutrofílica
Estos pacientes están con síntomas, los biomarcadores de inflamación para el eosinófilo son negativos y se encuentra inflamación en el esputo inducido y la biopsia bronquial por el neutrófilo73,74. No queda claro aún el papel del neutrófilo en este fenotipo: si realmente tiene un papel central en la fisiopatología o sencillamente es un reflejo del efecto de tratamientos prolongados con corticoides que prolongarían la supervivencia de los neutrofilos y retrasarían su apoptosis. Otras hipótesis abogarían porque su presencia fuera secundaria a un estímulo desconocido, como una posible infección oculta. En la actualidad hay pocos trabajos que han demostrado que la disminución de neutrófilos en la vía aérea condiciona una mejora en la gravedad del asma, aunque la experiencia de diferentes grupos así lo hace pensar.
- •
Asma de control difícil con hiperreactividad persistente no inflamatoria
Los niños con este fenotipo persisten con síntomas, no se les encuentra ningún signo de inflamación y característicamente tienen una función pulmonar con una marcada reversibilidad a la broncodilatación. Los mecanismos fisiopatológicos de este grupo no están claros y tampoco el continuar tratándolos con antiinflamatorios73,74.
- •
Asma de control difícil con limitación persistente del flujo aéreo
Puede formar parte de otros fenotipos descritos o presentarse como tal de forma individualizada. Se caracterizaría por una obstrucción bronquial no reversible, ausencia de inflamación y ausencia de cambios en la función pulmonar tras el tratamiento con corticoides. Causas frecuentes de este fenotipo son la bronquiolitis obliterante, el RGE o las aspiraciones graves. Menos frecuentemente pueden ser también causa el rechazo a un trasplante, reacciones a fármacos y enfermedades vasculares del colágeno. En general, son pacientes a los que se les ha ido escalando el tratamiento y “lo llevan todo”. Es posible que el tratamiento pueda reducirse hasta que se observe evidencia de inflamación o hiperreactividad bronquial. Frecuentemente nos podremos sorprender de que el tratamiento prácticamente puede discontinuarse por completo.
Aunque no está claro con qué frecuencia hay que revisar el tipo de fenotipo del niño con ACD ni qué significado pueden tener esos cambios, lo que sí se sabe es que puede cambiar y que hay que ajustar el tratamiento a la nueva situación. Hasta un 40% de los niños cambia de fenotipo tras un seguimiento de un año75.
Básicamente, el tratamiento del asma está dirigido a reducir la inflamación y a mejorar los síntomas del paciente. Por eso, los pilares básicos son los fármacos antiinflamatorios y los broncodilatadores. Numerosos estudios controlados han demostrado que la mayoría de los pacientes asmáticos son capaces de alcanzar un control muy aceptable de la enfermedad y que pueden disfrutar de una vida normal con dosis moderadas de medicación76. Pero, por otra parte, sigue existiendo un pequeño número de enfermos asmáticos que presentan síntomas persistentes y exacerbaciones frecuentes, a pesar de recibir tratamiento continuo, intensivo y con altas dosis.
Afortunadamente, el número de niños que precisa dosis mayores de 400–500μg/día de fluticasona es pequeño, ya que la mayor parte del efecto terapéutico se alcanza con dosis de 100–250μg/día, y el máximo efecto se alcanza con dosis de alrededor de 500μg/día77. Sin embargo, estos hallazgos están limitados por la ausencia de estudios dosis-respuesta con dosis superiores a 500μg/día de fluticasona. De cualquier manera, estas observaciones muestran que todo niño que precise dosis superiores a 800μg/día de budesonida o equivalente requiere, como ya se ha comentado anteriormente, una cuidadosa evaluación5.
En la última actualización de la guía World Health Organization/Global Initiative for Asthma (WHO/GINA)1, el asma se clasifica en 5 estadios de gravedad. A la mayoría de los pacientes se los puede incluir en alguno de los 4 niveles inferiores. En los pacientes con asma grave, clasificados como nivel 5 de la GINA, se recomienda iniciar tratamiento diario con dosis bajas de glucocorticoides orales. Sin embargo, la elevada frecuencia de efectos adversos graves asociados al tratamiento con glucocorticoides orales ha motivado la realización de numerosas investigaciones, que durante los últimos 30 años han buscado tratamientos alternativos, denominados genéricamente “agentes ahorradores de corticoides”78,79. Antes del abordaje del tratamiento fenotípico del ACD sería conveniente analizar de qué agentes ahorradores de corticoides disponemos en la actualidad.
Fármacos ahorradores de glucocorticoidesEsta forma de tratamiento puede estar indicada en el asma resistente a los glucocorticoides inhalados (GCI) o sensible a éstos, pero que precise dosis inaceptablemente altas para obtener un control adecuado.
- 1.
Glucocorticoides inhalados en altas dosis
Los pacientes con ACD deberían recibir dosis máximas de GCI. Hay evidencia suficiente para afirmar que el uso regular de GCI se asocia con disminución del riesgo de muerte por asma80. Además, varios estudios aleatorizados han mostrado que el uso de dosis altas de GCI (2.000μg/día de fluticasona81, 400–800μg/día de mometasona82, 800–1.600μg/día de budesonida83) permite reducir o suspender la dosis de glucocorticoides orales con una frecuencia significativamente mayor que cuando se utilizan dosis bajas. Sin embargo, uno de los puntos más polémicos del tratamiento del asma es la utilidad de continuar aumentando la dosis de GCI, una vez alcanzadas dosis elevadas, por el riesgo de efectos secundarios84. En la última actualización de la guía británica para el tratamiento del asma, se recomienda que los niños tratados con dosis superiores o iguales a 800μg de beclometasona o equivalente lleven consigo unas recomendaciones escritas que indiquen la reposición con esteroides sistémicos en caso de un proceso intercurrente grave85.
La utilización de dosis elevadas de GCI, concretamente budesonida y beclometasona, mediante nebulización, se ha evaluado en el tratamiento del ACD. La eficacia de la nebulización parece semejante a la encontrada con dosis similares administradas mediante presurizador y cámara espaciadora86.
- 2.
Broncodilatadores de acción prolongada
Los broncodilatadores de acción prolongada (LABA) (formoterol y salmeterol) se introdujeron en la década de 1980 en el tratamiento del asma, y actualmente su uso regular está recomendado en el tratamiento del asma moderada y grave, en combinación con GCI. Los efectos de los corticoides y los LABA en la obstrucción de la vía aérea pueden ser aditivos o incluso sinérgicos87,88.
Numerosos estudios han documentado, en adultos, que la adición de LABA al tratamiento con GCI es más eficaz para alcanzar el control del asma que doblar la dosis de GCI89,90. La revisión de la evidencia actual, incluyendo estudios que comparan la combinación de GCI y LABA, con la combinación de GCI y antileucotrienos y con un incremento de la dosis de GCI, muestra que la combinación GCI-LABA se relaciona con mejor evolución de la función pulmonar, de los síntomas y del uso de broncodilatadores a demanda, que las otras alternativas mencionadas91,92. Una reciente revisión Cochrane concluyó que los LABA poseen un efecto ahorrador de glucocorticoides orales y que su uso permite reducciones de hasta el 57% de la dosis de GCI93. Muy recientemente se ha comprobado la no inferioridad de la combinación GCI+LABA frente a doblar la dosis de GCI en niños asmáticos de 4 a 11 años94.
Uno de los problemas encontrados con cierta frecuencia con el uso prolongado de agonistas β2 es la disminución de respuesta clínica, probablemente atribuible al desarrollo de desensibilización del receptor (que parece prevenirse o revertir con el uso concomitante de GCI), o a polimorfismos genéticos del receptor β95.
- 3.
Antileucotrienos
Los fármacos antileucotrienos están incluidos actualmente en numerosas guías como tratamiento coadyuvante en el asma grave1,84,85,96. Son especialmente eficaces en pacientes asmáticos con intolerancia a aspirina, un fenotipo claramente asociado con asma grave, así como en personas obesas, donde los GCI muestran una eficacia reducida97.
Sin embargo, hasta la fecha, muy pocos estudios han evaluado el uso de los antileucotrienos en el asma grave y generalmente se añaden a otros múltiples fármacos en los pacientes con asma grave, sin que exista una evidencia irrefutable de su beneficio. Muy recientemente, un estudio llevado a cabo por el National Heart, Lung and Blood Institute en 55 niños con asma moderada-grave no ha podido demostrar el supuesto papel ahorrador de corticoides del montelukast98.
El expert panel report 3 (EPR-3) recomienda como primera elección la combinación de GCI+LABA en el asma grave en niños mayores de 5 años. Si existe preocupación por la utilización de un LABA, se puede plantear el tratamiento combinado GCI+antileucotrieno, y suspender este último si no se observa mejoría99.
- 4.
Antiinmunoglobulina E (omalizumab [Xolair®])
El omalizumab es el primer anticuerpo monoclonal recombinante humanizado que se ha evaluado para el tratamiento de las enfermedades alérgicas de las vías aéreas y es, hasta la fecha, el tratamiento antiinflamatorio no basado en esteroides mejor documentado.
El tratamiento con antiinmunoglobulina E (anti-IgE) reduce los niveles séricos de IgE entre un 89 y un 99% de una manera dependiente de la dosis, y reduce la cantidad de mediadores que se liberan en respuesta a la exposición a un alérgeno100.
Se han realizado varios ensayos clínicos aleatorizados controlados con placebo en adultos asmáticos y sólo uno en niños. Los resultados muestran que omalizumab es eficaz en mejorar los síntomas y la calidad de vida relacionada con el asma, en reducir la dosis de GCI, la frecuencia de las exacerbaciones y las hospitalizaciones en los pacientes con asma alérgica101–106. Muy recientemente se ha evaluado el efecto del tratamiento con omalizumab en la frecuencia de exacerbaciones asmáticas en 419 pacientes de 12 a 75 años, con asma grave persistente no controlada a pesar de dosis altas de GCI y agonistas β2 de acción prolongada107, con una disminución significativa en el número de exacerbaciones graves y en el número de visitas a urgencias en el grupo tratado con omalizumab. Busse et al108 han mostrado la eficacia de omalizumab en la reducción de las exacerbaciones asmáticas con necesidad de glucocorticoides orales. También se ha comprobado el papel de omalizumab como ahorrador de glucocorticoides orales en pacientes asmáticos con asma grave109.
Actualmente, omalizumab está aprobado para el tratamiento del asma persistente moderada y grave en adultos y niños >12 años con asma atópica (demostrado por un prick-test o una determinación de IgE específica positiva a algún aeroalérgeno perenne), inadecuadamente controlada con GCI, que tienen un nivel de IgE sérico de entre 30 y 700U/ml y con un peso entre 30 y 150kg110.
Aunque la licencia no permite el uso de omalizumab antes de los 12 años, existe actualmente experiencia clínica sustancial en el grupo entre los 6 y 12 años, por lo que su utilización en esta franja de edad no supone una contraindicación absoluta17.
Es importante señalar que los datos disponibles en la actualidad indican que los pacientes con asma alérgica grave y con peor función pulmonar tienen mayor probabilidad de responder a omalizumab111 y, por tanto, podría considerarse como tratamiento coadyuvante en estos casos.
Dado su mecanismo de acción sistémico, puede ser de interés en el paciente con comorbilidades por enfermedades alérgicas múltiples. Aún no se conoce si el beneficio del omalizumab podrá extenderse a los pacientes con ACD no alérgico112,113.
La dosis de omalizumab se calcula en función del peso corporal y los niveles de IgE, y la dosis mínima es de 0,016mg/kg porU/ml de IgE. La vía de administración es subcutánea cada 2-4 semanas. Este sistema de administración puede ser especialmente beneficioso en los pacientes con mal cumplimiento terapéutico.
En general, el tratamiento con omalizumab es bien tolerado y los efectos secundarios más frecuentemente descritos son cefalea y dolor local en la zona de inyección. Uno de los mayores problemas que plantea el tratamiento con omalizumab es el elevado coste.
- 5.
Metotrexate
Desde la primera publicación en 1988 se han realizado varios ensayos clínicos y metaanálisis en los que se ha evaluado la eficacia de dosis bajas de metotrexate (MTX) oral o intramuscular en la reducción de corticoides orales114–119, con resultados contradictorios.
No se han realizado ensayos clínicos aleatorizados, controlados con MTX en niños, aunque sí se han publicado algunos estudios abiertos con escaso número de pacientes pediátricos, en los que el uso de MTX permitió reducir la dosis de corticoides orales, sin efectos secundarios significativos120,121.
- 6.
Ciclosporina
La ciclosporina, bien conocida por sus efectos antiinflamatorios e inmunomoduladores, se ha utilizado ampliamente en el trasplante de órganos.
Se han publicado 3 ensayos prospectivos aleatorizados, controlados con placebo que han evaluado el efecto de 5mg/kg de ciclosporina en pacientes con asma grave. Los resultados no fueron demasiado prometedores, aunque es necesario tener en cuenta el escaso número de pacientes incluidos.
No se ha llevado a cabo ningún ensayo clínico con ciclosporina en niños asmáticos. El grupo de Bush et al122 publicó un estudio abierto de 5 niños con asma grave dependiente de corticoides orales, tratados con ciclosporina. En 3 de ellos se pudo reducir o suspender el tratamiento con corticoides, en un caso no se observó ningún beneficio y una adolescente suspendió el tratamiento debido a la aparición de hirsutismo.
La mayoría de los efectos adversos asociados con el uso de ciclosporina no han aparecido con las dosis bajas empleadas en los ensayos previamente mencionados123–125, aunque algunos pacientes sí presentaron hipertricosis y empeoramiento de hipertensión preexistente, que obligaron a abandonar el estudio.
En resumen, los efectos beneficiosos de la ciclosporina en el asma son pequeños y de dudoso significado clínico, por lo que con la evidencia disponible no se puede recomendar su uso habitual en el tratamiento del asma grave dependiente de corticoides orales126.
- 7.
Inmunoglobulina intravenosa
La experiencia con inmunoglobulina intravenosa (IGIV) en el tratamiento del asma es limitada y los mecanismos implicados en su posible efecto ahorrador de glucocorticoides no son totalmente conocidos.
En 1991, Mazer y Gelfand127 publicaron un estudio abierto de 6 meses de duración, en el que 8 pacientes pediátricos con asma grave dependiente de los corticoides recibieron tratamiento con dosis altas de IGIV, y se observó una importante disminución de la necesidad de glucocorticoides orales, así como mejoría de los síntomas y de la función pulmonar. Sin embargo, en estudios aleatorizados controlados con placebo en niños y adolescentes, no se pudo demostrar mejoría clínica o funcional en los tratados con IGIV en comparación con el grupo placebo128–130.
- 8.
Macrólidos
A pesar de que el tratamiento con troleandomicina se introdujo en 1957 en el asma grave, el mecanismo de acción de los macrólidos en el asma sigue siendo controvertido. Los macrólidos pueden interferir con la producción de citoquinas (IL-8, TNF-α) y con el metabolismo de diversas células implicadas en el proceso inflamatorio asmático. Además, disminuyen la quimiotaxis de los neutrófilos y la producción de moco131.
A pesar de que algunos macrólidos como la claritromicina parecen disminuir la hiperreactividad bronquial en pacientes asmáticos no tratados con glucocorticoides, hasta hace muy poco sólo una pequeña serie de 3 casos demostró algún posible beneficio en la disminución o discontinuación de glucocorticoides orales en pacientes con asma grave132. Muy recientemente, un estudio llevado a cabo por el National Heart, Lung, and Blood Institute en 55 niños con asma moderada-grave no ha observado el supuesto papel ahorrador de corticoides de la claritromicina133.
En conclusión, los antibióticos macrólidos representan una opción teóricamente prometedora en el tratamiento del asma, fundamentalmente por sus propiedades inmunomoduladoras, aunque no hay claras evidencias que demuestren su eficacia en los niños con asma grave.
- 9.
Inhibidores de la fosfodiesterasa
Se han realizado diversos ensayos clínicos en pacientes asmáticos y se ha evaluado el papel del roflumilast, un inhibidor selectivo de los receptores B de la fosfodiesterasa-4 administrado por vía oral; se observó que atenúa la reacción asmática precoz y la tardía tras exposición a alérgenos, y mejora la función pulmonar de forma dependiente de la dosis134. La mejoría en la función pulmonar es ya evidente a las 24h de iniciado el tratamiento, y la dosis de 500μg/día de roflumilast parece equivalente a 400μg/día de beclometasona en la reducción de los síntomas, de la medicación de rescate y en la mejoría de la función pulmonar135.
No se han publicado hasta ahora estudios controlados con placebo ni estudios en pacientes con asma grave. Por tanto, antes de definir con claridad el papel del roflumilast en el ACD se necesitan estudios encaminados a clarificar su utilidad en este grupo de pacientes.
- 10.
Citoquinas
La IL-5 es una citoquina clave en la diferenciación y maduración de los eosinófilos en la médula ósea, así como en su selección y activación en el lugar de la inflamación alérgica. Aunque los estudios iniciales indicaban que a pesar del espectacular efecto de mepolizumab, un anticuerpo monoclonal anti-IL-5, en la reducción del número de eosinófilos en sangre periférica, no tenía ninguna acción sobre la hiperrespuesta bronquial o la reacción asmática tardía tras la provocación con alérgeno, 2 estudios recientes ofrecen resultados muy prometedores. En el primero de ellos, el tratamiento mensual durante un año con mepolizumab en pacientes adultos con asma eosinofílica refractaria y exacerbaciones frecuentes se asoció con reducción el número de exacerbaciones y mejoría de la calidad de vida relacionada con el asma136. En el siguiente estudio, el tratamiento con mepolizumab redujo el número de eosinófilos en sangre y esputo y se asoció con mejoría del control del asma y del volumen forzado espiratorio en el primer segundo (FEV1) en pacientes con asma eosinofílica, sintomáticos a pesar de tratamiento con prednisona oral137. Estos estudios confirman el papel de los eosinófilos en las exacerbaciones asmáticas en un subgrupo de pacientes y el beneficio que puede ofrecer el anticuerpo monoclonal mepolizumab en su tratamiento, aunque se necesitan nuevos estudios que confirmen su eficacia tanto en adultos como en niños.
- 11.
Lidocaína nebulizada
Durante décadas se ha observado el efecto antiinflamatorio de la lidocaína nebulizada en la vía aérea de gran y pequeño calibre.
El tratamiento con lidocaína nebulizada 4 veces al día se ha asociado en un estudio con una reducción de entre el 80 y el 100% de la dosis de glucocorticoides orales en adultos con asma grave138.
Se ha publicado hasta la fecha un estudio abierto realizado en niños con asma grave, en los que el tratamiento con lidocaína se asoció con suspensión de los glucocorticoides orales en 5 de los 6 casos139.
El excelente perfil de seguridad junto con un posible papel como ahorrador de glucocorticoides hace pensar que el tratamiento con lidocaína nebulizada debería estudiarse en mayor profundad mediante ensayos clínicos adecuadamente diseñados.
Como ya se ha comentado previamente, las opciones del tratamiento del asma grave en el niño se basan fundamentalmente en el uso de GCI en dosis altas asociados a LABA y a antileucotrienos. Algunos pacientes necesitarán glucocorticoides orales y fármacos ahorradores de glucocorticoides. El protocolo de tratamiento del Hospital Brompton de Londres propone un enfoque terapéutico de los niños con asma grave, en función del fenotipo asmático140, monitorizando no sólo los síntomas y la función pulmonar, sino también evaluando indirectamente la inflamación mediante la medición de la FENO y de la celularidad en el esputo inducido o en muestras obtenidas mediante fibrobroncoscopia141,142. Según los resultados, el paciente se clasifica en uno u otro fenotipo, y en función de ello se elige el tratamiento más adecuado.
- 1.
Asma eosinofílica sensible a corticoides
Es el fenotipo más común. El tratamiento consistirá en utilizar corticoides orales en dosis elevadas, y una vez conseguido el control del paciente (asintomático, función pulmonar normal y sin alteraciones inflamatorias), intentar reducir los corticoides hasta la mínima dosis que controle los síntomas sin efectos secundarios. Si no se puede reducir la dosis a un nivel en que los efectos secundarios sean tolerables, se podría ensayar un tratamiento con fármacos ahorradores de corticoides, aunque con frecuencia suelen ser menos efectivos en este fenotipo.
- 2.
Asma eosinofílica resistente a corticoides
Este fenotipo incluye los niños con persistencia de síntomas y evidencia de inflamación eosinofílica en la biopsia o el LBA a pesar de tratamiento con triamcinolona intramuscular. En estos pacientes es necesario buscar causas de resistencia secundaria a corticoides, como la exposición persistente a neumoalérgenos y al humo del tabaco (ver apartado de fenotipos y factores ambientales)17.
Los autores17,140 proponen para este grupo, tratamiento con dosis altas y prolongadas de corticoides o fármacos ahorradores de corticoides, habitualmente ciclosporina o MTX, durante al menos 3 meses, y posteriormente intentar reducir al mínimo la dosis de corticoides orales. Probablemente, y aunque los autores aún no lo incluyen en este protocolo, se podría valorar un ensayo terapéutico con omalizumab en pacientes con ACD alérgica encuadrable en este grupo.
- 3.
Asma con inflamación eosinofílica persistente, sin síntomas
Este fenotipo se ha descrito, sobre todo, en adultos jóvenes que clinicamente están asintomáticos, pero que mantienen eosinofilia persistente en la vía aérea. Se especula si en estos pacientes hay un retraso en el cese de la inflamación y riesgo de remodelación continuada, a pesar de la ausencia de síntomas9,17. Se relaciona con la falta de adherencia al tratamiento, ya que el paciente se encuentra bien. Debería tratarse como un asma sensible a corticoides y observación estrecha con espirometrías repetidas y mediciones no invasivas de la inflamación.
- 4.
Asma resistente a los esteroides con inflamación no eosinofílica
Está descrito un fenotipo en el que los neutrófilos son las células predominantes en las muestras obtenidas mediante biopsia o LBA en pacientes con asma grave, que se mantienen sintomáticos a pesar de dosis altas de corticoides orales143. No está claro cuál es el papel del neutrófilo en estos pacientes, aunque se baraja, entre otras posibilidades, que el neutrófilo puede ser la célula efectora en este tipo de asma. No hay estudios que demuestren que la reducción de los neutrófilos de la vía aérea mejore los síntomas asmáticos. Sin embargo, se han utilizado de forma empírica distintos fármacos que pueden reducir la neutrofilia de la vía aérea. Algunos de ellos, como los antibióticos macrólidos, actúan bloqueando la producción de IL-8144; otros, como las teofilinas, aceleran la apoptosis de los neutrófilos145. También se pueden considerar en este fenotipo los fármacos inhibidores de la 5 lipooxigenasa17.
- 5.
Hiperreactividad bronquial persistente no inflamatoria
Los niños con este fenotipo no tienen evidencia de inflamación residual en la vía aérea en la segunda visita. Sin embargo, permanecen sintomáticos y muestran reversibilidad tras la administración de broncodilatador. La base molecular de este fenotipo no está clara, pero no parece lógico tratar a estos pacientes con tratamientos antiinflamatorios más potentes. Se ha ensayado el tratamiento con dosis altas de agonistas β2 inhalados con poco éxito. Los autores refieren cierta respuesta con terbutalina subcutánea en perfusión continua en 5 de 8 niños146. Se necesitan estudios controlados para evaluar este tratamiento.
- 6.
Asma con limitación persistente al flujo aéreo
Este fenotipo se caracteriza por obstrucción continuada del flujo aéreo, sin inflamación ni reversibilidad con los agonistas beta-2-adrenérgicos. En general, son pacientes con tratamiento escalonado múltiple y en los que actualmente se recomienda el uso de tratamiento mínimo que conserve la función pulmonar.
En conclusión, y a la luz de las escasas evidencias disponibles en cuanto al tratamiento de los niños con ACD, parece aconsejable, siempre que sea posible, utilizar los fármacos habitualmente recomendados por las guías terapéuticas para el tratamiento del asma. Los posibles beneficios de la mayoría de los tratamientos alternativos descritos en esta revisión necesitan confirmarse con estudios multicéntricos que reúnan número suficiente de pacientes para poder evaluar con claridad su utilidad.
La definición de ACD en niños mayores y adultos está razonablemente establecida4; sin embargo, no existe una definición aceptada de este problema para niños preescolares. Las recomendaciones de la Sociedad Europea de Respiratorio (ERS Task Force) sobre asma difícil147 excluyen explícitamente a los niños por debajo de los 5 años de edad por considerar que el asma en niños de estas edades está poco caracterizado. Cada vez está más claro que el asma, a cualquier edad, no es una única enfermedad, sino un grupo de enfermedades con un componente variable de inflamación de la vía aérea, hiperreactividad bronquial y limitación persistente al flujo aéreo.
El primer problema que se plantea ante un niño con sibilancias recurrentes que no responde a un tratamiento antiasmático es si realmente tiene asma. Las sibilancias recurrentes son muy frecuentes durante la primera infancia. En la gran mayoría de los niños son secundarias a infecciones virales. Un pequeño subgrupo de estos niños tiene una base atópica, con antecedentes familiares de asma o con dermatitis atópica, y estas sibilancias son más similares a las que tienen los niños mayores con asma. Afortunadamente, la mayoría de los niños con sibilancias tienen un pronóstico excelente e irán mejorando durante los primeros años de vida, y muchos se curarán definitivamente148,149.
Por otro lado, las sibilancias son síntomas muy inespecíficos que aparecen tanto en un niño con una infección viral banal como en un niño con una enfermedad respiratoria grave (fibrosis quística o malformación congénita broncopulmonar o anillo vascular). Existen enfermedades muy diversas que se manifiestan con sibilancias durante los primeros años de vida y cuya presentación clínica puede ser muy similar en unas y otras, y es un gran reto distinguirlas (tabla 3). Cuanto menor es el niño con problemas respiratorios, mayor es la probabilidad de que tenga otras enfermedades que simulen el asma14.
El siguiente problema es que la definición de ACD incluye la falta de respuesta a un tratamiento adecuado. La gran mayoría de los niños con asma, de cualquier edad, responden bien al tratamiento con broncodilatadores y GCI. Sin embargo, no es raro encontrar niños con crisis de broncoespasmo exclusivamente durante las infecciones respiratorias y que tienen mala respuesta a un tratamiento antiasmático adecuado. Estos episodios pueden ser graves y muy frecuentes y no por aumentar mucho el tratamiento se consigue evitar las crisis15,150. Probablemente, ésta sea la principal razón por la que se clasifique a un lactante o un preescolar como ACD, y la falta de reconocimiento de este proceso hace que se utilicen tratamientos cada vez más intensivos sin eficacia clara en este tipo de paciente151. Indudablemente, existen diversos fenotipos de niños sibilantes y no todos responden igualmente al tratamiento. Por lo tanto, es necesario preguntarse si el niño presenta un cuadro con inflamación de las vías aéreas susceptible de tratarse con corticoides o si, por el contrario, no existe inflamación y sólo el tiempo lo curará.
No es fácil valorar la falta de control a estas edades. La persistencia de los síntomas respiratorios que refieren los padres es muy inespecífica, y el miedo de los padres a que el proceso se cronifique por falta de un tratamiento adecuado puede hacer que exageren los síntomas para que el médico les haga caso. La existencia de ruidos respiratorios es muy frecuente en los lactantes. Hay muchas razones para que un niño tenga ruidos al respirar, las vías aéreas superiores son pequeñas, el tejido adenoamigdalar es grande y ocupa gran parte de este espacio y los niños tienen con mucha frecuencia infecciones respiratorias virales con gran producción de moco. El ruido del aire al pasar por las vías respiratorias superiores se transmite al tórax y simula la existencia de sibilancias. Existe una gran disparidad a la hora de interpretar los ruidos respiratorios entre los distintos padres152,153 e incluso entre diversos médicos. Otro síntoma muy frecuente, y que la mayoría de las veces no tiene nada que ver con el asma, es la tos. Durante mucho tiempo se ha pensado en la tos como en un equivalente asmático, lo que ha hecho que muchos niños sin asma recibieran tratamientos inadecuados154. Además, un niño con asma también puede toser por otros motivos y la existencia de tos no siempre significa mal control del asma.
La dificultad para observar la obstrucción bronquial mediante pruebas de función pulmonar hace que generalmente haya que basarse en signos y síntomas muy inespecíficos, lo que lleva a diagnósticos y tratamientos poco precisos. Se debe intentar buscar datos lo más objetivos posibles, como la presencia de dificultad respiratoria o que un médico observe polipnea durante las crisis o, mejor aún, la bajada de la saturación de oxígeno durante estos episodios. Hoy es posible realizar estudios de función pulmonar que permitan observar la existencia de obstrucción bronquial, como la espirometría en niños por encima de los 3 años de edad155 o medidas de resistencia mediante oclusión u oscilometría en niños menores o no colaboradores156.
Por tanto, aunque no exista una definición universalmente aceptada sobre el asma de control difícil en el niño pequeño por toda la problemática expuesta, parece razonable, desde un punto de vista práctico, considerar que un niño pequeño presenta ACD cuando tenga ingresos hospitalarios que exijan asistencia en UCIP, o cursos frecuentes de corticoides orales por síntomas graves o síntomas persistentes que afecten de forma importante a su calidad de vida, a pesar de recibir un tratamiento adecuado151.
EnfermedadLos estudios con LBA han mostrado que los niños pequeños con episodios frecuentes de sibilancias tienen un incremento mayor de linfocitos y neutrófilos que de eosinófilos157; en niños mayores es más frecuente encontrar inflamación eosinofílica, aunque también en una parte importante tienen inflamación mediada por linfocitos o neutrófilos158. Probablemente existan diferentes subgrupos de niños con ACD; algunos tienen un aumento de la FENO que se reduce tras un tratamiento con prednisolona, mientras que en otros persiste elevado a pesar del tratamiento7.
En lactantes sintomáticos con obstrucción reversible al flujo aéreo, incluso con atopía, no se han encontrado los cambios patológicos característicos del niño mayor o del adulto con asma, como el engrosamiento de la membrana basal o la inflamación eosinofílica159. Un estudio reciente ha valorado el momento de aparición de estos cambios, y comprobó que éstos comienzan entre los 1 y los 3 años de edad160, una edad en la que una intervención adecuada podría quizás modificar la historia natural del asma.
Tratamiento del niño pequeño con asma de control difícilEn un niño pequeño con clínica indicativa de asma, que no responda adecuadamente al tratamiento, se debe, en primer lugar, confirmar el diagnóstico de asma. Es imprescindible hacer un diagnóstico diferencial exhaustivo que permita descartar otras enfermedades diferentes del asma que se presentan con clínica similar (tabla 3).
Historia clínica: existen algunos síntomas o signos que deben hacer sospechar que se está ante un paciente de este tipo, como la edad muy precoz de inicio de los síntomas o los antecedentes de prematuridad, la persistencia de los síntomas sin remisión entre los episodios, la existencia de otras enfermedades asociadas, como malnutrición o diarrea crónica o la asociación con enfermedades infecciosas supuradas o diarrea crónica que debe hacer pensar en una inmunodeficiencia, la presencia de vómitos o aspiraciones que deben hacer descartar una enfermedad por RGE. La existencia de una historia familiar de enfermedades respiratorias debe hacer pensar en una enfermedad hereditaria. Se debe investigar la relación de los síntomas respiratorios con factores ambientales como tabaquismo o contacto con alérgenos.
Examen físico: generalmente es de poca ayuda, pues entre los episodios suele ser normal, pero puede ayudar a identificar algunos pacientes con causas atípicas de episodios de sibilancias. Un niño malnutrido probablemente tendrá alguna causa más grave de enfermedad pulmonar, como fibrosis quística, inmunodeficiencia, etc.; un niño con retraso psicomotor puede tener fácilmente aspiraciones, y la presencia de acropaquias debe hacer descartar fibrosis quística u otros procesos respiratorios graves.
Pruebas complementarias: los estudios necesarios se indicarán de acuerdo a la clínica del paciente y están, sobre todo, enfocados a descartar otros diagnósticos (tabla 6). Una vez descartada la existencia de otras enfermedades diferentes del asma, los estudios intentarán evaluar qué factores pueden incidir en la mala evolución del paciente para intentar modificarlos. Los estudios dirigidos a la evaluación del asma en el niño pequeño son función pulmonar, grado y tipo de inflamación de la vía aérea y cambios estructurales en la vía aérea. Desgraciadamente, existen pocas evidencias sobre su utilidad real para tratar el asma en el niño pequeño.
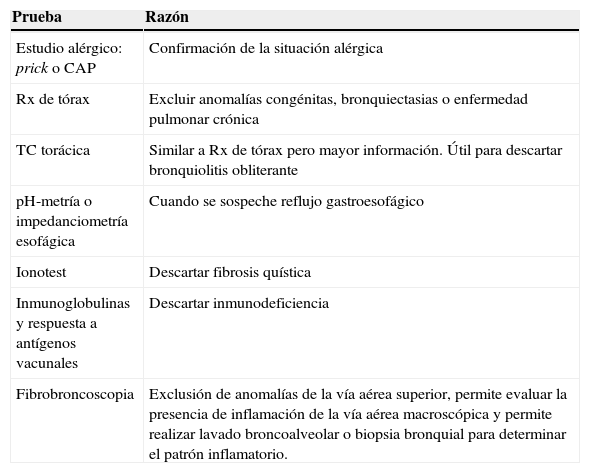
Pruebas necesarias en el diagnóstico diferencial del asma de control difícil
| Prueba | Razón |
| Estudio alérgico: prick o CAP | Confirmación de la situación alérgica |
| Rx de tórax | Excluir anomalías congénitas, bronquiectasias o enfermedad pulmonar crónica |
| TC torácica | Similar a Rx de tórax pero mayor información. Útil para descartar bronquiolitis obliterante |
| pH-metría o impedanciometría esofágica | Cuando se sospeche reflujo gastroesofágico |
| Ionotest | Descartar fibrosis quística |
| Inmunoglobulinas y respuesta a antígenos vacunales | Descartar inmunodeficiencia |
| Fibrobroncoscopia | Exclusión de anomalías de la vía aérea superior, permite evaluar la presencia de inflamación de la vía aérea macroscópica y permite realizar lavado broncoalveolar o biopsia bronquial para determinar el patrón inflamatorio. |
CAP: Pharmacia CAO system R; Rx: radiografía; TC: tomografía computarizada.
Pocos centros tienen la tecnología adecuada para estudiar la función pulmonar en el lactante y sólo algunos en el niño preescolar. Es posible medir la resistencia de las vías aéreas por oscilometría o por interrupción en niños por encima de los 3 años de edad, y cada vez se utiliza más la espirometría en niños tan pequeños como 3 años155.
Además de los medios técnicos adecuados, es imprescindible contar con personal bien adiestrado en la realización de estas técnicas.
Marcadores de la inflamaciónUnos niveles plasmáticos de proteína catiónica del eosinófilo mayores de 20ng/ml en un lactante con sibilancias recurrentes indican inflamación eosinofílica y ayudan a predecir persistencia de la sintomatología 2 años después161.
La presencia de un porcentaje de eosinófilos en sangre periférica superior o igual al 4% es un criterio menor en el índice de predicción de asma, que intenta ayudar a preveer qué lactante con sibilancias recurrentes tendrá asma atópica en el futuro162.
La medición del FENO parece ser útil en la evaluación del componente inflamatorio del asma en el adulto y niño mayor pero está mucho peor estudiada en el niño pequeño. En el niño poco colaborador no puede realizarse la técnica de la espiración única, por lo que se realizan mediciones a volumen corriente163. Esta técnica está peor estandarizada y no está exenta de problemas técnicos, y su utilidad en el tratamiento del asma en el niño pequeño no está aclarada. El estudio del esputo inducido también es complejo en el niño pequeño.
Lavado broncoalveolar y biopsia bronquialLa fibrobroncoscopia es una técnica segura en el niño pequeño cuando la realizan personas con experiencia suficiente y su técnica está bien estandarizada164. La biopsia bronquial permite valorar de forma directa el tipo y grado de inflamación de la vía aérea. El conocimiento de las características del fenotipo inflamatorio del niño o la comprobación de la ausencia de inflamación pueden ayudar al diagnóstico y a seleccionar mejor el tratamiento165. La fibrobroncoscopia puede ayudar también a evaluar la presencia de RGE o aspiraciones mediante la valoración del aspecto macroscópico de la vía aérea166 o la presencia de macrófagos cargados de lípidos167. En un estudio en el que se evaluó la utilidad de la fibrobroncoscopia en la valoración de preescolares con sibilancias recurrentes graves encontraron alteraciones estructurales macroscópicas en el 28% de los niños y alguna alteración (macroscópica, LBA o biopsia bronquial) en el 79% de los niños, por lo que se considera esta técnica muy útil168.
Aspectos específicos del tratamiento en el asma de control difícil del lactante y preescolarEl tratamiento del lactante y preescolar con ACD presenta algunas dificultades suplementarias. En primer lugar, existe una falta importante de estudios de calidad realizados en niños de esta edad, lo que hace que muchas de las recomendaciones estén basadas en opiniones de expertos y extrapolen resultados de niños mayores o adultos. Un número importante de estos pacientes tienen un tipo de asma, exclusivamente inducido por virus y con escaso componente inflamatorio o con inflamación principalmente neutrofílica, que tiene poca respuesta al tratamiento con corticoides y no hay otros fármacos que hayan demostrado su eficacia clara en estos casos. Muchas veces no hay más remedio que suspender el tratamiento ineficaz y esperar a que el tiempo haga su labor: “primum non nocere”. Otro problema importante a esta edad es la dificultad para lograr que los fármacos alcancen adecuadamente la vía respiratoria. Es imprescindible emplear un tiempo suficiente para explicar a los padres el uso de las cámaras de inhalación apropiadas para cada edad.
Existe un fenotipo de asma especialmente difícil de controlar que consiste en niños completamente asintomáticos entre crisis pero que tienen episodios muy agudos y graves de broncoespasmo durante las infecciones virales. En estos pacientes, el uso de GCI en altas dosis al primer signo de infección respiratoria169, posiblemente combinados con antagonistas de los leucotrienos170 y quizás macrólidos, puede ser una alternativa pragmática pero insuficientemente estudiada. La administración de corticoides orales durante las crisis de asma en niños con sibilancias inducidas por virus era, hasta ahora, el pilar principal del tratamiento, pero recientemente se ha cuestionado171. No existen estudios que apoyen la prescripción de broncodilatadores de acción prolongada en niños menores de 4 años, y además, su uso está fuera de ficha técnica, por lo que no puede recomendarse habitualmente. Parece razonable, de todos modos, realizar un intento terapéutico en niños mal controlados con GCI en dosis medias más antagonistas de los leucotrienos.