Introducción
Los tumores neonatales, a pesar de su rareza (1,5-2 % de los tumores pediátricos), atraen indudablemente la atención de los investigadores biosanitarios, porque además de los retos clínicos y evolutivos, está el importante enigma de su etiopatogenia. La incidencia oscila entre el 1,7 y 3,74 por 100.000 recién nacidos vivos/año incluyendo sólo los de histología maligna 1-4 o del 7,20 por 100.000 recién nacidos vivos/año si se engloban las tumoraciones benignas 5.
Todos los tumores se originan por la combinación variable de dos tipos de determinantes, el genético o endógeno y el ambiental o exógeno. Diversos autores asignan el 4-15 % de los tumores infantiles a los factores de riesgo genéticos, prevaleciendo en los restantes casos los cancerígenos ambientales. El corto período de latencia de los tumores infantiles se atribuye a acciones preconcepcionales, transplacentarias y posnatales, sobre tejidos celulares morfológica y funcionalmente inmaduros 6,7. En los últimos años ha resurgido con fuerza el concepto ecogenetics para agrupar y entrelazar a factores ambientales y genéticos 8,9.
La etiopatogenia de los tumores neonatales es diferente a la encontrada en otras épocas de la vida 6,7,10-16. Teóricamente, los factores de riesgo ambientales pueden actuar sobre las células germinales de los progenitores (oncogénesis preconcepcional) 11,17, durante la gestación (oncogénesis transplacentaria) 18-21, y desde el nacimiento hasta el momento del diagnóstico (oncogénesis posnatal). Un tipo especial de oncogénesis preconcepcional es la transgeneracional que originará los cánceres hereditarios o familiares por la mutación de las células germinales que se hereda con carácter recesivo o dominante 22,23. La brevedad del período neonatal y las prolongadas fases de latencia de los cánceres humanos, hacen improbable que un recién nacido sano desarrolle un tumor en un mes, por lo que podemos afirmar que en el período neonatal la oncogénesis posnatal es inexistente.
Diversas publicaciones, con mayor o menor evidencia científica, han objetivado un incremento de cánceres en descendientes de progenitores expuestos preconcepcional o transplacentariamente a radiaciones ionizantes y no ionizantes, agentes infecciosos, fármacos y drogas, tabaco, alcohol, dieta y ocupaciones parentales, maternas y paternas 6. Generalmente, los estudios epidemiológicos hacen referencia a toda la edad pediátrica, y aunque incluyen casos neonatales, no son específicos de ellos, siendo muy escasos los trabajos exclusivos del período neonatal que estudien los factores de riesgo 16.
El objetivo de nuestro estudio es describir los factores de riesgo, ambientales o genéticos, en una serie de tumores neonatales diagnosticados en el Hospital Infantil Universitario La Fe de Valencia.
Material y métodos
Descripción de los factores de riesgo presentes en los tumores neonatales diagnosticados en el Hospital Infantil Universitario La Fe de Valencia, desde enero de 1990 a diciembre de 1999. Revisión bibliográfica de los últimos 25 años del Medline, Cancerlit, Index Citation Science y Embase de los factores de riesgo asociados a los tumores neonatales y cánceres infantiles en general, seleccionando los más importantes y entre sus referencias, los más relevantes publicados previamente a la búsqueda. El perfil de búsqueda utilizado, fue la combinación de etiology/epidemiology/risk factor con neonatal/congenital y con tumor/cancer/neoplasms.
Los factores de riesgo se obtuvieron mediante un cuestionario a través de una entrevista personal a los padres de los pacientes, previo contacto telefónico y/o por correo. La entrevista se realizó en la Unidad de Salud Medioambiental Pediátrica (PEHSU-Valencia) o en los domicilios particulares de los sujetos del estudio. La entrevista fue realizada por el mismo observador, con una duración media de 3,5 h (rango, 1,5-4 h).
En el cuestionario se recogieron factores de riesgo de exposición preconcepcional y transplacentaria, así como antecedentes familiares. Todos estos factores de riesgo han sido descritos en la literatura médica con una mayor o menor evidencia científica. Datos de exposición preconcepcional: a) vivienda y su entorno; b) trabajos y ocupaciones maternos o paternos; c) dieta; d) consumo de drogas legales e ilegales; e) radiación ionizante, y f) tratamiento esterilidad. Datos de exposición transplacentaria: a) patología gestacional; b) trabajo materno-gestacional; c) radiación ionizante; d) radiación no ionizante; e) dieta, y f) fármacos o drogas u otros productos químicos. Antecedentes familiares: enfermedades tumorales y otras de interés.
Resultados
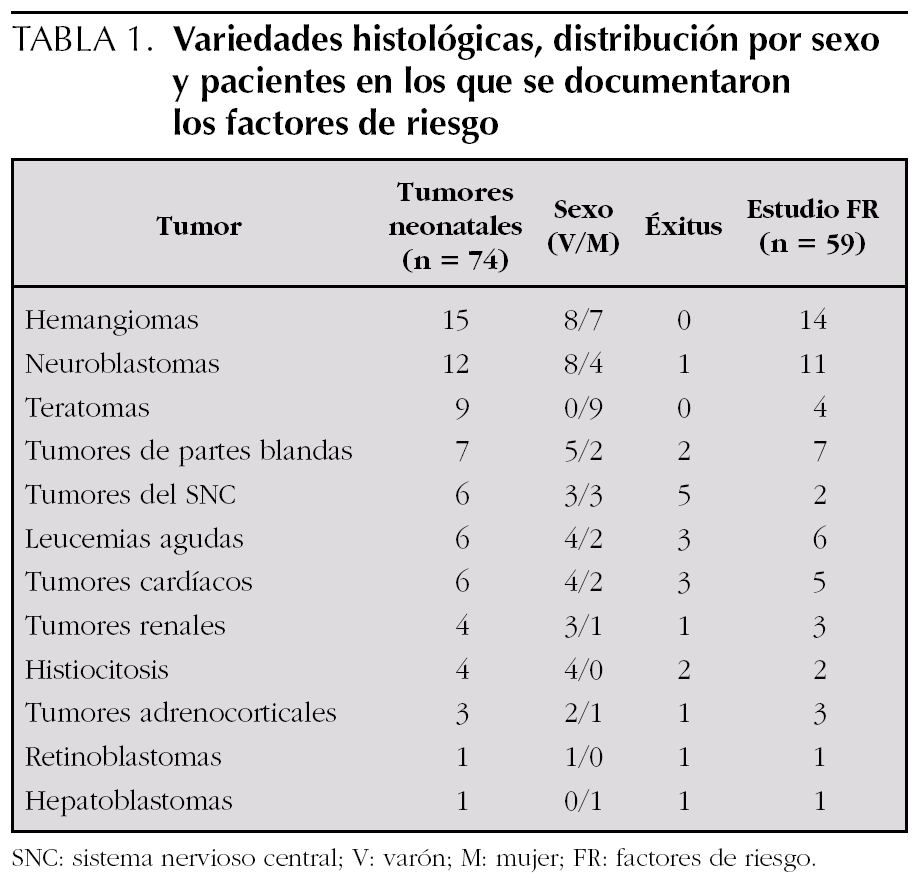
Hemos encontrado 74 tumores neonatales (42 varones). Las variedades tumorales están expuestas en la tabla 1. Todos los pacientes eran de raza blanca y de nacionalidad española. La supervivencia en el momento del estudio (enero 2005) se sitúa en el 73 %, con una media de seguimiento de 8 años.
De los 74 pacientes seleccionados, 59 (80 %) aceptaron participar en el estudio. En 8 casos fue imposible contactar con ellos y los padres de los 7 pacientes restantes rechazaron su participación.
Los diferentes factores de riesgo genético-constitucionales documentados figuran en la tabla 2 y los ambientales, en las tablas 3 y 4.
Factores genéticos-constitucionales
Los factores de riesgo genético-constitucionales están asociados en el 13,6 % de los casos. No se ha identificado ningún síndrome hereditario recesivo de cáncer familiar; en cambio, sí que aparecen cinco síndromes hereditarios dominantes (un retinoblastoma familiar y cuatro esclerosis tuberosas en pacientes con tumores cardíacos). Además registramos tres síndromes cromosómicos no hereditarios, trisomía 21 en pacientes con leucemia-síndrome mieloproliferativo transitorio (tabla 2).
Factores ambientales
Radiación ionizante
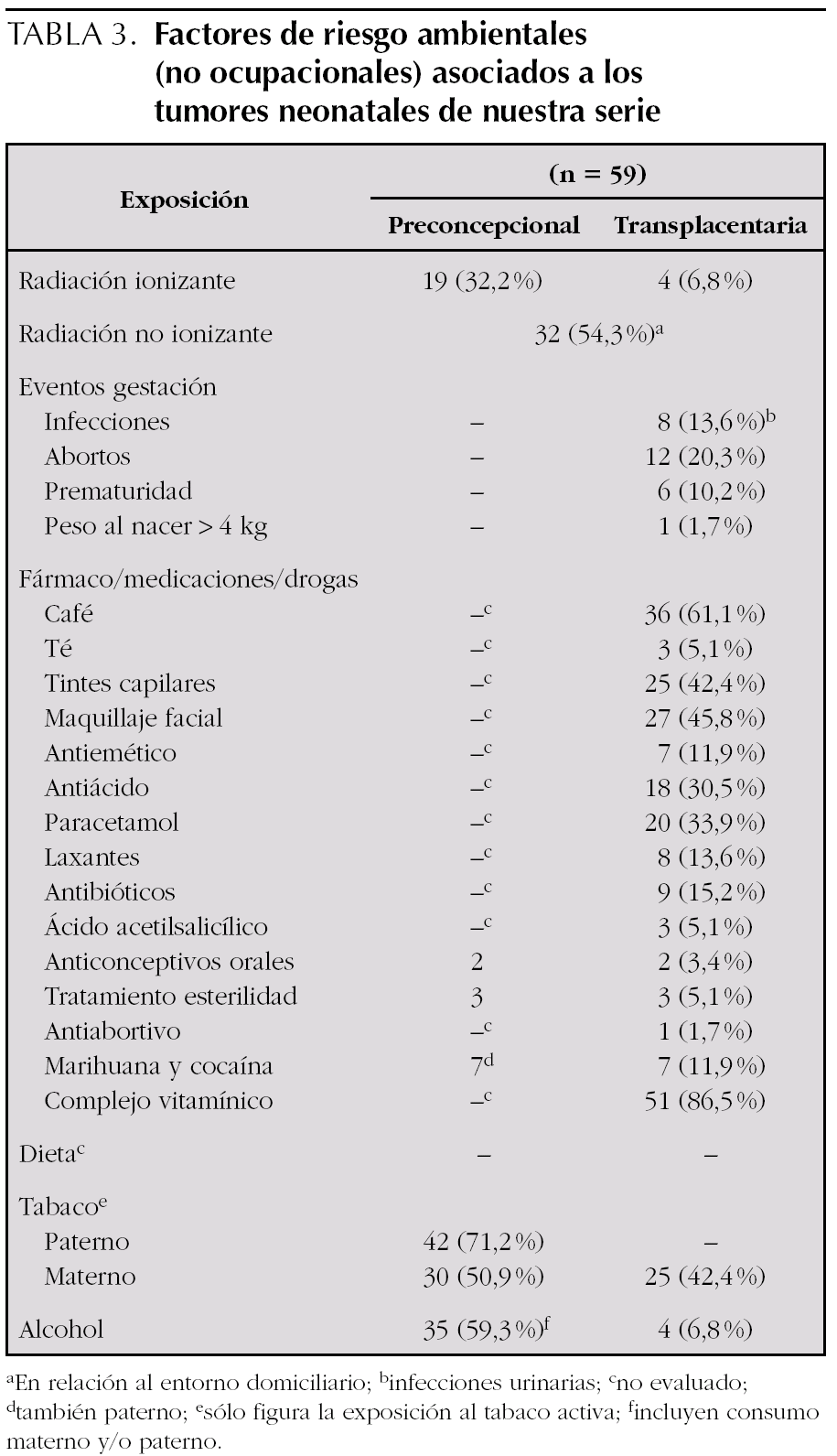
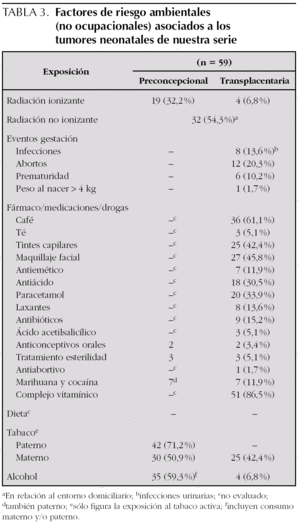
En el 32,2 % de los casos (una leucemia aguda, dos tumores renales y un tumor de partes blandas; así como, dos hemangiomas, tres neuroblastomas, dos teratomas, dos tumores cardíacos, dos histiocitosis, tres tumores adrenocorticales y una hepatoblastoma) había constancia de exposición preconcepcional a radiaciones ionizantes. En el 6,8 % (4 casos) la exposición fue transplacentaria, por desconocimiento materno de la gestación, correspondiéndose con una leucemia aguda, un tumor de partes blandas, un hemangioma y un tumor adrenocortical (tabla 3).
Radiación no ionizante. Radiaciones electromagnéticas de baja frecuencia
Más de la mitad de los pacientes estudiados (32 casos) relataban exposición a radiaciones electromagnéticas de baja frecuencia durante el período preconcepcional y transplacentario en el entorno ambiental domiciliario (instalaciones eléctricas o líneas férreas), aunque la intensidad de las mismas no ha sido cuantificada. Así mismo y como comentaremos en el apartado de exposición ocupacional, 6 madres (10 %) presentaron exposición ocupacional a radiaciones no ionizantes, cinco trabajaban en la industria textil y una adicional en empresa ferroviaria, y se correspondían con un neuroblastoma, un teratoma, un tumor de partes blandas, un tumor renal, un tumor adrenocortical y un hepatoblastoma (tabla 3).
Problemas gestacionales
En 8 pacientes se reseñaron infecciones gestacionales, con predominio de las urinarias. El 20,3 % de los pacientes (12 casos) presentaban el antecedente de aborto previo, de los que cuatro eran en neuroblastoma y una leucemia. Otros sucesos como la prematuridad y el peso al nacimiento mayor de 4 kg están presentes en 6 y 1 casos, respectivamente (tabla 3).
Fármacos/medicaciones/drogas durante la gestación
1. En 36 casos existía un consumo de café elevado.
2. La utilización de tintes capilares y maquillaje facial diario, se objetiva en el 42,4 y 45,8 %, respectivamente.
3. La ingesta de medicaciones ha sido variada, destacando antiácidos en 18 casos, y paracetamol en 20 casos (sólo uno de ellos se correspondía con un tumor de partes blandas y el único hepatoblastoma). El consumo de otras medicaciones ha sido menos frecuente destacando: antieméticos en siete, laxantes en ocho, y antibióticos en nueve.
4. La utilización de tratamiento hormonal (anticonceptivos orales o antiabortivos durante la gestación, o aplicaciones de tratamientos para la esterilidad), se ha asociado en 6 casos (dos hemangiomas, un neuroblastoma, dos teratomas y un retinoblastoma).
5. En 7 casos existía el consumo de marihuana y cocaína, siendo dos tumores de partes blandas y dos leucemias mieloides agudas, y los otros casos se correspondieron con un hemangioma, un neuroblastoma y un tumor del sistema nervioso central.
6. En 51 de los 59 casos entrevistados tomaban suplementos vitamínicos (tabla 3).
Dieta
Por problemas metodológicos, los datos dietéticos gestacionales no se toman en consideración (tabla 3).
Tabaco
Preconcepcionalmente, existía exposición activa al tabaco en el 71,2 % de los padres (42 padres) y el 50,9 % de las madres (30 madres). La exposición activa transplacentaria ocurrió en el 42,4 % de las madres gestantes (25 casos). Sólo 5 mujeres dejaron de fumar al conocer su embarazo. No incluimos los numerosos casos de exposición al tabaco con carácter pasivo, de manera que son muy pocos los casos que han estado alejados de una exposición activa o pasiva, preconcepcional o transplacentaria. De los 59 casos, sólo 13 (22 %) estaban libres de exposición activa materna y paterna, pero en nueve de ellos los padres eran ex fumadores, con un período variable de años desde la deshabituación hasta la concepción, que oscila entre 6 años y 3 meses. Así pues, el tabaquismo activo (preconcepcional o transplacentario) estuvo asociado al 93,2 % de los pacientes, es decir en sólo 4 casos no existía ni existió nunca exposición activa al tabaco (tabla 3).
Alcohol
En 35 casos (59,3 %) los progenitores referían un consumo preconcepcional elevado de alcohol. En 4 casos había consumo transplacentario (una leucemia aguda, dos tumores adrenocorticales y un hepatoblastoma) (tabla 3).
Exposición ocupacional de los padres
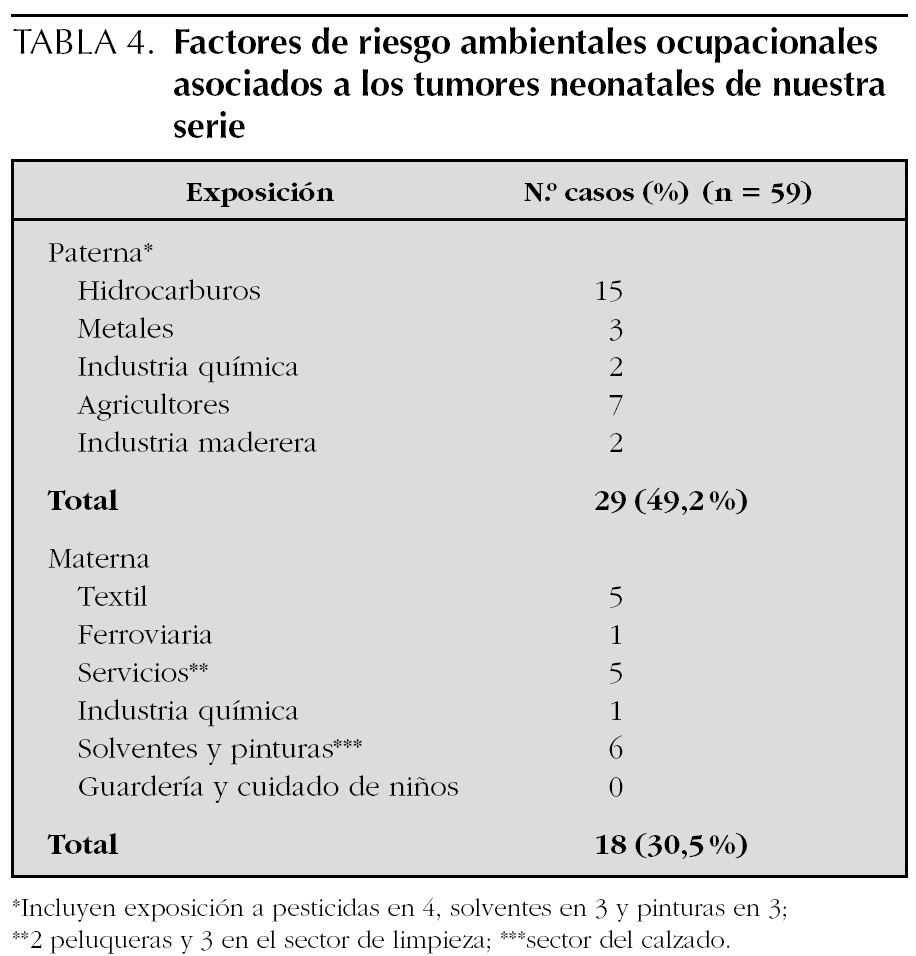
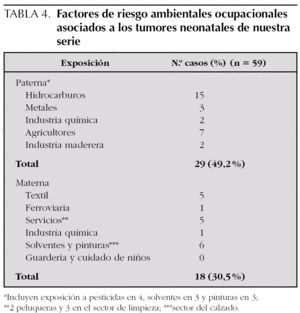
En 15 casos existía exposición paterna a hidrocarburos y en tres a metales, es decir, que un tercio de los casos se asociaba a una de estas dos exposiciones a través de diferentes trabajos o contactos con sustancias (tabla 4). Otros 11 casos presentaban exposiciones de riesgo: dos químicas, dos madereras y siete agricultores. En el 49 % de los pacientes estudiados (29 de 59), el padre trabajaba en ocupaciones profesionales consideradas de mayor riesgo, en la literatura médica, para el desarrollo de tumores en la descendencia. Respecto a las exposiciones específicas, objetivamos exposición a pesticidas (ocupacional o por acumulación de insecticidas o pesticidas para uso doméstico) en 4 casos, a solventes en tres y a pinturas en otros tres, destacando el caso de un pintor cuyo hijo desarrolló una leucemia. En 12 casos (20 %) existía exposición materna ocupacional asociada a mayor riesgo de cáncer en los descendientes: seis a radiaciones no ionizantes de baja frecuencia (cinco industria textil y una ferroviaria, como ya hemos comentado en el apartado de radiaciones no ionizantes), cinco en el sector de servicios (dos peluqueras y tres limpiadoras), y una en la industria química. En otros 6 casos existía exposición a solventes y pinturas a través de diferentes trabajos en el sector del calzado.
Discusión
La etiopatogenia de los tumores neonatales es diferente a la encontrada en otras épocas de la vida 6,7,10-16. Las principales vías de oncogénesis, son la preconcepcional y la transplacentaria, donde los factores de riesgo ambientales pueden actuar en las células germinales de los progenitores (oncogénesis preconcepcional) 11,17 o en el feto durante la gestación (oncogénesis transplacentaria) 18-21. Un tipo especial de oncogénesis preconcepcional es la transgeneracional que originará los cánceres hereditarios o familiares en la que la mutación de las células germinales se hereda con carácter recesivo o dominante 22,23.
Genéricamente, el cáncer es una enfermedad genética que se desarrolla por la acumulación de mutaciones generadoras de la selección clonal de células con un comportamiento biológico agresivo. La gran mayoría de las mutaciones son somáticas y, por tanto, sólo se encuentran en las células neoplásicas. Estrictamente se denominan cánceres genéticos o hereditarios a los que se desarrollan en pacientes portadores de mutaciones específicas en sus células germinales y que, por tanto, están presentes en todas las restantes células somáticas. Están descritos varios centenares de cánceres hereditarios, permitiendo las técnicas de biología molecular identificar y secuenciar los genes implicados en varias decenas de estos síndromes. La mayoría de los factores genéticos también desencadenan diversos tumores durante las décadas posteriores entre los pacientes supervivientes 7,24. De los síndromes genéticos, en nuestra serie no se ha identificado ningún síndrome hereditario recesivo; en cambio, sí que aparecen síndromes hereditarios dominantes (5 casos), así como síndromes cromosómicos no hereditarios (tres síndromes de Down). Globalmente en nuestra serie, los factores genético-constitucionales están presentes en el 13,6 % de los casos, situándose por tanto, en los límites superiores descritos en la bibliografía como comentamos en la introducción. Es un resultado esperado teniendo en cuenta que en los tumores neonatales los factores de riesgo genéticos adquieren mayor protagonismo que en épocas posteriores de la edad pediátrica.
La radiación ionizante es el cancerígeno humano más estudiado y su acción sobre el ADN causa mutaciones en los protooncogenes y genes supresores tumorales, que inician el proceso de oncogénesis 6. Aunque en modelos animales se ha demostrado un incremento en el riesgo de cáncer ante diferentes exposiciones preconcepcionales y transplacentarias, en humanos la evidencia en ocasiones resulta equívoca, puesto que los humanos no somos tan sensibles a los efectos cancerígenos de las radiaciones ionizantes como los animales de experimentación 25. La exposición preconcepcional no está aceptada como agente cancerígeno seguro 25, aunque en diferentes estudios sí se encuentra un mayor riesgo de desarrollo de diferentes estirpes tumorales en su descendencia, principalmente para las leucemias agudas y con menor evidencia para el tumor de Wilms, retinoblastoma, sarcomas y tumores del sistema nervioso central (SNC) 26-28. La exposición transplacentaria sí que está aceptada como agente cancerígeno seguro 25 y diferentes estudios encuentran un mayor riesgo de diferentes estirpes tumorales, principalmente para las leucemias agudas, tumor de Wilms, retinoblastoma, tumores óseos, linfomas, neuroblastoma y tumores del SNC 29-31. En nuestra serie el 32,2 % presentaban una exposición preconcepcional, sin embargo, en sólo el 6,8 % existía exposición transplacentaria.
A pesar de las controversias entre radiación no ionizante (radiaciones electromagnéticas de baja frecuencia) y el riesgo de cáncer pediátrico 32-37, existen 2 estudios que encuentran una asociación estadísticamente significativa entre la exposición materna gestacional y el incremento de leucemias agudas en sus hijos. En un estudio realizado en nuestro país en madres que trabajan con máquina de coser para la industria textil, donde existe una evidente proximidad entre la fuente de emisión de radiaciones no ionizantes y el abdomen de la madre gestante, encuentran un incremento en el riesgo para leucemia, con odds ratio (OR) de 7,0 (intervalo de confianza [IC] del 95 %: 1,59-30,79) 38 y de 2,5 (IC 95 %: 1,2-5,0) en otro estudio realizado en Canadá 39. En ambos se incluyen casos de leucemias neonatales. En nuestra serie, más de la mitad de los pacientes estudiados (32 casos) presentan una exposición a radiaciones no ionizantes preconcepcional y transplacentaria en relación al entorno ambiental del domicilio de residencia por proximidad a instalaciones eléctricas o líneas férreas, aunque la intensidad de las mismas no ha sido cuantificada. Así mismo, 6 madres (10 %) presentaron exposición ocupacional a radiaciones no ionizantes, cinco trabajaban en la industria textil y una adicional en empresa ferroviaria, pero ningún caso se dio en leucemias.
Existen datos discordantes de la asociación entre infección materna gestacional y el riesgo de leucemia aguda infantil en los hijos expuestos intraútero, encontrándose como agentes implicados el virus influenza, herpesvirus (varicela-zóster, citomegalovirus) y rubéola. También se ha publicado que infecciones víricas del tracto urogenital por herpes simple y papilomavirus se asocian a un mayor riesgo de desarrollar tumor de Wilms en los hijos 6, así como la relación entre infecciones urinarias e histiocitosis 40. En nuestra serie registramos procesos infecciosos en 8 pacientes durante la gestación, siendo mayoritariamente infecciones urinarias, aunque ninguna de ellas se dieron en las histiocitosis.
La presencia de abortos previos se ha relacionado con neuroblastomas 41-44 y leucemias agudas 43. En nuestra serie, el 20,3 % de los pacientes estudiados (12 casos) presentaban dicho antecedente obstétrico, de los que cuatro eran en neuroblastoma y uno leucemia aguda. Teniendo en cuenta que la frecuencia media poblacional de abortos se sitúa en el 3,84 % para mujeres menores de 35 años 45, nuestros resultados son claramente superiores a lo esperado. El antecedente materno de pérdida fetal sugiere que la hipotética exposición a un factor de riesgo preconcepcional, transplacentario o genético puede producir efectos variables en el feto, desde la no viabilidad hasta el desarrollo de tumores neonatales. Probablemente la mayor frecuencia de pérdidas fetales en nuestra serie traduzca la resistencia innata antitumoral de las células fetales durante las primeras fases de la embriogénesis.
Otros sucesos como la prematuridad, asociado a los teratomas 43,46, hepatoblastoma 47-50 o a neuroblastomas, aunque en este último como factor protector y no en todos los estudios 41-44,51,52, así como el peso mayor de 4 kg, asociado a los teratomas 43,46, leucemias 43,53 y tumor de Wilms 43, también se dan en nuestra serie, aunque con una escasa frecuencia, 6 y 1 casos respectivamente.
Múltiples medicaciones y drogas durante la gestación se han relacionado con el desarrollo de tumores en la descendencia, desde el período neonatal al adulto. El único agente cancerígeno seguro lo constituye el dietilestilbestrol 25, mostrando los restantes una evidencia menor. Aunque en cada estirpe tumoral existen fármacos o drogas relacionados con un incremento en el riesgo de desarrollarlos, queremos mencionar aquí el estudio de Daniel Satgé et al 16, único estudio que hace referencia exclusivamente al período neonatal, para todos los fármacos o medicaciones y para las diversas variedades histológicas tumorales. En nuestra serie, registramos un elevado consumo de café, sustancia inhibidora de la topoisomerasa II y relacionada con leucemias agudas 54 y tumor de Wilms 43 (61 %, 36 casos) y dándose en cuatro de las seis leucemias-síndrome mieloproliferativo transitorio, y en los tres tumores renales estudiados. La utilización de tintes capilares y maquillaje facial diario, relacionados con neuroblastoma 43, tumores del SNC (en relación a compuestos N-Nitrosos) 43,55-59, y tumor de Wilms 43, se objetiva en el 42,4 y 45,8 % respectivamente de los casos estudiados; la ingesta de medicaciones ha sido variada, destacando los antiácidos (asociados al tumor de Wilms) 43 en 18 casos, y el paracetamol (asociado a tumores de partes blandas y hepatoblastoma) 16 en 20 casos, aunque sólo uno de ellos se correspondía con un tumor de partes blandas y el único hepatoblastoma; la ingestión de otras medicaciones ha sido menos frecuente: antieméticos (asociados a los tumores del SNC) 60 en siete, laxantes en ocho, y antibióticos en nueve, entre las más destacables.
La utilización de tratamiento hormonal se ha asociado con la presencia de diferentes tumores en la descendencia (angiomas 16, neuroblastomas 43,44,61-63, teratomas 43 y tumores adrenocorticales 16,64). En nuestra serie 6 casos asociaban la utilización de estas sustancias, y se correspondían con casos de las estirpes tumorales anteriormente comentadas (dos hemangiomas, un neuroblastoma, un teratoma [uno cardíaco]), así como en un retinoblastoma.
El consumo de drogas ilegales como cocaína y marihuana se asocia a mayor riesgo de tumores de partes blandas 43,65,66 y leucemia mieloide aguda 43 en los descendientes. En nuestra serie, 7 casos consumían estas sustancias (11,9 %), siendo dos tumores de partes blandas, dos leucemias mieloides agudas, un hemangioma, un neuroblastoma y un tumor del SNC.
La administración de complejos vitamínicos durante la gestación, como hemos comentado con anterioridad, se ha asociado a un efecto protector tumoral en relación a tumores de SNC 67-70, neuroblastoma 6,67,71 y retinoblastoma 6,67,72. En nuestra serie, 51 de los 59 casos entrevistados referían consumo de estas sustancias durante toda la gestación.
A pesar de las dificultades epidemiológicas, el consumo de tabaco parental (materno/paterno) se asocia a un mayor riesgo de cáncer pediátrico en general y de leucemias agudas, tumores del SNC, linfomas no hodgkinianos, neuroblastomas, sarcomas de partes blandas, tumor de Wilms y sarcoma de Ewing 68, no encontrándose artículos específicos para los tumores neonatales. Un metaanálisis basado en 11 estudios (cuatro de cohortes y siete de casos-controles) ha evidenciado un riesgo relativo (RR) de 1,11 (IC 95 %: 1,00-1,23), entre tabaquismo materno gestacional y el riesgo de cáncer pediátrico en sus hijos 73. En otro estudio sobre la asociación de cáncer pediátrico y tabaquismo paterno se evidenció un RR de 1,5 (IC 95 %: 1,0-2,3) 14, aunque en otros no se ha encontrado esta relación 74. En nuestra serie existe una exposición al tabaco muy intensa, tanto preconcepcional como transplacentaria. No incluimos los numerosos casos de exposición al tabaco con carácter pasivo, de manera que son muy pocos los casos que han estado alejados de una exposición activa o pasiva, preconcepcional o transplacentaria. Así, de los 59 casos estudiados, sólo 13 (22 %) estaban libres de exposición activa materna y paterna, aunque en nueve de ellos los padres eran ex fumadores (con un período variable de años desde la deshabituación hasta la concepción que oscila entre 6 años y 3 meses), es decir, en sólo 4 casos no existía ni existió nunca exposición activa al tabaco. Dicho de otra forma, el tabaquismo activo estuvo asociado al 93,2 % de los pacientes, promedio muy superior al de la población española (34,5 %) según datos del Plan Nacional de Salud para la prevención del tabaquismo 75.
En un estudio de leucemias en niños menores de 18 meses, incluyendo casos neonatales, se encontró una relación directa entre el consumo de alcohol durante la gestación y el desarrollo de leucemias, principalmente mieloides en la infancia (OR: 2,64; IC 95 %: 1,36-5,06), pero no con el consumo paterno 76,77. Otros autores no han obtenido resultados similares 74,78-80. En nuestra serie registramos un elevado consumo de alcohol a nivel preconcepcional, aunque de muy escasa cantidad, en 35 casos (59,3 %), siendo en tan sólo 4 casos el consumo transplacentario y se corresponden con una leucemia aguda, dos tumores adrenocorticales y el hepatoblastoma.
Numerosos estudios con muchas limitaciones han investigado la asociación entre ocupación parental y el riesgo de cáncer en los hijos 6,81. Existe una probada relación entre ciertas exposiciones parentales y un riesgo incrementado de cáncer en sus hijos, siendo estas asociaciones biológicamente plausibles por los hallazgos en investigaciones experimentales y estudios epidemiológicos de cáncer en adultos. La evidencia más consistente es para la leucemia infantil con la exposición paterna de pesticidas 82, solventes, pinturas y empleados relacionados con los vehículos a motor, y para los cánceres del SNC con la exposición a pesticidas y pinturas 81,83. No obstante, otros estudios no encuentran estas asociaciones tan evidentes; así, en un estudio reciente de cohortes sobre exposición ocupacional paterna, encuentra un incremento en el riesgo de cáncer del SNC en la descendencia con exposición paterna a pesticidas y pinturas, y de leucemias en relación a la industria de la madera, pero no en relación a pesticidas o pinturas, encontrada en otros estudios 84.
En nuestra serie encontramos que el 49 % de todos los pacientes estudiados (29 de 59) presentaban una ocupación profesional considerada de riesgo para el desarrollo de tumores en la descendencia. En relación a las exposiciones concretas en asociación a tumores del SNC y leucemias, objetivamos una exposición a pesticidas (ocupacional o por acumulación de insecticidas o pesticidas para uso doméstico) en 4 casos, solventes en tres y a pinturas en otros tres, aunque de ellos solo un caso se asoció a tumores del SNC o leucemias, y se correspondió con un pintor cuyo hijo desarrolló una leucemia. En relación a la exposición laboral materna, los estudios son escasos y la mayoría de ellos hacen referencia a la asociación entre trabajos relacionados con la industria química, textil (radiaciones no ionizantes), cuidadoras de niños, guardería, enfermera o en el sector de servicios que incluye a salones de belleza, peluquerías, hostelería y limpieza 43. En 12 casos (20 %) existía exposición ocupacional a ellos: seis expuestas a radiaciones no ionizantes de baja frecuencia (cinco industria textil y una ferroviaria, como ya hemos comentado en el apartado de radiaciones no ionizantes), cinco en relación al sector de servicios (dos peluqueras y tres limpiadoras), y una en la industria química. Además en 6 casos más existía exposición a solventes y pinturas en relación fundamentalmente con el sector del calzado.
Nuestra revisión presenta algunas limitaciones que pasamos a comentar. Por el diseño metodológico es útil para generar hipótesis, pero al no ser de casos controles no sirve para evaluarlas, siendo la presencia de los factores de riesgo probables coincidencias. Nos hemos centrado exclusivamente en el período neonatal, y por razones de extensión, hemos omitido muchos trabajos que relacionaban diversos factores de riesgo constitucionales y ambientales con los tipos y variedades tumorales que aparecen en niños mayores. También los tumores pueden iniciarse en el período neonatal, pero no manifestarse y diagnosticarse hasta épocas pediátricas posteriores. Los hipotéticos factores de riesgo implicados en las fases preconcepcionales y transplacentarias pueden desarrollar tumores tras años o décadas de latencia. Finalmente, el sesgo de memoria al realizar las entrevistas, mayor en los casos más antiguos, constituye otra limitación de nuestro trabajo. No obstante, consideramos que constituye un paso imprescindible para avanzar en el conocimiento de esta patología y de sus formas de prevención, y es el inicio de un proceso que brinda la oportunidad de transformar las impresiones en observaciones medibles. Estas observaciones, y las hipótesis que se desprenden de ellas, deberán ser contrastadas en estudios de casos controles y cohortes, objetivo de futuras investigaciones.
Las hipótesis que modestamente formulamos en el presente trabajo observacional, y que deben documentarse y demostrarse en futuros estudios de casos-controles y cohortes, son las siguientes: primera, documentar con mayor solidez científica la presencia de los factores de riesgo constitucionales-genéticos en la etiopatogenia de los tumores neonatales. Segunda, constatar la frecuencia y la etiología del antecedente materno de aborto o pérdida fetal, y su hipotética relación con los tumores neonatales. Tercera, importancia del tabaquismo activo preconcepcional y transplacentario como factor de riesgo de los tumores neonatales. Cuarta, averiguar la importancia de los factores de riesgo ocupacionales parentales en la etiopatogenia de los tumores neonatales. Quinta, finalmente, detallar con más precisión la contribución del resto de factores de riesgo físicos y químicos en el desarrollo de los tumores neonatales.
Así mismo, el conocimiento y obtención de los factores de riesgo implicados en la etiopatogenia de los tumores neonatales, plantean la necesidad de obtener una detallada historia medioambiental en los cánceres pediátricos. En ella deben documentarse la presencia o ausencia de los factores de riesgo constitucionales y ambientales que constituyen uno de los principales objetivos de las Unidades de Salud Medioambiental Pediátrica 85. Avanzar en esta dirección permitirá conocer, en un futuro no muy lejano, las probables causas de los tumores neonatales y conseguir su prevención.
Agradecimientos
Los autores expresan su agradecimiento por el apoyo y financiación del proyecto MACAPE (Medioambiente y Cáncer) a la Fundación Científica de la AECC y al Programa de Capacitación en Salud Ambiental y Ocupacional del Mount Sinai Medical Center apoyado por el Fogarty International Center (NIH TW00640).
Correspondencia: Dr. Josep Ferrís i Tortajada.
Unidad de Salud Medioambiental. Sección de Oncología Pediátrica.
Hospital Materno-Infantil Universitario La Fe.
Avda. Campanar, 21. 46009 Valencia. España.
Correo electrónico: ferris_jos@gva.es
Recibido en mayo de 2005.
Aceptado para su publicación en marzo de 2006.