Introducción
La leucemia linfoblástica aguda (LLA) de la infancia se consideraba una enfermedad uniformemente fatal hace 50 años, con una supervivencia de 3-4 meses para la mayoría de los pacientes que la padecían. En los últimos años se ha logrado un aumento en el porcentaje de supervivencias prolongadas y curaciones en esta enfermedad que alcanza del 60 al 80 % en varios grupos internacionales 1-3. Los protocolos de tratamiento del grupo alemán BFM 3, que han sido adaptados por varios países han contribuido evidentemente a los resultados obtenidos en los últimos años.
A pesar de los avances obtenidos, esta enfermedad sigue siendo una causa importante de mortalidad en el niño mayor de un año. Se han identificado numerosos factores al inicio de la enfermedad que pueden contribuir a predecir la evolución y el pronóstico 4-6. De las alteraciones clínicas y hematológicas, la edad y la cifra de leucocitos se consideran los más importantes para la mayoría de los autores 6,7. Los progresos obtenidos en los últimos años con relación a la inmunología, la citogenética y la biología molecular han permitido definir con más exactitud distintos grupos de riesgo; también es muy importante la respuesta temprana al tratamiento analizada por distintos parámetros 8-11.
Muchas de las características antes mencionadas sirven para clasificar a los pacientes en grupos de riesgo que pueden requerir modificaciones en el tratamiento 12.
Un factor que ha contribuido indudablemente a los logros obtenidos en el tratamiento de la LLA es la creación de grupos cooperativos que utilizan protocolos comunes en varias instituciones del país o de varios países, lo que permite sintetizar los esquemas terapéuticos y obtener resultados confiables. Cuba forma parte desde 1973 del Grupo Latinoamericano de Tratamiento de Hemopatías Malignas (Glathem) 13,14.
El Hospital Pediátrico Universitario José Luis Miranda, de Santa Clara, inició los estudios del Glathem en 1973, conjuntamente con el Instituto Cubano de Hematología e Inmunología. En éste se trataban a los pacientes procedentes de las provincias centrales (Villa Clara, Cienfuegos y Sancti Spíritus). Desde su incorporación al Glathem, nuestro centro ha participado en 8 protocolos sucesivos de tratamiento en los que se habían incluido hasta 2000 un total de 189 pacientes. A partir del año 1984 se comenzaron ha incorporar centros hospitalarios de otras provincias a los estudios del Glathem, por lo que 26 pacientes fueron tratados en las 2 provincias centrales vecinas. Se incluyen además 20 pacientes de nuestro centro tratados en los años 1971 y 1972, previos a los estudios del Glathem.
Los protocolos de tratamiento del Glathem de la década de 1970 eran poco agresivos en correspondencia con los protocolos internacionales de esa época. A partir de la década de 1980 el Glathem adoptó los protocolos del grupo BFM.
En este trabajo nos proponemos analizar los resultados obtenidos en el tratamiento de la LLA en las tres provincias centrales del país a lo largo de estos 29 años y correlacionar la evolución con los factores pronósticos considerados.
Material y métodos
Se incluyeron en este estudio un total de 235 pacientes pediátricos diagnosticados de LLA en la región central de Cuba (provincias de Villa Clara, Cienfuegos y Sancti Spíritus) en un período de 29 años (1972-2000).
La mayoría de los pacientes (n = 209) fueron tratados en el Hospital Pediátrico Universitario de Santa Clara (Villa Clara) y los restantes en los hospitales pediátricos de las demás provincias. Se consideraron 4 grupos de pacientes según período de diagnóstico y protocolo de tratamiento incluido en ellos. El grupo 1, constituido por 20 pacientes diagnosticados antes de comenzarse en nuestro centro los protocolos del Glathem, sin un esquema de tratamiento uniforme, representa un grupo histórico del cual sólo se analiza la supervivencia; los restantes pacientes están incluidos en distintos protocolos del grupo cooperativo a partir de 1973. El grupo 2 comprende 96 pacientes tratados con los protocolos de la década de 1970 (10-LLA-72, 1-LLA-76 y 1-LLA-79), los cuales eran, en general, poco agresivos y similares a los esquemas clásicos preconizados por Pinkel 13-15. Los grupos 3 y 4 fueron tratados con protocolos modernos más agresivos similares a los propuestos por grupo alemán BFM 16-18. El grupo 3 incluye 44 pacientes tratados con protocolos de principios de la década de 1980 (1-LLA-82 y 3-LLA-84), en los cuales la poliquimioterapia recibida no tenía en cuenta el uso del método del metotrexato intravenoso en dosis altas. El grupo 4, que incluye los protocolos 7-LLA-87, 1-LLA-90 y 1-LLA-96, está constituido por 75 pacientes, que fueron tratados por protocolos tipo BFM y que incluyen el uso del metotrexato intravenoso a 1 a 2 g/m 2 con rescate folínico.
Todos los pacientes recibieron profilaxis del sistema nervioso con quimioterapia intratecal; sólo se utilizó radioterapia craneal profiláctica en el primer protocolo del Glathem (10-LLA-72).
La clasificación por grupos pronósticos ha variado en los distintos grupos. En los grupos 2 y 3 se hizo fundamentalmente en función de la edad y la cifra de leucocitos, mientras que en el grupo 4, han existido variaciones en los distintos protocolos. Así, en 1987 y 1990 se tuvieron en cuenta variables tales como la carga tumoral, la respuesta al esteroide y a la poliquimioterapia, mientras que en el protocolo 96 se realizaron estudios moleculares, citogenéticos e inmunológicos en un número limitado de pacientes.
De cara a este trabajo, se clasificaron todos los pacientes según la edad, cifra de leucocitos y algunas características clínicas que fueron las utilizadas en protocolo 3-LLA-84 del Glathem 16; se consideraron 3 grupos:
Riesgo bajo (estándar) (RE): edad comprendida entre 1 y 8 años, cifra de leucocitos inferior a 10 x 10 9/l, ausencia de adenopatías mediastínicas y de infiltración del sistema nervioso central (SNC).
Riesgo alto (RA): aquéllos con cifra de leucocitos superior a 50 x 10 9/l.
Riesgo intermedio (RI): los restantes.
Se utilizó el método de Kaplan Meier, implementando el sistema SPSS sobre Windows para un estimado de supervivencia y el método de Log Rank para establecer las comparaciones. Se le consideraron dos niveles de significación: p < 0,05 significativo; p < 0,01 muy significativo.
Resultados
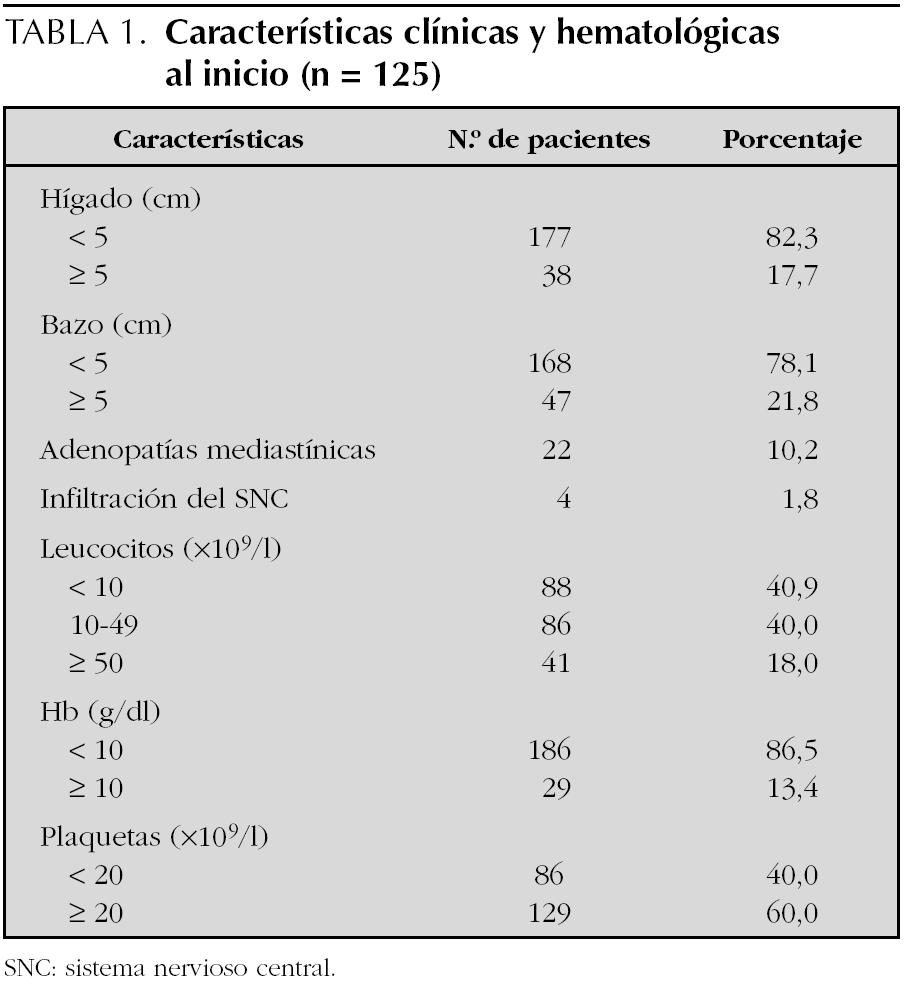
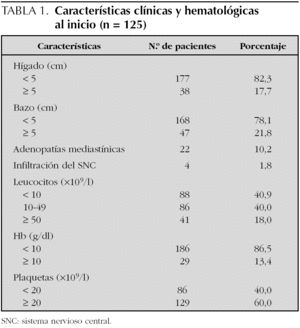
Del total de los pacientes, cinco eran menores de un año, 186 se encontraban entre 1 y 8 años y 44 eran mayores de esa edad. Pertenecían al sexo masculino 120 y al femenino, 115. Por raza, 192 eran blancos, 34 mestizos y 9, negros. En la tabla 1 se muestran las características clínicas y hematológicas de los 215 pacientes incluidos en los protocolos del Glathem. Con relación a los grupos de riesgo de estos 215 casos, predominó el RI con 105 pacientes; 56 eran de RA y 54 fueron catalogados RE (estándar).
De los 215 pacientes incluidos en los protocolos del Glathem, 197 hicieron remisión (91,6 %), 11 no hicieron remisión y siete fallecieron durante la terapia de inducción a la remisión. No existieron diferencias significativas ente los distintos grupos considerados con relación a la respuesta a la inducción.
De los 197 pacientes tratados con los protocolos del Glathem que hicieron remisión completa recayeron en la médula ósea 48 (24,4 %), en el SNC 18 y en los testículos, siete. Dos casos presentaron recaída mixta con toma de médula ósea. Una paciente tuvo una recaída aislada en los ovarios y un varón presentó una infiltración ganglionar como primer sitio de recaída. Al comparar el total de recaídas en los protocolos clásicos y los modernos podemos señalar que en los primeros se produjeron 51 recaídas en 96 pacientes (50,3 %), mientras que en los protocolos modernos recayeron sólo 27 de 119 pacientes (14,2 %) (p < 0,01). Del total de pacientes que recayeron, 14 presentaron una segunda remisión prolongada y se llevan sin tratamiento varios años, probablemente curados. De estas recaídas de evolución favorable, tres ocurrieron en la médula ósea, cinco en los testículos, cuatro el SNC y uno en los ovarios. Fallecieron en remisión completa 11 pacientes en total, uno por toxicidad medicamentosa y el resto por infecciones; de ellas, tres fueron citomegalovirus, uno hepatitis B y el resto, procesos bacterianos.
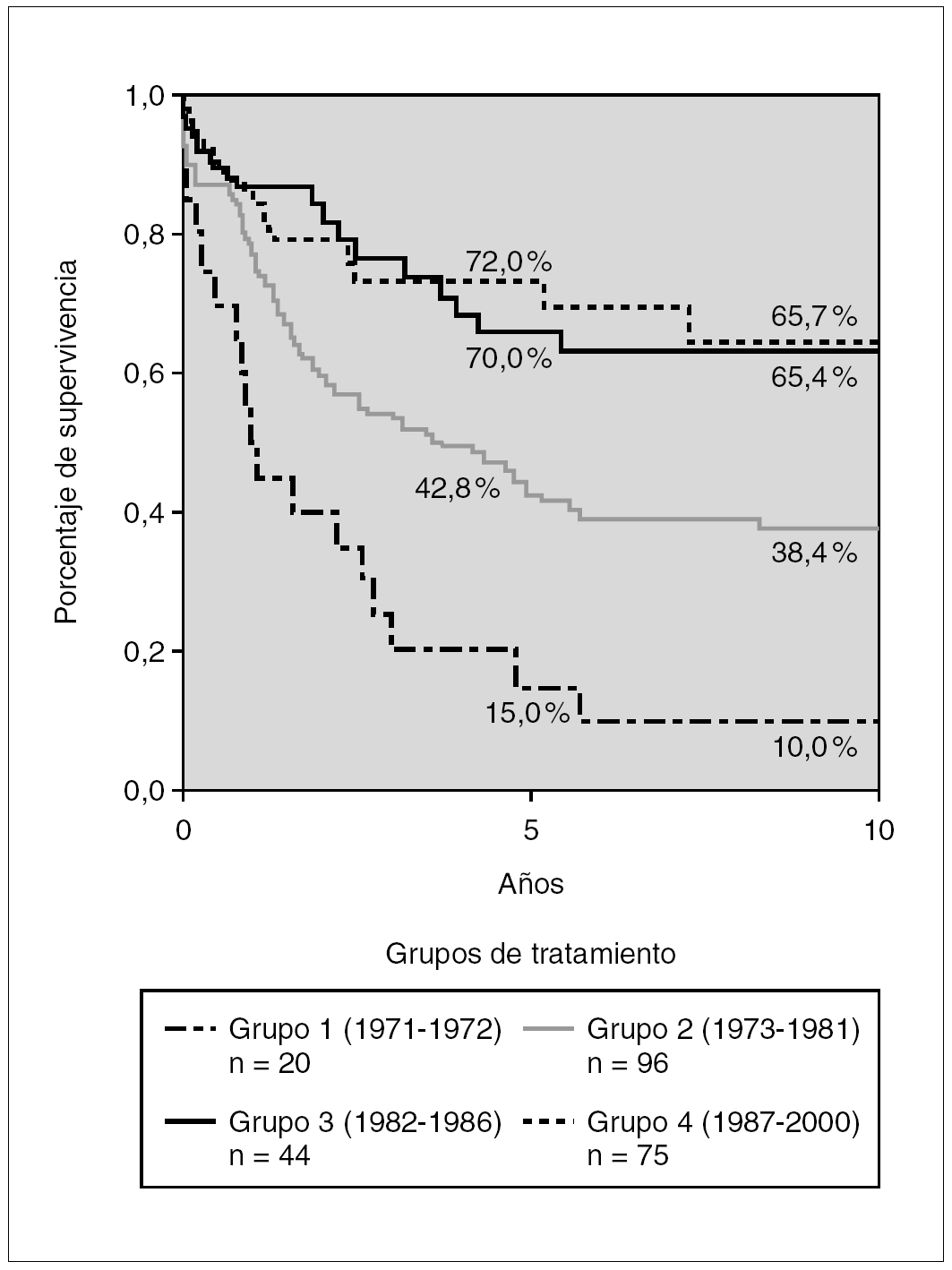
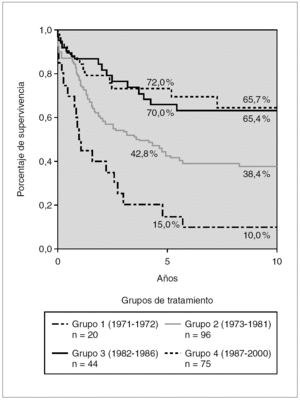
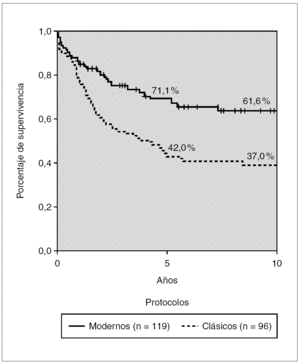
La figura 1 muestra la supervivencia global (SG) estimada según el método de Kaplan Meier en los distintos grupos de tratamiento. Se observa un incremento progresivo en los porcentajes de supervivencia en estos 30 años. De los pacientes del grupo 1 tratados en 1972-1973 sólo sobrevivían el 15 % a los 5 años y el 10 % a los 10 años de diagnosticados, mientras que en los pacientes incluidos en los estudios del Glathem la probabilidad de supervivencia se incrementó al 42,8 % en los protocolos de la década de 1970 (grupo 2) y a más del 70 % en los pacientes de grupo 4. A los 10 años se alcanza una supervivencia de 38,4 % en el grupo 2 y del 64,7 % en el grupo 4 (fig. 1).
Figura 1. Kaplan-Meier. Supervivencia global según grupos de tratamiento, de 1971 a 2000 (n = 235).
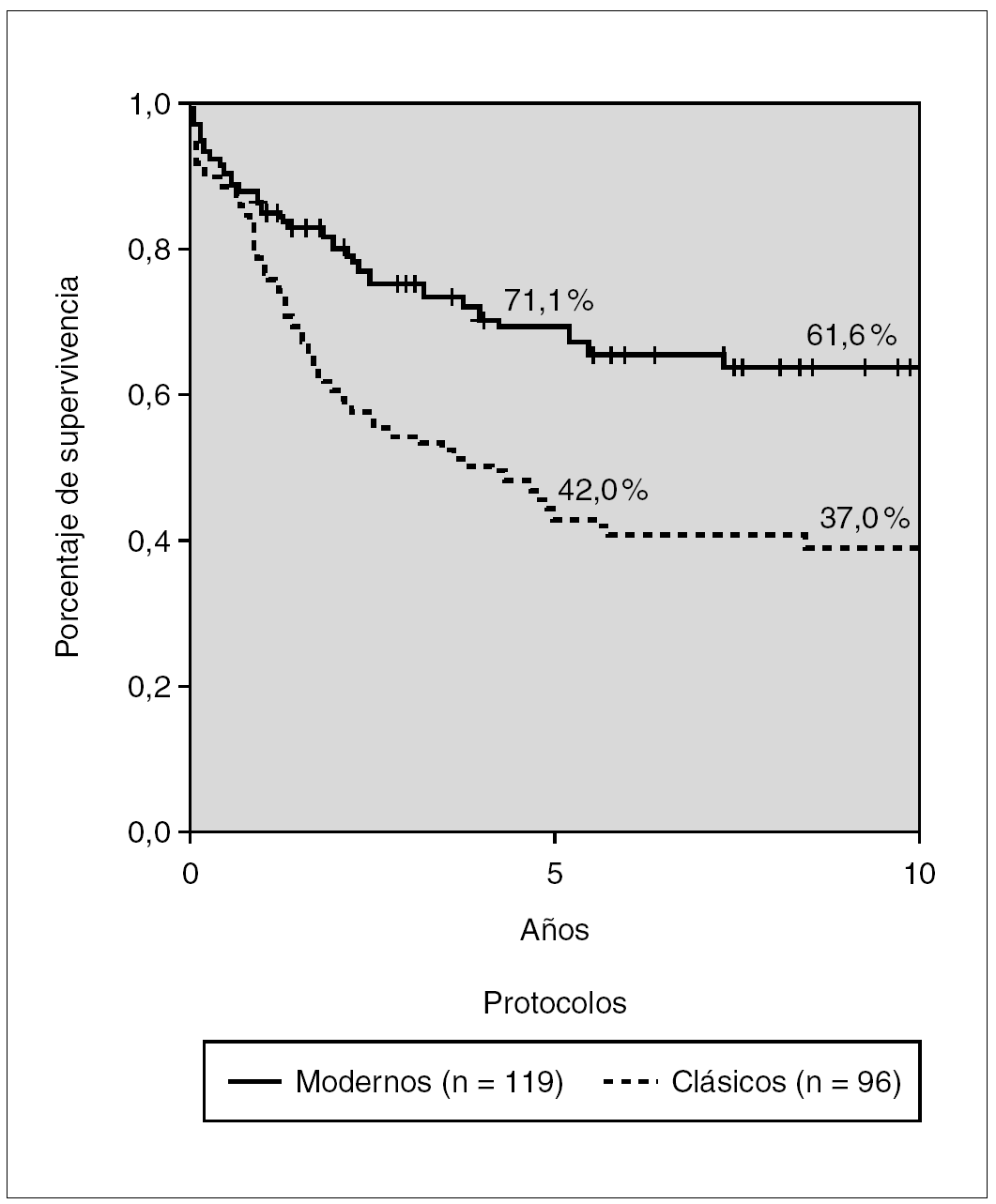
Comparando la SG de los pacientes del Glathem de la década de 1970 (grupo 2) con los protocolos tipo BFM (grupos 3 y 4) mediante el método de Log Rank (fig. 2) se observa una diferencia significativa con porcentaje de supervivencia a 5 años de 42 y 71,1 %, respectivamente (p < 0,05).
Figura 2. Kaplan-Meier. Supervivencia global en tratamientos clásicos y modernos. Glathem 1972-2000 (n = 215). Log Rank p < 0,005.
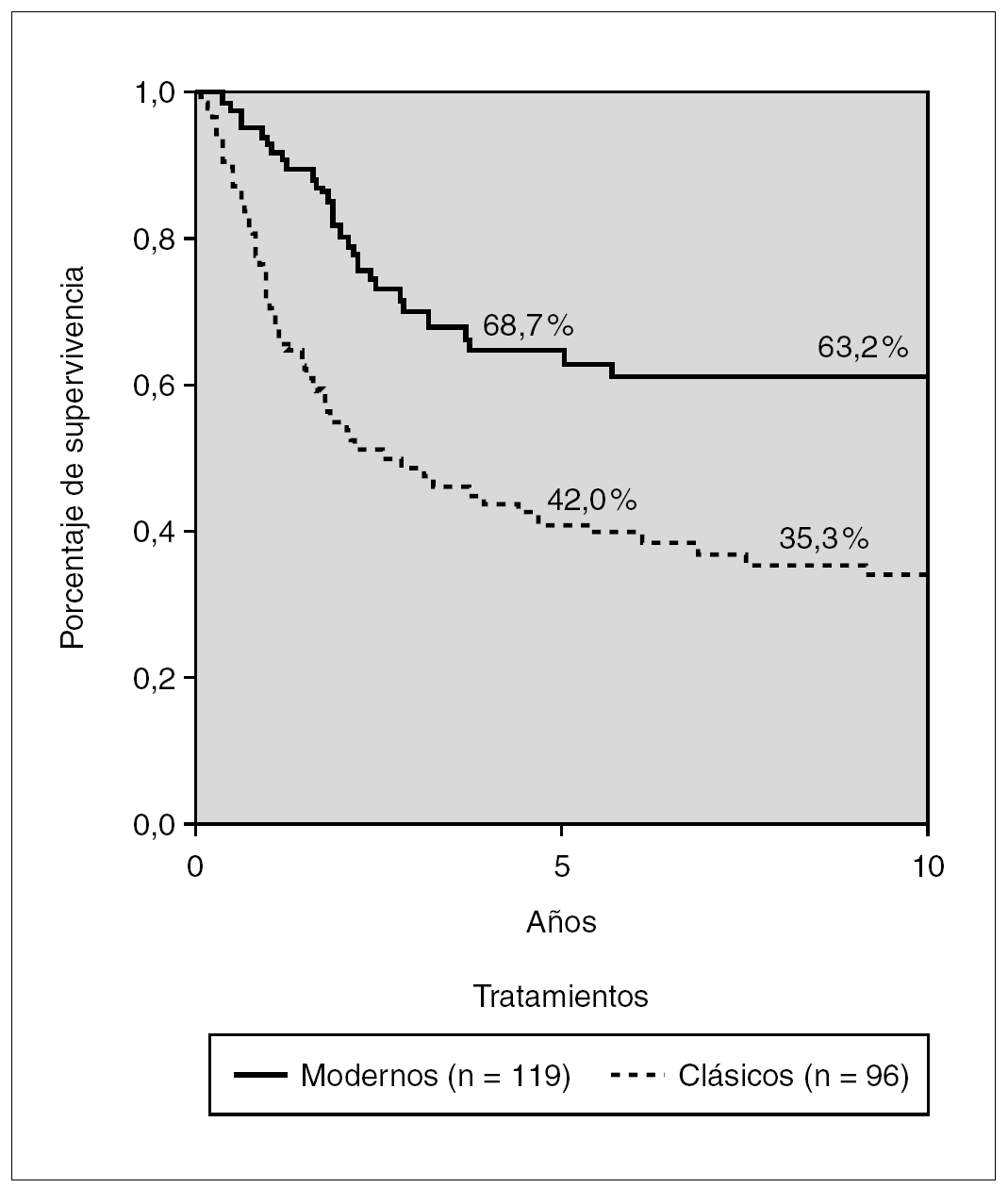
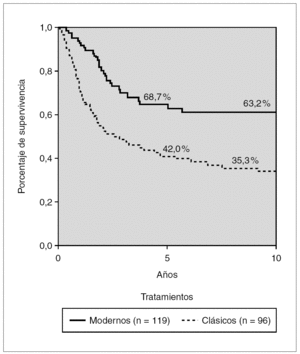
La figura 3 muestra la supervivencia libre de eventos (SLE) a los 5 y 10 años comparando los esquemas clásicos y los de tipo BFM. La SLE a los 5 años se eleva del 42 al 68,7 %, y la diferencia es muy significativa (p < 0,01).
Figura 3. Kaplan-Meier. Supervivencia libre de eventos en tratamientos clásicos y modernos. Glathem 1973-2000 (n = 215) Log Rank p < 0,01.
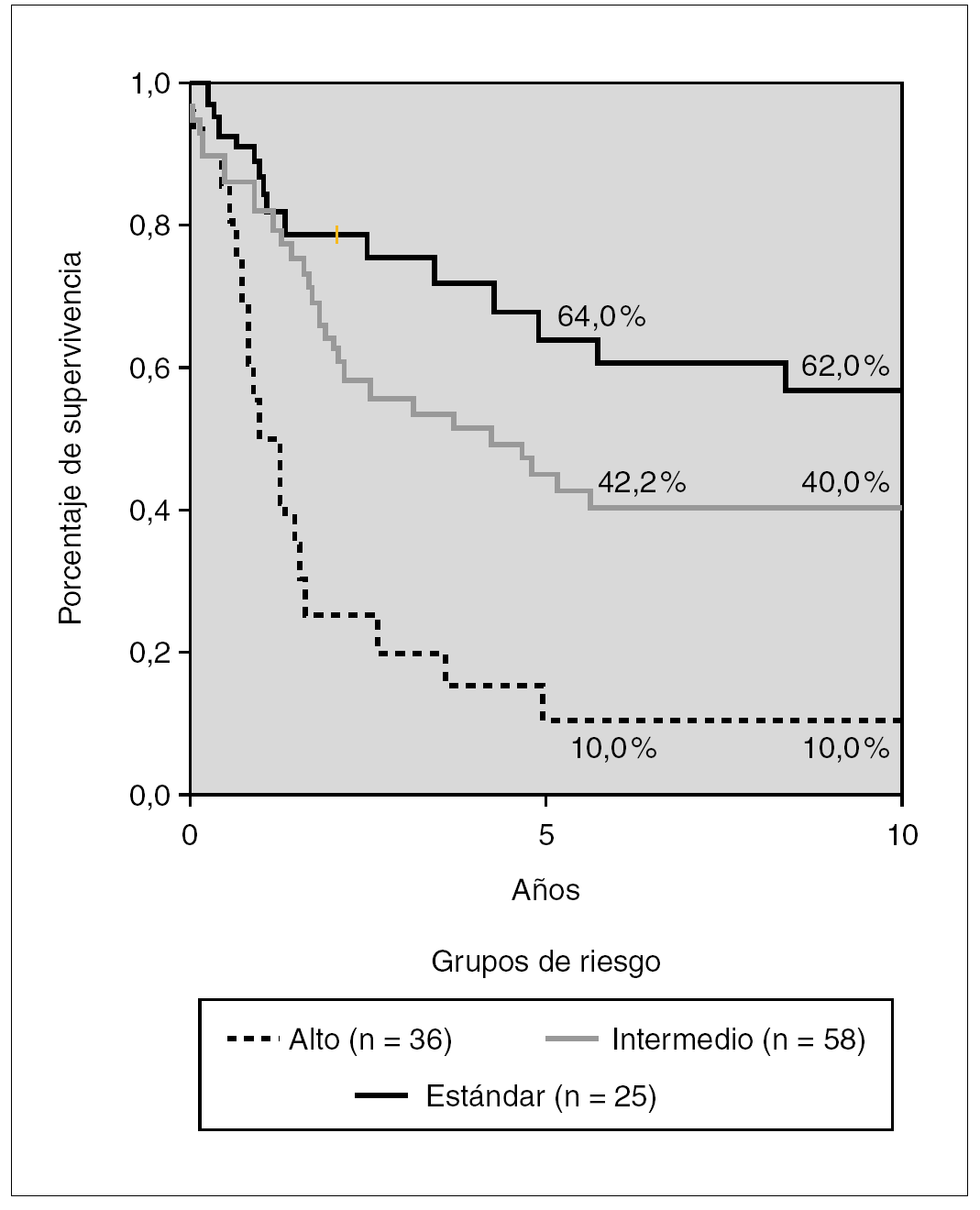
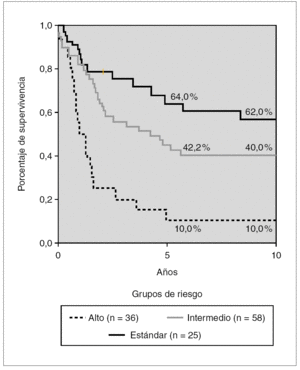
La probabilidad de SG a los 5 y 10 años del grupo 2 según grupos de riesgo se muestra en la figura 4. Existe una diferencia significativa en los pacientes de RE y RI (p < 0,05) y entre estos con los de RA (p < 0,01). Los porcentajes de supervivencia a los 5 años son del 64, 42 y 10 % para los grupos RE, RI y RA, respectivamente.
Figura 4. Kaplan-Meier. Supervivencia global en tratamientos clásicos según grupos de riesgo. Glathem 1973-1981 (n = 96) Log Rank bajo frente a intermedio, p < 0,005, intermedio frente a alto p < 0,01.
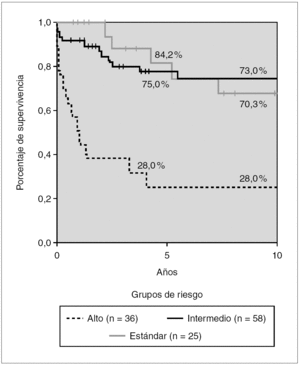
Figura 5. Kaplan-Meier. Supervivencia global en tratamientos modernos según grupos de riesgo. Glathem 1982-2000 (n = 119) Log Rank bajo frente a intermedio n/s, intermedio frente a alto p < 0,01.
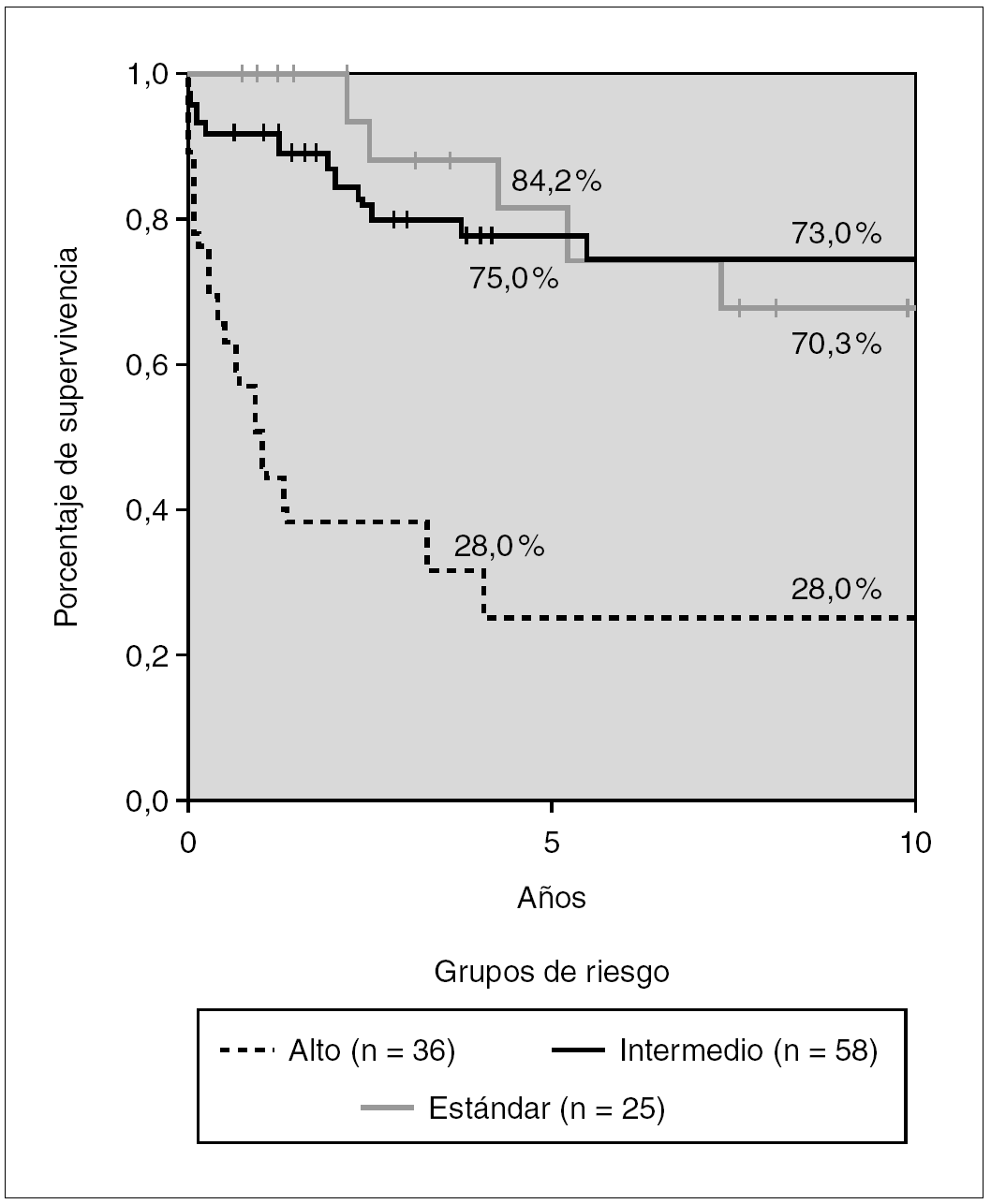
En los protocolos tipo BFM (grupos 3 y 4) se elevan de forma notable, los porcentajes de supervivencia para cada uno de los grupos de riesgo: RE, 84,2 %; RI, 75 %, y RA, 28 %. Existen diferencias significativas entre los grupos de riesgo RI y RA (p < 0,01), pero no entre RI y RE.
Discusión
Los pacientes del grupo 1 (grupo histórico), tratados antes de los protocolos de Glathem con esquemas no programados ni uniformes, sólo alcanzaron el 10 % de supervivencia a los 10 años de ser diagnosticados. Esto coincide con los trabajos revisados de esa etapa del tratamiento de la LLA en todo el mundo. En un estudio realizado en Argentina se pudo determinar que antes de 1967 menos del 1 % de los pacientes con LLA tenían posibilidad de sobrevivir 5 años o más 19. Hay trabajos publicados en Cuba que señalan que antes de 1970 la supervivencia de los niños con LLA no pasaba del 7 % a los 5 años 20.
Ortega et al 21 obtienen también el 10 % de supervivencia de 5 años en pacientes diagnosticados en el período 1967-1969. En los estudios del St. Jude Hospital se obtuvo el 17 % de supervivencia de 5 años en los pacientes diagnosticados de 1962 a 1965 22.
Con relación a los pacientes de este estudio tratados con los protocolos del Glathem, se obtuvo el 91,6 % de remisiones completas como respuesta a la inducción sin diferencias significativas entre los esquemas convencionales de la década de 1970 (grupo 2), que utilizaban vincristina y prednisona solos o asociados a daunorrubicina, con los protocolos iniciados en la década de 1980, en que se usó daunorrubicina en todos los esquemas y se agregó L-asparaginasa 15,16. Perera et al 23 encontraron el 91 % de remisiones completas con esquemas semejantes a los empleados en este trabajo en el grupo 4. Se sabe que con el empleo de vincristina y prednisona pueden obtenerse hasta el 90 % de remisiones completas 21,22, pero el empleo de 3 a 4 fármacos produce una destrucción más rápida de las células leucémicas, lo que repercute en el aumento de la supervivencia 3.
En los protocolos de la década de 1970, se obtuvo una SLE de 42 % a los 5 años lo que es comparable a lo obtenido por el Glathem en el grupo total de pacientes tratados con estos protocolos clásicos 24. En ninguno de estos esquemas la terapéutica fue lo suficientemente agresiva al comienzo de la enfermedad y no en todos se establecieron modificaciones del tratamiento en base a factores pronósticos.
Con el objeto de disminuir más rápidamente la carga tumoral, prevenir la emergencia de clones resistentes y elevar el porcentaje de curaciones se introdujeron en las últimas décadas nuevos esquemas de tratamiento de la LLA. Estos esquemas fueron propuestos inicialmente por el grupo alemán BFM 3,25.
Los resultados obtenidos en este trabajo con los esquemas tipo BFM (grupos 3 y 4) fueron muy superiores a los obtenidos con los protocolos anteriores, elevándose notablemente la SG y la SLE sobre todo en el grupo 4, en el que se alcanza una SG del 72 % a los 5 años y del 65,7 % a los 10 años. Matsuzoki et al26, en un estudio de 187 pacientes en Japón, comunican una supervivencia a los 15 años de 68,2 %; Perera y el grupo cooperativo venezolano 23 en un seguimiento de 209 niños con LLA obtienen una SLE del 68 % a los 8 años. Ambos estudios obtienen resultados muy similares a los de este trabajo. Varios autores y grupos cooperativos de distintos países comunican en los últimos años el 70 % o más de SLE de más de 5 años en niños tratados por LLA 27-29.
El aumento de la supervivencia en nuestros pacientes está, sin duda, relacionado con la disminución de las recaídas al utilizarse una quimioterapia más intensa. Así, vemos que las recaídas disminuyeron el 50 % en los protocolos de la década de 1970 (grupo 2) al 14,2 % en los protocolos tipo BFM (grupos 3 y 4). En estudios recientes se plantea que el 20 % de niños tratados con los protocolos actuales pueden recaer 30.
Con relación a la profilaxis del SNC, el Glathem fue uno de los primeros grupos que desde 1976 sustituyó la radioterapia craneal más metotrexato intratecal por metotrexato intratecal solo o combinado con otros fármacos 31, ya que desde esa época comenzaban a observarse efectos neurocognoscitivos que luego se confirmaron 32. En esta serie sólo se irradiaron en forma profiláctica los pacientes del protocolo 10-LLA-72 del grupo 2 (30 casos). De ellos, dos presentaron tumores del SNC (neurinoma del acústico y tumor cerebeloso de crecimiento lento) que aparecieron a los 15 y 20 años de ser irradiados, respectivamente. Se han comunicado distintas neoplasias del SNC en pacientes que recibieron irradiación craneal como profilaxis del SNC en la LLA 33. Se plantea que las neoplasias y otras alteraciones del SNC son más frecuentes cuando la irradiación se indica a niños menores de 5 años 32. Los pacientes de este estudio que presentaron neoplasias secundarias tenían menos de 3 años cuando fueron irradiados. En los últimos años distintos grupos cooperativos han elaborado protocolos con quimioterapia agresiva sin irradiación craneal, excepto en los pacientes de RA 34-36. La irradiación craneal es suprimida ahora en alrededor del 80 % de los niños tratados por LLA 30. Con la disminución de la irradiación craneal en forma profiláctica, se ha constatado una disminución evidente de las neoplasias secundarias del SNC en niños con LLA 37. En este estudio a partir del protocolo 96, en que se analizaron otros parámetros además de la edad y la cifra de leucocitos para clasificar los pacientes en grupos de riesgo, se irradiaron los catalogados como de RA por translocación 9;22 o mala respuesta al tratamiento.
La introducción por el BFM y otros grupos del metotrexato intravenoso en dosis altas tuvo entre sus objetivos disminuir el número de recaídas del SNC y del testículo. En este estudio se comenzó a usar esta terapéutica a partir de los protocolos 87, 90 y 96 (grupo 4), y se constató una disminución de las recaídas del SNC del 11 al 5 % y las testiculares del 6 al 2 %, comparado con los protocolos anteriores en que no se usó. Se ha señalado que el uso de metotrexato intravenoso en dosis altas ha contribuido a disminuir la irradiación craneal 38.
En este trabajo se encontraron diferencias significativas entre los 3 grupos de riesgo en los protocolos de la década de 1970. Sin embargo, con el empleo de la quimioterapia más agresiva (protocolos del tipo BFM) se eleva de manera notable la supervivencia de cada grupo pronóstico y desaparecen las diferencias entre los grupos RE y RI. Se ha tenido en cuenta que el tratamiento en sí es un factor pronóstico importante 5, lo cual se confirma en estos resultados. Los pacientes con leucocitos iguales o superiores a 50 x 10 9/l que fue el criterio para catalogar los pacientes como RA en la mayoría de los casos de esta serie, tuvieron porcentaje de supervivencia significativamente inferiores, aún en los protocolos recientes, lo cual demuestra su importancia como factor pronóstico. El grupo BFM 90 informó de una SLE del 86 % a los 6 años en pacientes de RE 25; esto es comparable con el grupo de RE de este estudio tratados con los protocolos modernos (grupos 3 y 4), en los cuales se obtuvo una SG del 84,2 % a los 6 años. En esta serie se demostró la presencia de translocación 9;22 en una niña de 3 años que por la edad y la cifra de leucocitos hubiera sido catalogada como RI. Esta paciente se incluyó en el protocolo de RA y pudo terminar su tratamiento con éxito. Esto demuestra la importancia de incluir los estudios citogenéticos, inmunológicos y moleculares para la clasificación de los grupos de riesgo. Se ha señalado que la edad persiste como factor de riesgo aun disponiendo de los parámetros más modernos. Así, la translocación 9;22 se asocia con un pronóstico muy desfavorable en los adolescentes pero tiene una mejor evolución en el niño de 1 a 9 años 39. Esto es aplicable a nuestra paciente diagnosticada a los 3 años que lleva en remisión completa 4 años y fuera de la quimioterapia, 2 años.
Correspondencia: Dra. B. Vergara Domínguez.
Leoncio Vidal, 61, entre Maceo y Unión.
50100 Santa Clara. Cuba.
Correo electrónico: bvergara@capiro.vcl.sld.cu
Recibido en mayo de 2005.
Aceptado para su publicación en octubre de 2005.