La otitis media aguda (OMA) es común en niños menores de 3 años. En España hay disponible una vacuna neumocócica conjugada (VNC) (VNC7; Prevenar (Pearl River, NY), Pfizer/Wyeth, EE. UU.) desde 2001, habiéndose alcanzado una cobertura vacunal del 50-60% en niños menores de 5 años.
Materiales y métodosSe reclutó a niños de 3 a 36 meses con OMA confirmada por especialista en otorrinolaringología en 7 centros españoles (febrero 2009-mayo 2012) (Proyecto GSK: 111425). Se obtuvieron muestras de exudado del oído medio mediante timpanocentesis o de otorrea espontánea, y se hizo cultivo para identificación bacteriana. En muestras con cultivos negativos se realizó análisis adicional mediante reacción en cadena de la polimerasa (PCR).
ResultadosDe 125 episodios de OMA confirmados en 124 niños, se analizaron 117 (edad mediana: 17 meses [rango: 3-35]); 8 episodios de OMA fueron excluidos del análisis. En total, combinando resultados de cultivo y PCR, se identificaron uno o más patógenos bacterianos en el 69% (81/117) de los episodios; identificándose Haemophilus influenzae (Hi) en el 44% (52/117) y Streptococcus pneumoniae (Spn) en el 39% (46/117). En 77 de los 117 episodios se hizo cultivo para uno o más patógenos, resultando positivo en 63, con mayor frecuencia para Spn (24/77; 31%) e Hi (32/77; 42%). La PCR en episodios con cultivos negativos detectó Hi en el 48% y Spn en el 55% de las muestras. El serotipo de Spn más común fue el 19F (4/24; 17%) seguido del 19A (3/24; 13%); todos los episodios en los que se identificó Hi correspondieron a Hi no tipificable (HiNT). Un total de 81/117 episodios de OMA (69%) se presentaron en niños que habían recibido una o más dosis de vacuna antineumocócica.
ConclusionesHiNT y Spn resultaron ser los principales agentes etiológicos de la OMA en España. Para conocer el impacto de la vacunación antineumocócica en la OMA en España harán falta estudios adicionales cuando se haya alcanzado un nivel de cobertura mayor.
Acute otitis media (AOM) is common in children aged <3 years. A pneumococcal conjugate vaccine (PCV) (PCV7; Prevenar, Pfizer/Wyeth, USA) has been available in Spain since 2001, which has a coverage rate of 50-60% in children aged <5 years.
Materials and methodsChildren aged ≥3 to 36 months with AOM confirmed by an ear-nose-throat specialist were enrolled at seven centers in Spain (February 2009-May 2012) (GSK study identifier: 111425). Middle-ear-fluid samples were collected by tympanocentesis or spontaneous otorrhea and cultured for bacterial identification. Culture-negative samples were further analyzed using polymerase chain reaction (PCR).
ResultsOf 125 confirmed AOM episodes in 124 children, 117 were analyzed (median age: 17 months (range: 3–35); eight AOM episodes were excluded from analyses. Overall, 69% (81/117) episodes were combined culture- and PCR-positive for ≥1 bacterial pathogen; 44% (52/117) and 39% (46/117) were positive for Haemophilus influenzae (Hi) and Streptococcus pneumoniae (Spn), respectively. 77 of 117 episodes were cultured for ≥1 bacteria, of which 63 were culture-positive; most commonly Spn (24/77; 31%) and Hi (32/77; 42%). PCR on culture-negative episodes identified 48% Hi- and 55% Spn-positive episodes. The most common Spn serotype was 19F (4/24; 17%) followed by 19A (3/24; 13%); all Hi-positive episodes were non-typeable (NTHi). 81/117 AOM episodes (69%) occurred in children who had received ≥1 pneumococcal vaccine dose.
ConclusionsNTHi and Spn were the main etiological agents for AOM in Spain. Impact of pneumococcal vaccination on AOM requires further evaluation in Spain, after higher vaccination coverage rate is reached.
La otitis media aguda (OMA) es una de las infecciones más frecuentes en la infancia, afectando a más del 75% de los niños mayores de 3 años a nivel mundial1, a la vez que representa la principal causa de prescripción de antibióticos en niños pequeños2. Cada año se producen 709 millones de casos de OMA en el mundo, de los que el 51% se presentan en niños menores de 5 años3.
En España, la incidencia anual de la OMA en niños menores de 2 años se estima en 392 casos por cada 1.000 personas por año, frente a 263 por cada 1.000 personas por año en niños de 3 a 5 años4. En más del 90% de los niños españoles que presentan síntomas de OMA (p. ej., otorrea) se prescriben antibióticos como tratamiento de elección, a pesar de que se recomienda la observación inicial del paciente antes de comenzar la antibioterapia5.
Tras la introducción en 2001 de la vacuna neumocócica conjugada (VNC) heptavalente (VNC7; Prevenar 7, Pfizer/Wyeth, EE. UU.) en el mercado privado español6, la cobertura vacunal en niños menores de 5 años alcanzó un porcentaje de entre el 50 y el 60% en el año 20077. Desde entonces se han autorizado otros preparados de VNC para su distribución en España, como la VNC decavalente (VNC10; Synflorix™ (Rixensart), GSK Vacunas, Bélgica) en 2009 y la VNC 13-valente (VNC13; Prevenar 13 (Pearl River, NY), Pfizer/Wyeth, EE. UU.) en 20107.
Con anterioridad a la introducción de la VNC, el Streptococcus pneumoniae (Spn) y el Haemophilus influenzae (Hi) eran los agentes etiológicos más importantes en la OMA en niños españoles8. Sin embargo, la microbiología de las enfermedades infecciosas cambia con el paso del tiempo como consecuencia de la vacunación y del consumo de antibióticos9, y varios estudios globales han descrito un descenso en la circulación de serotipos neumocócicos vacunales y un incremento en la circulación de serotipos no vacunales y de Hi desde la introducción de la VNC710. Este estudio fue diseñado para valorar la etiología bacteriana de la OMA en niños españoles menores de 3 años mediante cultivo y reacción en cadena de la polimerasa (PCR), complementando un estudio previo que describía la etiología bacteriana de la OMA recurrente o con fracaso terapéutico en niños españoles en la era de la vacunación antineumocócica7.
Materiales y métodosDiseño y participantesEntre febrero del 2009 y mayo del 2012 se llevó a cabo un estudio epidemiológico prospectivo en 7 centros españoles (Proyecto GSK: 111425) para el que fueron reclutaron niños de 3 a 36 meses de edad con OMA confirmada por otorrinolaringólogo y que podían proveer una muestra de exudado del oído medio (EOM). Las muestras de EOM se obtuvieron por timpanocentesis; en presencia de otorrea, se recogieron las muestras mediante aspiración con aguja de EOM previa limpieza del conducto auditivo.
El diagnóstico de OMA se hizo sobre la base del inicio agudo y repentino de síntomas en los 3 días precedentes: fiebre, irritabilidad, eritema intenso del tímpano u otalgia, y presencia de EOM. La presencia de exudado en la cavidad del oído medio se caracterizó por el abombamiento del tímpano, la ausencia o disminución de la movilidad del tímpano (evaluada mediante otoscopia neumática), acumulación de líquido detrás del tímpano y/u otorrea (definida como perforación ocurrida en las 48 h previas al reclutamiento).
Se excluyó del estudio a niños hospitalizados durante el episodio de OMA (para evitar la posible confusión con infecciones intrahospitalarias), con otitis externa o media con exudado (OMA de duración superior a las 72 h o con otorrea de más de 48 h previa al reclutamiento), o con drenajes timpánicos in situ. También fueron excluidos los pacientes que recibieron antibióticos para tratar otras enfermedades en las 72 h previas al reclutamiento y a los que se prescribió antibióticos antes de realizarse la timpanocentesis. Por último, fueron excluidos los pacientes con enfermedades no permitidas por el protocolo.
El estudio se hizo conforme a los principios de la buena práctica clínica, incluyendo la Declaración de Helsinki de 1964 y las leyes y normativas españolas. El estudio fue aprobado por el comité ético de cada centro participante y antes de incluir a los pacientes se obtuvo el consentimiento informado por escrito de los padres y tutores.
Identificación bacteriana y pruebas de sensibilidad a antimicrobianosLas muestras de EOM se obtuvieron mediante timpanocentesis, realizada bajo otoscopia con un aspirador CDT reutilizable acoplado a un espéculo CDT o mediante la recogida de muestras de otorrea espontánea. En casos de OMA bilateral, se recogieron muestras de ambos oídos. La timpanocentesis se llevó a cabo sin anestesia. Las muestras de aspirado de EOM fueron inoculadas en medio de transporte de Amies11 y mantenidas a temperatura ambiente durante 16 h (y hasta un máximo de 48 h) antes de su análisis en un laboratorio designado por GSK. En el laboratorio, las muestras de EOM se inocularon en agar de chocolate (con bacitracina para muestras de otorrea) y de sangre (con ácido nalidíxico). La identificación bacteriana se llevó a cabo mediante procedimientos bacteriológicos estandarizados12. Los serogrupos de Spn se determinaron mediante la prueba de Quellung, y los de Hi mediante antisueros monovalentes.
Las muestras con cultivos negativos se sometieron a análisis adicional mediante PCR cuantitativo para detectar la presencia del gen neumocócico de la neumolisina (ply)13, el gen neumocócico wzg14 y el gen omp2 para cepas de Hi capsuladas y no capsuladas15. Se evaluaron las reacciones de PCR inhibidas mediante un control interno positivo exógeno disponible en el mercado (Applied Biosystems, Foster City, EE. UU.). A continuación, se procedió a eliminar los inhibidores de las muestras inhibidas por extracción de una solución al 20% p/v de resina Chelex-100 (BioRad Laboratories, Hercules, EE. UU.). También se hicieron pruebas de sensibilidad a antimicrobianos. Las concentraciones inhibitorias mínimas se obtuvieron por el método E-test (bioMérieux, Craponne, Francia) y se interpretaron de acuerdo con los criterios publicados en 2009 por el Clinical and Laboratory Standards Institute16.
Análisis estadísticoSe analizaron los datos de los niños que cumplieron todos los criterios de selección y para los que se disponía de resultados del análisis del EOM, de acuerdo con los procedimientos establecidos en el protocolo. Se calcularon las proporciones de episodios causados por Spn, por Hi y por otros patógenos bacterianos, y los porcentajes correspondientes a los distintos serotipos de Spn y Hi. El análisis solo incluyó el primer episodio de OMA, excluyendo episodios de OMA recurrente. Se determinó la sensibilidad a antimicrobianos de las cepas de Spn y Hi. Se documentaron los antecedentes de vacunación contra neumococo, Hi tipo b y gripe. Todos los análisis estadísticos se realizaron con la aplicación SAS versión 9.2 (SAS Institute Inc., Cary, EE. UU.).
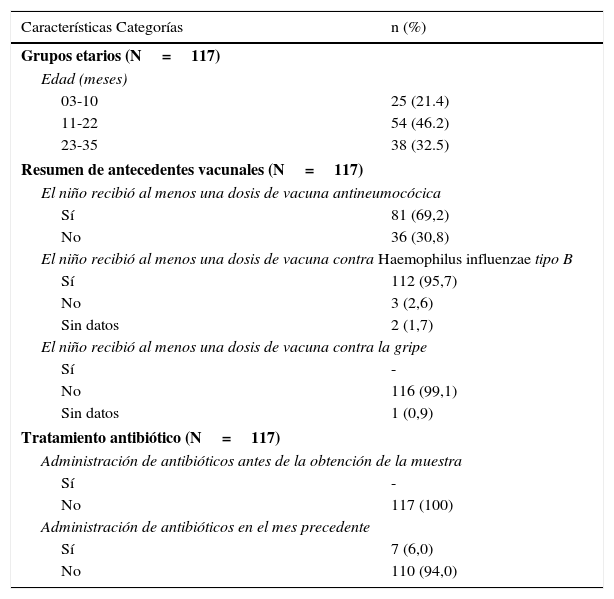
ResultadosParticipantes y características demográficasDe los 125 episodios de OMA, en 124 sujetos registrados durante el período de estudio se analizaron 117 episodios (timpanocentesis, 91; otorrea, 26) correspondientes a 117 sujetos. Solo hubo un participante con 2 episodios de OMA, de los que se excluyó uno. Así, se excluyeron un total de 8 episodios de OMA de los análisis: por violación del protocolo (n=1), por dolencia no permitida por el protocolo (n=4) y por falta de muestra de EOM/otorrea (n=3). La edad mediana de los niños fue de 17 meses (rango: 3-35) y el 60,7% eran varones. Los episodios de OMA se observaron con mayor frecuencia en niños de 11 a 22 meses de edad (46,2%; 54/117) seguidos de niños de 23 a 35 meses (32,5%; 38/117) y de 3 a 10 meses (21,4%; 25/117). El 69,2% de los participantes habían recibido al menos una dosis de vacuna antineumocócica y el 95,7% al menos una de vacuna frente a Hi tipo b. Ninguno de los sujetos había sido vacunado contra la gripe. La tabla 1 presenta información sobre los grupos etarios del estudio, los antecedentes vacunales de los participantes y el tratamiento antibiótico.
Características de los niños incluidos en el estudio
| Características Categorías | n (%) |
|---|---|
| Grupos etarios (N=117) | |
| Edad (meses) | |
| 03-10 | 25 (21.4) |
| 11-22 | 54 (46.2) |
| 23-35 | 38 (32.5) |
| Resumen de antecedentes vacunales (N=117) | |
| El niño recibió al menos una dosis de vacuna antineumocócica | |
| Sí | 81 (69,2) |
| No | 36 (30,8) |
| El niño recibió al menos una dosis de vacuna contra Haemophilus influenzae tipo B | |
| Sí | 112 (95,7) |
| No | 3 (2,6) |
| Sin datos | 2 (1,7) |
| El niño recibió al menos una dosis de vacuna contra la gripe | |
| Sí | - |
| No | 116 (99,1) |
| Sin datos | 1 (0,9) |
| Tratamiento antibiótico (N=117) | |
| Administración de antibióticos antes de la obtención de la muestra | |
| Sí | - |
| No | 117 (100) |
| Administración de antibióticos en el mes precedente | |
| Sí | 7 (6,0) |
| No | 110 (94,0) |
N=número total de sujetos; n (%): número (porcentaje) de sujetos en cada grupo.
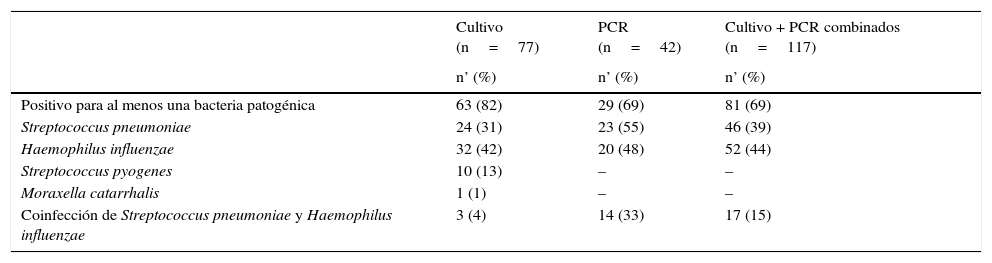
Los resultados microbiológicos se exponen en la tabla 2. Se hicieron pruebas de cultivo bacteriano en 117 episodios. Se observó crecimiento bacteriano de algún tipo en los cultivos correspondientes al 66% de los episodios (77/117), de los cuales el 82% (63/77) fueron positivos para al menos uno de los patógenos estudiados (Spn, Hi, Streptococcus pyogenes [Spy] o Moraxella catarrhalis [Mcat]). Los patógenos identificados con mayor frecuencia fueron Hi (42%; 32/77) y Spn (31%; 24/77). Se detectó Spy en 10 muestras y Mcat en una, y hubo coinfección en 10 episodios, en 4 de ellos por alguna de las especies estudiadas: Spn y Hi (n=3); Spy y Hi (n=1). Los cultivos fueron negativos en los 40 episodios restantes. No obstante, se analizaron las muestras de 42 episodios mediante PCR (40 con cultivo negativo y 2 con cultivo positivo), con detección de Hi en el 48% (n=20) y de Spn en el 55% (n=23).
Identificación bacteriana en episodios de OMA por cultivo y PCR
| Cultivo (n=77) | PCR (n=42) | Cultivo + PCR combinados (n=117) | |
|---|---|---|---|
| n’ (%) | n’ (%) | n’ (%) | |
| Positivo para al menos una bacteria patogénica | 63 (82) | 29 (69) | 81 (69) |
| Streptococcus pneumoniae | 24 (31) | 23 (55) | 46 (39) |
| Haemophilus influenzae | 32 (42) | 20 (48) | 52 (44) |
| Streptococcus pyogenes | 10 (13) | – | – |
| Moraxella catarrhalis | 1 (1) | – | – |
| Coinfección de Streptococcus pneumoniae y Haemophilus influenzae | 3 (4) | 14 (33) | 17 (15) |
En 2 episodios de OMA se realizó estudio por cultivo y también por PCR.
En los episodios con cultivos negativos no se hicieron pruebas de detección de Streptococcus pyogenes y Moraxella catarrhalis por PCR.
n: número de episodios analizados mediante cultivo, PCR o ambos; n’ (%): número (porcentaje) de episodios positivos para cada bacteria; OMA: otitis media aguda; PCR: reacción en cadena de la polimerasa.
Los resultados combinados de los cultivos y la PCR indicaron la presencia de Hi en 52 episodios de OMA (44%), la presencia de Spn en 46 episodios (39%) y la presencia de tanto Hi como Spn en 17 episodios (15%).
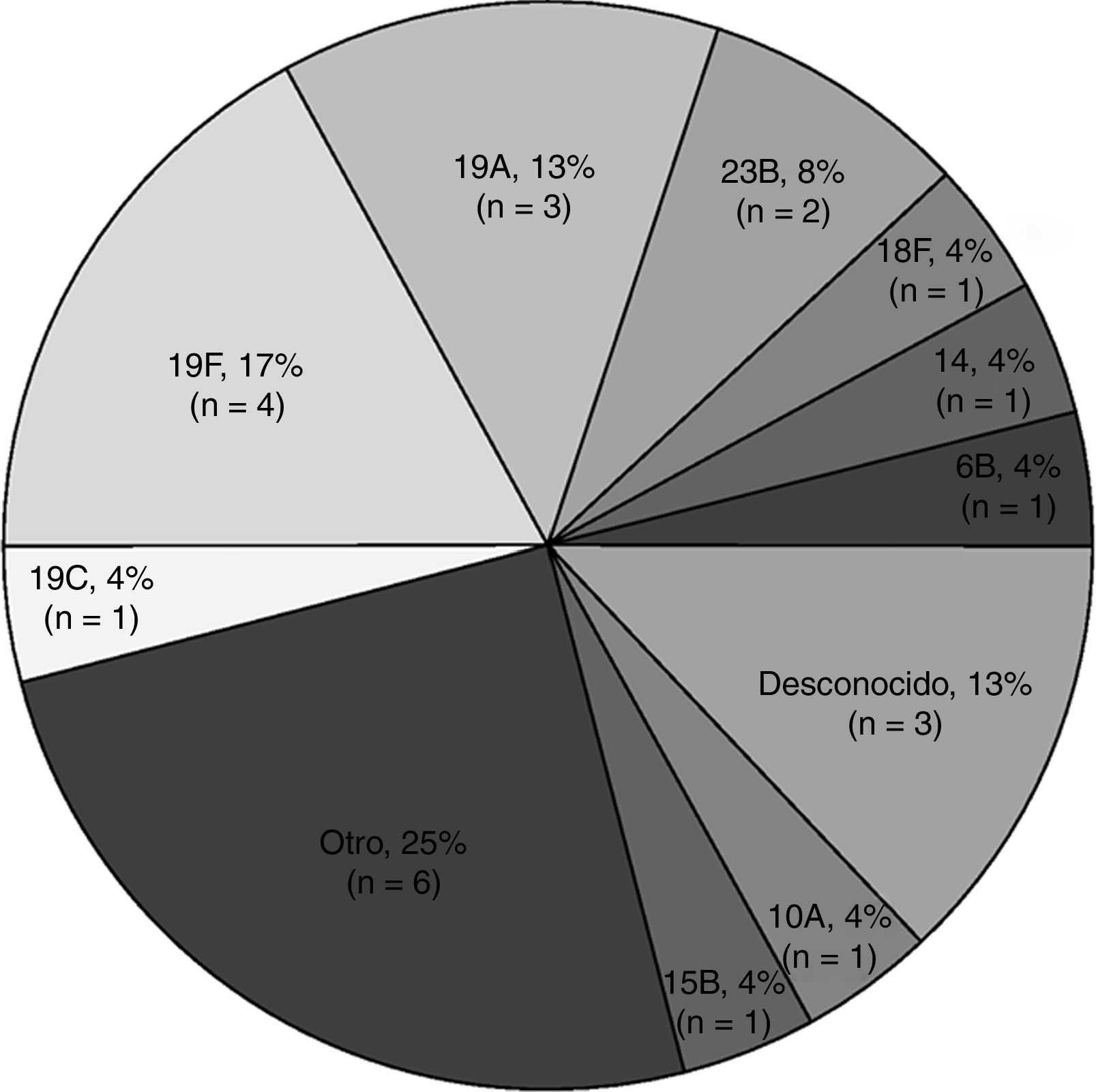
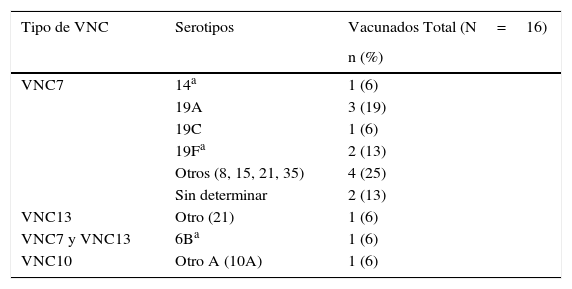
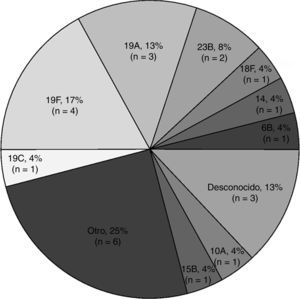
Los serotipos de Spn identificados con más frecuencia en episodios con cultivos positivos fueron el 19F (17%; 4/24) y el 19A (13%; 3/24) (fig. 1). En niños que habían sido vacunados previamente se aislaron serotipos vacunales de la VNC7 (14 y 19F) en el 19% (3/16) de los episodios, y un serotipo vacunal de la VNC7 y la VNC13 (6B) en el 6% (1/16) de los episodios (tabla 3). Se detectó un serotipo vacunal de la VNC7 (19F) en el 25% (2/8) de los episodios en niños no vacunados.
Distribución de serogrupos y serotipos en los episodios con cultivo positivo para Streptococcus pneumoniae (N=24).
n: número de episodios con aislado de Streptococcus pneumoniae, con sus respectivos serotipos y serogrupos; OTRO: serogrupos 8, 15, 22, 35 (1 episodio cada uno) y 21 (2 episodios).
Serogrupos y serotipos de Streptococcus pneumoniae identificados en episodios con cultivo positivo, según tipo de vacuna antineumocócica recibida (N=16)
| Tipo de VNC | Serotipos | Vacunados Total (N=16) |
|---|---|---|
| n (%) | ||
| VNC7 | 14a | 1 (6) |
| 19A | 3 (19) | |
| 19C | 1 (6) | |
| 19Fa | 2 (13) | |
| Otros (8, 15, 21, 35) | 4 (25) | |
| Sin determinar | 2 (13) | |
| VNC13 | Otro (21) | 1 (6) |
| VNC7 y VNC13 | 6Ba | 1 (6) |
| VNC10 | Otro A (10A) | 1 (6) |
| Serotipos | No vacunados Total (N=8) |
|---|---|
| n (%) | |
| 18F | 1 (13) |
| 19F | 2 (25) |
| 23B | 2 (25) |
| Otro (22) | 1 (13) |
| Otro B (15B) | 1 (13) |
| Sin determinar | 1 (13) |
N=número de episodios con aislamiento de Streptococcus pneumoniae en pacientes vacunados y no vacunados con vacuna neumocócica conjugada; n (%): número (porcentaje) de episodios con aislamiento de Streptococcus pneumoniae en cada categoría; VNC: vacuna neumocócica conjugada; VNC7: VNC heptavalente; VNC10: VNC decavalente; VNC13: VNC 13-valente.
Los 32 episodios en los que se aisló Hi correspondieron a Hi no tipificable (HiNT): el 69% (n=22) en niños vacunados (VNC) y el 31% (n=10) en niños no vacunados (VNC).
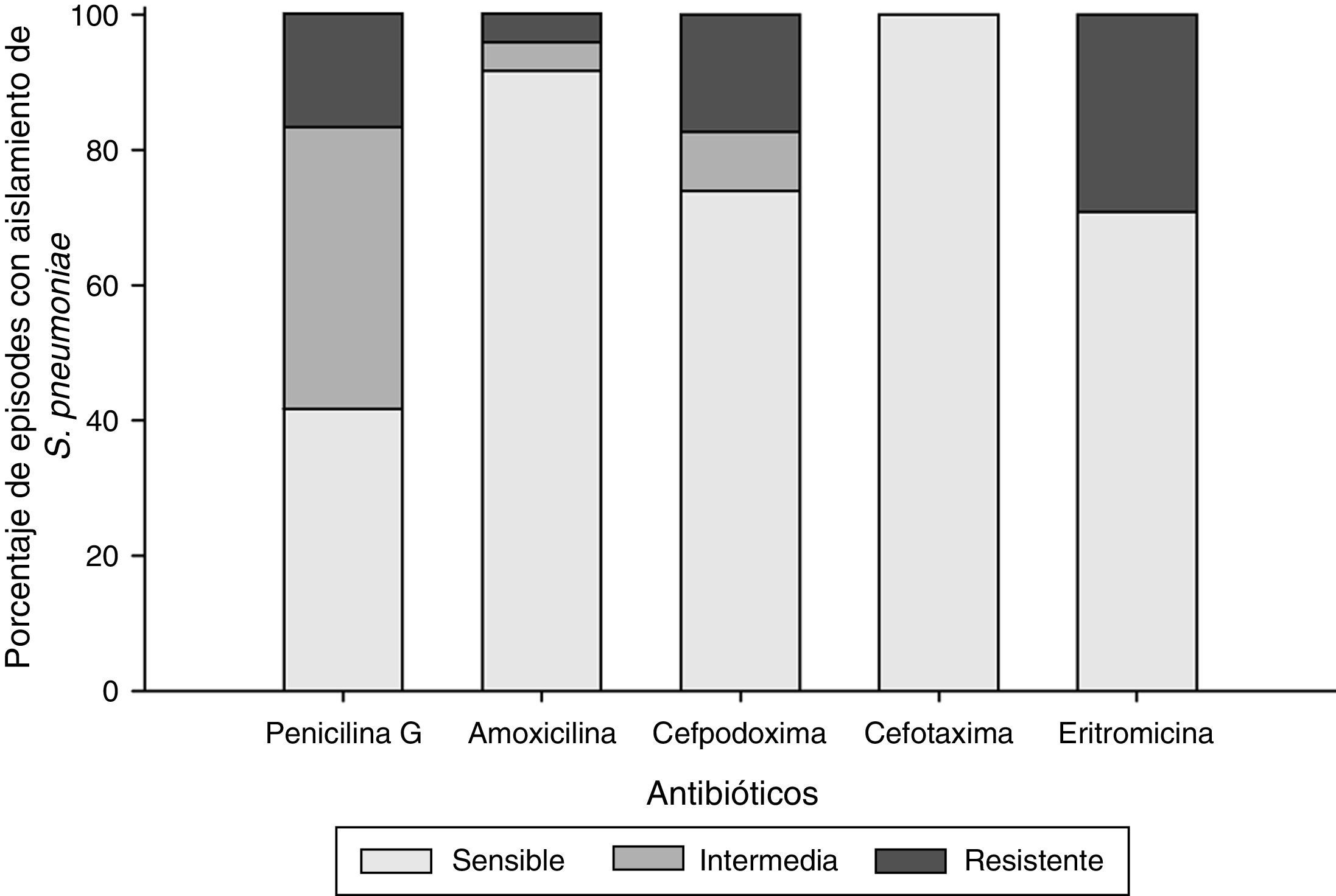
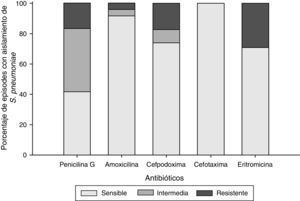
Sensibilidad a antimicrobianosEn los 24 episodios con muestras positivas para Spn, todos los aislados (100%) fueron sensibles a la cefotaxima, 22 (92%) a la amoxicilina, 17 (71%) a la eritromicina y 17 (74%) a la cefpodoxima (como faltaba un episodio con cultivo positivo para Spn sensible únicamente a la cefpodoxima, solo se incluyeron 23 de los 24 episodios positivos para Spn en el análisis). Diez aislados eran sensibles o tenían sensibilidad intermedia a la penicilina G y 4 (17%) eran resistentes a la penicilina (fig. 2). El serotipo 19A fue con más frecuencia resistente a la penicilina G, la amoxicilina, la cefpodoxima y la eritromicina.
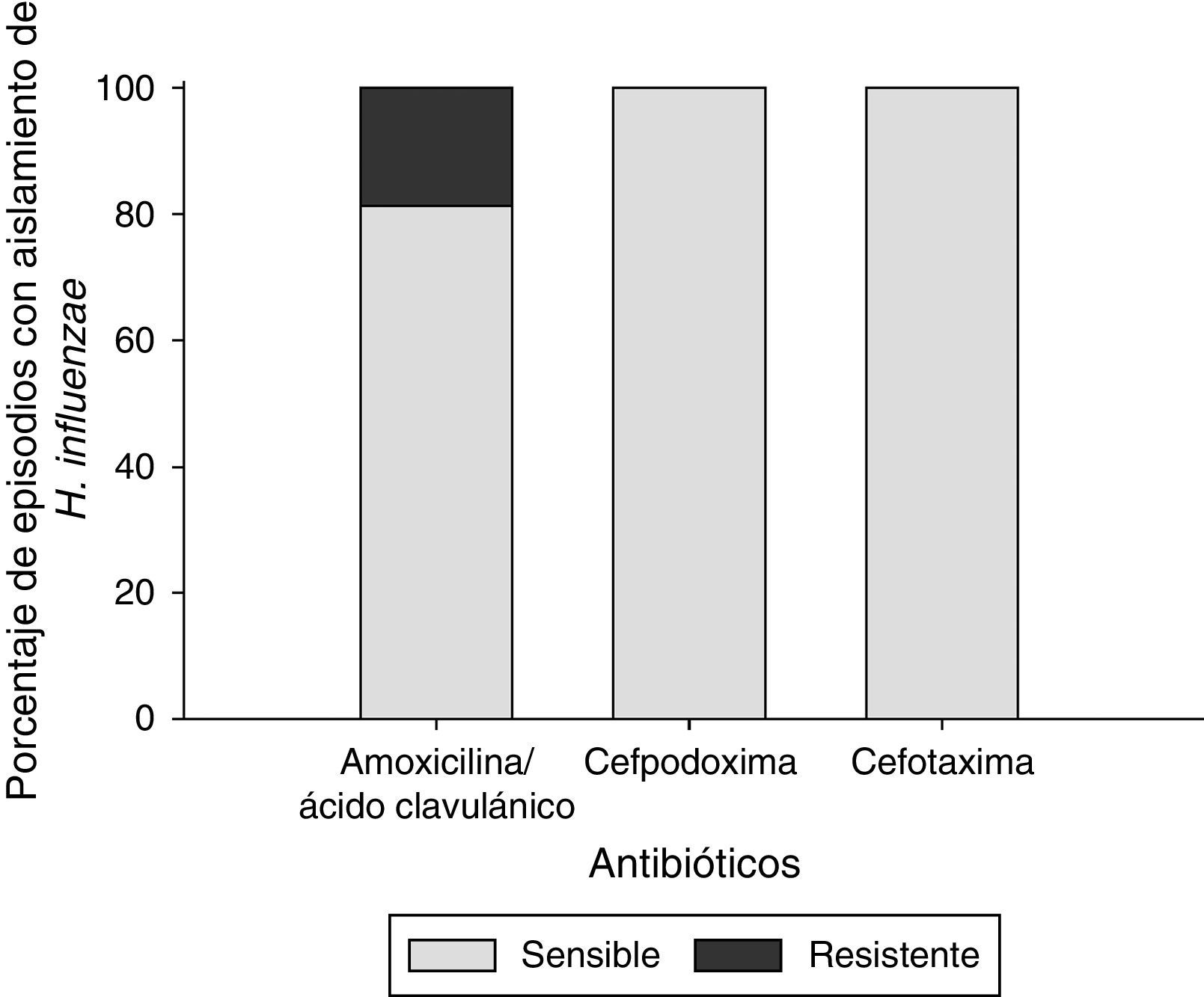
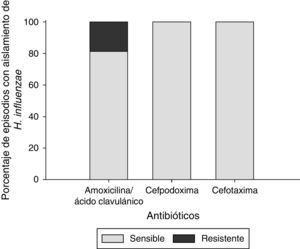
En los 32 episodios con cultivos positivos para Hi, todos los aislados (100%) fueron sensibles a la cefpodoxima y la cefotaxima, y 26 (81%) a la amoxicilina/ácido clavulánico. Seis (19%) fueron resistentes a la amoxicilina/ácido clavulánico (fig. 3).
Se observó multirresistencia en el 17% (4/24) de los aislados de Spn: en un episodio, Spn mostró resistencia a la penicilina G, la cefpodoxima y la eritromicina, y en 3, a la penicilina G, la amoxicilina, la cefpodoxima y la eritromicina. También se observó resistencia a múltiples antibióticos en 6 episodios con aislados de HiNT (19%).
Resultados microbiológicos en relación con el estado de vacunaciónDe los 81 niños con resultados positivos para al menos uno de los patógenos bacterianos por cultivo y/o PCR, 55 (68%) habían recibido las dosis de VNC adecuadas para su edad: el 61% (11/18) de los de 3-10 meses, el 64% (21/33) de los de 11-22 meses y el 77% (23/30) de los de 23-35 meses. La vacuna administrada fue la VNC7 en 62 niños (77%, de los que 44 [71%] recibieron ≥3 dosis), VNC10 en 9 (11%, de los que 6 [67%] recibieron ≥3 dosis) y VNC13 en 17 niños (21%, de los que 2 [12%] recibieron ≥3 dosis). No se encontraron diferencias significativas con respecto a los antecedentes vacunales entre los niños con cultivos positivos para Hi (p=1,000) y los niños con cultivos positivos para Spn (p=0,9497).
DiscusiónEl estudio identificó y caracterizó los patógenos bacterianos asociados a la OMA en niños españoles menores de 3 años tras la introducción de la VNC. Encontramos un porcentaje relativamente alto (69%) de episodios con cultivos positivos para al menos una bacteria patogénica por combinación de cultivo y PCR. Hi y Spn fueron los patógenos aislados con más frecuencia en los episodios de OMA. Este hallazgo es consistente con los de estudios realizados con anterioridad en México, Colombia, Venezuela, Alemania y España, que han implicado a estos patógenos como los principales agentes etiológicos de la OMA17-21. Se debe destacar que la similitud de las proporciones de Spn e Hi detectados por cultivo y por PCR subraya la relevancia de la PCR como método efectivo para la detección de patógenos, lo que corrobora un estudio previo en el que se identificaron Spn e Hi en muestras con cultivos negativos mediante PCR diagnóstico22.
Spn e HiNT son responsables en gran medida del elevado número de casos de OMA a nivel mundial, que no ha cambiado de manera significativa en los últimos 50 años, previa o posteriormente a la introducción de la VNC17,23. La vacunación extensiva con VNC podría resultar en una reducción del protagonismo del Spn en la OMA. Es posible que esto resulte en una mayor importancia del HiNT como agente etiológico en años venideros23.
Ciento doce niños (97%) recibieron al menos una dosis de vacuna frente a Hi tipo b. En nuestro estudio, el HiNT fue responsable de todos los episodios en los que se identificó Hi, como se ha observado en otros estudios etiológicos en los que la mayoría o todos los casos con aislados de Hi correspondieron a cepas no tipificables17,18,20,24. Es posible que la vacunación frente a Hi tipo b dé como resultado una menor incidencia de OMA por Hi tipo b, pero no ha conseguido reducir la incidencia de casos causados por HiNT. En nuestro estudio, el serotipo más común de neumococo fue el 19F, seguido del 19A. El serotipo 19F también fue el más frecuente en un estudio anterior realizado en España, seguido por el 23F, que no se encontró en nuestro estudio21. La persistencia del 19F es digna de atención y hace patente la ineficacia de la vacuna en la protección contra este serotipo en España. Aunque la distribución de serotipos varía según el área geográfica, estudios en España y otros países han destacado la predominancia del serotipo 19A tras la introducción de la VNC21,25-27. La presencia del 19A en nuestro estudio indica que la protección cruzada que ofrecen las VNC no es suficiente para proteger contra este serotipo. Aunque Spn e HiNT son los principales agentes causales de la OMA, con menor predominio de Spn, estudios recientes han indicado un desplazamiento de los patógenos, con una mayor frecuencia de HiNT en comparación con Spn en niños pequeños, lo que es consistente con nuestros datos23,28.
En línea con lo descrito, de que más del 80% de los médicos en España prescriben un antibiótico como tratamiento inicial de pacientes con OMA5, cabía esperar una resistencia alta a los antibióticos29. Sin embargo, en nuestro estudio observamos que la mayoría de las cepas de Spn e Hi identificadas en episodios de OMA eran susceptibles a la amoxicilina y la amoxicilina/ácido clavulánico, respectivamente. Este hallazgo apoya el uso continuado de amoxicilina/ácido clavulánico como tratamiento de primera línea de la OMA en España7. Por añadidura, todas las cepas de Spn e Hi identificadas en los episodios resultaron ser susceptibles a la cefotaxima. Los patrones de sensibilidad a antimicrobianos que observamos fueron similares a los descritos con anterioridad en España21 y pueden ser de utilidad cuando se considere el tratamiento antibiótico en España.
Es posible que los casos de OMA incluidos este estudio no sean representativos del total de casos de OMA en la población española y los resultados han de considerarse meramente descriptivos. Aunque la timpanocentesis es un método efectivo para identificar patógenos bacterianos en el oído medio, no se realiza de manera sistemática en España, lo que contribuyó al número relativamente pequeño de pacientes incluidos en el estudio y a la imposibilidad de sacar conclusiones contundentes. Además, nuestro estudio excluyó casos de OMA recurrente y solo incluyó el primer episodio en cada paciente, lo que puede ser otra limitación teniendo en cuenta que en España suele resultar difícil realizar una timpanocentesis en el primer episodio de OMA.
Nuestro estudio muestra que tras la introducción de la vacuna neumocócica conjugada, el HiNT y el Spn han sido los principales agentes etiológicos bacterianos de la OMA en niños pequeños en España, observándose un desplazamiento a otros agentes, con el HiNT emergiendo como un patógeno importante de la OMA. Se requieren estudios adicionales para evaluar el impacto de la vacunación antineumocócica en la carga de enfermedad de la OMA una vez se hayan alcanzado coberturas vacunales mayores.
Marcas registradasPrevenar y Prevenar 13 son marcas registradas de Pfizer/Wyeth.
Synflorix™ es una marca registrada del grupo GSK.
FinanciaciónEste estudio (Identificación de estudio de GSK: 111425) fue promovido por GlaxoSmithKline Biologicals SA. GlaxoSmithKline Biologicals SA también financió todos los costes asociados a la elaboración y publicación de este artículo.
AutoríaTodos los autores tuvieron pleno acceso a los datos y contribuyeron a la revisión crítica de los contenidos intelectuales del artículo y dieron su aprobación final. La responsabilidad última de entregar el artículo para su publicación correspondió al autor designado para la correspondencia. Los autores y el promotor establecieron un acuerdo de confidencialidad.
Conflicto de interesesSistiaga-Hernando A., García-Corbeira P., McCoig C. y Devadiga R. son empleados del grupo GSK. Sistiaga-Hernando A., García-Corbeira P. y McCoig C. declaran ser poseedores de stock options/acciones restringidas del grupo GSK. Pumarola F. declara haber recibido pagos del grupo GSK para su inscripción en congresos. Gómez Martínez J.R. y Iniesta Turpin J. declaran honorarios por su labor investigadora recibidos de GSK por su institución en el período en el que se llevó a cabo el estudio. Salamanca de la Cueva I., Moraga-Llop F.A., Cardelús S. y Rosell Ferrer R. declaran no tener conflicto de intereses.
Los autores quieren expresar su agradecimiento a Ashmita Ravishankar y Mark Franco por la redacción de contenidos médicos (Publications Writer, GSK), a Julia Donnelly (freelance Publications Manager en representación de GSK Vacunas) por su apoyo editorial y a Jérémie Dedessus Le Moutier y Grégory Leroux (Publications Manager, Business & Decision Life Sciences en representación de GSK Vacunas) por coordinar la elaboración del manuscrito.