Introducción
La polisomnografía neonatal que realizamos en la Unidad comprende el estudio simultáneo de los siguientes parámetros fisiológicos: electroencefalograma (EEG) (8 canales como mínimo), electrooculograma (EOG) (oculografía, 1 canal como mínimo), electromiograma (EMG) de los músculos submentonianos (1 canal), electrocardiograma (ECG) (1 canal), flujo aéreo nasobucal (2 canales) y esfuerzo respiratorio torácico y abdominal (2 canales). La curva de saturación de oxihemoglobina, obtenida a partir de un pulsioxímetro, se deriva a un canal del EEG digital, en el que además se obtiene el valor de la saturación de oxígeno (SaO2) cada segundo. El análisis de estos parámetros nos permite estudiar el sueño del neonato y los episodios cardiorrespiratorios en relación con la fase del sueño y la edad gestacional (EG) 1. La ventilación puede evaluarse también, mediante gafas nasales para la recogida de end-tidal CO2 (dióxido de carbono) o mediante la detección de la presión parcial del dióxido de carbono (PCO2) transcutánea. Como no se puede insertar en los orificios nasales una doble cánula (nosotros utilizamos cánulas para registrar el flujo aéreo), se suele utilizar un sensor transcutáneo para medir la PCO2, que no se ha realizado en este estudio 2.
Las apneas del prematuro son más frecuentes a menor edad gestacional y a menor peso al nacer, lo que nos hace pensar en la inmadurez como un factor determinante. Las apneas y bradicardias del prematuro se acompañan de una disminución significativa y constante del flujo sanguíneo cerebral, más marcado para las apneas obstructivas que para las centrales y mixtas 3,4.
La vídeo-polisomnografía (VPSG) en neonatos pretérmino de peso inferior a 1.800 g, se realiza antes del alta hospitalaria para descartar la existencia de apneas, y proporcionar a estos niños un seguimiento adecuado con una monitorización cardiorrespiratoria a domicilio, y/o tratamiento con metilxantinas si fuera necesario. Esta técnica permite también analizar otros episodios respiratorios como la respiración periódica, el patrón de sueño del recién nacido y descartar la existencia de patología asociada como movimientos anormales, crisis o reflujo gastroesofágico (RGE) que puedan precisar de un tratamiento y seguimiento específicos 5,7.
La monitorización por VPSG permite además identificar anomalías como estridor laríngeo, posición cefálica inadecuada, llanto o quejidos inhabituales, sudoración excesiva, cambios de coloración, etc. 1.
Nuestro objetivo fue estudiar en prematuros de menos de 1.800 g la presencia de apneas, hipopneas y respiración periódica y su repercusión sobre el sueño, sobre la frecuencia cardíaca y sobre la SaO2. Además, analizamos la maduración cerebral en relación con el patrón EEG durante el sueño a diferentes edades gestacionales corregidas (EC), la organización del ciclo de sueño y la normalidad o no del EEG.
Pacientes y método
Hemos realizado un estudio observacional transversal descriptivo mediante la revisión de las historias clínicas de neonatos de peso inferior a 1.800 g, a los que se había realizado VPSG en el período enero 2001-diciembre 2003. De 388 neonatos nacidos en ese período con un peso por debajo de 1.800 g, se solicitó el estudio a 31 bebés, lo que representa el 7,98 %. Los parámetros revisados fueron los siguientes: edad gestacional, edad gestacional corregida, peso al nacimiento, sexo, indicación de realizar VPSG, patologías asociadas, existencia de RGE, necesidad de ventilación mecánica invasiva o no invasiva, necesidad y duración de la oxigenoterapia y tratamiento con metilxantinas. También se evaluó su evolución, incluyendo la necesidad de monitorización y/o oxigenoterapia domiciliaria, así como los reingresos por nuevos episodios de apneas. Se detallan los resultados de la VPSG incluyendo: presencia de alteraciones cardiorrespiratorias, del patrón de sueño y del EEG.
La VPSG consistió en el registro simultáneo de 11 canales de EEG con derivaciones bipolares, del EOG (1-2 canales), del ECG (1 canal), del EMG submentoniano (1 canal), del flujo aéreo nasobucal (2 canales) y del esfuerzo respiratorio torácico y abdominal (2 canales). El flujo nasobucal se ha registrado mediante un sensor de presión de flujo (cánulas nasales), que tiene un gran interés diagnóstico y ha desplazado el registro mediante termistancias. Las termistancias detectan aceptablemente los diferentes tipos de apneas, pero en cambio no son fiables en el registro de las hipopneas y no detectan las limitaciones inspiratorias de flujo (LIFA) y el ronquido. Las cánulas, al igual que las gafas nasales, utilizadas en oxigenoterapia, se insertan en los orificios nasales. Con las cánulas registramos perfectamente las hipopneas, ya sean centrales u obstructivas, y las LIFA. La curva de saturación de oxihemoglobina, obtenida a partir de un pulsioxímetro, se deriva a un canal del polígrafo digital y se obtiene el valor de la SaO2 por segundo (fig. 1). No se ha registrado la PCO2 transcutánea. La duración de la monitorización fue de 2 h, se efectuó en posición de decúbito supino e incluyó dos ciclos de sueño (sueño activo-sueño tranquilo). Iniciamos el registro durante la toma alimentaria para observar si se efectuaba con normalidad o si por el contrario se producía atragantamiento, regurgitación, succión defectuosa, bradicardia y desaturaciones de oxígeno.
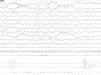
Figura 1.Registro polisomnográfico (30 s) de un prematuro nacido a las 34 semanas de edad gestacional, efectuado a las 3 semanas de vida, EC: 37 semanas, durante una fase de sueño tranquilo. El EEG muestra un patrón de actividad discontinua, ausencia de movimientos oculares rápidos, EMG submentoniano con escasa actividad, respiración regular y SaO2 del 98 %. El registro es normal. Montaje: EEG (11 canales, derivaciones bipolares); oculogramas derecho e izquierdo (EOG1 y EOG2); ronquido (RES1); flujo nasal registrado con cánulas (RES2); esfuerzo abdominal (RES3) y SaO2. Sensibilidad = 10 mV/mm. Filtro de red = 50 Hz.
Con los datos obtenidos se realizó una estadística descriptiva mediante el programa SPSS 12.0 para Windows.
Resultados
El número de niños estudiados fue de 31, de los que el 68 % eran de género masculino, con una edad gestacional media de 27,8 semanas (23-31 semanas) y un peso medio al nacimiento de 1.158 g (580-1.790 g).
La indicación de realización de VPSG en todos los prematuros menores de 1.800 g fue la existencia de apneas y desaturaciones de oxígeno durante las tomas alimentarias y/o durante el sueño (fig. 2).
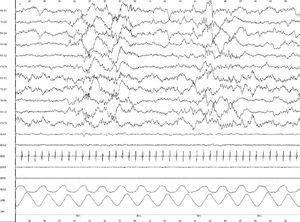
Figura 2.Registro polisomnográfico (30 s) de un bebé prematuro que muestra una apnea central de 30 s de duración, durante una fase de sueño tranquilo, que se acompaña de una bradicardia marcada y una desaturación de O2 del 72 %, que provoca una activación en el EEG con una desincronización de la electrogénesis cerebral. Montaje: EEG (11 canales, derivaciones bipolares); oculograma horizontal (EOG); EMG submentoniano; flujo nasal registrado con cánulas (RES2); esfuerzo toracoabdominal (ABD) y SaO2. Sensibilidad = 10mV/mm. Filtro de red = 50 Hz.
Se analizaron las diferentes patologías asociadas que presentaban los prematuros. La más frecuente fue enfermedad de membrana hialina en el 68 % de los casos, seguida de sepsis neonatal en un 58 %, hemorragia intraventricular en un 52 % (grado III en un 4 %, grado II en otro 4 % y grado I en un 75 %), y displasia broncopulmonar en un 45 % de los prematuros evaluados. Todos los prematuros que desarrollaron enfermedad pulmonar crónica de la prematuridad tenían una edad gestacional de entre 25 y 27 semanas. Otras enfermedades asociadas, halladas en menor número de casos, fueron: ictericia, anemia multifactorial, ductus arterioso persistente, enterocolitis necrosante, neumotórax y laringomalacia (figs. 3 y 4).
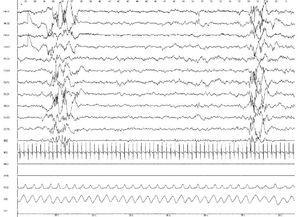
Figura 3.Registro polisomnográfico (30 s) de un prematuro nacido a las 28 semanas de edad gestacional, efectuado a las 6 semanas de vida (EC: 34 semanas) durante una fase de sueño tranquilo. El EEG muestra un patrón de actividad discontinua, ausencia de movimientos oculares rápidos en el EOG, EMG submentoniano inactivo, respiración regular y SaO2 del 96 %. El registro es inmaduro, aunque sin anomalías, para la edad corregida. Montaje: igual que en la figura 2.
Figura 4.Registro polisomnográfico (30 s) del mismo bebé de la figura 3, durante una fase de sueño activo. El EEG muestra un patrón de actividad continua y en el EOG se observan movimientos oculares rápidos. Se aprecia una apnea obstructiva caracterizada por una ausencia de flujo nasobucal (en RES1 y RES2) y un esfuerzo abdominal in crescendo (en ABD). La AO, de 11 s, se acompaña de una bradicardia (véase ECG), de una desaturación de O2 del 99 % al 76 % y de una activación en el EEG (desincronización), y una pequeña sacudida muscular (véase EMG1). La AO se sigue de una pausa respiratoria central de 8 s de duración. Este bebé presentaba una laringomalacia. Montaje: igual que en las figuras 2 y 3.
Fue revisado el tratamiento que habían recibido durante su ingreso, y se halló que el 97 % habían sido tratados con teofilina, y el 65 % había precisado ventilación mecánica, mientras que el 90 % necesitó oxigenoterapia.
En todos los neonatos estudiados se evaluó la presencia de RGE, por ser una patología que frecuentemente se asocia a pausas respiratorias. El 35 % de los pretérminos de peso inferior a 1.800 g presentaba esta alteración. La monitorización de la pH-metría se realizó independientemente de la VPSG, ya que la cánula nasogástrica impide el colapso hipofaríngeo en el caso de la existencia de apneas obstructivas 8.
Analizamos también los resultados de la VPSG y se detectaron alteraciones cardiorrespiratorias (bradicardias, desaturaciones de oxígeno o ambas) en el 65 % de los prematuros estudiados.
El patrón de sueño fue anormal en el 6 % de los pacientes evaluados. Consideramos patrón de sueño anormal cuando la cantidad de sueño está disminuida por despertares frecuentes, o bien la latencia del sueño es muy prolongada debido a llanto e irritabilidad como consecuencia de gases, cólicos, etc. Por último, también cuando el sueño se inicia con una fase de sueño tranquilo en vez de sueño activo.
El registro EEG era inmaduro para la edad gestacional corregida en el 32 % de los casos. Se hallaron además, alteraciones en el trazado EEG (asimetrías interhemisféricas, presencia de puntas, existencia de ondas lentas, hipoactividad bioeléctrica cerebral) en el 13 % de los neonatos estudiados, y en el 3 % el registro EEG era inmaduro para su EC además de presentar anomalías (fig. 3).
En 3 bebés fue necesario realizar la VPSG con aporte de oxígeno, lo que nos impidió registrar el flujo aéreo nasobucal ya que no pudimos insertar en los orificios nasales una doble cánula.
En el 69 % de los casos se prescribió una monitorización domiciliaria, por alteraciones cardiorrespiratorias graves detectadas en la VPSG. El 23 % precisó oxigenoterapia domiciliaria.
En su evolución, 4 casos monitorizados adecuadamente (12,9 %) reingresan en varias ocasiones por apneas.
Discusión
Desde hace años venimos realizando registros de VPSG en neonatos prematuros con apneas, durante su hospitalización en Neonatología, normalmente cuando alcanzan las 35-38 semanas de EC y antes del alta hospitalaria. Es un método útil e inocuo, para identificar a aquellos bebés con riesgo elevado de padecer apneas en su domicilio 3,5,9. A partir de la semana 43-44 de EC, la incidencia de alteraciones cardiorrespiratorias en neonatos pretérmino no excede significativamente de las del neonato a término 10.
Otros estudios, encuentran que las apneas/bradicardias del prematuro frecuentemente persisten por encima de las 36 semanas de EC, en los nacidos entre las semanas 24 y 28 de EG, lo que explican como secundario a la mayor incidencia de enfermedad pulmonar crónica en los neonatos de menor EG 12. En nuestro trabajo, hemos hallado que un 45 % de los neonatos estudiados, asociaban apneas y enfermedad pulmonar crónica de la prematuridad, y todos tenían una EG comprendida entre las 25 y 27 semanas.
La VPSG ha mostrado en nuestros casos una frecuencia elevada de alteraciones en el registro EEG, de la maduración cerebral y un patrón de sueño anormal. También se han registrado alteraciones cardiorrespiratorias graves: apneas (centrales, obstructivas y mixtas) con bradicardia concomitante, y desaturaciones de oxígeno, acompañadas o no, de despertamiento en el EEG (fig. 4).
Científicamente no existen estudios que demuestren la eficacia de un monitor domiciliario en estos bebés prematuros, aunque su indicación se plantea en algunos casos como una alternativa a una hospitalización muy prolongada 3,5. La duración de la monitorización dependerá de los datos epidemiológicos, hoy por hoy, inexistentes. Desde hace años se sabe que la apnea de prematuridad no es un factor de riesgo independiente, para el síndrome de la muerte súbita del lactante (SMSL) 13.
La VPSG en neonatos prematuros 14 y lactantes 10 no tiene un valor predictivo para el SMSL, en futuras víctimas y en hermanos de bebés fallecidos por esta causa. Sin embargo, la información obtenida es importante para evaluar la normalidad del EEG, la estructura y organización del sueño en relación con la EC (criterios de maduración cerebral) y para la detección de episodios cardiorrespiratorios anormales: apneas, arritmias cardíacas e hipoxemia. Además, el registro de la respiración que utilizamos (cánulas) nos permite distinguir entre los 3 tipos de apneas: central, obstructiva y mixta, además de la respiración periódica. Esta información tiene un indudable valor para el pronóstico y para la elección del tratamiento: farmacológico (metilxantinas), quirúrgico, ventilación no invasiva.
Aunque existe una gran controversia, tampoco la monitorización domiciliaria parece eficaz en la prevención del SMSL 5,14,15. Nos parecen interesantes las conclusiones del estudio del grupo para la Evaluación de la Monitorización Domiciliaria (CHIME), indicando que las alteraciones cardiorrespiratorias graves son frecuentes, aunque solamente las observadas en neonatos prematuros hasta la semana 43 de EC 11. Este grupo, se basa en miles de horas de monitorización ambulatoria, en una población de 1.079 lactantes (clasificados como bebés a término sanos y 6 grupos distintos de lactantes con riesgo para el SMSL). El estudio se realiza en los primeros 6 meses de vida, con monitores cardiorrespiratorios, mediante técnica de pletismografía respiratoria inductiva, que detecta apneas centrales y obstructivas. Concluyen en la necesidad de diseñar nuevos monitores, ya que la mayor parte de los episodios graves registrados son de naturaleza obstructiva y los monitores comercializados no se basan en esta técnica, y, por tanto, no detectan apneas obstructivas.
Pese a las importantes limitaciones mencionadas: falta de estudios epidemiológicos y monitores insuficientes, existen grupos de trabajo que defienden a ultranza la monitorización domiciliaria, basándose en que las apneas/ bradicardias del prematuro aparecen con mayor frecuencia en el primer mes después del alta y deben ser detectadas 17.
Por ello, y a pesar de las discrepancias en torno al tema, a todos los bebés con alteraciones cardiorrespiratorias en la VPSG, se les prescribió monitorización domiciliaria y seguimiento por la Unidad de Enfermedad Pulmonar Crónica de la Prematuridad. La detección de estas alteraciones permite la prevención de la morbilidad de este grupo de pacientes. Sólo 4 (12,9 %) precisaron reingreso por apneas. La decisión de la monitorización fue debatida con los padres, haciéndoles ver los pros y los contras. También se les instruyó adecuadamente en el uso del monitor y en la evaluación de las falsas alarmas. Estas actuaciones van encaminadas a mejorar la calidad de vida de estos bebés y sus familias, que presentan un hospitalismo exagerado y problemas psicosociales asociados en muchas ocasiones.
Queremos resaltar, pese a las limitaciones de nuestro estudio, la importancia de realizar VPSG con una metodología adecuada, en recién nacidos pretérmino de menos de 1.800 g, con alteraciones cardiorrespiratorias y/o neurológicas, para detectar alteraciones EEG, de la maduración cerebral, y de la respiración en relación con el sueño. Esta información tiene valor pronóstico y es importante para orientar el tratamiento. No menos importante es el seguimiento evolutivo de estos casos, tanto clínicamente como con controles por VPSG a lo largo del primer año de vida.
Serían necesarios más estudios sistemáticos y controlados, para valorar si los neonatos prematuros con alteraciones en la VPSG, que se van de alta con monitorización domiciliaria, presentan más incidencia que el resto de la población de SMSL o episodios aparentemente letales. De momento y con los datos disponibles, no podemos asegurar que la monitorización ambulatoria ayude a prevenir estos episodios.
Correspondencia:
Dra. R. Peraíta Adrados.
Unidad de Sueño y Epilepsia. Neurofisiología Clínica.
Hospital General Universitario Gregorio Marañón.
Dr. Esquerdo, 46. 28007Madrid. España.
Correo electrónico: mperaita.hgugm@salud.madrid.org
Recibido en marzo de 2005.
Aceptado para su publicación en junio de 2006.