Introducción
El síndrome de apneas-hipopneas del sueño (SAHS) forma parte de los trastornos respiratorios relacionados con el sueño y es una entidad relativamente frecuente en niños. La prevalencia se estima en el 1-3 % en población general infantil con una distribución similar entre niños y niñas 1. Es más frecuente entre los 2 y 6 años, por el abundante tejido linfoide de la vía respiratoria superior característico de la edad, con relación al diámetro de la vía respiratoria 2.
La polisomnografía (PSG) es el método de referencia para el diagnóstico del SAHS en la infancia; sin embargo, dada la dificultad técnica y económica para realizarla en muchos centros hospitalarios, han surgido nuevas alternativas diagnósticas 3,4. La poligrafía respiratoria (PR), ampliamente validada en adultos y pendiente de validar en niños respecto a la PSG, es una de las técnicas alternativas más utilizadas 5. Su principal desventaja, respecto a la PSG, es que no realiza estudio neurofisiológico ni estadiaje del sueño. Sin embargo, a pesar de los falsos negativos de la prueba y la posibilidad de infravalorar la gravedad del SAHS, se trata de una técnica de detección adecuada para el diagnóstico del síndrome de apneas-hipopneas obstructivas del sueño (SAHOS) en la infancia 6,7.
Se están realizando estudios, mediante PR domiciliaria (PRD), en niños con sospecha clínica de SAHOS con resultados concordantes con los obtenidos por PR hospitalaria y PSG (el 75 % de acuerdo respecto a la PSG y un área bajo la curva ROC entre 0,84 y 0,89) 8-10.
El objetivo del estudio ha sido analizar en una muestra de niños y niñas remitidos a consultas externas de Neumología Infantil por sospecha de apneas del sueño, ronquidos o ambos, la rentabilidad de la PRD en el diagnóstico de SAHOS.
Material y métodos
Estudio retrospectivo de una muestra de niños y niñas, remitidos de Otorrinolaringología, Neumología Infantil y Atención Primaria por sospecha de apneas del sueño, ronquidos o ambos, para realizar PR del sueño, entre febrero de 2000 y enero de 2006. Por cada niño al que se le realizó PRD, se incluyeron de forma consecutiva 2 niños (misma edad ± 1 año) con PR hospitalaria (PRH).
Los criterios de selección de los sujetos de la muestra a los que se les realizó la PRD fueron la edad (≥ 4 años) y el entorno sociofamiliar (adecuado para poder entender y realizar la prueba correctamente en el domicilio por parte de los padres).
Se ha realizado anamnesis detallada y exploración física estandarizada en todos los sujetos a estudio. Así mismo, se practicó radiografía de tórax, radiografía de cavum y PR del sueño en todos los casos mediante polígrafo ApnoeScreen Pro®, de 21:00 a 7:00 h, con una duración media de 7 h. Se ha estudiado el flujo oronasal (termistor nasobucal), el esfuerzo torácico y esfuerzo abdominal (sensores piezoeléctricos), la saturación de oxígeno mediante pulsioximetría (SpxO2), la frecuencia cardíaca por onda de pulso, la posición corporal, el ronquido interno y la actividad muscular. La lectura final se llevó a cabo mediante análisis manual diferido por observador único, durante todo el período del estudio.
El día previo a la realización de la PRD, la enfermera responsable de los estudios de sueño de la Unidad de Neumología Infantil explica a los padres la manera correcta de realizar la prueba, hasta que se asegura de que han entendido el proceso y les entrega el polígrafo y un manual resumido con esquemas, que éstos devuelven tras la realización de la prueba. La PRD ha sido realizada en su domicilio con el concurso de los padres, exclusivamente.
Se ha considerado válida la PRD, si el tiempo de registro válido ha sido superior a 3 h, considerando registro válido el que se obtiene a partir del tiempo estimado sin artefactos (CEST; estimated sleep time without movement or artifactual/uninterpretable periods). Si la señal obtenida mediante el polígrafo presenta artefactos o períodos no interpretables superiores a 5 min, se descuenta del período del tiempo total medido y se obtiene así el tiempo corregido o tiempo total estimado 11.
Se han analizado las variables cualitativas siguientes: lugar (hospital, domicilio), resultado de la PR (no válido, SAHS leve, moderado, grave o normalidad), sexo, motivo de consulta, procedencia, exploración otorrinolaringológica (ORL) (hipertrofia amigdalar, adenoidea, adenoamigdalar o normalidad) y tratamiento. Las variables cuantitativas han sido la edad, número total de apneas (N.º A), número total de hipopneas (N.º H), índice de apneas por hora (IA/h), índice de hipopneas por hora (IH/h), índice de apneas-hipopneas por hora (IAH/h), SpxO2 medio y mínimo, número de ronquidos (N.º R) e índice de ronquidos por hora (IR/h).
Se ha realizado análisis estadístico mediante test de chi cuadrado de Pearson, para estudiar la relación entre la validez de PR, sexo, motivo de consulta, procedencia, exploración ORL, tratamiento y lugar de realización de la PR. Así mismo, se ha utilizado la t Student para analizar la relación entre edad, N.º A, N.º H, IAH/h, SpxO2 y lugar de realización de la PR.
Se ha definido apnea obstructiva como reducción de la señal de flujo aéreo oronasal mayor al 90 % con esfuerzo respiratorio continuo, hipoxemia mayor o igual al 4 % y duración mayor a 2 ciclos respiratorios. La hipopnea obstructiva se ha definido como la disminución del flujo aéreo mayor del 50 % (medida por termistor nasobucal), hipoxemia y duración mayor a 2 ciclos respiratorios.
A pesar de la falta de consenso y un estudio reciente realizado en niños por Uliel et al con publicación de valores de referencia de normalidad, se ha considerado SAHS leve, un IAH/h comprendido entre 3 y 5; SAHS moderado un IAH/h entre 6 y 9, y SAHS grave, un IAH/h ≥ 10 12-14.
Resultados
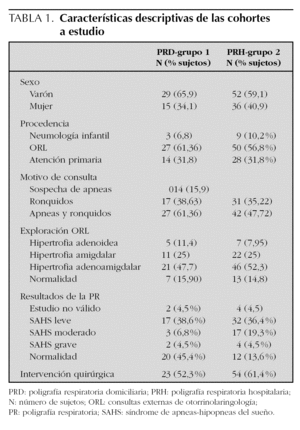
Se ha analizado una cohorte constituida por 132 pacientes estudiados con PR del sueño, 44 de ellos (33,3 %) mediante PRD (grupo 1) y 88 (66,6 %) mediante PRH (grupo 2).
En el grupo 1, se estimaron estudios no válidos 2 (4,5 %), SAHS leve 17 (38,6 %), moderado 3 (6,8 %), grave 2 (4,5 %) y fueron estudios normales 20 (45,4 %). La edad media fue de 8,3 años (desviación estándar [DE] 3,02), distribuidos en 29 niños (65,9 %) y 15 niñas (34 %). Consultaron por ronquido 17 pacientes (38,6 %) y por ronquido y apneas 27 (61,4 %). Fueron remitidos tres de ellos (6,8 %) desde consultas externas de Neumología Infantil, 27 (61,4 %) desde consultas externas de ORL y 14 (31,8 %) desde Atención Primaria. En la exploración física se constató hipertrofia adenoidea en 5 casos (11,4 %), amigdalar en 11 (25 %) y adenoamigdalar en 21 (47,7 %) (tabla 1). Los resultados de la PRD en medias y DE fueron: N.º A 15,88 (30,8), N.º H 9,02 (8,6), IA/h 2,21 (4,1), IH/h 1,25 (1,2), IAH/h 3,4 (4,3), SpxO2 media 97,3 (1,8), SpxO2 mínima 87,7 (10,3), N.º R 277 (468,5) e IR/h 17,6 (11,8).
En el grupo 2 fueron estudios no válidos 4 (4,5 %), SAHOS leve 32 (36,4 %), moderado 17 (19,3 %), grave 4 (4,5 %) y normal 31 (35,2 %). La edad media fue de 7,4 años (DE 3), distribuida en 52 niños (59 %) y 36 niñas (40,9 %). Consultaron por sospecha clínica de apneas 14 (15,9 %), por ronquidos 31 (35,2 %) y ronquido y apneas 42 (47,7 %). Fueron remitidos desde Neumología Infantil 9 (10,2 %), consultas de ORL 50 (56,8 %) y 28 (31,8 %) de Atención Primaria. A la exploración física presentaron hipertrofia adenoidea 7 pacientes (7,9 %), amigdalar 22 (25 %) y adenoamigdalar 46 (52,2 %) (tabla 1). Los resultados de la PRH fueron: N.º A 18,9 (28,2), N.º H 13,7 (17,4), IA/h 2,5 (3,5), IH/h 1,9 (2,5), IAH/h 4,45 (5,4), SpxO2 media 96,8 (1,8), SpxO2 mínima 87 (11), N.º R 249,8 (484,8) e IR/h 12,3 (7,9). Se realizó intervención quirúrgica (adenoamigdalectomía) en 23 pacientes (52,3 %) en los que se realizó estudio domiciliario y en 54 pacientes (61,4 %) en los que se realizó estudio hospitalario.
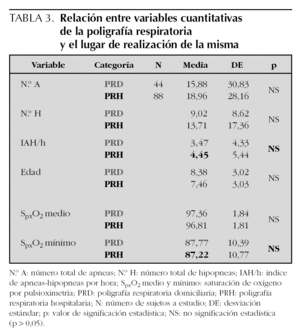
No se han encontrado diferencias estadísticamente significativas entre validez de la PR, sexo, motivo de consulta, procedencia, exploración ORL y lugar de realización de la prueba (tabla 2). Así mismo, tampoco se han encontrado diferencias significativas entre edad, N.º A, N.º H, IAH/h, SpxO2 y lugar de realización de la PR (tabla 3).
Discusión
El SAHS es una entidad frecuente en niños y en adultos, en quienes alcanza una prevalencia del 1-3 y 2-4 %, respectivamente 15. En población infantil, el grupo de edad con mayor prevalencia es el preescolar. Sin embargo, el incremento de la obesidad infantil ofrece un nuevo grupo de riesgo, el del adolescente o adulto joven, cuyo patrón de enfermedad recordaría al adulto 16.
La clínica del SAHS en la infancia difiere respecto a la época adulta. Es característico el ronquido, la hipersudoración, la enuresis y en ocasiones el retraso ponderoestatural por disminución nocturna de secreción de hormona de crecimiento (GH), reflejada por disminución de insulina-like growth factor-I (IGF-I), principal mediador de GH, y disminución de IGF-I binding protein 3 (IGFBP-3), proteína transportadora dependiente de GH 17. Así mismo, el sueño no reparador produce problemas de comportamiento, como hiperactividad y déficit de atención, problemas de relación social y disminución de rendimiento escolar. Estos déficit neurocognitivos se producen quizá por la cronicidad del SAHS en una época de desarrollo neurológico importante, como es la primera década de la vida 18,19. La cronicidad de la hipoxemia intermitente y la fragmentación ocasional del sueño activan mecanismos inflamatorios como el de la proteína C reactiva, la cual se ha asociado recientemente con el IAH/h, saturación media de oxígeno y número de microdespertares nocturnos. La magnitud del proceso inflamatorio puede desarrollar alteraciones cardiovasculares o neurocognitivas en los niños afectados 20.
Debido al importante impacto clínico y epidemiológico del SAHS en nuestro medio, resulta imprescindible poder realizar un diagnóstico precoz y fiable, con el fin de instaurar un tratamiento temprano y poder evitar o disminuir las complicaciones 21.
La PSG es el método de referencia para el diagnóstico del SAHS en la infancia; sin embargo, como ya hemos comentado, existen dificultades técnicas y económicas para realizarla 22. La principal ventaja de la PSG respecto a otras técnicas diagnósticas es que, además del estudio de las variables cardiorrespiratorias (flujo oronasal, saturación de oxígeno [SaO2], capnograma y PetCO2, ronquido, esfuerzo toracoabdominal y posición corporal), realiza estudio neurofisiológico y estadiaje del sueño (electroencefalograma, electrooculograma y electromiograma). Será, por tanto, capaz de diagnosticar episodios de hipoventilación mantenida que no cumplan criterios de apnea, las apneas centrales y los microdespertares eléctricos o arousals, a pesar de que los valores de normalidad en niños, no están todavía bien definidos. Así mismo, la PSG será capaz de diagnosticar el síndrome de resistencia elevada de la vía respiratoria superior, que a pesar de ser de incidencia desconocida, parece ser incluso más frecuente que el SAHOS en niños. Los pacientes afectados presentan una obstrucción parcial de la vía respiratoria superior que ocasiona episodios repetidos de incremento del esfuerzo respiratorio, con microdespertares eléctricos posteriores y reapertura de la vía aérea. El patrón del sueño se altera, sin embargo, no presentan apneas, hipopneas, desaturaciones ni alteración del intercambio gaseoso en la PSG, por lo que la clínica que presentan parece ser consecuencia de los microdespertares eléctricos y la desestructuración del sueño posterior 23,24.
Una de las alternativas diagnósticas utilizadas en nuestro medio es la PR, en la que se monitorizan durante el sueño los parámetros cardiorrespiratorios (flujo aéreo oronasal, SaO2, ronquido, frecuencia cardíaca, esfuerzo respiratorio toracoabdominal y posición corporal), excluyendo del estudio las variables neurofisiológicas. Se trata de una técnica validada en adultos para el diagnóstico del SAHS (sensibilidad del 97 % y especificidad del 90,0 %) y pendiente de validación en niños frente a PSG. La PR no realiza estadiaje del sueño y, por tanto, no puede estimar la cantidad y calidad del mismo, por lo que el número de episodios se divide por el tiempo de registro en cama y no por número de horas de sueño. Por otro lado, al no detectar los microdespertares electroencefalográficos no permite diagnosticar el síndrome de resistencia aumentada de la vía aérea superior, si bien algunos estudios han relacionado la presencia de los microdespertares con otras variables, como el retraso en la onda de pulso (pulse transit time, PTT), el aplanamiento del asa del flujo inspiratorio o la disminución de la amplitud de las bandas seguido de una hiperventilación 25,26. Así mismo, infradiagnostica algunos de los episodios de hipopnea y, por tanto, la PR puede infravalorar la gravedad del SAHS. Si el estudio con PR resulta negativo y la sospecha clínica es alta, se recomienda la realización de estudio completo mediante PSG, debido a los falsos negativos de la prueba. Sin embargo, a pesar de la menor precisión diagnóstica respecto a la PSG, se considera una técnica de detección adecuada para el estudio del SAHS en la infancia, que permite abordar mayor número de pacientes y mejorar, por tanto, el grado de salud de la población 27-29.
Recientemente, se están comercializando multitud de polígrafos, algunos de ellos portátiles, que permiten su uso en el domicilio del paciente. Algunos organismos internacionales (American Thoracic Society, American College of Chest Physicians y American Association of Sleep Medicine) han analizado los estudios clínicos disponibles sobre el uso de dispositivos portátiles y encuentran algunas evidencias sobre su utilidad tanto para apoyar como para descartar el diagnóstico de SAHS 30-32. Moss et al 11, estudiaron mediante PR domiciliaria 54 niños con edad media de 10 años, y obtuvieron más de 4 h de señal interpretable en el 89 % de los casos. Concluyeron, en concordancia con otros autores, que la PRD era una técnica diagnóstica válida para el diagnóstico de SAHOS en niños mayores o escolares, y son necesarios más estudios para analizar su rentabilidad en preescolares, en quienes el SAHOS tiene mayor prevalencia.
Además de los numerosos dispositivos portátiles disponibles, existen diferentes formas de realizarlo, con técnico en el domicilio o siendo el propio paciente o los padres, quien recoge el polígrafo, lo instala y lo devuelve al día siguiente, que sería quizás el método más adecuado y rentable. Todo esto hace muy difícil la validación de los dispositivos y las metodologías, y a pesar de que los estudios llevados a cabo hasta la actualidad sugieren que los resultados de la PRD serían equiparables a los obtenidos por PRH, el Grupo Español del Sueño (GES) recomienda en el último Consenso Nacional sobre el SAHS, la valoración coste-efectividad individualizada en cada centro hospitalario de su PRD.
Recientemente, se han diseñado sistemas de PR monocanal que identifican el episodio directamente y no a través de la saturación transcutánea de oxígeno y que llevan además un transductor de presión unido a una cánula nasal o bien emplean termistores desechables. Se trataría, por tanto, de dispositivos portátiles de fácil manejo para personal no experto, lo que facilitaría enormemente los estudios mediante PRD. Sin embargo, no han sido todavía adecuadamente validados 33,34.
En este sentido, hemos querido analizar los resultados obtenidos mediante PRD y PRH en una muestra de niños y niñas de entre 3 y 14 años (media de edad de 7,8 años), remitidos desde consultas externas de ORL, Neumología Infantil y Atención Primaria por sospecha clínica de apneas del sueño, ronquido o ambos. Los 2 grupos en estudio en los que se realizó la PR tanto domiciliaria como hospitalaria fueron homogéneos, con sujetos de características clínicas similares y grados de SAHS equiparables (tablas 1 y 3). En concordancia con otros estudios en la literatura médica, en nuestra muestra, la PR realizada en el domicilio del paciente, ha tenido la misma rentabilidad diagnóstica que la PR realizada en el hospital. Así mismo, poder analizar el sueño en el propio domicilio ofrece la posibilidad de realizar un estudio más fisiológico y además, ofrece mayor rentabilidad económica, al eliminar el coste de hospitalización. Se trataría, por tanto, de una técnica diagnóstica válida y fiable para el diagnóstico de SAHOS en la infancia.
La mayor limitación de nuestro análisis ha sido quizá la edad de los sujetos a estudio, ya que, en su mayoría, los estudios en el domicilio y en el hospital fueron realizados en niños mayores (media de edad de 8,3 y 7,4 años, respectivamente). Debemos recordar que la mayor prevalencia de SAHOS en la infancia está entre los 2 y 6 años, por lo que sería de gran interés continuar el estudio de la rentabilidad de la PRD en este grupo de edad.
Correspondencia: Dra. O. Sardón Prado.
Unidad de Neumología Infantil. Hospital Donostia.
Avda. Dr. Beguiristain, s/n. 20014 San Sebastián. España.
Correo electrónico: osardon@chdo.osakidetza.net
Recibido en junio de 2006.
Aceptado para su publicación en junio de 2006.