Introducción
El estudio de la función pulmonar ya forma parte de las exploraciones habitualmente utilizadas por los pediatras españoles. Con una adecuada realización técnica, la interpretación de sus resultados puede ser de gran ayuda especialmente en el asma, pero también en otras patologías respiratorias.
Desde hace más de 3 décadas se han venido publicando y actualizando las directrices para estandarizar su práctica. Recientemente un grupo de expertos de la American Thoracic Society (ATS) y la European Respiratory Society (ERS) ha realizado una nueva actualización que ha sido publicada recientemente en el European Respiratory Journal.
El grupo de Técnicas de la Sociedad Española de Neumología pediátrica (SENP) se propuso elaborar un protocolo de estudio de la función pulmonar en el paciente colaborador, adaptado a pediatría y que incorporara los últimos estándares acordados. Fruto de ello y en base a su extensión se publicará en 2 partes en las que se abordarán de forma clara y sencilla las recomendaciones sobre la práctica de estudio de la función pulmonar básica (espirometría y prueba broncodilatadora) y el estudio de la hiperreactividad bronquial mediante pruebas de provocación inespecífica.
Al igual que cualquier estándar recomendado, éste no es perfecto, pero refleja los conocimientos actuales en la materia. Por lo tanto debería usarse como guía de buenas prácticas clínicas hasta que se produzcan cambios basados en nuevas evidencias científicas.
Espirometría
Introducción
La exploración de la función respiratoria es una herramienta fundamental en el estudio de los pacientes con problemas neumológicos. Permite detectar alteraciones fisiopatológicas, valorar la gravedad de un proceso, su evolución y la respuesta al tratamiento. Entre las distintas técnicas disponibles, la espirometría es el pilar básico, por su sencillez, bajo coste y reproducibilidad. Valora la función ventilatoria midiendo el volumen que se es capaz de exhalar o inhalar en valor absoluto, en función del tiempo o midiendo directamente el flujo. La nomenclatura de los distintos volúmenes, capacidades y flujos se muestran en las tablas 1 y 2.
La espirometría puede realizarse mediante una espiración máxima no forzada (simple) o mediante una espiración forzada. Para la realización de la espirometría forzada hay que partir de una inspiración máxima (capacidad pulmonar total) para posteriormente exhalar de forma forzada y lo más rápidamente posible todo el aire, hasta llegar al volumen residual. Generalmente esto se consigue con un tiempo espiratorio de 3-5 s, aunque puede ser incluso menor en niños pequeños. Los niños mayores de 5 años pueden realizar una espirometría de forma correcta, e incluso niños de 3 a 5 años si son entrenados adecuadamente.
Existen normativas de la ATS1 y la ERS2 para la estandarización de la espirometría. Recientemente se ha publicado una normativa conjunta en un intento de que se aplique de forma más generalizada3.
Aparataje
Para realizar una espirometría se dispone de espirómetros y neumotacógrafos. Los espirómetros miden el volumen de aire que es expulsado en función del tiempo, proporcionando una curva de volumen-tiempo. Pueden ser secos (recipiente hermético, con un sistema móvil de pistón o fuelle) o húmedos (cámara inmersa en un recipiente de agua) y se utilizan fundamentalmente como referencia para las señales de calibración.
Los neumotacógrafos o espirómetros de flujo miden inicialmente el flujo, que es integrado electrónicamente en volumen, y su relación con el tiempo. Proporcionan por tanto gráficas tanto de flujo-volumen como de volumen-tiempo. Existen varios tipos según el sistema que utilicen para la detección del flujo. El más conocido es el tipo Fleish (mide el flujo a partir de la relación entre la caída de presión espiratoria a uno y otro lado de una resistencia conocida). Existen otros de turbina (número de giros de una hélice), de malla, de alambre caliente y de ultrasonidos.
En todos los casos el aparato tiene que cumplir unos requisitos mínimos para su uso, entre otros, sencillez, portabilidad, capacidad de almacenamiento de al menos 6 maniobras, registro gráfico simultáneo de la curva flujo-volumen, valores de referencia para compararlos con los datos obtenidos, impresión numérica y gráfica. Las especificaciones mínimas sobre exactitud, precisión, rango, linealidad, resistencia, resolución de mínimo volumen detectable, calibración, etc., que deben cumplir los espirómetros y las recomendaciones sobre instrucción y ejecución de la maniobra, morfología de las curvas, control de la infección e interpretación de los resultados, han sido publicadas por la ERS y la ATS1-3.
Los espirómetros se deben calibrar a diario, con una jeringa de 3 l con un límite de ± 3 %, introduciendo de forma diaria la presión, temperatura y humedad ambiental para corregir de unidades ATPS (saturación de vapor de agua a temperatura ambiente) y BTPS (temperatura corporal, presión ambiental y saturación de vapor de agua). Se deben tomar medidas para controlar la infección y limpieza del equipo.
Técnica de realización
Para obtener una espirometría correcta es fundamental no sólo el equipamiento adecuado sino también la persona que la realiza, que debe tener adiestramiento en la técnica y estar habituada a trabajar con niños. El sitio donde se lleve a cabo la prueba debe ser tranquilo y adecuado a la edad, incluyendo juguetes o pósters que creen un entorno agradable para el niño. Previamente, se calibra el espirómetro (al inicio de cada sesión de espirometrías), y se introducen los datos del paciente (nombre, edad, altura, peso) y se interroga por el consumo de tabaco o medicamentos (tabla 3) así como la existencia de enfermedades previas. Se instruye y demuestra al niño de forma sencilla en qué consiste la prueba, animándole incluso cuando la realice de forma incorrecta, para conseguir ganar su confianza en pruebas posteriores. Los niños suelen aprender más rápido y sin miedo si ven cómo otros niños realizan la maniobra con normalidad, por lo que es aconsejable que el niño que va a realizar la espirometría por primera vez espere y vea cómo otros más antiguos y con experiencia la realizan. Tras colocar la boquilla en la boca, cogerla con los dientes y sellarla con los labios para evitar fugas, y tras colocar las pinzas nasales, puede respirar por la boca durante 1-2 min con el fin de que el niño se familiarice con el aparato.
La espirometría forzada consiste en realizar una inspiración rápida y completa, mantener el aire 1-2 s, e iniciar una espiración forzada enérgica que se continúa hasta el volumen residual. El técnico debe comprobar que existe una inspiración máxima, que la espiración se inicia de forma enérgica y que se continúa con el máximo esfuerzo. Sin embargo, en algunos pacientes asmáticos los flujos espiratorios forzados tras una inhalación máxima pueden ser menores (por relajación de las estructuras elásticas pulmonares) que tras inhalaciones menos intensas4. El final de la maniobra espiratoria no debe ser prematuro o con cierre de la glotis. La tos fundamentalmente en el primer segundo puede invalidar la prueba al afectar la medición del volumen espiratorio forzado en el primer segundo (FEV1), así como en el resto de la espiración si interfiere en la exactitud de las medidas. Hay que realizar un mínimo de tres maniobras aceptables y un máximo de ocho intentos. Se pueden obtener algunos datos de maniobras que no cumplan todos los requisitos, como por ejemplo el FEV1 de una espirometría finalizada precozmente. Aunque existen distintas normativas, en general se acepta elegir los mejores valores de capacidad vital forzada (FVC) y FEV1 obtenidos de cualquier maniobra y los mesoflujos de la mejor de las pruebas (> FEV1 + FVC). En algunos pacientes la medición de la capacidad vital no forzada puede proporcionar un denominador más apropiado para el cálculo del índice FEV1/FVC. Existen otras consideraciones técnicas que hay que tener en cuenta para que la prueba sea considerada correcta (tabla 4)3-6.
Recientemente se ha comprobado que sólo un 15 % de los niños de 5 a 19 años cumplen los criterios de tiempo de espiración forzada, y un 80 % los de reproducibilidad (diferencia entre las dos mejores FEV1 y FVC < 100 ml)7. La nueva propuesta pediátrica del grupo de Utrech plantea reducir el tiempo espiratorio forzado a más de un segundo para menores de 8 años (> 2 s en mayores de 8 años) y una diferencia entre los dos mejores FEV1 y FVC menor del 5 %8.
Estudio de los parámetros espirométricos
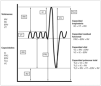
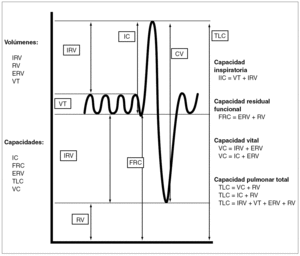
La espirometría valora la función ventilatoria, mediante la medición de volúmenes y flujos pulmonares. La espirometría simple consiste en la espiración máxima no forzada y permite medir los volúmenes y capacidades pulmonares estáticos mediante maniobras espiratorias lentas no dependientes del tiempo (fig. 1). Básicamente permite medir la capacidad vital y sus subdivisiones.
Figura 1. Volúmenes y capacidades pulmonares.
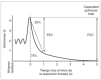
Curva volumen/tiempo
Muestra el tiempo en abscisas y el volumen en ordenadas (fig. 2). Permite estudiar los siguientes parámetros:
Figura 2.Curva volumen/tiempo.
1.FVC. Es el máximo aire que puede ser espirado de forma forzada tras una inspiración máxima, es decir, partiendo desde la capacidad pulmonar total. Es un indicador de la capacidad pulmonar y en los individuos normales sus valores son similares a los de la capacidad vital. Se encuentra disminuido en la patología restrictiva y en los casos moderados-graves de patología obstructiva.
2.FEV1 o VEMS. Es el volumen espirado en el primer segundo. Es el parámetro de función pulmonar de referencia en espirometría por su excelente reproducibilidad y especificidad, si bien es dependiente del esfuerzo. Mide el flujo de la vía aérea central y se correlaciona lineal e inversamente con el grado de obstrucción de la vía aérea. Se encuentra disminuido en la patología obstructiva y en menor grado en la restrictiva. En el diagnóstico es importante valorar su respuesta ante estímulos broncoconstrictores y broncodilatadores. Los niños muy pequeños pueden vaciar completamente sus pulmones en un segundo, por lo que se puede analizar el volumen espirado en menos de un segundo (p. ej., en el primer medio segundo o FEV0,5).
3.Cociente FEV1/FVC. Porcentaje de la capacidad vital que se espira en el primer segundo. En condiciones normales este porcentaje es del 80 %. Es un parámetro muy sensible de obstrucción bronquial, aunque puede ser normal en casos graves de obstrucción por disminución tanto del FEV1 como de la FVC. En los cuadros restrictivos también su valor es normal.
4.FEV1/VC (índice de Tiffeneau): Su valor normal es del 70-75 %. Puede ser distinto del cociente FEV1/FVC ya que la FVC puede ser algo menor por colapso dinámico de la vía aérea8.
5.FEF25-75 %. Flujo espiratorio forzado entre el 25 y el 75 % de la FVC (mesoflujos). Se mide en la parte central de la curva. Es un parámetro sensible y específico de obstrucción de las pequeñas vías aéreas y puede ser el único valor afectado. Sin embargo, es menos reproducible que el FEV1 y la FVC9, siendo los coeficientes de variación del 8 % para el FEF25-75 % y del 5 % para el FEV1 y la FVC10.
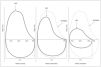
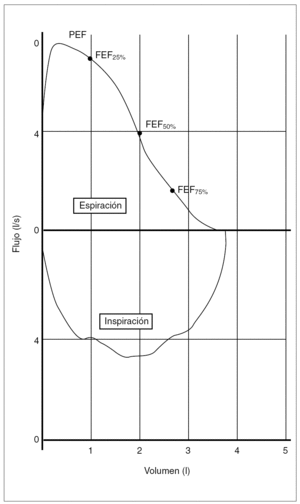
Curva flujo/volumen
Relaciona los flujos máximos y los volúmenes dinámicos (fig. 3). El niño debe realizar una inspiración máxima hasta la capacidad pulmonar total, insertar la boquilla en la boca y sin demora, realizar una espiración forzada completa, seguida por una inspiración máxima rápida. Ocasionalmente, la rama inspiratoria de la curva puede ser difícil de obtener en la misma maniobra tras la espiración forzada, por lo que se puede obtener una maniobra inspiratoria de forma aislada sin una maniobra espiratoria asociada. Un procedimiento alternativo consiste en poner inicialmente la boquilla en la boca, realizar una espiración lenta hasta el volumen residual, seguido de una inspiración lenta hasta la capacidad pulmonar total, y posteriormente realizar una espiración completa y rápida con el máximo esfuerzo hasta el volumen residual, seguido de una inspiración rápida y completa con el máximo esfuerzo hasta la capacidad pulmonar total. Este procedimiento obtiene medidas de la VC y de la FVC, pero es más complejo y no lo pueden realizar todos los equipos.
Figura 3.Curva flujo/volumen.
La rama espiratoria relaciona los flujos generados en la maniobra de FVC con el volumen exhalado durante la misma. El primer 30 % de esta rama espiratoria es esfuerzo dependiente, mientras que el resto no está en relación con el esfuerzo, sino que depende de la compresión dinámica de las vías aéreas8.
1.Pico espiratorio de flujo (PEF) o ápice del flujo espiratorio. Es el flujo espiratorio máximo durante una maniobra de FVC. También se puede medir con un medidor portátil.
2.FEF25 %, FEF50 %, FEF75 %. Son los flujos espiratorios máximos cuando el 25 o el 50 % de la FVC ha sido espirado. Esta denominación es preferible a la anteriormente utilizada (MEFX %) en relación al porcentaje de la FVC que quedaba por espirar3. Son parámetros independientes del esfuerzo y valoran especialmente la pequeña vía aérea. Cuando los valores son bajos, da lugar a una curva de forma cóncava característica de los cuadros obstructivos.
Interpretación de la espirometría
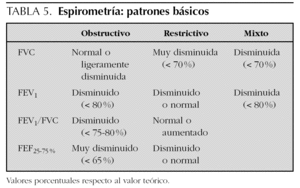
La valoración de la espirometría se puede realizar comparando los resultados de la misma con los valores teóricos de referencia (edad, género, peso, raza, y sobre todo, la talla), observando la morfología de la curva y considerando los cambios de los valores a lo largo del tiempo de seguimiento de la enfermedad. Existen diversos trabajos sobre los valores teóricos o de referencia en niños españoles11-14, europeos15 y americanos16. El resultado obtenido se expresa como porcentaje del teórico, siendo normal los valores iguales o mayores del 80 % para el FEV1 y la FVC y del 65 % para el FEF25-75 %.
Podemos identificar tres patrones básicos: obstructivo, restrictivo y mixto (tabla 5). Esta clasificación depende de la capacidad pulmonar total y de la relación entre sus componentes.
Así la capacidad vital está disminuida tanto en los procesos obstructivos como en los restrictivos, por lo que será el volumen residual el parámetro diferenciador.
Además, la alteración obstructiva, restrictiva o mixta de la función pulmonar se clasifica también según la intensidad en la que se afectan el FEV1 y la FCV, como leve (parámetros entre el 80 y el 65 % respecto al valor teórico), moderada (64-50 %) y grave (< 50 %).
1.Patrón obstructivo. Se caracteriza por una obstrucción de las vías aéreas desde la tráquea a los bronquiolos, como en el asma. Produce una limitación de la espiración disminuyendo fundamentalmente el FEV1 y por consiguiente la relación FEV1/FVC (< 0,75). La excepción sería en los casos graves donde este cociente puede ser normal por disminución del FEV1 y la FVC. Los mesoflujos (FEF50 %, FEF25-75 %) también pueden estar disminuidos originando una morfología de la curva característicamente cóncava y puede ser el único parámetro que se altere en los casos leves. El volumen residual se incrementa, lo que resulta en un aumento del cociente volumen residual/capacidad pulmonar total (RV/TLC).
2.Patrón restrictivo. Se produce por una disminución del tamaño del pulmón, de la caja torácica o por enfermedades neuromusculares. Cursa con una disminución del volumen pulmonar y se manifiesta con disminución marcada de la TLC, FVC y del RV, pero la relación FEV1/TLC es normal. La forma de la curva es normal pero más pequeña que la teórica.
3.Patrón mixto. Hay procesos que pueden cursar con ambos tipos de alteraciones ventilatorias, precisando técnicas más sofisticadas para completar el estudio funcional, medida de los volúmenes pulmonares estáticos, para delimitar el grado de alteración de cada componente.
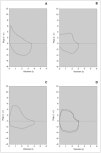
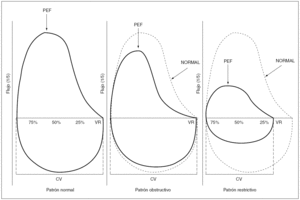
La forma de la curva permite distinguir no sólo el patrón obstructivo o restrictivo, sino también obstrucciones intratorácicas y extratorácicas, así como errores en la realización de la prueba (figs. 4, 5 y 6).
Figura 4.Curva flujo/volumen. Patrón normal, obstructivo y restrictivo.PEF: pico máximo de flujo; CV: capacidad vital.
Figura 5.Curvas flujo/volumen. A) Limitación al flujo aéreo.B)Obstrucción variable al flujo aéreo de la vía aérea intratorácica superior.C)Obstrucción variable al flujo aéreo de la vía aérea extratorácica superior.D)Obstrucción fija de la vía aérea superior.
Indicaciones
Las indicaciones principales de la espirometría son las siguientes17-23:
Diagnóstico
• Identificar la ausencia o presencia de enfermedad respiratoria.
• Valoración inicial del paciente con enfermedad pulmonar reconocida (tos, sibilancias, disnea, hemoptisis, etc.). La espirometría forzada y la radiografía de tórax constituyen dos pruebas complementarias básicas que hay que realizar en un paciente con enfermedad respiratoria. La espirometría nos va a permitir distinguir la limitación al flujo aéreo intratorácico y extratorácico, diferenciar la enfermedad obstructiva, restrictiva o mixta, así como cuantificar el grado de afectación respiratoria y efectuar estudios de hiperreactividad bronquial. Todo ello nos aportará una correcta evaluación inicial del paciente y nos servirá también de referencia en el control y la evolución de la enfermedad.
• Establecer el diagnóstico de asma y evaluar el grado de afectación pulmonar para clasificar correctamente la gravedad de la misma.
• Detección de patología respiratoria obstructiva en estadios subclínicos o asintomáticos (descenso de los mesoflujos espiratorios).
• Diagnosticar enfermedades intersticiales en estadios iniciales, cuando la radiografía de tórax aún es normal, y sin embargo la función pulmonar ya se encuentra alterada, aunque en estas enfermedades es necesario recurrir a técnicas más complejas para una evaluación completa.
• Detección y localización de estenosis de la vía aérea superior: la morfología de la curva flujo-volumen permite diferenciar la existencia de obstrucciones intratorácicas y extratorácicas.
• Valorar el impacto respiratorio de las enfermedades de otros órganos o sistemas.
• Tests de broncodilatación y provocación bronquial inespecífica o específica. Nos aportarán información sobre la hiperrespuesta bronquial acompañante y sus modificaciones con el tratamiento. En patologías de tipo obstructivo, como el asma bronquial, es importante conocer la respuesta del paciente a la inhalación de un broncodilatador. Los tests de broncoconstricción (ejercicio, metacolina, histamina, etc.) deben ser realizados en centros especializados, bajo la supervisión de médicos expertos y dotados de medios técnicos adecuados para resolver las posibles complicaciones que puedan surgir. El test más frecuentemente empleado en pediatría es el de broncoprovocación con ejercicio, bien mediante carrera libre, tapiz rodante o bicicleta ergométrica. Los tests de provocación bronquial serán expuestos ampliamente más adelante, como ya se ha comentado con anterioridad.
• Valoración de la función pulmonar prequirúrgica o pretrasplante.
Monitorización
• Evaluación de la respuesta terapéutica, para valorar la eficacia del tratamiento en procesos obstructivos, fundamentalmente en el asma bronquial, donde el parámetro espirométrico fundamental a valorar es el FEV1, para evaluar sus cambios por la medicación en cortos espacios de tiempo. En las enfermedades restrictivas deben monitorizarse la FVC o la VC, para controlar la eficacia terapéutica.
• Medir las posibles repercusiones de irritantes ambientales u ocupacionales.
• Valorar los efectos adversos de fármacos o tóxicos sobre la función pulmonar.
• Seguimiento del curso de diversas enfermedades respiratorias. En este sentido, la espirometría es la prueba más importante para monitorizar las enfermedades obstructivas, aunque obviamente, también es obligado su seguimiento en la patología restrictiva.
• Predecir la exacerbación. Anormalidades en la espirometría de forma mantenida y descensos del FEV1, ponen de manifiesto un deterioro y alertan sobre la posible aparición de una crisis aguda de asma.
• En el asma de control difícil, la espirometría es de gran ayuda en su manejo, pudiendo reducir su mortalidad.
• Para establecer un pronóstico.
Salud pública
• Estudios epidemiológicos en población sana.
• Evaluar los daños ocasionados por exposición a tóxicos, como: tabaco, contaminación, fármacos, etc.
• En ensayos clínicos farmacológicos.
Evaluación de discapacidades
• Debidas a enfermedades ambientales u ocupacionales.
• Producidas por accidentes.
• Valoración en programas de rehabilitación.
Por último, es importante conocer que para poder realizar correctamente una espirometría, el paciente ha de recibir en el momento de la cita, y por escrito, las siguientes recomendaciones35:
• Debe estar en ayunas al menos 2 h previas a la realización de la prueba.
• Antes de la espirometría deberán evitarse la comida abundante y las bebidas estimulantes como el café, colas, etc.
• No consumir alcohol al menos 4 h antes de la espirometría.
• Abstenerse de fumar, al menos durante 1 h antes de la misma.
• No realizar ejercicio vigoroso al menos 30 min antes de la técnica.
• No llevar ropas ajustadas que impidan una correcta movilidad torácica y abdominal.
• Controlar el tiempo previo en que el paciente ha tomado medicación que pueda interferir en los resultados de la prueba (tabla 3).
Contraindicaciones
Las contraindicaciones casi nunca son de tipo absoluto, y deben valorarse individualmente17-20,22,24. Hemos de considerar determinados cuadros clínicos que puedan alterar los resultados de la espirometría y posponer su realización hasta la normalización de dichas circunstancias, como son:
• Neumotórax.
• Enfermedad cardiovascular inestable.
• Haber transcurrido menos de un mes de haber padecido un infarto agudo de miocardio.
• Cardiopatías complejas y/o cianosantes.
• Aneurisma torácico, abdominal o cerebral.
• Hemoptisis reciente de origen desconocido.
• Traqueostomía.
• Cirugía cercana torácica, abdominal u ocular.
• Enfermedades intercurrentes.
• Dolor abdominal o torácico de cualquier etiología que pueda modificar una patología previa como aneurismas, desprendimiento de retina, etc.
• Dolor facial u oral exacerbado por pieza dentaria.
• Incontinencia por estrés.
• Demencia o estado confusional.
En pediatría, es de especial importancia considerar la falta de comprensión o colaboración del paciente para realizar correctamente las maniobras espirométricas, que pueden conducir por tanto a falsas interpretaciones de los resultados.
Complicaciones
Aunque la espirometría es un procedimiento seguro, en ocasiones puede dar lugar a complicaciones17,20,22,24, que generalmente son excepcionales en niños. La mayoría de estas complicaciones surgen por no contemplar adecuadamente las contraindicaciones que hemos comentado previamente.
Entre las complicaciones se han descrito: neumotórax, hipertensión intracraneal, síncope, dolor torácico, tos paroxística, broncoespasmo, hipoxia transitoria e infección nosocomial.
Control de la infección e higiene
Aunque no es frecuente, el equipo de espirometría puede tener el riesgo de ser transmisor de infección18,20,24-27. En el documento sobre la estandarización de los procedimientos espirométricos de la ATS están referidas las recomendaciones para evitar el riesgo de infección, y se basan fundamentalmente en la limpieza y el lavado de los componentes del espirómetro, teniendo especial precaución en los casos de tuberculosis o hemoptisis.
El objetivo del control de la infección es prevenir la transmisión de la misma a pacientes y personal sanitario durante la determinación de la función pulmonar. Este conjunto de recomendaciones se centra en el equipamiento usado para la realización de la espirometría, capacidad de difusión y volúmenes pulmonares. Los microorganismos pueden ser transmitidos por sondas de pulsioximetría y nebulizadores utilizados para la administración de broncodilatadores.
La infección puede transmitirse por contacto directo o indirecto:
1.Contacto directo. Enfermedades respiratorias, entéricas y sanguíneas. Aunque la transmisión por saliva del virus de la inmunodeficiencia humana (VIH) y hepatitis es rara, se convierte en una posibilidad cuando existen lesiones o sangrados en la cavidad oral.
Las superficies de contacto más contagiosas son las piezas bucales y la región proximal de las válvulas y los tubos.
2.Contacto indirecto. Tuberculosis, infecciones virales y oportunistas, así como neumonía nosocomial a través de los aerosoles.
Las superficies de contacto más contagiosas son las mismas que las descritas en el mecanismo directo.
Prevención
Transmisión a técnicos
La prevención de la transmisión de una infección a los técnicos expuestos a las superficies contaminadas del espirómetro, puede realizarse a través del lavado de manos apropiado entre pacientes y el uso de dispositivos de barrera como los guantes, sobre todo cuando el técnico presente heridas abiertas en las manos.
Contaminación
Para evitar la contaminación de las superficies de contacto del espirómetro, tales como piezas bucales, válvulas y tubos, éstas deben desinfectarse y esterilizarse regularmente. No se ha establecido aún la frecuencia adecuada de desinfección y esterilización.
Los fabricantes de los equipos recomiendan los métodos adecuados de limpieza y desinfección de los distintos aparatos, incluyendo también las sustancias químicas y las concentraciones adecuadas, así como las medidas de seguridad para los técnicos.
Espirómetros basados en volumen
En los espirómetros con técnica de circuito cerrado, deben descontaminarse los tubos y las piezas bucales entre pacientes. Cuando se usa circuito abierto sólo debe descontaminarse la parte del circuito que tiene contacto con el paciente (pieza bucal).
Tuberculosis
Para prevenir su transmisión se usa la filtración y descontaminación ultravioleta del aire.
Hemoptisis y lesiones orales
Los tubos y las válvulas deben ser descontaminados antes de reutilizarlos, y la superficie interna del espirómetro ha de ser descontaminada con desinfectantes efectivos contra agentes transmisibles por sangre.
Otras enfermedades transmisibles conocidas
Han de tomarse precauciones adicionales que incluyan:
1.Reservar el equipo con el propósito exclusivo de usarlo en pacientes infectados.
2.Utilizar el equipo el último día permitido antes de la desinfección.
3.Hacer la prueba en la habitación del paciente, con ventilación adecuada y apropiada protección del técnico.
Filtroson-linedesechables
Los filtros desechables pueden ser el método efectivo más barato para prevenir la contaminación del equipo.
La influencia de los filtros sobre la FVC y el FEV1 no está bien definida. Aunque se han determinado diferencias significativas entre medidas con y sin filtro para FVC, FEV1, resistencia de la vía aérea y conductancia, estas diferencias no se relacionan con los valores promedio de las medidas (salvo la conductancia), y los límites de conformidad están dentro del rango de la reproducibilidad individual de la mayoría de los índices.
El uso de los filtros no elimina la necesidad de limpieza regular y descontaminación del equipo.
Si se usan filtros on-line, el sistema de medida debe conocer las recomendaciones mínimas para la exactitud, precisión (reproducibilidad), resistencia al flujo y presión del aparato con el filtro instalado.
Los fabricantes han de diseñar equipos que puedan ser fácilmente desensamblados para la limpieza y desinfección, con instrucciones claras, así como filtros con evidencia documentada acerca de que no alteran los parámetros de la función pulmonar: VC, FVC, FEV1, PEF, TLC, DLCO, FEF25-75 %.
Nivel de riesgo de infección
El equipo de función pulmonar no ha sido directamente relacionado con la transmisión de infecciones, aunque hay evidencia indirecta de la misma durante la medición de la función pulmonar.
Existe un caso publicado de seroconversión tuberculínica tras utilizar el espirómetro previamente usado por un paciente con tuberculosis documentada. Del mismo modo, hay evidencia circunstancial de que el equipo de función pulmonar puede estar implicado en el aumento de la prevalencia de infecciones por Burkholderia cepacia en pacientes con fibrosis quística.
Se ha argumentado que pacientes inmunodeprimidos pueden requerir sólo una dosis infectiva relativamente baja de organismos oportunistas o patógenos comunes para desarrollar una infección. Sin embargo, no hay evidencia directa de que la prueba de función pulmonar rutinaria aumente el riesgo de infección en pacientes inmunodeprimidos.
Prueba broncodilatadora
Introducción
La prueba broncodilatadora debe ser una exploración habitual en cualquier laboratorio de función pulmonar. Entre otras razones para ello, recordemos que el asma (la patología crónica más frecuente durante la edad pediátrica) incluye en su definición la limitación al flujo aéreo intrapulmonar, parcial o totalmente reversible, espontáneamente o con medicación28. Por lo tanto, el estudio de esta reversibilidad tiene utilidad tanto en el diagnóstico como en los controles evolutivos de la enfermedad, por lo que se recomienda la incorporación rutinaria de la prueba de broncodilatación a la práctica de la espirometría forzada29.
Metodología
La prueba broncodilatadora consiste en realizar una espirometría forzada basal y repetir la misma, transcurrido un tiempo después (para la mayoría de autores, 10-20 min) de administrar una medicación broncodilatadora inhalada.
Antes de realizar la prueba broncodilatadora, debe llevarse a cabo la supresión de medicamentos que puedan interferir en la respuesta bronquial, como queda reflejado en la tabla 3. De esta manera, no sesgaremos el resultado de la prueba, pero si en la práctica clínica esto no fuera posible, sería necesario indicar que se ha realizado bajo la influencia de dichos fármacos, anotando la hora de su administración previa.
Fármacos, dosis y técnica de inhalación
Los fármacos de elección para realizar la prueba broncodilatadora son los agonistas β2-adrenérgicos de corta duración (salbutamol o terbutalina). El riesgo de la administración de agonistas β2-adrenérgicos con fines diagnósticos es mínimo. Se considerarán como riesgos relativos si el paciente presenta tirotoxicosis, insuficiencia cardíaca, hipertensión, diabetes mellitus o está bajo tratamiento con aminas simpaticomiméticas. Sólo en la enfermedad pulmonar crónica (EPC), como la fibrosis quística, se emplean los anticolinérgicos, por su eficacia, como medida de la respuesta broncodilatadora, practicándose la prueba 30 min después de su inhalación.
Las dosis administradas habitualmente son entre 200 y 400 μg de salbutamol mediante aerosol dosificador presurizado (MDI) y cámara espaciadora, o 500 μg de terbutalina en dispensador de polvo seco (DPI). Sin embargo, una revisión de las recomendaciones de los diferentes grupos de trabajo en neumología (ATS1, ERS2, etc.) no fijan las dosis de agonistas β2-adrenérgicos que deben utilizarse en la prueba broncodilatadora, y tampoco conocemos normativas pediátricas al respecto. La normativa SEPAR propone la administración de 0,2 mg de salbutamol en adultos29. Pero si en comparación, la fracción pulmonar disponible del broncodilatador en relación a la dosis dispensada en niños es mucho menor, parece lógico utilizar dosis más elevadas en éstos30. Así consideramos que una dosis de 0,4 mg de salbutamol inhalado mediante MDI y cámara espaciadora o 0,5 mg de terbutalina en DPI, pueden considerarse adecuadas a una práctica correcta3.
Los fármacos broncodilatadores de corta duración pueden administrarse mediante MDI con cámara espaciadora o mediante DPI. Ambos sistemas son adecuados. Sin embargo, en situaciones de obstrucción bronquial grave, se debe recordar que la administración con MDI y cámara es superior a la efectuada con DPI.
La técnica de inhalación de los MDI con cámara espaciadora en los niños mayores consiste en administrar las dosis del broncodilatador "pulsación a pulsación", es decir, separadas al inicio de una maniobra de inspiración lenta y profunda, manteniendo pausa al finalizar la inspiración y espirando después de forma muy lenta. Se repetirán tantos ciclos respiratorios como el resultado de dividir el volumen de la cámara (750 ml en la de tipo adulto; ± 300 ml en las infantiles) por el volumen corriente del niño estudiado (volumen corriente, 10 ml/kg de peso); por ejemplo, niño de 40 kg de peso con cámara de adulto, 750/10 x 40 = 2 inspiraciones. En los niños pequeños, la técnica de inhalación se realizará siempre a respiración corriente, estando tranquilo, relajado, nunca bajo llanto, chillando o hablando.
Interpretación de la respuesta broncodilatadora
Son varios los índices utilizados para expresar la respuesta broncodilatadora. No hay un consenso universalmente aceptado respecto a cuál de estos índices es el más informativo y por tanto, el más adecuado. Las distintas fórmulas propuestas son:
Incremento del FEV1 en valores absolutos expresado en ml
Valor posbroncodilatación Valor prebroncodilatación = ↑ ml
En los niños no se puede utilizar esta formula debido a la amplia variación de edades y tallas.
Cambio porcentual del FEV1 respecto del valor inicial
[(FEV1 post FEV1 pre)/FEV1 pre] x 100 = ↑ %
Hasta la fecha ésta ha sido la formula más utilizada, sin embargo introduce un sesgo matemático ya que al estar el FEV1 pre en el denominador, cuanto menor sea éste, mayor será la respuesta; de manera que los pacientes más obstruidos los que tienen un FEV1 de partida menor se etiquetan como "más reversibles" al ser mayor su probabilidad de mejorar su función pulmonar. Por el contrario, los pacientes menos obstruidos o con un FEV1 inicial próximo a los límites teóricos pueden ser calificados como "no respondedores"31.
Cambio porcentual del FEV1 respecto del valor teórico o predicho:
[(FEV1 post FEV1 pre)/FEV1 teórico] x 100 = ↑ %
Es la fórmula recomendada en adultos por la ERS2. Los estudios de Waalkens et al32 y Pardos et al33, entre otros, concluyen que también en los niños es la mejor manera de expresar la respuesta broncodilatadora, pues no depende de la edad, talla o calibre bronquial.
Interpretación de la respuesta broncodilatadora
Tampoco existe un consenso en la definición de positividad de la respuesta de la prueba broncodilatadora ya que el establecimiento de un punto de corte para una respuesta positiva es arbitrario.
Sin embargo, hoy en día creemos que es mayoritariamente aceptada la recomendación de considerar la prueba broncodilatadora positiva cuando el FEV1 posbroncodilatación aumenta como mínimo un 9 % respecto tanto del FEV1 teórico del paciente como de FEV1 inicial, pero siendo el primero el que mejor refleja el resultado de la prueba, pues no depende del grado de limitación del flujo aéreo intrapulmonar.
En todo caso, un incremento del FEV1 menor del 9 % sobre el valor teórico indica un efecto broncodilatador nulo. Así mismo, un aumento del FEV1 entre el 9 y el 12 % sobre el valor teórico, se considera una respuesta broncodilatadora moderada. Y un aumento superior al 12 % indica una respuesta broncodilatadora claramente significativa34.
Los aumentos del FEV1 en la prueba broncodilatadora, por pequeños que sean, pueden suponer un descenso considerable de las resistencias de las vías aéreas (sRaw), comportando un mucho menor trabajo respiratorio, lo que clínicamente puede ser relevante. Dicho con otras palabras, la mejoría clínica puede ser evidente aún sin incrementos significativos del FEV1.
Respuesta broncodilatadora en otras pruebas de función pulmonar
Al igual que con la espirometría forzada, se puede evaluar la respuesta broncodilatadora con otras pruebas de función pulmonar, aunque con estas técnicas sea más complejo.
1.En la pletismografía corporal total utilizando como variable la conductancia específica (sGaw) se considera una prueba broncodilatadora positiva cuando se producen aumentos superiores al 25 %35.
2.En la determinación de resistencias respiratorias por oscilometría de impulsos (Rsr y Xsr) medida R a 5 Hz se considera positiva si cae un 30 %, o medida X si aumenta un 40 %35,36.
3.Si las resistencias se miden por oclusión (Rint) se considera positiva una caída del 25 %37.
4.En la espirometría parcial forzada practicada en lactantes por la técnica de compresión rápida toracoabdominal, se considera positiva si el volumen espiratorio forzado en el primer medio segundo (FEV0,5) es superior al 10 %, o si los mesoflujos (FEF25-75 %) lo son un 18 %38.
Para concluir, "el patrón oro" de la respuesta broncodilatadora sigue siendo la práctica de una espirometría forzada basal y su repetición tras la administración de un agonista β2-adrenérgico de corta duración de forma inhalada. Su medida es obligada para establecer la obstrucción de la vía aérea y su respuesta al tratamiento. Por lo tanto tiene implicaciones en el diagnóstico y tratamiento de la patología obstructiva respiratoria. Sin embargo, recordemos que el cuadro clínico es lo fundamental (un paciente puede tener asma a pesar de una espirometría basal normal y una prueba broncodilatadora negativa).
La clínica, la espirometría forzada y la respuesta broncodilatadora, analizadas en su conjunto, ayudarán a establecer un diagnóstico y estrategia terapéutica correctas.
Grupo de Técnicas de la Sociedad Española de Neumología Pediátrica
D. Álvarez Gil (Hospital Infanta Margarita, Cabra, Córdoba), V. Alzina de Aguilar (Clínica Universitaria de Navarra, Pamplona), A. Andrés Martín (Hospital Universitario de Valme, Sevilla), C. Antelo Landeira (Hospital Infantil La Paz, Madrid), O. Asensio de la Cruz (Corporació Sanitaria Parc Taulí, Sabadell, Barcelona), M.I. Barrio Gómez de Agüero (Hospital La Paz, Madrid), J. Blanco González (Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid), M. Bermejo Pastor (Hospital Materno-Infantil, Badajoz), A. Bonillo Perales (Hospital Torrecárdenas, Almería), M. Bosque García (Corporació Sanitaria Parc Taulí, Sabadell, Barcelona), G. Cabrera Roca (Hospital Universitario Materno-Infantil, Las Palmas de Gran Canaria), M. Carrasco Zalvide (Hospital Juan Ramón Jiménez, Huelva), A. Cordón Martínez (Hospital Universitario Carlos Haya Materno-Infantil, Málaga), I. Cortell Aznar (Hospital Universitario La Fe, Valencia), J. Elorz Lambarri (Hospital de Cruces, Baracaldo, Bizkaia), A. Escribano Montaner (Hospital Clínico Universitario, Valencia), J. Figuerola Mulet (Hospital Son Dureta, Palma de Mallorca), D. Gómez-Pastrana Durán (Hospital de Jerez de la Frontera, Cádiz), M.D. Gutiérrez Guerra (Hospital Juan Ramón Jiménez, Huelva), C. Landaluce Ugarte (Hospital de Txagorritxu, Vitoria), S. Liñán Cortés (Hospital Materno-Infantil Vall d'Hebron, Barcelona), C. Luna Paredes (Hospital Universitario 12 de Octubre, Madrid), M. Machuca Contreras (Hospital Virgen del Rocío, Sevilla), C. Martínez Carrasco (Hospital Infantil la Paz, Madrid), A. Martínez Jimeno (Hospital Universitario 12 de Octubre, Madrid), A. Moreno Galdó (Hospital Materno-Infantil Vall d'Hebron, Barcelona), C. Oliva Hernández (Hospital Nuestra Señora de la Candelaria, Santa Cruz de Tenerife), B. Osona Rodríguez de Torres (Hospital Son Dureta, Palma de Mallorca), T. Pascual Sánchez (Hospital de San Joan, Reus, Tarragona), L. Pardos Rocamora (CAP Balaguer, Lleida), J. Pérez Frías (Hospital Universitario Materno-Infantil Carlos Haya, Málaga), G. Pérez Pérez (Hospital Universitario Virgen de la Macarena, Sevilla), E. Pérez Ruiz (Hospital Universitario Materno-Infantil Carlos Haya, Málaga), S. Pérez Tarazona (Hospital de la Rivera, Alzira, Valencia), C. Reverté Bover (CAP Amposta, Tarragona), A. Salcedo Posadas (Hospital Universitario del Niño Jesús, Madrid), J. Sánchez Jiménez (Hospital de San Jaume, Calella, Barcelona), E. Sánchez Sánchez (CAP Premià del Mar, Barcelona), L. Sanz Borrell (Hospital de San Joan, Reus, Tarragona), A. Sequeiros González (Hospital Universitario del Niño Jesús, Madrid), J. Sirvent Gómez (Complejo Hospitalario Juan Canalejo, A Coruña), J.M. Tabarés Lezcano (Hospital Cristal-Piñor, Orense), J.M. Torres Simón (Hospital de Palamós, Girona), M.I. Úbeda Sansano (CAP Godella, Valencia), J.R. Villa Asensi (Hospital Universitario del Niño Jesús, Madrid).
Correspondencia: Dr. O. Asensio de la Cruz.
Corporació Sanitaria Parc Taulí. Sabadell.
Parc Taulí, s/n. 08208 Sabadell.
Correo electrónico: 16333oac@comb.es
Recibido en enero de 2007.
Aceptado para su publicación en enero de 2007.