La muerte súbita supone, a pesar de las campañas para evitarla, una de las principales causas de mortalidad infantil en nuestro medio durante el primer año de vida1. Se define como la muerte inesperada de un lactante, que permanece inexplicada tras una minuciosa investigación (incluyendo necropsia, revisión de la historia clínica y del lugar del fallecimiento). Mostramos el caso de una paciente en el que la autopsia reveló una aparente causa cardiológica de muerte súbita, no registrado previamente en la literatura2,3.
Lactante mujer de 5 meses de edad, sin antecedentes personales ni familiares previos de interés, a la que sus cuidadoras encontraron desde un tiempo indeterminado sin signos vitales. Se inician maniobras de reanimación cardiopulmonar (RCP) básicas durante 10 min y a la llegada de los servicios de emergencias se continúa con maniobras de RCP avanzada, incluyendo intubación orotraqueal, canalización de vía intraósea y 4 dosis de adrenalina. Tras 10 min se revierte la parada cardiorrespiratoria y se traslada a nuestro centro para continuación de cuidados. A su ingreso en la unidad de cuidados intensivos pediátricos la exploración física no evidencia ninguna alteración, incluida la exploración cardiaca que fue normal, excepto midriasis bilateral arreactiva y una puntuación en la escala de coma de Glasgow (GCS) de 3. Se realiza análisis de sangre en el que se objetiva una coagulopatía severa (tiempo protrombina 50%, tiempo cefalina 85 s, control 29s), junto con signos metabólicos de disfunción multisistémica (glucosa 301mg/dl, GOT 567 U/l, GPT 265 U/l, GGT 77 U/l, LDH 1119 U/l, ácido úrico 10,6mg/dl, CPK 1.700 U/l, CPK-MB 427 U/l, troponina cardiaca I [CTnI] 0,12ng/ml), todo ello compatible con un síndrome posresucitación. Se realizan pruebas de imagen cerebrales (tomografía computarizada y resonancia magnética) en las que se observan imágenes compatibles con edema cerebral difuso supratentorial, con extensas lesiones hipóxico isquémicas con afectación del córtex supratentorial, ganglios basales, tálamos y tronco encéfalo. Durante el tiempo de su ingreso la paciente muestra signos clínicos compatibles con muerte encefálica. Se produce el fallecimiento pocas horas después por bradicardia extrema e hipoxemia grave. Se recogen muestra de sangre, orina y líquido cefalorraquídeo para estudio metabólico, así como biopsia hepática y muscular para estudio de enfermedades mitocondriales, siendo todas negativas.
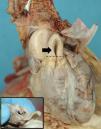
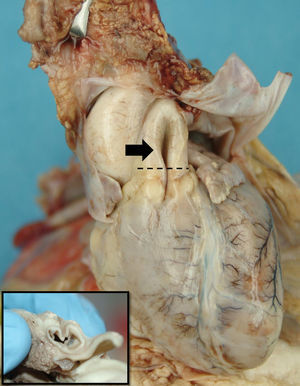
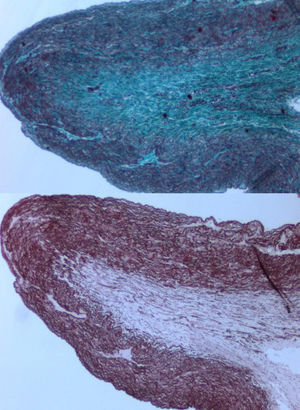
En la necroscopia se evidencia como hallazgo inesperado en el tronco de la arteria pulmonar un pliegue longitudinal que se extiende por el tracto de salida del VD en sentido ascendente con una longitud de 17mm (fig. 1). En las secciones transversales se observa un pliegue endoluminal, que condiciona un estrechamiento de la luz arterial (diámetro: 0,6cm [normal=1,25mm]). Histológicamente, la pared arterial presentó desorganización de las fibras elásticas de la túnica íntima con incremento de fibras colágenas (fig. 2). Se observaron además signos histológicos de hipoxia crónica a nivel del timo, intenso edema encefálico y pulmonar y necrosis tubular aguda con signos congestivos en diferentes vísceras.
La estenosis pulmonar es una cardiopatía congénita poco habitual (aproximadamente 5-8%)4, siendo la más frecuente la estenosis pulmonar valvular. Aparece en aproximadamente en el 83% de los pacientes con síndrome de Beuren-Williams, la arteriopatía familiar por déficit de elastina o la estenosis supravalvular aórtica esporádica5,6. Lo habitual en estos casos es la estenosis periférica de la arteria pulmonar, pero las arterias pulmonares centrales pueden tener estenosis localizadas o ser hipoplásicas7–9. Algunas estenosis pulmonares supravalvulares localizadas también han sido descritas10,11 y algunos pacientes pueden desarrollar un complejo patrón de estrechamientos en diferentes niveles. En nuestro paciente, la característica principal ha sido el hallazgo de una obstrucción supravalvular única de características severas, sin asociar estenosis periféricas ni de otros lechos vasculares. Tampoco existían antecedentes clínicos ni hallazgos físicos que orientasen a la existencia de un síndrome específico. El déficit de fibras elásticas que demuestra el estudio histológico del vaso recuerda al patrón descrito en el déficit de elastina. Dicha enfermedad supone la deleción del gen de la elastina (ELN), situado en la región 7q11.23. Se ha relacionado con enfermedades como cutis laxa y la estenosis aórtica supravalvular. En esta última, el hallazgo histológico típico es la alteración de las fibras elásticas de los grandes vasos, lo que produce una estenosis morfológica y funcional, similar a la hallada en este paciente. No obstante, el estudio genético de dicho gen no se pudo realizar y la historia clínica no aportó datos indicativos de cardiopatía descompensada, como fallo de medro, infecciones respiratorias de repetición o dificultad para realizar tomas. No obstante, el hallazgo de signos de isquemia crónica en el timo apoyaría que la estenosis pulmonar producía una hipoxia crónica en la paciente.
Por tanto, presentamos el caso de una paciente con un episodio de muerte súbita, en cuya investigación se encuentra una causa cardiológica probable descubierta gracias a la realización de la autopsia. En todos estos pacientes es necesaria la correcta investigación de las causas de su fallecimiento.