Se presenta el caso de una lactante de 8 meses ingresada para estudio de esplenomegalia masiva de 5 meses de evolución. No presentó incidencias durante el período perinatal. La niña nació en nuestro país, sus padres eran de origen sudamericano y estaban sanos. A los 3 meses de vida se detectó esplenomegalia.
Se realizó:
- •
Analítica: hemoglobina (Hb) 9,54g/dl; volumen corpuscular medio 81 fl; reticulocitos 10%; monocitosis (20% del total de leucocitos de 12,6×109/l) y plaquetas 134×109/l. El estudio de anemia e inmunoglobulinas (Ig) resultó normal. Las serologías para el virus de la inmunodeficiencia humana, el virus de la hepatitis B, el virus de Epstein-Barr y de Leishmania fueron negativas; la IgM fue negativa a citomegalovirus con IgG positiva. La reacción en cadena de la polimerasa de Leishmania resultó negativa.
- •
Ecografía abdominal: esplenomegalia homogénea de 84mm.
Durante los siguientes 4 meses, la lactante se mantuvo sin clínica aguda a pesar del empeoramiento progresivo de la esplenomegalia, la anemización (Hb 8,3g/dl), la disminución de plaquetas (39,3×109/l a los 7 meses) y el incremento progresivo de monocitos (desde 0,4×106/l a los 4 meses hasta 4,1×109/l a los 7 meses).
A los 8 meses reingresó por estancamiento ponderal de un mes de evolución, asociado los días previos a su ingreso a tos, diarrea y fiebre. Destacaba esplenomegalia gigante, palpable hasta la cresta ilíaca izquierda.
Se realizó:
- •
Ecografía: bazo de 130mm, sistema suprahepático permeable y hepatomegalia homogénea.
- •
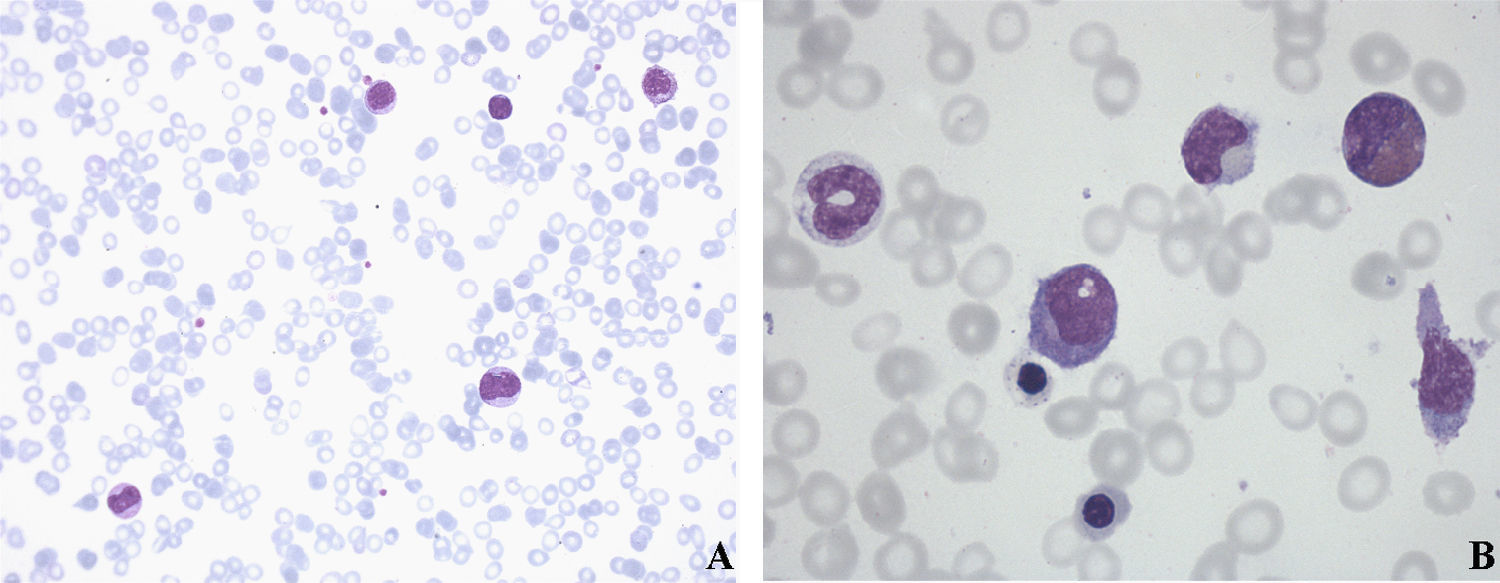
Analítica: Hb 7,8g/dl; plaquetas 20×109/l, y leucocitos de 17,7×109/l: 16% neutrófilos, 3% neutrófilos bandas, 49% linfocitos, 23% monocitos, 3% metamielocitos, 6% mielocitos y 6 eritroblastos por cada 100 leucocitos. La morfología de sangre periférica mostraba displasia en serie eritroide y monocitosis (fig. 1).
Figura 1.A) Extensión de sangre periférica que muestra displasia en serie eritroide y monocitosis discreta (10%) con el 1% de blastos en serie blanca. B) Aspirado de médula ósea, en el que el 10% corresponde a la serie eritroblástica con rasgos displásicos leves como punteado basófilo; el 41% corresponde a la serie granulopoyética con desgranulación y cuerpos de Dölhe; el 41% corresponde a la serie linfoide, con linfocitos de aspecto maduro; el 3,2% corresponde a la serie monocítica, y el 4,6% corresponde a la serie de blastos; los macrófagos son escasos, de aspecto normal y con ausencia de parásitos.
La electroforesis de hemoglobina mostró HbF de 13% (rango de normalidad del 2,3 al 12%); el estudio de hemólisis y fosfatasa ácida fueron normales.
- •
Aspirado de la médula ósea (AMO) y biopsia en cresta ilíaca posterior, en el que la celularidad y la citogenética fueron normales. Se solicitó cultivo de progenitores, en el que se apreció hipersensibilidad de progenitores mieloides a las unidades formadoras de colonias de granulocitos macrófagos (CFU-GM).
La presencia de esplenomegalia con leucocitosis, monocitosis importante, AMO compatible, el aumento de valores de HbF y la hipersensibilidad a las CFU-GM in vitro permitieron establecer el diagnóstico definitivo de leucemia mielomonocítica juvenil (LMMJ). Este caso cumple todos los criterios diagnósticos, a excepción de la monosomía 7 (tabla 1).
Criterios diagnósticos de la leucemia mielomonocítica juvenil
| Criterios principales (obligados los tres): |
|
| Criterios menores (son necesarios dos o más): |
|
CFU-GM: unidades formadoras de colonias de granulocitos macrófagos; HbF: hemoglobina F.
Se derivó el caso a un hospital de tercer nivel donde se practicó trasplante de precursores hematopoyéticos de cordón umbilical no emparentado, previo acondicionamiento. Presentó fallo de implante con reconstitución autóloga en la lactante, por lo que se realizó un nuevo trasplante de cordón no emparentado, tras esplenectomía y acondicionamiento presentando también fallo de implante.
La LMMJ es una enfermedad medular clonal que representa el 2% de las leucemias infantiles1 y se clasifica en el grupo de los síndromes mielodisplásicos y neoplasias mieloproliferativas. Presentó alrededor de los 21 meses con síntomas constitucionales, hepatoesplenomegalia, linfadenopatías e infiltración de otros órganos2,3. Su incidencia está incrementada en pacientes afectados de neurofibromatosis tipo 1, síndrome de Noonan y mosaicismo de trisomía 82,4,5. A diferencia de la mayoría de leucemias, el AMO apoya el diagnóstico pero no es específico.
Una característica distintiva de las células de la LMMJ es la hipersensibilidad de las células leucémicas in vitro a las CFU-GM2. En la patogénesis de esta hipersensibilidad interviene la pérdida de regulación de la señal de transducción de la vía de la proteína ras4,6.
Son signos de mal pronóstico la edad superior a 2 años, el recuento plaquetario bajo y la concentración de HbF alta2. La supervivencia promedio sin tratamiento se sitúa en menos de 12 meses7. El trasplante alogénico de precursores hematopoyéticos es el único tratamiento curativo disponible (curación del 50% a los 5 años8), pero se han descrito casos de curación espontánea en un subgrupo de pacientes, fundamentalmente entre aquellos afectados de síndrome de Noonan.
En nuestra paciente se planteó el diagnóstico diferencial de esplenomegalia progresiva. Descartados los procesos más prevalentes de etiología infecciosa, hemolítica, autoinmunitaria y estructural, se debían considerar procesos menos habituales, como los de origen hematológico o las enfermedades de depósito. La principal enfermedad de depósito compatible clínicamente con este caso era la esfingolipidosis de Gaucher. Esta enfermedad, difícil de diagnosticar en ocasiones (ya que no siempre se visualizan las células de Gaucher en los AMO), suele cursar con fosfatasa ácida elevada y no hay hipersensibilidad a las CFU-GM en el cultivo de progenitores.
Dado el contexto de anemia y la procedencia de los padres, debían descartarse las anemias congénitas que cursan con esplenomegalia y fue necesario realizar frotis de sangre periférica, resistencia globular osmótica y electroforesis de hemoglobinas.
La aparición de monocitosis importante en la sangre periférica durante la evolución permitió orientar el cuadro hacia el diagnóstico de LMMJ.