El cáncer es la primera causa de muerte por enfermedad entre el primer año de vida y la adolescencia. Algunos tipos de enfermedad siguen constituyendo un reto en términos de curación. Existe por tanto una necesidad imperiosa de nuevos fármacos. Algunos descubrimientos recientes en la biología del cáncer abren la puerta al desarrollo de terapias dirigidas contra alteraciones moleculares concretas e inmunoterapia. Esto se ha traducido en resultados prometedores sobre todo en oncología de adultos, y en menor medida todavía en niños. Presentamos la actividad en ensayos clínicos precoces (fase i-ii) en oncología pediátrica en España.
Material y métodosA través de la Sociedad Española de Oncología y Hematología Pediátrica (SEHOP) contactamos a sus miembros para identificar los ensayos fase i-ii en cáncer pediátrico abiertos entre 2005 y 2015.
ResultadosEn este periodo se abrieron 30 ensayos: 21 (70%) en tumores sólidos y 9 (30%) en hemopatías malignas y se incluyó a 212 pacientes. La mayoría están promovidos por la industria farmacéutica (53%). Desde 2010, 4 centros se han integrado en el consorcio internacional ITCC cuyo objetivo es desarrollar nuevas terapias en cáncer infantil. Esto ha permitido ampliar el abanico de posibilidades terapéuticas. Los resultados de ensayos clínicos terminados muestran la contribución de los investigadores españoles, la introducción de terapias dirigidas y sus beneficios.
ConclusionesLa actividad en ensayos clínicos precoces ha aumentado en estos años. La SEHOP está comprometida a desarrollar y participar en ensayos clínicos académicos colaborativos, que favorezcan el avance en las terapias frente al cáncer infantil.
Cancer is the leading cause of death between the first year of life and adolescence, and some types of diseases are still a major challenge in terms of cure. There is, therefore, a major need for new drugs. Recent findings in cancer biology open the door to the development of targeted therapies against individual molecular changes, as well as immunotherapy. Promising results in adult anti-cancer drug development have not yet been translated into paediatric clinical practice. A report is presented on the activity in early paediatric oncology trials (phase I-II) in Spain.
Material and methodsAll members of the Spanish Society of Paediatric Haematology Oncology (SEHOP) were contacted in order to identify early clinical trials in paediatric cancer opened between 2005 and 2015.
ResultsA total of 30 trials had been opened in this period: 21 (70%) in solid tumours, and 9 (30%) in malignant haemopathies. A total of 212 patients have been enrolled. The majority was industry sponsored (53%). Since 2010, four centres have joined the international consortium of Innovative Therapies for Children with Cancer (ITCC), which has as its aim to develop novel therapies for paediatric tumours. A significant number of new studies have opened since 2010, improving the treatment opportunities for our children. Results of recently closed trials show the contribution of Spanish investigators, the introduction of molecularly targeted agents, and their benefits.
ConclusionsThe activity in clinical trials has increased in the years analysed. The SEHOP is committed to develop and participate in collaborative academic trials, in order to help in the advancement and optimisation of existing therapies in paediatric cancer.
En España se diagnostica anualmente un nuevo caso de cáncer por cada 6.500 niños menores de 15 años. Esto representa 1.100 casos nuevos entre los 0 y 14 años y 450 entre los 15 y 191.
Los avances médico-terapéuticos en cáncer pediátrico han sido enormes. En Europa, la mortalidad por cáncer infantil se redujo un 60% entre las décadas de los 50 y 902. Desde entonces las cifras siguen mejorando, aunque más discretamente, habiendo alcanzado una «meseta» en ciertas enfermedades1. En Europa, la supervivencia global a los 5 años para todos los tipos de tumores diagnosticados entre el 2000 y el 2007 fue del 77,9%3. Gran parte de este éxito se debe al desarrollo de ensayos clínicos multiinstitucionales por grupos de investigación colaborativos4.
No obstante, el cáncer continúa siendo la primera causa de muerte por enfermedad a partir del primer año de vida y hasta la adolescencia1: en 2014, el cáncer fue responsable del 29% de las muertes entre 1 y 14 años y del 20% entre los 15 y los 195.
Más concretamente, el pronóstico continúa siendo sombrío en determinadas enfermedades, como neuroblastomas, sarcomas y meduloblastoma metastásicos y gliomas de alto grado, así como en aquellos pacientes con otras neoplasias que recaen o son refractarios a la primera línea de tratamiento.
Existe, por tanto, una necesidad imperiosa de nuevos fármacos.
Estos nuevos agentes anticancerosos son necesarios para mejorar la supervivencia y reducir las secuelas derivadas del tratamiento multimodal que combina cirugía, radioterapia, quimioterapia y trasplante de progenitores hematopoyéticos. Recientemente, la identificación de alteraciones moleculares particulares en determinados tumores ha conducido al desarrollo de terapias dirigidas frente a ellas, lo que se conoce como «medicina personalizada»6. Esto abre la puerta hacia estrategias adaptadas a la presencia de alteraciones moleculares o la inmunoterapia en el momento del diagnóstico o recaída, exclusivas del paciente oncológico.
Existen ejemplos en tumores sólidos pediátricos donde las nuevas terapias dirigidas han demostrado su papel: los inhibidores de ALK en el linfoma anaplásico de células grandes7,8, inhibidores de la vía de señalización Sonic-Hedgehog en meduloblastoma9 o inhibidores de BRAF en glioma de alto grado con mutación BRAFV600E10,11.
En leucemia, los 2 mejores ejemplos los encontramos en leucemia mieloide crónica y leucemia linfoblástica aguda, donde el descubrimiento del cromosoma Philadelphia (t(9;22)(q34;q11)) ha permitido la identificación de la proteína de fusión BCR-ABL, que desempeña un papel fundamental en su patogénesis. Este hallazgo ha permitido desarrollar medicamentos como el imatinib, dasatinib o nilotinib, capaces de eliminar las células leucémicas a través de la inhibición de la actividad cinasa-ABL, mejorando el pronóstico de estos pacientes12,13.
Es, por tanto, de vital importancia continuar invirtiendo en investigación y desarrollo de nuevos agentes anticancerosos en oncología infantil.
Ante la falta de información pediátrica en los medicamentos ya aprobados, se implanta en Europa en 2007 una nueva legislación en materia de regulación de los medicamentos en pediatría que hace referencia al llamado «Plan de investigación pediátrica» que las compañías farmacéuticas deben proponer a la Agencia Europea del Medicamento al registrar un nuevo medicamento14. De esta forma, en el momento en que una compañía farmacéutica registra un nuevo medicamento (generalmente para población adulta) debe acompañarlo de un plan de desarrollo para su uso en pediatría (siempre y cuando tenga potencial interés en niños). A aquellos planes de investigación pediátrica que son completados satisfactoriamente se les recompensa con una extensión de hasta 6 meses del certificado de protección suplementario, o en el caso de los llamados medicamentos huérfanos, una extensión de 2 años sobre los 10 de exclusividad para la indicación ya autorizada.
Los objetivos de esta medida son15:
- -
Aumentar la disponibilidad de nuevos medicamentos autorizados en niños por medio de estudios de investigación que cumplan con los más altos estándares éticos y de calidad y permita obtener datos precisos de seguridad y eficacia.
- -
Aumentar y mejorar la información ya disponible sobre medicamentos utilizados en pediatría.
A pesar de la introducción de estas iniciativas en los últimos 15 años en Europa, el desarrollo de nuevos fármacos en niños con cáncer es todavía insuficiente: solo 14 de los 28 medicamentos anticancerosos aprobados en adultos obtuvieron una exención para su uso en pediatría; 26 de ellos eran relevantes en tumores infantiles16. Es por tanto necesario que los representantes de las instituciones académicas, los cuerpos reguladores, las compañías farmacéuticas, las organizaciones de padres, los grupos de defensa de los derechos del paciente y otras organizaciones filantrópicas continúen trabajando y colaborando estrechamente para facilitar el acceso de los niños a estos nuevos fármacos16.
En general, el uso de ciertos tratamientos utilizados en pacientes refractarios o en recaída no están fundamentados sobre una sólida base de evidencia científica, y la mayoría no tiene una indicación pediátrica. El uso en pediatría de medicamentos fuera de ficha técnica que solo están autorizados en adultos conlleva riesgos significativos y no permite mejorar el conocimiento científico sobre su uso17.
Clásicamente, el desarrollo de un nuevo fármaco transcurre por diferentes fases de evaluación (fases i a iii) donde se evalúa su perfil de toxicidad y seguridad (i), eficacia (ii) y mejoras en la supervivencia (iii) en poblaciones concretas18. Los ensayos fase iv son estudios poscomercialización y su objetivo es identificar toxicidades previamente no observadas y su eficacia a largo plazo. En el caso de los ensayos en oncología, la población que participa en las fases precoces (i y ii) son en su mayoría pacientes que han recaído tras al menos una línea de tratamiento, o que son refractarios. Este es un proceso largo (más de 10 años en general desde su identificación en el laboratorio hasta su comercialización) y costoso (hasta 2.000 millones de dólares por producto19). Menos de un 5% de los fármacos que se evalúan en ensayos clínicos fase i obtendrá la autorización final para su comercialización20 y solo uno de entre 10.000 compuestos estudiados en el laboratorio llegará a comercializarse21.
En esta línea, el consorcio Innovative Therapies For Children With Cancer (ITCC; http://www.itcc-consortium.org) es una organización internacional cuyo objetivo principal es evaluar nuevos fármacos para el tratamiento del cáncer en niños y adolescentes. El ITCC proporciona la acreditación necesaria para implementar y desarrollar ensayos clínicos en cáncer infantil, facilitar el contacto con los promotores académicos o farmacéuticos y abrir nuevas unidades de investigación clínica22 con el objetivo de acelerar el acceso de estos nuevos medicamentos a los niños.
El objetivo de este trabajo es describir la actividad en ensayos clínicos precoces en cáncer pediátrico en España en los últimos 10 años, plantear las dificultades a las que nos enfrentamos, sus posibles soluciones y retos futuros. El presente estudio servirá como referencia de esta actividad con la que poder ser comparada en un futuro, siguiendo el ejemplo del proyecto BEST de Farmaindustria, una plataforma de excelencia en investigación clínica de medicamentos en España y de medida del desempeño de esta actividad, su eficacia y calidad (www.farmaindustria.es).
Pacientes y métodosA través de la Sociedad Española de Oncología y Hematología Pediátrica (SEHOP; www.sehop.org), que representa a todas las unidades de Oncología infantil en España, se contactó a sus miembros para identificar los ensayos clínicos fase i y ii en tumores sólidos y hemopatías malignas abiertos entre 2005 y 2015. Elegimos este periodo porque es a partir de 2005 cuando se introducen en nuestro país ensayos clínicos en fase precoz en población pediátrica.
De cada uno de ellos se extrajo información relativa al tipo de ensayo (fase i o ii), promotor (académico o industria farmacéutica), número de centros participantes, periodo durante el cual estuvo abierto, tipo(s) de tumor(es) a estudio, tipo de medicamento en investigación y mecanismo de acción y número de pacientes incluidos. La actualización de estos datos se realizó el 1 de diciembre del 2015. La confirmación sobre el estado de reclutamiento activo o no de estos estudios se hizo el 15 de junio del 2016.
En caso de precisar información adicional, se recurrió al Registro de Ensayos Clínicos del Instituto Nacional de Salud de los Estados Unidos (www.clinicaltrials.gov), al Registro Europeo de Ensayos Clínicos (www.clinicaltrialsregister.eu) y al Registro Español de Estudios Clínicos de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS; https://reec.aemps.es).
ResultadosCentros con unidades dedicadas a ensayos clínicos precoces: El papel del consorcio ITCCDesde 2010, 4 centros españoles han entrado a formar parte del ITCC: Hospital Universitari La Fe en Valencia; Hospital Universitari Vall d’Hebron en Barcelona, Hospital Niño Jesús en Madrid y Hospital Sant Joan de Déu en Barcelona. Otros centros SEHOP también han participado en algunos estudios aquí descritos, en su mayoría fase ii: hospitales La Paz, Gregorio Marañón y Doce de Octubre en Madrid, H. Santa Creu i Sant Pau en Barcelona, H. Virgen del Rocío en Sevilla, H. Virgen de la Arrixaca en Murcia, H. de Cruces en Bilbao, H. Son Espases en Palma de Mallorca, H. Clínico en Valencia, H. Universitario de Canarias en Tenerife, H. Miguel Servet en Zaragoza, H. Central de Asturias en Oviedo, H. Regional Universitario en Málaga y H. General Universitario en Alicante.
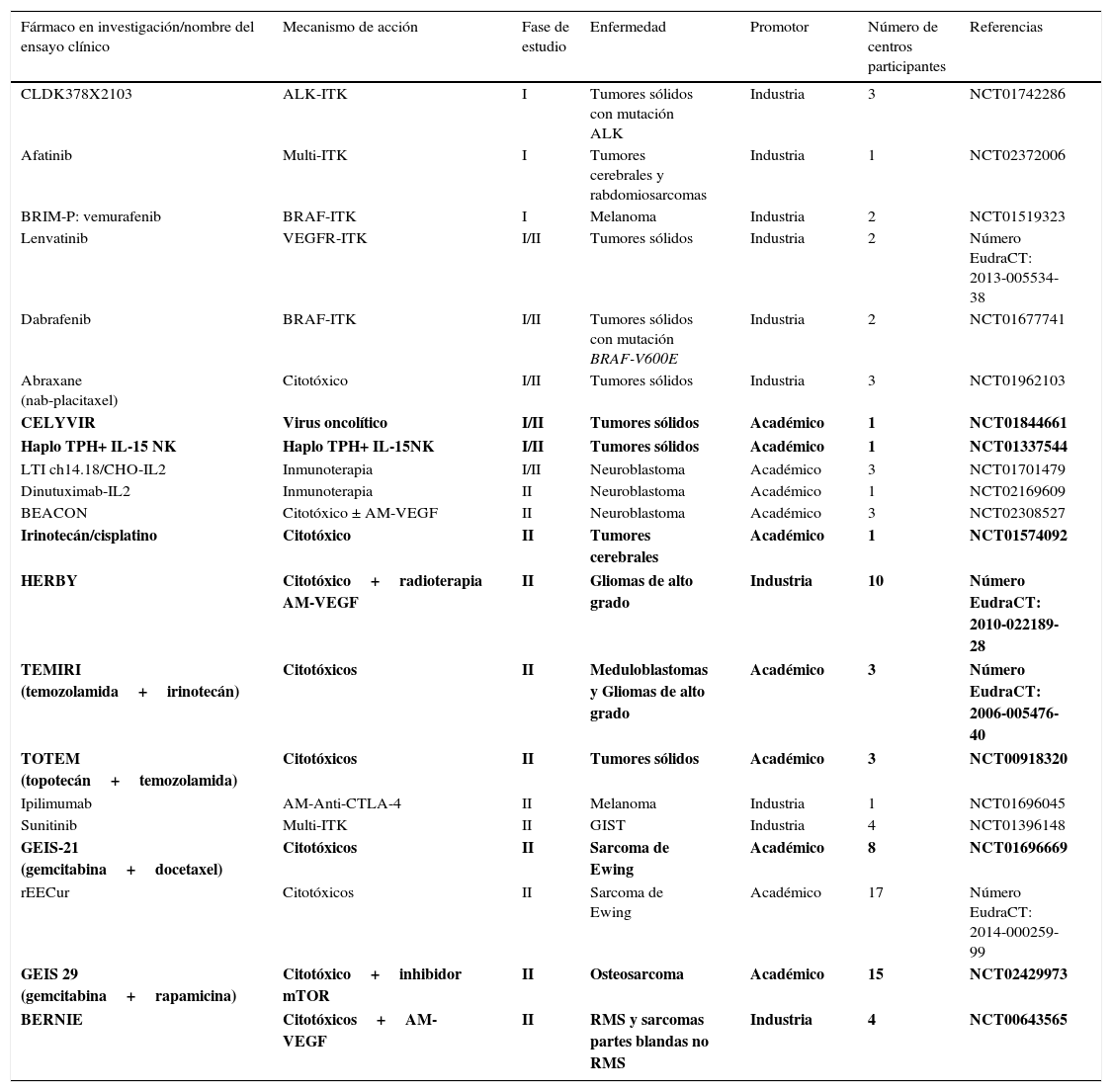
Cartera de ensayos clínicos en oncología pediátricaLas tablas 1 y 2 recogen los ensayos clínicos precoces en tumores sólidos y hematológicos, respectivamente, abiertos en España entre 2005 y 2015.
Ensayos clínicos pediátricos fase i/ii en tumores sólidos abiertos en centros españoles entre 2005 y 2015
| Fármaco en investigación/nombre del ensayo clínico | Mecanismo de acción | Fase de estudio | Enfermedad | Promotor | Número de centros participantes | Referencias |
|---|---|---|---|---|---|---|
| CLDK378X2103 | ALK-ITK | I | Tumores sólidos con mutación ALK | Industria | 3 | NCT01742286 |
| Afatinib | Multi-ITK | I | Tumores cerebrales y rabdomiosarcomas | Industria | 1 | NCT02372006 |
| BRIM-P: vemurafenib | BRAF-ITK | I | Melanoma | Industria | 2 | NCT01519323 |
| Lenvatinib | VEGFR-ITK | I/II | Tumores sólidos | Industria | 2 | Número EudraCT: 2013-005534-38 |
| Dabrafenib | BRAF-ITK | I/II | Tumores sólidos con mutación BRAF-V600E | Industria | 2 | NCT01677741 |
| Abraxane (nab-placitaxel) | Citotóxico | I/II | Tumores sólidos | Industria | 3 | NCT01962103 |
| CELYVIR | Virus oncolítico | I/II | Tumores sólidos | Académico | 1 | NCT01844661 |
| Haplo TPH+ IL-15 NK | Haplo TPH+ IL-15NK | I/II | Tumores sólidos | Académico | 1 | NCT01337544 |
| LTI ch14.18/CHO-IL2 | Inmunoterapia | I/II | Neuroblastoma | Académico | 3 | NCT01701479 |
| Dinutuximab-IL2 | Inmunoterapia | II | Neuroblastoma | Académico | 1 | NCT02169609 |
| BEACON | Citotóxico ± AM-VEGF | II | Neuroblastoma | Académico | 3 | NCT02308527 |
| Irinotecán/cisplatino | Citotóxico | II | Tumores cerebrales | Académico | 1 | NCT01574092 |
| HERBY | Citotóxico+radioterapia AM-VEGF | II | Gliomas de alto grado | Industria | 10 | Número EudraCT: 2010-022189-28 |
| TEMIRI (temozolamida+irinotecán) | Citotóxicos | II | Meduloblastomas y Gliomas de alto grado | Académico | 3 | Número EudraCT: 2006-005476-40 |
| TOTEM (topotecán+temozolamida) | Citotóxicos | II | Tumores sólidos | Académico | 3 | NCT00918320 |
| Ipilimumab | AM-Anti-CTLA-4 | II | Melanoma | Industria | 1 | NCT01696045 |
| Sunitinib | Multi-ITK | II | GIST | Industria | 4 | NCT01396148 |
| GEIS-21 (gemcitabina+docetaxel) | Citotóxicos | II | Sarcoma de Ewing | Académico | 8 | NCT01696669 |
| rEECur | Citotóxicos | II | Sarcoma de Ewing | Académico | 17 | Número EudraCT: 2014-000259-99 |
| GEIS 29 (gemcitabina+rapamicina) | Citotóxico+inhibidor mTOR | II | Osteosarcoma | Académico | 15 | NCT02429973 |
| BERNIE | Citotóxicos+AM-VEGF | II | RMS y sarcomas partes blandas no RMS | Industria | 4 | NCT00643565 |
En negritas, los ensayos clínicos que están cerrados al reclutamiento en el momento actual (15 de junio del 2016).
AM: anticuerpo monoclonal; CTLA-4: antígeno 4 asociado al linfocito T citotóxico (en sus siglas en inglés: cytotoxic T-lymphocyte antigen 4); GIST: tumor del estroma gastrointestinal (en sus siglas en inglés: gastrointestinal stromal tumor); IL: interleucina; ITK: inhibidor de tirosín-cinasa; RMS: rabdomiosarcoma; TPH: trasplante de progenitores hematopoyéticos; VEGF: factor de crecimiento del endotelio vascular (en sus siglas en inglés: vascular endothelial growth factor); VEGFR: receptor del factor de crecimiento del endotelio vascular (en sus siglas en inglés: vascular endothelial growth factor receptor).
Fuente: www.clinicaltrials.gov/www.clinicaltrialsregister.eu
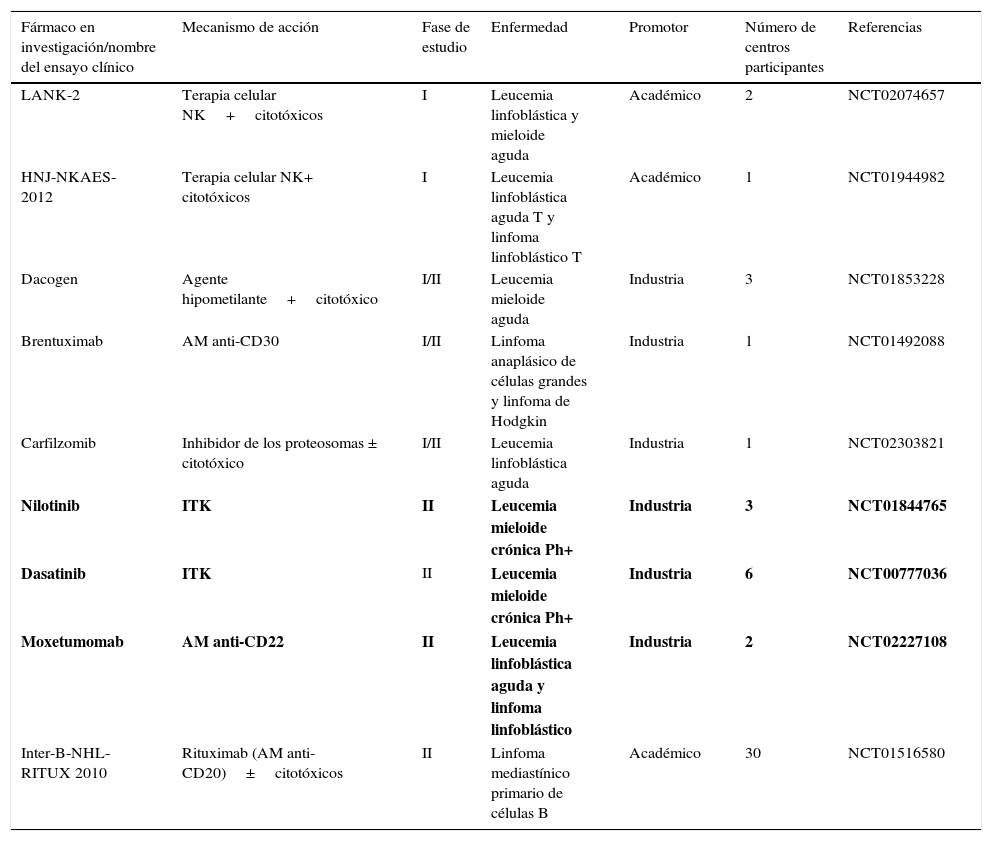
Ensayos clínicos pediátricos fase i/ii en tumores hematológicos abiertos en centros españoles entre 2005 y 2015
| Fármaco en investigación/nombre del ensayo clínico | Mecanismo de acción | Fase de estudio | Enfermedad | Promotor | Número de centros participantes | Referencias |
|---|---|---|---|---|---|---|
| LANK-2 | Terapia celular NK+citotóxicos | I | Leucemia linfoblástica y mieloide aguda | Académico | 2 | NCT02074657 |
| HNJ-NKAES-2012 | Terapia celular NK+ citotóxicos | I | Leucemia linfoblástica aguda T y linfoma linfoblástico T | Académico | 1 | NCT01944982 |
| Dacogen | Agente hipometilante+citotóxico | I/II | Leucemia mieloide aguda | Industria | 3 | NCT01853228 |
| Brentuximab | AM anti-CD30 | I/II | Linfoma anaplásico de células grandes y linfoma de Hodgkin | Industria | 1 | NCT01492088 |
| Carfilzomib | Inhibidor de los proteosomas ± citotóxico | I/II | Leucemia linfoblástica aguda | Industria | 1 | NCT02303821 |
| Nilotinib | ITK | II | Leucemia mieloide crónica Ph+ | Industria | 3 | NCT01844765 |
| Dasatinib | ITK | II | Leucemia mieloide crónica Ph+ | Industria | 6 | NCT00777036 |
| Moxetumomab | AM anti-CD22 | II | Leucemia linfoblástica aguda y linfoma linfoblástico | Industria | 2 | NCT02227108 |
| Inter-B-NHL-RITUX 2010 | Rituximab (AM anti-CD20)±citotóxicos | II | Linfoma mediastínico primario de células B | Académico | 30 | NCT01516580 |
En negritas, los ensayos clínicos que están cerrados al reclutamiento en el momento actual (15 de junio del 2016).
AM: anticuerpo monoclonal; ITK: inhibidor tirosín-cinasa; NK: natural killer.
Fuente: www.clinicaltrials.gov/www.clinicaltrialsregister.eu
Un total de 30 ensayos han sido abiertos: 21 (70%) en tumores sólidos y 9 (30%) en hemopatías malignas.
De los ensayos en tumores sólidos, 3 (14%) son fase i puros, 6 (29%) son fase i/ii y 12 (57%) son fase ii puros. Seis estudios (28%) evalúan inhibidores de tirosín-cinasa (ITK), 6 (28%) agentes citotóxicos, 3 (14%) la combinación de agentes citotóxicos con un anticuerpo monoclonal (AM), 2 (9%) la combinación de 2 inmunoterápicos en neuroblastoma, 1 (5%) un AM en melanoma, 1 (5%) la combinación de un ITK con un citotóxico en osteosarcoma y 1 (5%) un virus oncolítico (Celyvir23,24) y 1 (5%) la combinación de células natural killer estimuladas con interleucina-15 y trasplante hematopoyético haploidéntico. Dos ensayos (10%) están dirigidos a tumores con alteraciones moleculares específicas, 14 (66%) son específicos de determinados tipos de tumores y 5 (24%) son para todo tipo de tumor sólido. La mitad de los ensayos son promovidos por la industria farmacéutica y la otra mitad por instituciones académicas; 15 estudios (72%) están exclusivamente dirigidos a la edad pediátrica (< 18 años), 4 (19%) incluyen adultos jóvenes hasta los 21 años y 2 (9%) incluyen población adulta y pediátrica.
De los ensayos en hemopatías malignas, 2 (22,2%) son fase i puros, 3 (33,3%) son fase i/ii y 4 (44,5%) son fase ii puros; 2 (22,2%) investigan un ITK, 2 (22,2%) un AM, 2 (22,2%) terapia celular con y sin quimioterapia, 1 (11,1%) la combinación de un AM con agentes citotóxicos, 1 (11,1%) un agente hipometilante y 1 (11,1%) un inhibidor de los proteosomas. Dos ensayos (22,2%) están dirigidos a enfermedades con alteraciones moleculares específicas y 7 (77,8%) son específicos de determinadas hemopatías malignas. La mayoría están promovidos por la industria farmacéutica (n=6, 66%). Todos están exclusivamente dirigidos a la población pediátrica menor de 18 años.
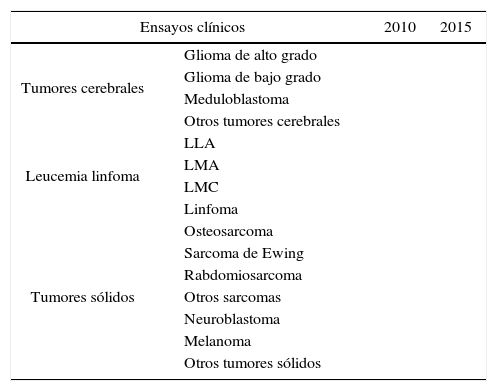
La tabla 3 refleja el notable incremento en las opciones disponibles para grupos de enfermedad a los que se dirigen los ensayos clínicos en los últimos 5 años en España.
Ensayos clínicos entre 2010 y 2015 por grupos específicos de enfermedad
| Ensayos clínicos | 2010 | 2015 | |
|---|---|---|---|
| Tumores cerebrales | Glioma de alto grado | ||
| Glioma de bajo grado | |||
| Meduloblastoma | |||
| Otros tumores cerebrales | |||
| Leucemia linfoma | LLA | ||
| LMA | |||
| LMC | |||
| Linfoma | |||
| Tumores sólidos | Osteosarcoma | ||
| Sarcoma de Ewing | |||
| Rabdomiosarcoma | |||
| Otros sarcomas | |||
| Neuroblastoma | |||
| Melanoma | |||
| Otros tumores sólidos | |||
LLA: leucemia linfoblástica aguda; LMA: leucemia mieloide agudag; LMC: leucemia mieloide crónica.
Un total de 212 pacientes han sido incluidos en este periodo: 179 (84%) en ensayos clínicos para tumores sólidos y 33 (16%) en ensayos para hemopatías malignas.
Ensayos clínicos completadosLos resultados de ensayos clínicos ya terminados o de aquellos todavía activos y cuyos resultados intermedios se han hecho públicos muestran la positiva contribución de los investigadores españoles, la introducción de terapias moleculares dirigidas en la población pediátrica y los beneficios que los pacientes pueden obtener de estos nuevos medicamentos (tabla 4)8,10,23,25-31.
Resumen de algunos de los ensayos clínicos completados
| Ensayo clínico[Ref] | Resultados |
|---|---|
| Ceritinib (LDK 378)8 | 22 pacientes menores de 18 años con tumores portadores de mutación/alteración de ALK en recaída/refractarios. Los pacientes fueron tratados con dosis crecientes de ceritinib DRE: 510mg/m2. Farmacocinética comparable a la de los adultos 2 TLD a las dosis de 560mg/m2/día. EA frecuentes: diarrea, vómitos, náuseas, elevación transaminasa ALT 6 respuestas objetivas: 2 de 2 en pacientes con LACG y 4 de 7 en pacientes con TM/TMI |
| Dabrafenib10 | 27 pacientes menores de 18 años con tumores portadores de mutación/alteración de BRAF en recaída/refractarios. Los pacientes fueron tratados con dosis crecientes de dabrafenib DRE: 4,5mg/kg/día para pacientes > 12 años y 5,25mg/kg/día para pacientes < 12 años 1 TLD a 4,5mg/kg/día. EA frecuentes: hipotensión, erupción cutánea, CID, fiebre y artralgias 23 respuestas objetivas: 6 de 8 pacientes con gliomas alto grado, 14 de 15 con gliomas de bajo grado, 2 HCL, un otro tipo de tumor sólido |
| Abraxane (nab-placitaxel)25 | 64 pacientes menores de 18 años con tumores sólidos en recaída/refractarios, excluyendo tumores cerebrales Los pacientes fueron tratados con dosis crecientes de nab-placitaxel DRE: 240mg/m2 2 TLD a las dosis de 120mg/m2 y 270mg/m2 (mareo y neutropenia respectivamente) 5 respuestas parciales: |
| Celyvir23 | 14 pacientes menores de 18 años con neuroblastoma refractario o en recaída Infusiones semanales de células mesenquimales autólogas pluripotentes portadoras de un adenovirus oncolítico (rango 4-70) Células totales (mín. 70×106, máx. 2.640×106) y partículas virales (mín. 1.80×1012, máx. 5.280×1013) No eventos adversos graves 4 respuestas objetivas: 1 enfermedad estable, 2 remisiones parciales y 1 remisión completa |
| Haplo+IL-15 NK cell31 | 6 pacientes menores de 18 años con sarcoma refractario y carcinoma de glándulas suprarrenales en recidiva Infusión a modo de ILD de células NK haploidénticas obtenidas por separación inmunomagnética en condiciones de BPM y estimuladas overnight con IL-15. Células totales infundidas 11×106/kg (3-27×106/kg) No eventos adversos graves relacionadas con la infusión de las células NK 4 respuestas objetivas: 1 enfermedad estable, 2 remisiones parciales y 1 muy buena remisión parcial |
| LTI ch14.18/CHO-IL226 | 97 pacientes menores de 21 años con neuroblastoma de alto riesgo Farmacocinética de ch14.18/CHO en ciclo 1: Cmáx = 12,2±0,4μg/ml, t½ = 8,4±1,1 d, AUC=145,3 ± 5,8μg*d/ml SLP al año y a los 4 años: 54,4±6,9% y 32,3%±6,9% frente al 19±2% y 8±3% de controles históricos SG al año y a los 4 años: 94,2±3,2% y 60,9±9,0% frente al 56±3% y 14±4% de controles históricos |
| GEIS-2127 | 43 pacientes con sarcoma de Ewing menores de 40 años en primera línea 22 pacientes de RE y 21 de AR Quimioterapia tipo mP6, cirugía y radioterapia en pacientes de RE y evaluación de la utilidad de gemcitabina/docetaxel como terapia ventana en pacientes de AR La SLE y la SG a 4 años en pacientes de RE fue del 67 y el 74%, respectivamente La SLE y la SG a 4 años en pacientes de AR fue del 27 y el 42%, respectivamente La SLE y SG fue significativamente superior en el grupo de edad de menores de 18 años |
| TEMIRI28 | 66 pacientes menores de 18 años con meduloblastoma en recaída/refractarios Los pacientes fueron tratados con temozolomida los días 1-5 e irinotecán los días 1-5 y 8-12 cada 21 días La toxicidad más frecuente fue: hematológica y digestiva (diarrea) La tasa de respuesta objetiva fue del 33% y el 68% experimentó beneficio clínico |
| TOTEM29 | 38 pacientes menores de 18 años con neuroblastoma en recaída/refractarios Los pacientes fueron tratados con temozolomida los días 1-5 y topotecán los días 1-5 y 8-12 cada 28 días La toxicidad más frecuente fue hematológica La SLP y la SG a los 12 meses fueron del 42 y el 58%, respectivamente |
| BERNIE30 | 154 pacientes menores de 18 años con rabdomiosarcoma metastásico fueron incluidos 80 fueron aleatorizados al brazo de quimioterapia sola y 74 al brazo de quimioterapia y bevacizumab El perfil de toxicidad fue similar en ambos grupos La SLE fue similar en ambos grupos (12,5 vs. 18,9, p=0,71) La SG fue similar en ambos grupos (42,2 vs. 32,3, p=0,32) |
AR: alto riesgo; AUC: área bajo la curva (en sus siglas en inglés: area under the curve); BMP: buenas prácticas de manufactura; CID: coagulación intravascular diseminada; DRE: dosis recomendada para la expansión (fase II); EA: eventos adversos; HCL: histiocitosis de células de Langerhans; IL: interleucina; ILD: infusión de linfocitos de donante; LACG: linfoma anaplásico de células grandes; NK: natural killer; RE: riesgo estándar; SG: supervivencia global; SLE: supervivencia libre de evento; SLP: supervivencia libre de progresión; TLD: toxicidad limitante de dosis; TM: tumor miofibroblástico; TMI: tumor miofibroblástico inflamatorio.
Este artículo describe la actividad en el desarrollo de nuevas terapias en oncología pediátrica a nivel nacional.
Los niños con cáncer de alto riesgo o mal pronóstico todavía siguen teniendo dificultades para acceder a nuevos medicamentos. En los últimos 5 años en nuestro país se han abierto más ensayos clínicos, probablemente como resultado de haber entrado a formar parte del ITCC, de los cambios en la regulación pediátrica y los esfuerzos de las instituciones para constituir unidades dedicadas a estos estudios, incluyendo personal médico, enfermeras de investigación, directores de proyecto y data managers.
Entre 2010 y 2014, 4 centros se han incorporado al ITCC, un consorcio creado en 2003 que aúna 9 laboratorios de investigación básica europeos y 47 unidades de oncología pediátrica con capacidad suficiente para llevar a cabo ensayos clínicos en oncología pediátrica fase i y ii. Uno de los objetivos de este consorcio es desarrollar nuevas terapias para el tratamiento del cáncer pediátrico y del adolescente en colaboración con las compañías farmacéuticas, cuerpos reguladores y organizaciones de padres y pacientes22. Entre 2007 y 2013 el ITCC pasó de evaluar 7 a 12 nuevos fármacos en el contexto de ensayos clínicos precoces; la mitad de estos ensayos se llevaron a cabo con el objetivo de cumplir con los requerimientos del plan de investigación pediátrica; esto ha favorecido de manera notable el acceso a las nuevas terapias en niños de nuestro continente15. Como país, formar parte activa del ITCC nos abre la puerta a participar en estudios colaborativos internacionales y facilitar el acceso a prometedoras terapias para nuestros pacientes.
La mayoría de ensayos clínicos precoces en oncología y hematología pediátricas que se han abierto en nuestro país son promovidos por la industria farmacéutica (n=16; 53%). De ellos, solo un tercio están dirigidos a hemopatías malignas. Esto puede explicarse porque en su conjunto las leucemias y los linfomas tienen altas tasas de curación en primera línea, y de aquellos que recaen, un porcentaje importante va a alcanzar una segunda remisión completa y eventualmente una curación a largo plazo con quimioterapia convencional y/o trasplante de progenitores hematopoyéticos. De esta forma, la población pediátrica diana para nuevos fármacos en hematología maligna es más reducida. Si a ello le añadimos los estrictos criterios de inclusión y exclusión, la dificultad para la movilidad del paciente de su hospital de origen al centro donde se dispone de estos nuevos medicamentos y la propia naturaleza de la enfermedad que, en ocasiones, no permite esperar para poder iniciar un tratamiento, esta tarea de reclutamiento se dificulta todavía más. Estos condicionantes son también aplicables a los pacientes con tumores sólidos, donde en el caso particular de determinadas enfermedades del sistema nervioso central o sarcomas la disponibilidad de ensayos clínicos es todavía más reducida.
Todo esto hace que en su conjunto el cáncer pediátrico sea un «mercado» pequeño y poco atractivo para la industria farmacéutica32.
Creemos que estos grupos de pacientes «huérfanos» deben beneficiarse de ensayos clínicos académicos. A través de nuestra Sociedad de Hematología y Oncología Pediátrica33, y en colaboración con otras sociedades científicas, como el Grupo de Investigación en Sarcomas (GEIS), aspiramos a desarrollar y participar en ensayos clínicos académicos colaborativos que favorezcan el avance y la optimización de las terapias existentes en enfermedades poco frecuentes como el cáncer infantil, que no son normalmente el objetivo de las compañías farmacéuticas. Nuestra obligación como investigadores es mejorar el diseño de los estudios, hacerlos más ágiles y flexibles y construirlos sobre bases científicas sólidas que nos permitan dirigirlos a poblaciones con mayores posibilidades de responder favorablemente34. A este respecto, la iniciativa de Sociedad Española de Oncología Médica en forma de manifiesto dirigido a las Administraciones Públicas para favorecer la investigación clínica académica independiente es verdaderamente importante35.
Una dificultad añadida a este respecto es la falta de financiación para el desarrollo de ensayos clínicos académicos. Esto resulta un problema a la hora de participar en ensayos clínicos académicos internacionales, donde los costes de apertura a nivel local y nacional deben ser sufragados en su casi totalidad por los propios países participantes. Existen muy pocas organizaciones sin ánimo de lucro que financien programas de investigación en cáncer pediátrico o con planes de apoyo específicos para ensayos clínicos. El nuevo Real Decreto 1090/2015 que regula los ensayos clínicos con medicamentos, beneficiará a los estudios de investigación clínica no comercial, por un lado con reducciones o exenciones en las tasas de evaluación, y por otro, agilizando los costosos y complicados trámites de apertura de estos estudios. Este problema de financiación no es solo un problema a este lado del Atlántico. En los Estados Unidos, el 60% de la financiación biomédica procede del sector biofarmacéutico36, seguido del Instituto Nacional de la Salud que aporta un 25%. Sin embargo, en el cáncer infantil el soporte económico de la industria farmacéutica es prácticamente inexistente y su sustento depende del Instituto Nacional del Cáncer, organizaciones privadas y asociaciones de carácter filantrópico32.
En la parte positiva, los resultados satisfactorios observados en poblaciones seleccionadas de acuerdo con los hallazgos moleculares tratados con terapias dirigidas como los inhibidores de ALK o BRAF8,10,11 o el AM anti-GD2 en neuroblastomas de alto riesgo26 son alentadores y nos deben hacer seguir siendo optimistas. Estos descubrimientos deben servir para estimular la inversión en investigación básica y clínica, y favorecer el que los pacientes puedan derivarse con más facilidad a aquellos centros que disponen de nuevas terapias que pueden resultarles beneficiosas.
La experiencia de 2 de las unidades más grandes de ensayos clínicos precoces en oncología infantil en Europa, The Royal Marsden (Londres, Reino Unido)37 y Gustave Roussy (Villejuif, Francia)38, muestra que implementar estas terapias dentro de la actividad rutinaria de la oncología pediátrica es posible y segura para el paciente, al mismo tiempo que un porcentaje significativo de estos pacientes se va a beneficiar de estos tratamientos.
Los ensayos clínicos son el medio necesario e imprescindible para evaluar nuevos tratamientos que permitan obtener una información robusta y una evidencia sólida sobre la seguridad y eficacia de un nuevo tratamiento, lo que redunda en un beneficio para la comunidad científica y los pacientes de igual modo. La evaluación de nuevos medicamentos anticancerosos en niños y adolescentes debe de hacerse conforme con la regulación vigente, evitando el uso fuera de ficha técnica17,39 y en el contexto de ensayos clínicos aprobados por los comités de ética y desarrollados de acuerdo con las normas de buena práctica clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Gracias a todos los niños y padres que han participado en estos ensayos clínicos así como al personal clínico, enfermeras de investigación, directores de proyecto y data-managers de las diferentes instituciones.
Gracias a nuestros compañeros de la Sociedad Española de Hematología y Oncología Pediátrica (SEHOP), por su entusiasmo y apoyo.
Gracias a nuestros compañeros del Grupo Español de Investigación en Sarcomas (GEIS), cuya colaboración con el grupo SEHOP ha permitido el acceso de nuestros pacientes a nuevos ensayos clínicos.