La incidencia de la enfermedad meningocócica invasiva (EMI) por serogrupo C ha disminuido desde la introducción de la vacunación sistemática el año 2000. El objetivo de este estudio es determinar los casos de EMI diagnosticados desde entonces y los fallos vacunales en los casos por serogrupo C.
Pacientes y métodosAnálisis retrospectivo de pacientes diagnosticados de EMI confirmada por cultivo o reacción en cadena de la polimerasa, en un hospital infantil de tercer nivel de Barcelona, entre 2001 y 2018. Se analizó el número de dosis de vacuna recibidas y la edad, recogidos de la historia clínica y del carnet de vacunaciones.
ResultadosSe confirmaron 128 casos de EMI (7,1 casos/año; 70,3% en <5 años). Se estudió el serogrupo en 125 casos (97,6%): 103 fueron B (82,4%), 10 fueron C (8%), uno fue 29E (0,8%) y uno fue Y (0,8%); solo 10 (8%) no fueron serogrupables. De los 10 pacientes con serogrupo C, 4 no estaban vacunados y en 3 la pauta fue incompleta en cuanto a número de dosis; 3 de ellos recibieron la pauta completa según la edad y el calendario vacunal vigente, por lo que se consideran fallos vacunales. Fallecieron 6 pacientes (tasa de letalidad: 4,7%): 5 por serogrupo B (letalidad: 4,8%) y uno por serogrupo C (letalidad: 10%).
ConclusionesEl serogrupo C representó solo el 8% de los casos de EMI en el periodo de estudio y los fallos vacunales de este serogrupo fueron del 30%.
The incidence of serogroup C invasive meningococcal disease (IMD) has decreased since the introduction of systematic vaccination in 2000. The aim of this study is to determine the number of serogroup C IMD cases diagnosed since then and the vaccine failures.
Patients and methodsA retrospective analysis was performed on patients diagnosed with IMD by culture or polymerase chain reaction (PCR) in a maternity and childhood hospital in Barcelona between 2001 and 2018. An analysis was made of the number of vaccine doses and the age received, as well as on the medical records and vaccine cards.
ResultsThere were 128 confirmed cases of IMD (7.1 cases/year; 70.3 in <5 years). The serogroup was studied in 125 (97.6%) cases, in which 103 (82.4%) were B, 10 (8%) were C, one (0.8%) was 29E, and one (0.8%) was Y, and only 10 (8%) were not able to be serogrouped. Of the 10 patients with serogroup C, 4 were not vaccinated, and in 3, the course was not complete as regards the number of doses. The other 3 received the complete course according to age and current calendar, and thus were considered vaccine failures. A total of 6 patients died (mortality rate: 4.7%), 5 due to serogroup B (mortality: 4.8%), and one due to serogroup C (mortality: 10%).
ConclusionsSerogroup C only represented 8% of IMD cases in the period studied, with 30% of cases due to this serogroup being vaccine failures.
La enfermedad meningocócica invasiva (EMI) continúa siendo un importante problema de salud pública por su letalidad, el elevado número de secuelas que comporta, la importante repercusión familiar que tiene y la gran alarma social que genera1,2.
Neisseria meningitidis es un diplococo gramnegativo, patógeno exclusivo de los humanos, que se adhiere a la superficie de las células mucosas de la nasofaringe, lo que da lugar a un estado de portador asintomático; la colonización nasofaríngea es una condición necesaria para que se pueda desarrollar una EMI. La tasa de portadores varía entre el 4,5% en los lactantes y el 23,7% a los 19 años de edad, y disminuye al 7,8% a los 50 años3,4. A partir de las personas colonizadas en la nasofaringe, el meningococo puede transmitirse a los niños pequeños, a los adolescentes y a los adultos mayores, que son los grupos con mayor incidencia de EMI.
N. meningitidis incluye 12 serogrupos, de los que 6(A, B, C, W, Y y X) causan más del 95% de las enfermedades meningocócicas5,6. Cinco de ellos son inmunoprevenibles y se dispone de 5tipos de vacunas: 2monovalentes conjugadas, A y C (VCMenC); una tetravalente conjugada, ACWY, y 2no conjugadas frente al serogrupo B. Están en estudio 3vacunas combinadas pentavalentes7-9, de las que una incluye el serogrupo X (ACWYX), de gran interés para el continente africano, y otras 2incluyen el serogrupo B (ABCWY), de elección en Europa.
La incidencia de la enfermedad meningocócica en España ha disminuido significativamente en los últimos 20 años, en parte debido a la introducción de la VCMenC en el año 2000 con excelentes coberturas vacunales. Asimismo, la vacunación no sistemática frente a meningococo B desde 2015 puede haber contribuido en parte, gracias a la demostración de la existencia de protección cruzada frente al serogrupo C10. No obstante, continúa siendo una enfermedad grave con una alta letalidad. Según datos del Sistema Nacional de Vigilancia Epidemiológica11, durante la temporada 2017-2018 se confirmaron 346 casos, lo que supone una tasa de incidencia de 0,74 casos confirmados por 100.000 habitantes, con un aumento del 76,2% desde la temporada 2013-2014 (tasa de 0,42 y 195 casos); a finales de los años 90, antes del inicio de la vacunación frente a meningococo C, la tasa de incidencia de EMI alcanzó los 4 casos por 100.000 habitantes. Sin embargo, la incidencia por grupos de edad en esta última temporada es muy superior en los niños menores de un año (8,65 casos por 100.000 habitantes). Entre los casos confirmados, el 41% se asociaron al serogrupo B, el 13,9% al serogrupo W, el 11,6% al serogrupo C y el 10,7% al serogrupo Y. El resto de los casos fueron por cepas no tipificables (9,2%), serogrupos menos prevalentes en nuestro medio (1,1%) o serogrupos no identificados (12,1%)11.
A pesar de la amplia cobertura vacunal, en los últimos años se han descrito casos de EMI por serogrupo C11-17. Hay que destacar un aumento del número de casos por serogrupo C en la última temporada 2017-2018 (40 casos), respecto a la 2013-2014 (15 casos)11. Sin embargo, desde su implementación en el calendario vacunal, la vacunación frente al meningococo C ha tenido un gran impacto para controlar la enfermedad11,12,18.
El objetivo de este trabajo es analizar los casos de EMI que precisaron ingreso en un hospital terciario desde que se incluyó la VCMenC en el calendario sistemático en el año 2000 en nuestra comunidad, ver la distribución por serogrupos y analizar el estado vacunal de los pacientes con enfermedad por serogrupo C.
Pacientes y métodosSe expone un análisis retrospectivo de las historias clínicas de los pacientes menores de 16 años diagnosticados de EMI, confirmada por cultivo o por amplificación genómica (reacción en cadena de la polimerasa [PCR]), ingresados en nuestro hospital (centro de referencia pediátrico de tercer nivel con más de 3.000 ingresos anuales y 41 camas de cuidados intensivos) durante el periodo de enero de 2001 a diciembre de 2018. Se recogieron los estudios microbiológicos y las variables epidemiológicas y clínicas.
Estudios microbiológicosSe registraron los resultados de los cultivos o de la PCR de las muestras de sangre o líquido cefalorraquídeo (LCR). Los hemocultivos fueron realizados en botellas de formato pediátrico Bact/Alert® (bioMèrieux, Marcy-l’Etoile, Francia) y las muestras de LCR, previa centrifugación, se cultivaron en medios sólidos convencionales y medios líquidos de enriquecimiento; el tiempo de incubación de ambas muestras fue de 5-6 días. La identificación de los microorganismos aislados en el cultivo se realizó mediante sistemas automatizados basados en pruebas bioquímicas o análisis de proteínas (Vitek®2 NH Card o espectrometría de masas Vitek MS MALDI-TOF, respectivamente, ambos de bioMèrieux, Marcy-l’Etoile, Francia). En la interpretación del antibiograma se utilizaron los puntos de corte recomendados por las guías del European Committee on Antimicrobial Susceptibility Testing y del Clinical and Laboratory Standard Institute. El estudio molecular del LCR se realizó en muestras con un volumen ≥100μl mediante PCR en tiempo real multiplex para detectar N. meningitidis (región ctrA, capsular transport gene), Haemophilus influenzae serotipo b (bexA, capsulation gene) o Streptococcus pneumoniae (ply, pneumolysin gene) mediante sondas fluorescentes tipo TaqMan® en un termociclador Smartcycler® (Cepheid, Sunnyvale, EE. UU.)19. La determinación del serogrupo de N. meningitidis se hizo mediante una técnica de aglutinación con antisueros específicos para los serogrupos B y C (Difco™ Neisseria meningitidis Antiserum Group B y C, Becton Dickinson, Sparks, MD, EE. UU.) o por PCR en tiempo real, que podía detectar los serogrupos B, C, W e Y20,21. Las cepas no serogrupables fueron enviadas al Laboratorio de Referencia de Neisserias del Centro Nacional de Microbiología del Instituto de Salud Carlos III de Majadahonda (Madrid), donde, entre otras, se identificó la cepa 29E.
Variables epidemiológicasSe recogieron datos demográficos y relacionados con la VCMenC en los casos con enfermedad por este serogrupo. De la historia clínica y del carnet de vacunaciones se obtuvieron el número de dosis recibidas y la edad en el momento de la vacunación. Se establecieron las siguientes categorías de pacientes en relación con la vacunación:
- •
No vacunado: paciente que no ha recibido ninguna dosis de VCMenC hasta el momento del diagnóstico.
- •
Vacunación incompleta: paciente con un número de dosis menor que el correspondiente según su edad y el calendario vacunal vigente en el momento del diagnóstico.
- •
Fallo vacunal: paciente que ha recibido la pauta vacunal completa para su edad según el calendario vigente en el momento del diagnóstico y que presentó síntomas de la enfermedad al menos 14 días después de la última dosis.
Se recogieron las formas de presentación de la EMI y los datos del estudio del complemento (capacidad hemolítica del suero, por la vía clásica [CH50] y por la vía alterna [AP50]) realizados en estos pacientes para el cribado de inmunodeficiencias.
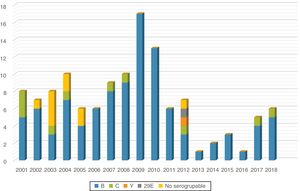
ResultadosDe enero de 2001 a diciembre de 2018 ingresaron 128 pacientes con diagnóstico clínico de EMI (7,1 pacientes/año), confirmada mediante cultivo, PCR o ambos métodos, en muestras de sangre o LCR. La distribución de los casos fue homogénea durante los primeros años del estudio (6-10 casos anuales), con un ligero aumento durante los años 2009 y 2010, con 17 y 13 casos, respectivamente, y con tendencia al descenso en años posteriores; 2013 fue el año con menor número de casos (fig. 1).
Hubo una mayor proporción de pacientes de sexo masculino (79 niños y 49 niñas), con edades comprendidas entre un mes y 16 años (mediana: 2 años; rango intercuartílico de 9 meses a 5 años). De los 128 pacientes, 90 eran menores de 5 años (70,3%) y una cuarta parte eran menores de un año (34; 26,6%). En cuanto al diagnóstico clínico, 68 casos (53,1%) se manifestaron en forma de sepsis, 39 (30,5%) como meningitis y 21 (16,4%) como sepsis con meningitis. Fallecieron 6 pacientes (tasa de letalidad: 4,7%), 5 por serogrupo B y uno por C, lo que representa una letalidad del 4,8 y del 10%, respectivamente; el paciente por serogrupo C era un adolescente de 15 años no vacunado. En la tabla 1 se muestran las diferencias más relevantes en cuanto a los datos demográficos y clínicos de los pacientes con enfermedad por serogrupo C respecto al resto de los serogrupos.
Datos comparativos entre el total de pacientes con enfermedad meningocócica invasiva no C y los pacientes con EMI por serogrupo C
| EMI no serogrupo C (N=118) | EMI serogrupo C (N=10) | |
|---|---|---|
| Edad | 1 m-16 a | 1 a-15 a |
| (mediana 1año, RIC 7 mes-5años) | (mediana 5,5años, RIC 1 año-9años) | |
| <5 años | 87 (73,7%) | 3 (30%) |
| <1 año | 34 (28,8%) | 0 |
| Sexo n (%) | ||
| Niños | 74 (62,7) | 5 (50) |
| Niñas | 44 (37,3) | 5 (50) |
| Presentación clínica n (%) | ||
| Sepsis | 61 (51,7) | 7 (70) |
| Meningitis | 38 (32,2) | 1 (10) |
| Sepsis con meningitis | 19 (16,1) | 2 (20) |
| Tasa de letalidad (%) | 4,2 | 10 |
RIC: rango intercuartílico.
En 92 casos los cultivos fueron positivos y en 36 (28,1%) fueron negativos. El estudio molecular mediante PCR de sangre o LCR se realizó en 95 pacientes y se obtuvo un resultado positivo en 86 (90,5%). De las muestras positivas mediante PCR, el 41,9% tuvieron cultivo negativo. El antibiograma se realizó en 120 cepas: 105 eran sensibles a la penicilina (87,5%), 12 mostraron una sensibilidad intermedia y 3 eran resistentes, pero sensibles a las cefalosporinas de tercera generación.
Se determinó el serogrupo en 125 (97,6%) de los 128 casos. Destaca una elevada proporción del serogrupo B, con 103 casos (82,4%); 10 fueron del serogrupo C (8%), principalmente distribuidos en el primer periodo del estudio, y 2 fueron de los serogrupos Y y 29E. Solo 10 casos (8%) no fueron serogrupables y en 3 no fue posible determinar el serogrupo (fig. 1).
El estudio de la vía del complemento se realizó en 86 pacientes y se observó una deficiencia en 3 (3,5%): 2 pacientes con serogrupos poco habituales en nuestro medio (serogrupo Y y 29E) y un paciente con serogrupo desconocido. Los diagnósticos fueron deficiencias de C5 en los 3 casos. Todos ellos presentaban otros factores de riesgo de sufrir un defecto inmunitario (consanguinidad, antecedentes familiares…).
Los antecedentes vacunales de los 10 pacientes con EMI por serogrupo C se resumen en la tabla 2. No habían recibido ninguna dosis de vacuna 4 pacientes; en 3 pacientes, de 2, 5 y 10 años de edad, la pauta vacunal era incompleta (habían recibido solo 2 dosis antes del año de edad los 2primeros y el paciente de 10 años no recibió la dosis de catch-up recomendada cuando se modificó la pauta vacunal). Los 3 pacientes restantes, de 1, 9 y 7 años de edad, habían recibido la pauta vacunal completa según su edad y el calendario vacunal vigente en el momento del diagnóstico, con 3 dosis cada uno (3 dosis en el primer año un paciente y pauta 2 + 1 los 2restantes).
Antecedentes vacunales de los pacientes con enfermedad meningocócica invasiva por serogrupo C
| Caso | Año del diagnóstico | Edad en el momento del diagnóstico en años | Dosis de vacuna | Situación vacunal |
|---|---|---|---|---|
| 1 | 2001 | 6 | 0 | No vacunado |
| 2 | 2001 | 15 meses | 0 | No vacunado |
| 3 | 2001 | 6 | 0 | No vacunado |
| 4 | 2003 | 15 | 0 | No vacunado |
| 5 | 2007 | 2 | 2 en el primer año | Vacunación incompleta |
| 6 | 2008 | 5 | 2 en el primer año | Vacunación incompleta |
| 7 | 2012 | 10 | 3 en el primer año | Vacunación incompleta |
| 8 | 2004 | 13 meses | 3 en el primer año | Fallo vacunal |
| 9 | 2017 | 9 | 3 (pauta 2 + 1)a | Fallo vacunal |
| 10 | 2018 | 7 | 3 (pauta 2 + 1)a | Fallo vacunal |
La EMI es una enfermedad de distribución mundial, endémica en la mayoría de los países y que se presenta también en brotes epidémicos. La forma clínica más frecuente, en el 50-70% de los casos22, es la meningitis, aunque en nuestra serie lo fue la sepsis, con un 53,1%; la meningitis se observó en el 30,5% y la forma de sepsis con meningitis en el 16,4%. La letalidad por serogrupo C fue el doble que por serogrupo B (10 frente a 4,8%). Como está descrito previamente, el grupo de pacientes de mayor riesgo son los de menor edad: un 70% de los casos corresponden a menores a 5 años y un 38% de estos son en menores de un año; los pacientes con serogrupo C tuvieron una mayor edad y solo el 30% eran menores de 5 años. Por todo ello, el Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) recomienda la vacunación sistemática frente al serogrupo B, porque es el más frecuente (67,6%), con una tasa de incidencia de 5,85 casos confirmados por 100.000 en los lactantes menores de 12 meses11.
El desarrollo de técnicas moleculares ha supuesto un avance en el diagnóstico microbiológico de la EMI, por ser más sensibles, específicas y rápidas, y porque su resultado no se ve modificado por la administración previa de antibióticos23-25. Gracias a la utilización de estas técnicas pudo confirmarse el diagnóstico en el 28,1% de los pacientes, cuyo cultivo resultó negativo debido probablemente a la administración previa de antibióticos. No obstante, el cultivo continúa siendo el método de referencia y, además, permite pruebas de sensibilidad a los antimicrobianos y de estudios de tipificación de la cepa aislada, de gran importancia para la vigilancia epidemiológica.
Desde la inclusión de la VCMenC en el calendario de vacunaciones sistemáticas, se han utilizado 3 pautas de administración. En primer lugar, en diciembre de 1999, el Consejo Interterritorial del Sistema Nacional de Salud (CISNS) aprobó la recomendación de incluir la VCMenC13, que se introdujo en el año 2000 en todas las comunidades autónomas a los 2, 4 y 6 meses (se recoge en los calendarios de 2001 del CISNS y del CAV-AEP). En enero de 2006 se modificó la pauta de vacunación: se redujo la primovacunación a 2 dosis en el primer año de vida y se administraba una dosis de refuerzo en el segundo año (se recoge en los calendarios de 2005 del CAV-AEV y de 2007 del CISNS), pues se había demostrado que la efectividad vacunal disminuía con el tiempo y que el descenso de anticuerpos es más rápido si se vacuna en el primer año de vida14 (solo el 30% de los niños primovacunados estaban protegidos a los 5 años de vida). El porcentaje de protegidos se incrementa según aumenta la edad de vacunación, hasta el 70% a los 10 años en personas vacunadas con una dosis a los 16 años de edad15. Por este motivo, en 2014 se introdujo la tercera pauta, en la que se suprime una dosis de la serie primaria y se añade una segunda dosis de recuerdo en la adolescencia (se recoge en los calendarios de 2013 del CISNS y de 2014 del CAV-AEV)13,15.
Estas 3pautas son un ejemplo de estrategias dinámicas de la vacunación, según la epidemiología de la enfermedad y el seguimiento de la efectividad vacunal con el tiempo. La estrategia dinámica continúa y este año se ha incorporado otro cambio: esta vez la sustitución de la tercera dosis de vacuna monovalente C por una tetravalente ACWY (calendario 2019 del CISNS) debido a los cambios epidemiológicos en los serogrupos de meningococo que se están produciendo.
Después de la inclusión de la VCMenC en el calendario vacunal, la incidencia de la enfermedad meningocócica por este serogrupo descendió de manera notable11,12,18, pero aparecen fallos vacunales, de tipo primario cuando el paciente no alcanza una adecuada concentración de anticuerpos tras la vacunación y de tipo secundario cuando el paciente es capaz de generar una respuesta de anticuerpos, pero no de mantenerla a lo largo del tiempo, que es el fallo predominante en la EMI14. En cuanto a la persistencia de los anticuerpos, diversos estudios ponen de manifiesto, en general, una disminución a medida que transcurre el tiempo desde la vacunación, en especial si la primovacunación fue en el primer o el segundo año de vida14. La respuesta inmunitaria protectora tras la serie primaria en el primer año de vida se pierde rápidamente, por lo que es necesaria una dosis de recuerdo en el segundo año de vida. La primovacunación en el segundo año proporciona también una respuesta inmunitaria que disminuye en los primeros años y no es suficiente a largo plazo, mientras que la vacunación a partir de los 5 años produce títulos de anticuerpos más cercanos a la inmunidad natural y que van aumentando con la edad de vacunación25-29.
En los estudios realizados en España se ha observado que la efectividad vacunal desciende tras un año de la vacunación, principalmente si se ha vacunado en el primer año, y se ha demostrado que la edad y el tiempo tras la primovacunación son 2de los principales factores que influyen en los fallos vacunales14,30.
De los 10 pacientes con EMI por serogrupo C de este estudio, 4 no habían recibido ninguna dosis de vacunación y 3 pacientes estaban vacunados de forma incompleta según su edad y el calendario vacunal vigente. En los 3 pacientes restantes hubo un fallo vacunal, ya que la pauta de vacunación era adecuada a su edad y al calendario vacunal; en 2niños (casos 9 y 10), de 9 y 7 años, el tiempo transcurrido tras la última dosis de vacunación excedía los 5 años, lo que probablemente fue el motivo del descenso de los anticuerpos circulantes (fallo secundario); el tercer paciente (caso 8), de 13 meses de edad, recibió las 3 dosis de la serie primaria, según el calendario vigente en ese momento, y pudo tratarse de un fallo primario.
El mantenimiento de la vigilancia epidemiológica, aun en enfermedades con tendencia a la disminución, como la EMI por serogrupo C, es muy importante para evaluar la efectividad vacunal con el paso de los años y realizar nuevas intervenciones o modificaciones de las estrategias de vacunación, como ha sucedido desde el año 2000. La implementación primero de una dosis de recuerdo en el segundo año de vida y después de una segunda en la adolescencia se ha derivado de los estudios que demuestran la disminución de la efectividad con el tiempo transcurrido desde la primovacunación.
Conflicto de interesesFAML ha recibido honorarios de GSK y de Pfizer como ponente en actos científicos y como asesor. El resto de los autores no presentan conflictos de intereses respecto a este manuscrito.
Datos de este trabajo se presentaron en el X Congreso Nacional de la Asociación Española de Vacunología (Oviedo, 3-5 de octubre de 2019).