El déficit de biotinidasa o disfunción de carboxilasas múltiple de inicio tardío (OMIM # 253260) es un trastorno metabólico infrecuente, con una incidencia de 1:60.000 recién nacidos y herencia autosómica recesiva. Debuta habitualmente en los primeros meses de vida1–3. Sus manifestaciones clínicas más comunes son: neurológicas (crisis convulsivas, retraso psicomotor, ataxia intermitente e hipotonía), cutáneas (exantema maculo papuloso y alopecia) y sensoriales (hipoacusia neurosensorial, atrofia del nervio óptico y conjuntivitis). Los pacientes con presentación tardía pueden presentar paraparesia espástica, alteraciones visuales y debilidad en las extremidades4. Bioquímicamente se caracteriza por la presencia de acidosis láctica, acidemia orgánica, hiperamoniemia y una típica excreción de ácidos orgánicos en orina (elevación de 3 hidroxipropiónico, 3 hidroxivalérico, 3 metilcrotonilglicina y metilcítrico). El tratamiento con biotina a dosis entre 5–20mg diarias resuelve todos los síntomas, salvo el retraso psicomotor y la hipoacusia establecidos, pero impide su aparición si se inicia el tratamiento en fase presintomática.
Se presenta un lactante varón, hijo de padres sanos consanguíneos (primos hermanos), sin antecedentes de interés. Embarazo obtenido por inyección intracitoplasmática de espermatozoide. Las ecografías prenatales mostraron una displasia renal izquierda. Parto a las 39 semanas sin complicaciones. Cribado neonatal para fenilcetonuria, hipotiroidismo congénito, fibrosis quística e hiperplasia suprarrenal congénita por déficit de 21 hidroxilasa normal.
A la edad de 2 meses presenta hasta 6 episodios diarios de crisis de salvas de espasmos tónicos en flexión de extremidades superiores de hasta 10 segundos de duración, al despertar, concluyendo con llanto, y somnolencia posterior. La exploración mostraba un fenotipo facial tosco, sin contacto ni seguimiento visual y escasa respuesta a estímulos auditivos. Hipertonía e hiperreflexia, principalmente en extremidades inferiores.
Vídeo-EEG en vigilia y sueño mostraba signos sugestivos de encefalopatía epiléptica, actividad de fondo desorganizada, de elevada amplitud y pobre diferenciación topográfica, con abundantes brotes de aplanamiento. En la transición vigilia-sueño se recogieron episodios de sacudidas de extremidades, en relación con dichos brotes de aplanamiento.
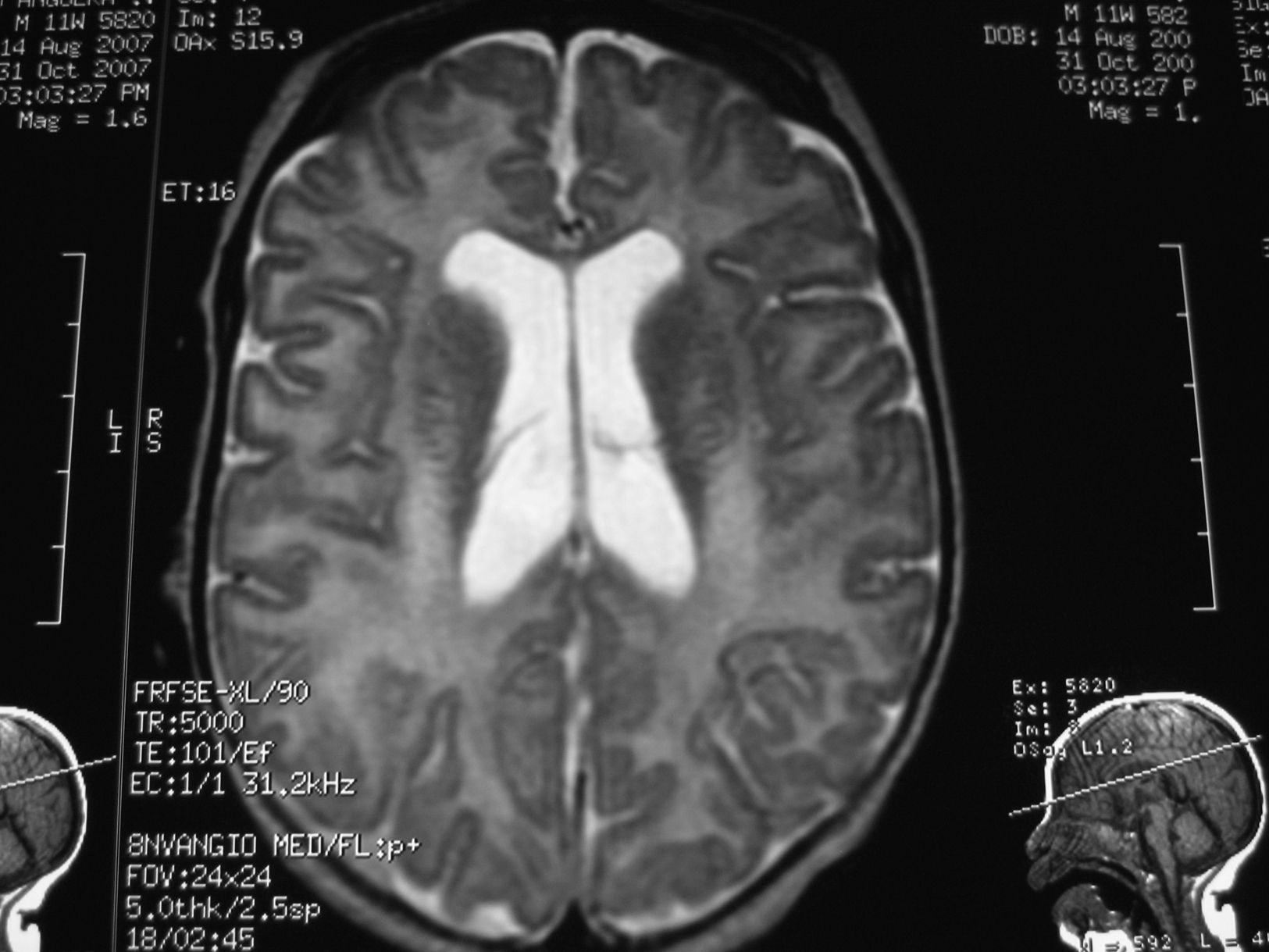
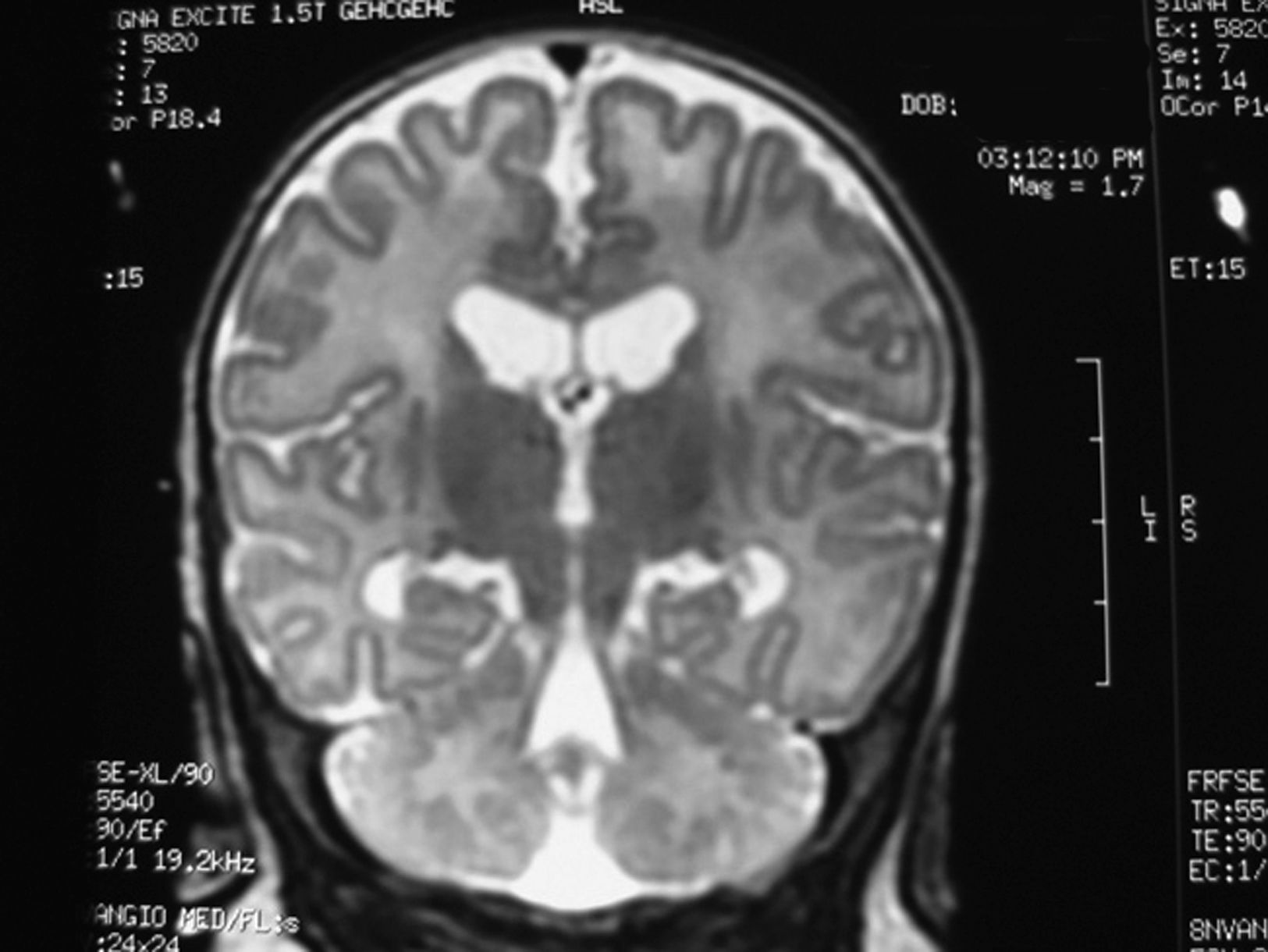
Se inició tratamiento con valproato (hasta 60mg/kg/día), con respuesta parcial de las crisis, reduciéndose a 1–2 episodios al día. Se completó estudio neurometabólico; en sangre: hemograma, bioquímica, transaminasas, hormonas tiroideas, cobre, ceruroplasmina, LDH, CPK, homocisteina, amonio, láctico, cuerpos cetónicos, ácidos grasos libres, cromatografía de ácidos grasos de cadena muy larga y aminoácidos normales. En orina: aminoácidos y mucopolisacáridos normales. Serologías de toxoplasma, CMV, rubéola, herpes virus y herpes VI negativas. Cariotipo 46 XY. TC craneal normal. RM cerebral discreta dilatación triventricular, marcada falta de mielina supra e infratentorial y aumento de los espacios pericerebrales frontoparietales (figs. 1 y 2).
Estudio oftalmológico normal, estudio cardiológico foramen oval permeable. Ecografía abdominal mostró displasia renal izquierda y bazo supernumerario.
A las tres semanas del inicio de la epilepsia, tras 2 semanas de tratamiento con valproato, presentó un exantema máculo-papular eritematoso, en tronco y extremidades, con múltiples lesiones redondeadas de unos 10mm.
Al mes y medio del inicio del cuadro, se reciben los resultados de los ácidos orgánicos en orina que mostraron elevación de los ácidos 3-hidroxipropiónico, 3-hidroxiisovalérico, 3-metilcrotonilglicina y metilcítrico, perfil compatible con un déficit de biotinidasa, al igual que el perfil de acilcarnitinas (aumento de propionilcarnitina C3: 3,68 μM [0,12–1,01]). La actividad enzimática de biotinidasa en sangre fue 4,00 nmol/min.mil (7,80–13,50), compatible con un defecto parcial de biotinidasa. Pendientes del estudio molecular. Se inició tratamiento con biotina a dosis de 20mg/día desapareciendo las crisis en 48h y normalizándose totalmente los EEG, procediéndose a la retirada gradual del valproato.
Los potenciales evocados auditivos troncoencefálicos realizados posteriormente al inicio del tratamiento con biotina mostraron disfunción de la transmisión del impulso nervioso en la vía auditiva, de forma bilateral, sin aparecer respuestas por debajo de 60dB.
En la actualidad, con 23 meses de edad, solo precisa tratamiento con biotina a 20mg/día, no ha sufrido nuevas crisis. Presenta importante hipoacusia neurosensorial, hipertonía e hiperreflexia en las extremidades inferiores, y retraso psicomotor moderado (fija mirada, se gira a su nombre, capaz de coger objetos y realizar sedestación autónoma, pero carece de lenguaje propositivo, y bipedestación autónoma).
El déficit de biotinidasa debe ser contemplado en encefalopatías precoces (sobre todo con clínica cutánea o convulsiones) ante leucoencefalopatías (la afectación de sustancia blanca puede ser reversible con el tratamiento4–6), en hipoacusias neurosensiorales no filiadas (el tratamiento presintomático evita la afectación auditiva7–9) y en afectaciones cutáneas (rash inespecíficos y/o alopecia) que se presenten con clínica neurológica. En el protocolo diagnóstico terapéutico de convulsiones en época neonatal y en primeros meses de vida de causa no aclarada tras una primera línea de investigación, y tras recoger muestras biológicas adecuadas, se debe iniciar tratamiento con cóctel vitamínico (biotina, piridoxina y ácido folínico), dado que el pronóstico depende en gran parte del inicio precoz del tratamiento en los cuadros dependientes de dichas vitaminas10.