Se ha descrito un nuevo síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2. Este cuadro presenta una expresividad clínica variable y se asocia a infección activa o reciente por SARS-CoV-2. En este documento se revisa la literatura existente por parte de un grupo multidisciplinar de especialistas pediátricos. Posteriormente, se realizan recomendaciones sobre estabilización, diagnóstico y tratamiento de este síndrome.
A new paediatric multisystem inflammatory syndrome, linked to SARS-CoV-2, has been described. The clinical picture is variable and is associated with an active or recent infection due to SARS-CoV-2. A review of the existing literature by a multidisciplinary group of paediatric specialists is presented in this document. Later, they make recommendations on the stabilisation, diagnosis, and treatment of this syndrome.
Es sabido que la infección por el nuevo coronavirus (SARS-CoV-2) en población pediátrica cursa de forma general de manera leve1,2. En España, los pacientes pediátricos menores de 15 años han supuesto un 0,4% de los ingresos hospitalarios, un 0,7% de los ingresados en cuidados intensivos y un 0,15 por 1.000 de los fallecidos1. A pesar de esto, a principios de mayo del 2020 se describe un número limitado de niños con un síndrome inflamatorio sistémico de expresividad variable3. Este muestra rasgos clínicos y analíticos similares a los observados en la enfermedad de Kawasaki (EK), el síndrome de shock tóxico (SST) o síndromes de activación macrofágica (SAM)4-7. Organismos oficiales como los Centros para el Control de Enfermedades de EE. UU., la Organización Mundial de la Salud, o el Colegio Real de Pediatría de Reino Unido definieron las características generales de este proceso5-7.
Este nuevo síndrome parece asociarse con infección activa o reciente por SARS-CoV-2. La mayoría presenta serología IgG positiva y aumento de biomarcadores de inflamación, lo que sugiere disregulación inmunitaria más que efecto patogénico directo por el virus6,7. En este documento se utilizará la denominación «síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2» o SIM-PedS para hacer referencia a este nuevo cuadro clínico.
Definiciones y diagnóstico diferencialLa definición de SIM-PedS difiere ligeramente entre distintos organismos sanitarios (tabla 1)4-6. Se debe considerar en áreas con alta incidencia actual o reciente de transmisión o enfermedad por SARS-CoV-28. En relación con la EK, muestra semejanza con sus diversos espectros clínicos (EK clásica o completa, EK incompleta, EK con shock-KDSS). Tal es así que algunos expertos recomiendan considerar el SIM-PedS en aquellos pacientes que cumplan los criterios de EK en alguna de sus formas9.
Definiciones de SIM-PedS por la Organización Mundial de la Salud (OMS), los Centros para el Control y la Prevención de Enfermedades (CDC) y el Royal College of Paediatrics and Child Health (RCPCH)
| OMS | Paciente <19 años con fiebre>3 díasy 2de los criterios siguientes: Erupción cutánea o conjuntivitis no purulenta bilateral o signos de inflamación mucocutánea (boca, manos o pies) Hipotensión o shock Datos de disfunción miocárdica, pericarditis, valvulitis o anomalías coronarias (incluidos hallazgos ecocardiográficos o valores elevados de troponina/NT-pro-BNP) Evidencia de coagulopatía (alteración de TP, TTPa o valores elevados de dímeros D) Síntomas gastrointestinales agudos (diarrea, vómitos o dolor abdominal)Y valores elevados de marcadores de inflamación (elevación de VSG, PCR o PCT)Y ninguna otra causa microbiológica evidente de inflamación, incluida la sepsis bacteriana y los síndromes de shock tóxico estafilocócico o estreptocócicoY evidencia de COVID-19 (RT-PCR, pruebas antigénicas o serología positivas) o contacto probable con un caso de COVID-19 |
| CDC | Paciente <21 años con fiebre > 24 hY evidencia de enfermedad grave que precise hospitalización con afectación de>2 órganos o sistemas (cardiaco, respiratorio, hematológico, gastrointestinal, dermatológico o neurológico) signos de respuesta inflamatoria (elevación de PCR, VSG, fibrinógeno, PCT, dímero D, ferritina, LDH o IL-6, neutrofilia, linfopenia o descenso de cifra de albúmina)Y exclusión de otros diagnósticos alternativosY evidencia de COVID-19 reciente o actual (RT-PCR, pruebas antigénicas o serología positivas) o con contacto con caso de COVID-19 en las últimas 4 semanas |
| RCPCH, UK | Fiebre persistenteY signos de respuesta inflamatoria (neutrofilia, PCR elevada y linfopenia)Y evidencia de disfunción orgánica o multiorgánica (shock, cardiaca, respiratoria, renal, gastrointestinal o neurológica), con características adicionales (ver tabla en la definición de caso). Puede incluir diagnóstico de enfermedad de Kawasaki completa o incompletaY exclusión de otras causas infecciosas, incluyendo sepsis bacteriana, shock tóxico estreptocócico o estafilocócico e infecciones asociadas a miocarditis como enterovirusLa RT-PCR para COVID-19 puede ser positiva o negativa |
COVID: del inglés coronaVirus disease; IL-6: interleucina 6; LDH: lactato deshidrogenasa; NT-pro-BNP: porción N-terminal del pro-péptido natriurético tipo B; PCR: proteína C reactiva; PCT: procalcitonina; RT-PCR: del inglés reverse transcription-polymerase chain reaction; TP: tiempo de protrombina; TPPa: tiempo de tromboplastina parcial activado; VSG: velocidad de sedimentación globular.
Son datos de especial interés en la sospecha de SIM-PedS: criterios de EK completa o incompleta de cualquier edad, presencia de síntomas gastrointestinales (vómitos, náuseas, dolor abdominal, diarrea), reactantes de fase aguda elevados, shock, hipotensión, disfunción miocárdica, linfopenia, anemia, trombocitopenia, shock, hipotensión y disfunción miocárdica (tabla 2)10.
Datos clínicos y analíticos observados con mayor frecuencia
| Datos clínicos |
| Fiebre casi 100% de los casos; fiebre> 3 días (una fiebre de corta evolución no lo descarta) |
| Síntomas digestivos (> 50%): dolor abdominal, vómitos, diarrea |
| Exantema (eritrodermia escarlatiniforme, eritema multiforme, livedo reticularis), conjuntivitis no exudativa, alteraciones mucosas, edemas periféricos (>2/3 de los pacientes) |
| Shock, taquicardia, hipotensión, hipoperfusión (alrededor de la mitad de los pacientes) |
| Cefalea, meningismo, confusión (10-20%) |
| Síntomas respiratorios: tos, disnea (30-60%) |
| Datos analíticos |
| Hemograma: leucocitosis con linfopenia, neutrofilia y trombocitopenia |
| Marcadores de inflamación: elevación de PCR, VSG, ferritina, fibrinógeno, LDH, IL-6. PCT normal o elevada (en ausencia de infección bacteriana) |
| Coagulación: fibrinógeno, dímero D elevado |
| Bioquímica: hiponatremia, hipoalbuminemia, elevación de transaminasas (ALT, AST) |
| Marcadores cardiacos: NT-pro-BNP muy elevado (> 200 ng/l), elevación de enzimas miocárdicas (troponina-I, CPK-MB) |
ALT: alanina aminotransferasa; AST: aspartato transaminasa; CPK-MB: creatina-fosfocinasa; IL-6: interleucina 6; LDH: lactato deshidrogenasa; NT-pro-BNP: porción N-terminal del pro-péptido natriurético tipo B; PCR: proteína C reactiva; PCT: procalcitonina; TP: tiempo de Protrombina; TTPa: tiempo de tromboplastina parcial activado; VSG: velocidad de sedimentación globular.
En el diagnóstico diferencial se deben considerar siempre los siguientes procesos:
- –
Sepsis de causa bacteriana.
- –
Infecciones víricas (adenovirus, enterovirus, sarampión en población no inmunizada).
- –
Abdomen agudo.
- –
SST estreptocócico o estafilocócico.
- –
Miocarditis por otros microorganismos.
- –
EK no relacionada con SARS-CoV-2.
- –
Reacción de hipersensibilidad a fármacos (síndrome de Stevens Johnson).
- –
Otras enfermedades reumatológicas sistémicas (artritis idiopática juvenil sistémica y otras enfermedades autoinflamatorias o autoinmunes).
- –
Linfohistiocitosis hemofagocítica primarias o secundarias (SAM).
La asistencia y la estabilización inicial se basarán en la aproximación ABCDE. La vía aérea habitualmente se encontrará permeable, salvo alteración del nivel de consciencia. Se administrará oxígeno suplementario acorde con las necesidades del paciente. Se monitorizará la saturación de oxígeno (SatO2) y, si está disponible, el dióxido de carbónico espirado (EtCO2). Se preparará material y medicación para secuencia rápida de intubación.
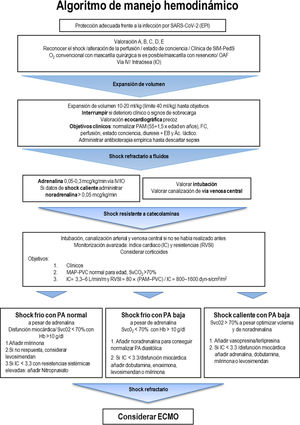
Se monitorizará la frecuencia respiratoria (FR), siendo la taquipnea sin dificultad respiratoria algo posible (compensatoria de la acidosis metabólica del shock). Se debe descartar infección pulmonar o edema pulmonar de causa cardiogénica. Se registrarán presión arterial), la frecuencia cardiaca (FC) y la perfusión periférica (relleno capilar, temperatura y coloración cutánea, calidad del pulso). Se canalizará una vía periférica (idealmente 2). Se considerará canalizar vía intraósea si no se logra. En la figura 1 se describe el abordaje hemodinámico recomendado. Es obligado valorar nivel de consciencia, pupilas, glucemia y presencia de dolor. También la presencia de exantemas, petequias y determinar la temperatura11.
Algoritmo de manejo hemodinámico en el SIM-PedS. EB: exceso de bases; ECMO: circulación por membrana extracorpórea; FC: frecuencia cardiaca; FR: frecuencia respiratoria; IC: índice cardiaco; IV: intravenoso, PAS: presión arterial sistólica; OAF: oxigenoterapia de alto flujo; PAM: presión arterial media; PVC: presión venosa central; RVSI: índice de resistencia sistémicas; SvCO2: saturación venosa central.
Modificada de American College of Critical Care Medicine Clinical Practice Parameters for Hemodynamic Support of Pediatric and Neonatal Septic Shock. Critical Care Medicine 2017;45:1062-1093.
Todo paciente con sospecha clínica de SIM-PedS será trasladado a un centro hospitalario que permita su abordaje multidisciplinar. En los casos graves, será recomendable el traslado a un centro con Unidad de Cuidados Intensivos Pediátricos (UCIP)4-6,12.
Pruebas complementarias no vinculadas a SARS-CoV-2Se deben descartar otras causas infecciosas potencialmente causantes del cuadro clínico. En la tabla 3 se muestran las pruebas complementarias recomendadas y las alteraciones más habituales en pacientes con sospecha de SIM-PedS10-13. Linfopenia, anemia y trombocitopenia, con valores más elevados de ferritina, LDH y dímero D (DD) se han observado en pacientes con shock10. En el caso de los aneurismas coronarios, se han descrito leucocitosis y linfopenia más intensas con elevación de proteína C reactiva (PCR)10-13,14.
Pruebas complementarias recomendadas y alteraciones más habituales
| Prueba | Alteración |
|---|---|
| Hemograma | Leucocitosis (habitualmente <20.000/mm3) con linfopeniaAnemia variableTrombocitopenia leve (normalmente> 50.000/mm3) |
| Ionograma | Hiponatremia |
| Bioquímica hepática y albúmina | Aumento de transaminasasHipoalbuminemia |
| Bioquímica cardiacaa | Aumento de pro-BNP (> 35 pg/ml) o NT-pro-BNP (> 125 pg/ml) y troponina ultrasensible (> 14 ng/l) |
| Gasometría | Acidosis metabólica/respiratoria, según estado clínico |
| Marcadores inflamatoriosa | Elevación de PCR (> 20 mg/l), PCT (> 0,5 μg/ml), IL-6 (> 8,5 pg/ml) y ferritina (> 120 mg/dl) |
| Estudio de coagulación | Aumento de fibrinógeno (> 400 mg/dl)Aumento significativo del dímero D (> 500 ng/ml)TP/TPPa alterados |
| Hemocultivo | Generalmente negativos |
| Otros | Coinfecciones |
| Urocultivo | |
| PCR en aspirado nasal para patógenos respiratorios | |
| Cultivo de heces/PCR patógenos en heces | |
IL-6: interleucina 6; PCR: proteína C reactiva; PCT: procalcitonina; TP: tiempo de protrombina; TTPa: tiempo de tromboplastina parcial activado.
En comparación con la EK o el SST, los pacientes con SIM-PedS presentan habitualmente mayor elevación de parámetros inflamatorios10. De forma específica, comparado con la EK clásica, este síndrome se relaciona con valores más altos de PCR, ferritina, citocinas inflamatorias y porción N-terminal del propéptido natriurético tipo B (NT-pro-BNP), y con una mayor frecuencia de linfopenia y trombocitopenia, sin diferencias en los niveles de DD14-17.
Es común también un aumento de la ratio neutrófilo/linfocito. Se observa disminución de linfocitos CD4+, CD8+ y natural killers (NK). Dicho fenómeno podría estar en relación con la infiltración del tejido extracelular por parte de estas células leucocitarias pertenecientes al sistema inmunitario innato18. Con relación a las citocinas, se puede observar elevación de la interleucina (IL)-1 en su forma soluble (IL-1-beta) e IL-619-21.
Pruebas complementarias vinculadas a SARS-CoV-2La mayoría de los pacientes con SIM-PedS presentan positividad para algún tipo de prueba diagnóstica de infección aguda o pasada por SARS-CoV-2. En todo paciente con sospecha de SIM-Peds se recomienda realizar como mínimo una toma de muestra respiratoria para realización de reacción en cadena de la polimerasa (RT-PCR). En general, se acepta que la mayor sensibilidad en la enfermedad por SARS-CoV-2 es el lavado broncoalveolar o el aspirado bronquial. Otras muestras aceptables son el frotis nasofaríngeo, el lavado nasal o el frotis faríngeo22,23. En caso de resultar negativa, y si existe una sospecha clínica elevada, se recomienda repetir en las 24-48 h siguientes. En el caso de empeoramiento clínico que suponga la necesidad de ventilación mecánica invasiva, se recomienda obtener muestra de aspirado traqueal22.
Además, se recomienda realizar siempre serología independientemente de la RT-PCR. El rendimiento será superior una vez pasados un mínimo de 10días desde el primer signo o síntoma. En el caso de RT-PCR negativa con serología negativa y alta sospecha clínica, se recomienda repetir serología a las 3-4 semanas del ingreso. Se ha descrito que un 26-55% de los pacientes con SIM-PedS tienen RT-PCR positiva y hasta un 90% serología IgG positiva10-17. Se pueden detectar anticuerpos a partir de los 10-15 días desde el contagio, alcanzando la mayor seroconversión acumulada en torno a los 16-21 días22,23.
Pruebas de imagenLa radiografía o ecografía torácica se indicarán en caso de sintomatología respiratoria o para localizar dispositivos (tubo endotraqueal o catéter central)24. La radiografía de tórax puede mostrar alteraciones en un elevado porcentaje de casos8-25. Se ha descrito imagen neumónica con infiltrados, condensaciones parcheadas, en vidrio esmerilado o patrón intersticial, atelectasias o derrame pleural. En la ecografía torácica se pueden observar patrones de neumonía o aumento del agua pulmonar. La tomografía computarizada (TC) torácica no se recomienda de rutina, excepto en neumonía complicada, mala evolución o en paciente inmunocomprometido.
Se realizará ecografía o TC abdominal si existe clínica abdominal indicativa de abdomen agudo, para detectar complicaciones y la necesidad de cirugía. Está descrita la presencia de ileocolitis.
Pruebas complementarias vinculadas a la función cardiacaSe recomienda la realización de ecocardiografía a todos los pacientes con SIM-PedS. En las formas leves, no es habitual la presencia de alteraciones ecocardiográficas. En las formas más graves, se ha descrito disfunción sistólica del ventrículo izquierdo, disfunción del ventrículo derecho, insuficiencia mitral, derrame pericárdico y dilatación o aneurismas de las arterias coronarias (AC)13. La evaluación de las AC incluye la determinación del Z-score y la clasificación según el Consenso Nacional de la Enfermedad de Kawasaki26. A su vez, un porcentaje elevado presenta elevación de troponina I o T (55-68%) y BNP/NT-pro-BNP (83-100%), con cifras significativamente mayores en aquellos que desarrollan shock3,10-19.
El electrocardiograma generalmente es inespecífico. Puede mostrar alteraciones indicativas de afectación miocárdica como voltajes bajos, anomalías del segmento ST y onda T o intervalo QTc prolongado. Se han descrito diversos grados de bloqueo auriculoventricular, arritmias supraventriculares y ventriculares9-13. En cuanto a la resonancia magnética cardiaca, no está indicada en el periodo agudo. Se debe valorar su realización con base en la sospecha de afectación cardiaca, la seguridad durante su realización y la disponibilidad en el centro.
Hospitalización y seguimientoTodo paciente con sospecha de SIM-PedS debe ser ingresado en planta de hospitalización para observación y tratamiento, si procede. Se primará que el personal sanitario que esté en contacto con el paciente sea el mínimo necesario. Utilizará, como mínimo, mascarilla FFP2, bata desechable, guantes y protección ocular hasta al menos una segunda RT-PCR negativa. Un elevado porcentaje de pacientes tendrán una prueba RT-PCR negativa. Esto indicaría una baja o nula contagiosidad. En casos de posible de infección activa aún con RT-PCR negativa, se realizará un segunda RT-PCR. Se resumen las recomendaciones de aislamiento, monitorización y tratamiento en la figura 2.
Paciente críticoEn caso de requerir ingreso en la UCIP se ingresará en una habitación aislada, preferentemente con presión negativa27. Si se requieren maniobras que produzcan aerosoles, se utilizará mascarilla FFP3, gafas de protección integral, mono integral o capucha, bata desechable impermeable o, si no lo es, con delantal impermeable y guantes. En caso de requerir maniobras como la intubación se utilizará también doble guante.
El paciente estará acompañado de un familiar o cuidador que seguirá las medidas de aislamiento e higiene que se le indiquen y que llevará, como mínimo, mascarilla quirúrgica, bata y guantes. Si los resultados de RT-PCR resultan negativos, se valorará modificar las medidas de protección, manteniendo siempre el aislamiento por contacto y por gotas.
Se realizará la monitorización habitual establecida para los pacientes ingresados en la UCIP, en función de su situación y gravedad. En los casos graves, se valorará realizar una canalización arterial y venosa central precoces28.
Soporte respiratorioSe ha descrito afectación respiratoria hasta en un 70% de casos y el requerimiento de soporte respiratorio habitualmente se relaciona con la repercusión cardiaca o hemodinámica24. Se administrará oxigenoterapia mediante gafas nasales cubiertas con mascarilla quirúrgica para mantener la SatO2 entre 94-98%. Si por la situación clínica o gasométrica la oxigenoterapia no fuera suficiente, se valorará el uso de oxigenoterapia de alto flujo (OAF) o de ventilación no invasiva (VNI). Siempre debe hacerse con las medidas de aislamiento y protección adecuadas.
Si hay hipoxemia sin hipercapnia, considerar iniciar OAF.
Si la OAF no es efectiva o como alternativa a esta, iniciar VNI con CPAP, con mascarilla buconasal, facial total o Helmet (este último es el modo más estanco). Si existe hipercapnia asociada, valorar el uso de bilevel positive airway pressure (BIPAP, o presión positiva en 2niveles en vía aérea)29.
Si no hay una mejoría clara de los parámetros clínicos (FC, FR, dificultad respiratoria) y de oxigenación (PaO2/FiO2, SatO2/FiO2) en las primeras horas, se recomienda intubación precoz. Además, se valorará intubación precoz si existe deterioro del estado de consciencia o shock refractario a fluidos o resistente a catecolaminas29. Se recomiendan los siguientes parámetros iniciales de asistencia: volumen tidal de 4-8ml/kg, búsqueda de presión positiva al final de la espiración óptima para lograr un reclutamiento adecuado, presiones mesetas menores de 30cmH2O y drive pressure menor de 15cmH2O22. Si evoluciona a un síndrome de distrés respiratorio agudo moderado-severo, se seguirán las recomendaciones de ventilación protectora con hipercapnia permisiva, uso de prono y de bloqueo neuromuscular. Se reserva el óxido nítrico para situaciones de hipoxemia refractaria, especialmente si está asociada a hipertensión pulmonar30.
Soporte hemodinámicoLa inestabilidad hemodinámica se encontrará habitualmente relacionada con shock vasopléjico o disfunción cardiaca5,31. Los abordajes recomendados y los objetivos del tratamiento hemodinámico se resumen en la figura 111. En la disfunción cardiaca, además de adrenalina, valorar asociar milrinona o si es moderada/grave, levosimendán.
Tratamiento farmacológicoEl tratamiento inmunomodulador se usará de forma escalonada, constituyendo la primera línea la inmunoglobulina intravenosa (IGIV) o los corticoides24-32. En casos graves o sin respuesta, se recomienda combinarlos.
Tratamiento inmunomoduladorInmunoglobulina intravenosaLa IGIV se utiliza en dosis de 2g/kg, sobre todo en casos que cumplen criterios de EK o de SST12-17. En caso de inestabilidad hemodinámica se podrá administrar 1g/kg/día durante 2días. Se consideraría la administración de una segunda dosis a las 36 h de la primera ante la persistencia de fiebre17-31.
Corticoides sistémicosLa administración de corticoides por vía intravenosa estaría indicada tanto como primer escalón como para en pacientes que no respondan a una primera dosis de IGIV. Se debe considerar su uso precoz ante factores de riesgo para la presencia de aneurismas coronarios o criterios analíticos compatibles con SAM20-26.
- –
Formas leves-moderadas: metilprednisolona por vía intravenosa 1-2mg/kg/día durante 3-5 días y suspender. En aquellos casos que requieren un tratamiento de 6 o más días o bien persiste clínica o biomarcadores de inflamación elevados, se realizará paso posterior a prednisona oral y reducción progresiva en 2-3 semanas.
- –
Formas graves (shock, especialmente si requieren altas dosis de inotrópicos/vasopresores): metilprednisolona intravenosa 1-2mg/kg/día durante 3-5 días o metilprednisolona intravenosa 30mg/kg/día durante 1-3 días (máximo 1 g). Se continuará en caso de buena respuesta con prednisona por vía oral a 1-2mg/kg/día, con disminución progresiva hasta normalización de los parámetros inflamatorios.
- –
Formas Kawasaki-like: asociar corticoides juntamente con la IGIV en los pacientes de alto riesgo de resistencia a IGIV (varón, menor de 12 meses, PCR mayor de 100mg/l, cifra de plaquetas inferior a 300.000/mm3, alanina aminotransferasa mayor de 100 UI/l, neutrofilia superior al 80%, sodio menor de 133 mmol/l)9.
El bloqueo de IL-1 (anakinra) se ha utilizado con éxito en la neumonía grave con hiperinflamación por SARS-CoV-233, SAM y en EK refractaria a IGIV/corticoides. Con base en esto, podría ser de utilidad en SIM-PedS. Su vida media corta, su rapidez de acción y la escasa asociación a sobreinfecciones bacterianas lo postulan como un fármaco seguro. Aunque se presenta en jeringa para administración subcutánea, se ha empleado por vía intravenosa en casos graves5-10. Se mantendría durante 5-14 días, según respuesta clínica (tabla 4).
Dosificación, precauciones y forma de administración de los inmunomoduladores
| Fármaco | Dosis | Dilución | Efectos secundarios | Precauciones | |
|---|---|---|---|---|---|
| Anti- IL-1 | Anakinra | Subcutáneo2 mg/kg/día con ascenso progresivo hasta 8 mg/kg/día c/12ha (dosis máxima 400 mg/día)Intravenosob2 opciones:1) pauta similar a la vía subcutánea2) perfusión continua<20 kg: 2 mg/kg dosis única, seguido de 0,02 ml/kg/h en pc> 20 kg: 2 mg/kg dosis única, seguido de 0,01 ml/kg/hDosis máx. 400 mg/día | Si intravenosa, diluir con SF con concentración 4-36 mg/ml | Reacción local en lugar de inyección, cuadro seudogripal, neutropenia, cefalea, mialgias, susceptibilidad infecciones | Aplicar frío local en el punto de administración subcutáneaMonitorizar transaminasas |
| Anti-TNF-α | Infliximab | 5 mg/kg | Diluir el volumen de dosis reconstituida en 250ml de SF. Administrar en 2 h | Reacción anafiláctica, infecciones | Valorar premedicar con antihistamínico y corticoide para evitar reacción infusional |
| Anti- IL-6 | Tocilizumab | Dosis única<30 kg: 12 mg/kg> 30 kg: 8 mg/kg(dosis máxima 800 mg) | <30 kg: diluir en 50ml de SF> 30 kg: diluir en 100ml de SFAdministrar en 1 h | Neutropenia, trombocitopenia, hipertransaminasemia, infecciones, perforación intestinal | Vigilancia estrecha de infecciones asociadas (evita ascenso PCR)No usar si <100.000 plaquetas, <500 neutrófilos o GOT/GPT> 3 veces el valor basal |
Infliximab se ha propuesto como una alternativa al tratamiento en los pacientes con EK resistente a IGIV, sin embargo, en los ensayos clínicos, aunque aceleró la mejoría clínico-analítica, no modificó el pronóstico a nivel coronario a largo plazo10,11. La experiencia en SIM-PedS es limitada (tabla 4).
Bloqueo de interleucina 6Tocilizumab está aprobado para el tratamiento del síndrome liberador de citocinas asociado a CAR-T y existen diferentes ensayos para el tratamiento de pacientes con neumonía por SARS-CoV-2. Se ha empleado puntualmente en el SIM-PedS, no obstante el uso de tocilizumab en pacientes con EK podría acelerar la formación de aneurismas coronarios34,35 (tabla 4).
Tratamiento antiviralEn el momento de redactar este documento no se ha descrito evidencia con relación a la eficacia y seguridad de ningún fármaco dirigido contra el virus en la infancia. No se recomienda el uso de hidroxicloroquina36,37 ni su combinación con azitromicina37,38. A pesar de que el papel del SARS-CoV-2 en el SIM-PedS no está claro, en caso de infección activa, alta sospecha o casos graves cabe plantearse el tratamiento con remdesivir (tabla 5). Su uso en pediatría se logra a través de ensayo clínico o como uso compasivo previa autorización39.
Dosificación y efectos secundarios de fármacos antivirales
| Fármaco | Indicación | Dosis | Efectos secundarios | Monitorización |
|---|---|---|---|---|
| Remdesivir (intravenoso) | Ensayo clínico/uso compasivo | – 2,5-40 kgDosis carga: 5 mg/kg/24 h (1 dosis)Dosis mantenimiento: 2,5 mg/kg/24 h– ≥ 40 kgDosis carga: 200 mg/24 h (1 dosis)Dosis mantenimiento: 100 mg/24 h | HipertransaminasemiaAlteración función renal | TransaminasasFunción renal |
Se considerará el uso de heparina de bajo peso molecular de forma profiláctica en los siguientes casos39:
- a.
DD igual o superior a 6 veces su valor normal.
- b.
Paciente inmovilizado.
- c.
Presencia de aneurismas gigantes.
- d.
Disfunción grave del ventrículo izquierdo (fracción de eyección <30%).
- e.
Antecedentes personales o familiares de enfermedad tromboembólica.
- f.
Antecedentes personales de enfermedad isquémica arterial (periférica, cardiaca o neurológica).
Se usará enoxaparina subcutánea 1mg/kg/día (en el caso de presentar insuficiencia renal con filtrado glomerular menor de 30ml/min/m2, se utilizará una dosificación de 0,25mg/kg/12h). Control de anti-Xa a las 48-72h (nivel recomendado 0,3-0,49). Se mantendrá hasta resolución del cuadro y hasta DD normalizado según valores de referencia en el centro de ingreso.
En pacientes con tromboembolia o sospecha de trombosis venosa profunda, se indicará enoxaparina 1mg/kg/dosis cada 12 h por vía subcutánea. En dosis de anticoagulación (0,5-1 de anti-Xa), control de anti-Xa a las 48h (ajuste de dosis según referencia). Se mantendrá durante todo el ingreso realizándose consulta al servicio de Hematología de forma previa al alta.
Tratamiento con ácido acetilsalicílicoExisten 2posibles indicaciones:
- –
Antiinflamatoria: pacientes SIM-PedS que cumplan criterios de EK clásica o incompleta. Será indicado junto con la IGIV. Se debe iniciar tratamiento con ácido acetilsalicílico (AAS) a 30-50mg/kg/día cada 6 h, por vía oral, hasta que el paciente esté 48 h afebril. En ese momento se disminuirá a dosis antiagregante, 3-5mg/kg/día en una dosis oral. Se mantendrá esta dosis hasta 6-8 semanas del inicio de la enfermedad y tras comprobar la normalización del recuento plaquetario, reactantes de fase aguda y ecocardiograma26.
- –
Antiagregante: en los pacientes con SIM-PedS con afectación clínica grave, presencia de aneurismas, datos clínicos o analíticos de inflamación o trombocitosis superior a 700.000/mm3, se valorará AAS a dosis antiagregante durante 6 semanas (se debe confirmar una ecocardiografía normal tras este periodo). Esta recomendación se realiza porque se ha descrito alteraciones coronarias también en pacientes sin características de EK o EK incompleta10.
Podrán ser candidatos a oxigenación por membrana extracorpórea (ECMO) los pacientes con SIM-PedS que presenten un cuadro clínico refractario a las medidas convencionales máximas, con situación que se prevé reversible y que no presentan contraindicaciones habituales absolutas para ECMO40. Resultará fundamental derivar estos pacientes antes de que su condición haga imposible el transporte convencional. En estas ocasiones, valorar el transporte en ECMO con canulación en su hospital de origen por equipos entrenados.
Alta y seguimientoSe evaluará el riesgo potencial de transmisión de SARS-CoV-2 en domicilio. Se considera que los pacientes con RT-PCR negativa y serología IgG positiva no son infecciosos. A su vez, la presencia de serología IgG positiva con RT-PCR positiva o positivización de esta prueba tras previas negativas se interpreta actualmente como detección de restos virales sin capacidad infectiva. Se recomienda un seguimiento ambulatorio multidisciplinar y coordinado con la participación de los pediatras de atención primaria (fig. 2).
Conflicto de interesesJordi Antón ha obtenido becas para proyectos de investigación, recibido honorarios por conferencias y consultorías y asistido a congresos médicos con el soporte de Sobi y Roche. Esmeralda Núñez ha participado en actividades formativas de AbbVie, Roche y Sobi. Inmaculada Calvo ha participado en actividades formativas de Novartis, AbbVie, Sobi, Roche y GSK. También ha colaborado en workshops de GSK, Novartis y Sobi. Javier Pérez-Lescure Picarzo ha realizado formación remunerada para MSD. El resto de los autores de este consenso no presenta conflicto de intereses.
A todos los profesionales sanitarios vinculados al cuidado de la infancia. A los pacientes y sus familias.
Sylvia Belda Hofheinz (SECIP, Hospital Universitario 12 de Octubre de Madrid), Inmaculada Calvo Penadés (SERPE, Hospital Universitario y Politécnico La Fe), Juan Carlos de Carlos Vicente (SECIP, Hospital Universitario Son Espases), Carlos Daniel Grasa Lozano (SEIP, Hospital Universitario La Paz), Susanna Hernández Bou (SEUP, Hospital Sant Joan de Déu), Rosa M. Pino Ramírez (SEPHO, Hospital Sant Joan de Déu), Esmeralda Núñez Cuadros (SERPE, Hospital Regional Universitario de Málaga), Javier Pérez-Lescure Picarzo (SECPCC, Hospital Universitario Fundación Alcorcón), Jesús Saavedra Lozano (SEIP, Hospital General Unversitario Gregorio Marañón), Diana Salas-Mera (SECPCC, Hospital Universitario La Paz), Enrique Villalobos Pinto (SEPHO, Hospital Infantil Universitario Niño Jesús).