La prevalencia de la hipertensión arterial ha aumentado considerablemente en la edad pediátrica como consecuencia principal de su detección en niños mayores y adolescentes, en quienes predomina la causa esencial (primaria). En otras etapas de la edad pediátrica la HTA es menos frecuente, en especial en lactantes. En este grupo la hipertensión arterial obedece casi siempre a causas secundarias, en ocasiones potencialmente graves, por lo que resulta imprescindible detectarla, llevar a cabo un proceso diagnóstico etiológico adecuado y proporcionar al paciente un adecuado tratamiento, que suele requerir de un profesional especializado. A las dificultades técnicas propias de la medición de la presión arterial en los lactantes se añade la ausencia de recomendaciones específicas relacionadas con su identificación sistemática y de valores de normalidad bien establecidos en este rango de edad, por lo que su manejo constituye un reto diagnóstico y terapéutico para el profesional. A través de la exposición de 3 casos de hipertensión detectada en la etapa de lactante, se pretende sensibilizar al pediatra sobre esta enfermedad, así como proporcionar información sobre su orientación diagnóstica y terapéutica, incidiendo asimismo en las medidas farmacológicas.
Arterial Hypertension prevalence (HTN) has significantly increased in paediatric patients, mainly in older children and teenagers. In these subjects the most common type is essential or primary HTN. However, in infants HTN prevalence is significantly lower and is almost always due to secondary causes, which can be potentially severe. Hence the importance of its detection, in order to establish an etiological diagnosis and provide an appropriate treatment, which usually requires a specialist physician. In addition to the technical difficulties of blood pressure measurement in infants, the lack of recommendations to perform a systematic screening in this age range and the absence of well-established normal values turns infancy-onset HTN into a diagnostic and therapeutic challenge for the physician. By means of the exposition of three infancy-onset HTN cases, the aim is to increase the paediatrician's awareness of this pathology and also to provide information about its diagnostic and therapeutic approach, dealing also with pharmacological measures of treatment.
La prevalencia de la hipertensión arterial (HTA) en edad pediátrica ha aumentado en las últimas décadas por el incremento del diagnóstico en niños mayores y adolescentes, vinculado, en líneas generales, con causas esenciales (primarias) y con la creciente concurrencia de sobrepeso y obesidad 1.
La HTA en lactantes y niños pequeños es significativamente menos frecuente y casi siempre secundaria a causas reconocibles. A diferencia de las indicaciones sólidamente establecidas en el despistaje sistemático de HTA en los niños por encima de los 3 años de vida, por debajo de esta edad solo se recomienda en casos específicos con factores de riesgo asociados 2 (tabla 1). Además, la dificultad para medir con fiabilidad la presión arterial (PA) complica la detección de HTA a esta edad.
Indicaciones de toma de la presión arterial en menores de 3 años
| Ingreso en cuidados intensivos en época neonatal |
| Cardiopatía |
| Enfermedad renal o malformación urológica grave |
| Infecciones urinarias recurrentes, hematuria o proteinuria |
| Tratamiento con fármacos que elevan la presión arterial |
| Evidencia de hipertensión intracraneal |
| Enfermedad oncohematológica |
| Trasplante de órgano sólido o de médula ósea |
| Enfermedades sistémicas asociadas con hipertensión (neurofibromatosis, esclerosis tuberosa, drepanocitosis, etc.) |
Con base en la breve descripción de 3 casos clínicos ilustrativos y la posterior discusión de los puntos más relevantes, este artículo pretende llamar la atención del pediatra sobre la HTA en lactantes con los objetivos de dar a conocer causas poco habituales de esta entidad, facilitar su identificación precoz y comentar aspectos clínicos relacionados con su manejo práctico.
Casos clínicosCaso 1PresentaciónUn varón de 2 meses de edad ingresó en la Unidad de Cuidados Intensivos Pediátricos de nuestro hospital por un cuadro de insuficiencia respiratoria aguda en el contexto de una bronquiolitis. Durante su estancia se objetivaron valores de PA persistentemente elevados, en torno a 150/80mmHg (percentil 95 para su edad y talla 95/50mmHg). Los estudios iniciales realizados, incluyendo urea y creatinina séricas, catecolaminas urinarias, hormonas (tiroideas, cortisol, renina y aldosterona), fondo de ojo, ecocardiografía y angio-TC abdominal, no mostraron alteraciones significativas. Se inició tratamiento con hidralazina (1,3mg/kg/día) y a los 10 días, tras el alta, se añadió enalapril oral hasta un máximo de 0,5mg/kg/día.
Evolución clínicaEn los meses posteriores presentó buen control de la PA, por lo que se suspendió el tratamiento con hidralazina a los 5 meses de vida y se mantuvo el enalapril en monoterapia. Durante el seguimiento del paciente se evidenció un fenotipo especial (macrocefalia y rasgos faciales toscos: frente prominente, puente nasal ancho con narinas antevertidas y sinofridia), junto a un estancamiento ponderoestatural, dificultad para la alimentación, retraso psicomotor e hipotonía generalizada. Entre las pruebas diagnósticas realizadas posteriormente se detectó una elevación de glucosaminoglicanos en orina de 52mg/mol de creatinina (valores normales 0,92-16,25). El estudio genético a los 12 meses de vida identificó una variante patogénica en homocigosis p.Trp402 en el gen IDUA. Se realizó trasplante de progenitores hematopoyéticos en 2 ocasiones (a los 17 y a los 19 meses de vida, tras el fallo del primer injerto) y se inició tratamiento sustitutivo con laronidasa. Dieciocho meses después del segundo trasplante se suspendió el tratamiento antihipertensivo. Actualmente, con 5 años de edad, tiene función renal y PA normales.
DiagnósticoMucopolisacaridosis (MPS) tipo i en su forma más grave (síndrome de Hurler). Las MPS son enfermedades raras de depósito lisosomal y de transmisión hereditaria autosómica recesiva, a excepción de la MPS tipo ii (ligada al cromosoma X). Su incidencia total se estima en uno de cada 20.000 nacidos vivos 3,4. Están causadas por un déficit de metabolización de glucosaminoglicanos, de tal forma que los fragmentos parcialmente degradados de estos se acumulan en los lisosomas, originando disfunción celular multiorgánica progresiva. La MPS tipo i está causada por el déficit de alfa-L-iduronidasa y la consiguiente acumulación de heparán sulfato y dermatán sulfato.
Caso 2PresentaciónUna recién nacida procedente de una gestación de 36 semanas (peso al nacimiento 2.410g) y diagnosticada intraútero de oligoamnios y nefromegalia bilateral desarrolló, en el período neonatal inmediato, un cuadro de dificultad respiratoria por neumotórax derecho que requirió drenaje y ventilación mecánica no invasiva. En la primera semana de vida presentó oligoanuria, elevación de la creatinina plasmática hasta un máximo de 1,05mg/dl y valores elevados de manera mantenida de PA (cifra máxima de 110/85mmHg, siendo el percentil 95 para su edad gestacional de 92/65mmHg). Fue tratada inicialmente con amlodipino y captopril. La ecografía abdominal mostró múltiples quistes hepáticos y nefromegalia bilateral, con pérdida de diferenciación corticomedular y pequeños quistes corticales y medulares. El estudio genético confirmó 2 variantes probablemente patogénicas en heterocigosis, p.Thr36Met (c.107C>T) y p.Arg3240Gln (c.9719 G>A), en el gen PKHD1.
Evolución clínicaTras la etapa neonatal persistió la HTA, que obligó a continuar el tratamiento antihipertensivo con enalapril y amlodipino, ambos a dosis entre 0,2-0,3mg/kg/día. A partir de los 3 meses de vida desarrolló proteinuria, que alcanzó rango nefrótico (cociente proteínas/creatinina máximo 10,2mg/mg), e hipertrofia leve del ventrículo izquierdo.
Actualmente, a los 20 meses de edad, presenta enfermedad renal crónica estadio 3a (filtrado glomerular estimado de 55ml/min/1,73m2), la proteinuria ha disminuido significativamente tras la optimización de la dosis de enalapril (si bien continúa en rango patológico: 0,6-1mg/mg) y persiste la hipertrofia del ventrículo izquierdo, aunque sin repercusión hemodinámica.
DiagnósticoPoliquistosis renal autosómica recesiva (PQRAR). La PQRAR es una enfermedad causada por mutaciones en el gen PKHD1, localizado en el cromosoma 6, que codifica la fibrocistina o poliductina, una proteína de membrana expresada en los túbulos colectores corticales y medulares y en las células epiteliales de los conductos biliares5. Estas alteraciones genéticas se traducen en la formación de quistes renales medulares y corticales. Posteriormente se desarrolla fibrosis intersticial, que contribuye a un deterioro progresivo de la función renal.
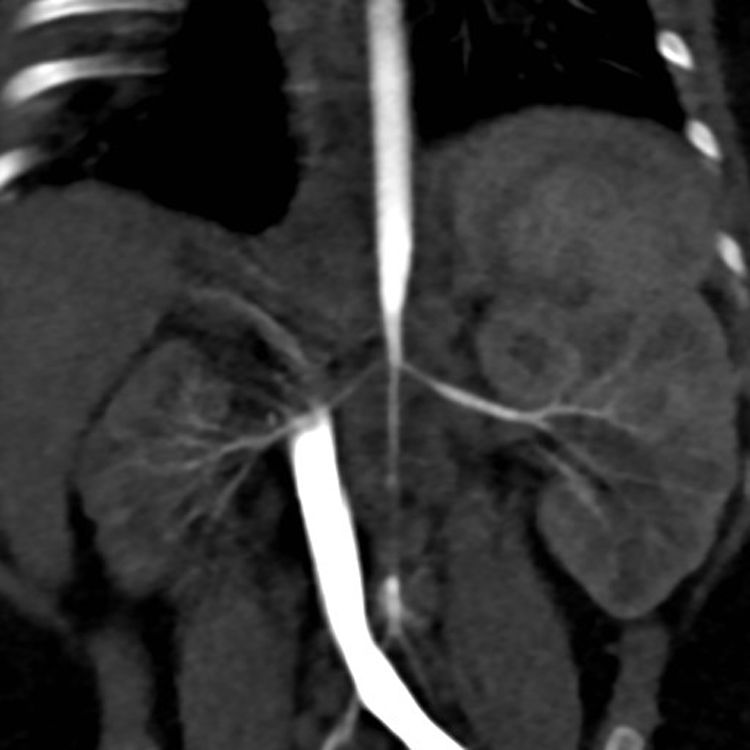
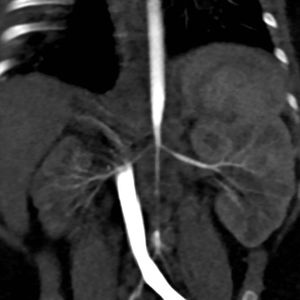
Caso 3PresentaciónUna lactante mujer de 4 meses de vida, con diagnóstico prenatal de miocardiopatía hipertrófica (atribuida inicialmente al cierre intraútero del ductus), ingresó en la Unidad de Cuidados Intensivos Pediátricos por una urgencia hipertensiva (PA domiciliaria de 180/110mmHg). En la exploración no presentaba pulsos femorales palpables y no tenía un soplo abdominal audible. Una gammagrafía renal y una angio-TC de aorta abdominal detectaron un riñón derecho pequeño e hipofuncionante (9,7% de función renal diferencial) y una disminución importante del calibre de la aorta abdominal por debajo de la arteria mesentérica superior, con estrechamiento del origen de las arterias renales (fig. 1).
Evolución clínicaSe inició tratamiento farmacológico (amlodipino y propranolol) y se derivó a un centro internacional de referencia, en el que se le practicó una angioplastia a los 6 meses de vida. Tras la misma, se objetivó una mejoría de la hipertrofia miocárdica. En la angio-TC de control se observó un aumento del calibre de las arterias renales (2,5 y 2mm respecto a 2 y 1,3mm previamente). A los 20 meses de vida se le realizó una nueva angioplastia. Actualmente, con 3 años de edad, presenta un buen control de la PA con un solo fármaco (atenolol).
DiagnósticoSíndrome de aorta media. Este término hace referencia al estrechamiento segmentario de la aorta abdominal y de sus ramas, principalmente las arterias renales6. Habitualmente, la HTA es grave y representa un reto terapéutico que puede requerir de múltiples fármacos y tratamiento quirúrgico o endovascular.
DiscusiónLos 3 casos comentados reflejan particularidades de la HTA del lactante que son de interés para el pediatra:
- I)
Todos fueron diagnosticados en el ámbito hospitalario, bien como pacientes ingresados, bien en consultas especializadas, mostrando así que la HTA a esta edad no suele identificarse en atención pediátrica general, si bien deben recordarse los signos clínicos de alarma y los grupos de riesgo en los que se recomienda tomar la PA antes de los 3 años (tabla 1).
- II)
Ponen de manifiesto el origen secundario de la HTA y la necesidad de estudios dirigidos a descartar enfermedades sistémicas, renales y vasculares, fundamentalmente.
- III)
Es cierto que el diagnóstico de HTA en las primeras semanas o meses de vida requiere un método de registro fiable y valores de referencia específicos, que se comentarán posteriormente. Sin embargo, los valores de PA encontrados en HTA secundarias son con frecuencia suficientemente altos para plantear pocas dudas diagnósticas e incluso causar afectación de órganos diana, aunque sí debe confirmarse su persistencia y considerarse factores transitorios como estrés, dolor y, por supuesto, errores de medición.
- IV)
El tratamiento de la HTA debe ir orientado tanto al abordaje de la enfermedad causal, en ocasiones por servicios multidisciplinares de referencia, como al descenso farmacológico de la PA, lo que requiere el conocimiento del pediatra de los medicamentos más eficaces y la utilización de aquellos con los que se tenga experiencia.
En el primer caso se describe una HTA, diagnosticada casualmente en el contexto de una infección respiratoria, que condujo al diagnóstico de una metabolopatía: la MPS tipo i (síndrome de Hurler). Con el tratamiento adecuado de esta enfermedad se obtuvo una normalización de las cifras de PA y el paciente no ha vuelto a precisar tratamiento antihipertensivo. La HTA en el síndrome de Hurler, si bien no es la manifestación más frecuente, está descrita en la literatura7–9. El mecanismo patogénico de la HTA en esta enfermedad no está bien establecido, pero se han implicado la oclusión arterial de la aorta y las arterias renales por el depósito de mucopolisacáridos10,11 y la obstrucción crónica de la vía aérea superior.
En el segundo caso, el diagnóstico de HTA se realizó en un paciente afecto de una nefropatía primaria (PQRAR). En estos pacientes la HTA habitualmente se desarrolla en los primeros meses de vida y es de difícil control, aunque a menudo tiende a mejorar transitoriamente después de la etapa de lactante12,13. La patogénesis de la HTA no está bien definida; puede estar provocada por una activación local del sistema renina-angiotensina-aldosterona y por el aumento de la reabsorción de sodio, por lo que el tratamiento con inhibidores de la enzima convertidora de angiotensina (IECA) constituye una buena opción terapéutica, aunque debe considerarse con precaución su uso en lactantes prematuros o por debajo del mes de vida14,15. Un control inadecuado de la HTA puede conllevar un empeoramiento acelerado de la función renal y ocasionar complicaciones cardíacas y del sistema nervioso central16. Debe medirse con frecuencia la PA en los primeros meses de la vida a estos pacientes. Aunque no es una medida generalizada, puede contemplarse la posibilidad de control de PA domiciliario con dispositivos oscilométricos validados con un manguito apropiado en pacientes seleccionados17.
En el último caso, la aparición de HTA refractaria llevó al diagnóstico de una HTA renovascular grave relacionada con un síndrome de aorta media, cuyo manejo supuso un reto diagnóstico y terapéutico. La HTA renovascular es una forma de HTA secundaria a una estenosis de las arterias renales. La consiguiente disminución del flujo plasmático renal conlleva una disminución del filtrado glomerular, lo cual estimula el sistema renina-angiotensina-aldosterona. La acción vasoconstrictora de la angiotensina-ii y la retención de sodio y agua a nivel renal inducida por la aldosterona elevan las cifras de PA18. El hallazgo de la HTA fue a raíz de los controles de una cardiopatía, por lo que esta paciente, al igual que el caso de la PQRAR, pertenecía a los grupos de riesgo en los que estaría indicado el cribado de HTA.
Como se puede observar en la casuística expuesta, resulta crucial detectar precozmente la HTA en la etapa de lactante. Los problemas derivados de la medición de la PA en este grupo etario, además de la ausencia de recomendaciones para realizar un despistaje sistemático en esta franja de edad, suponen una dificultad añadida para su correcta identificación. En efecto, la medición de la PA es ardua y puede verse influida de forma habitual por diversos condicionantes externos (aparataje técnico, lugar de medición, período de medición con llanto o sueño, posición del lactante, etc.). En la práctica clínica, una medición adecuada continúa siendo difícilmente alcanzable y en muchos centros aún no se utilizan habitualmente protocolos adaptados a pacientes menores de un año19. Con el objetivo de estandarizar la medición de la PA en esta población ya ha sido publicado un protocolo específico20, que ha sido apoyado por una revisión sistemática reciente21, con las siguientes recomendaciones:
- •
Método: oscilométrico, como procedimiento habitual. Medición invasiva intraarterial como confirmación, si es necesario en casos seleccionados.
- •
Manguito con vejiga hinchable que tenga una anchura de aproximadamente el 50% de la circunferencia de la zona media del brazo del niño.
- •
Lugar de medición: brazo derecho.
- •
La PA media por oscilometría es la mejor para comparar con los valores de referencia.
- •
Realizar al menos 3 determinaciones separadas por 2min entre ellas.
Otra dificultad en los lactantes es la propia definición de HTA. Se sabe que la PA aumenta fisiológicamente con la edad y la ganancia ponderal desde los primeros momentos de la vida, por lo que la definición de HTA en pediatría se sustenta en la distribución de la PA en la población de niños sanos y no en la morbimortalidad cardiovascular asociada con un nivel concreto de PA, al contrario que en la población adulta. Se define la HTA como la presencia de PA sistólica y/o diastólica persistentemente elevada por encima del percentil 95 para el sexo, edad y talla, en al menos 3 determinaciones separadas. Valores entre el percentil 90 y 95 se consideran pre-HTA (guías americanas2) o PA normal-elevada (guías europeas1).
Por otra parte, otros condicionantes añadidos (edad gestacional, edad posnatal y posconcepcional, peso al nacimiento, peso al nacimiento en relación con la edad gestacional, etc.) deben ser tenidos en cuenta a la hora de considerar los valores de normalidad durante los períodos iniciales de la vida. Dionne et al. recopilaron en 201217 los datos disponibles hasta entonces de PA neonatal22–31 y crearon una tabla resumen de los valores de PA en neonatos de entre 26 y 44 semanas de edad posconcepcional con el objetivo de clasificar la HTA en recién nacidos a término y en prematuros como se realiza en niños mayores. Hasta el momento actual no se han publicado datos alternativos, por lo que se mantienen como los valores de referencia en estos pacientes. Para los lactantes entre un mes y un año de vida se dispone de las curvas de valores normales de PA publicados en 1987 (Report of the second task force on blood pressure control in children--1987)32, que también continúan siendo de referencia. Para lactantes mayores de un año de edad, la Guía de Práctica Clínica americana de HTA en niños y adolescentes publicada en 20172, como instrumento de actualización de The fourth report on the diagnosis, evaluation, and treatment of high blood pressure in children and adolescents33, debe ser la base actual para la identificación de HTA.
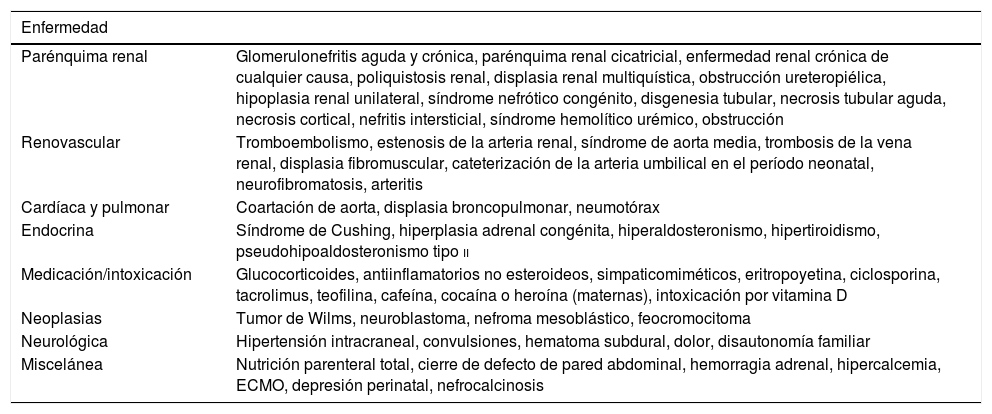
La particularidad con más repercusión clínica de la HTA en lactantes está relacionada con su etiología. Al contrario de lo que ocurre en niños mayores y adolescentes, aquellos muestran casi en su totalidad una causa potencialmente identificable de su HTA, por lo que cobra especial importancia realizar un diagnóstico etiológico adecuado. La HTA renovascular y las enfermedades del parénquima renal (poliquistosis, malformaciones urológicas, etc.) parecen suponer las causas más comunes, pero también se deben tener en cuenta formas no nefrourológicas de HTA. En la tabla 2 se muestran de manera detallada las posibles causas de HTA en lactantes. Una anamnesis y exploración física detalladas nos deben orientar a dirigir correctamente las pruebas complementarias indicadas (ver tabla 3).
Diagnóstico diferencial de hipertensión arterial en lactantes
| Enfermedad | |
|---|---|
| Parénquima renal | Glomerulonefritis aguda y crónica, parénquima renal cicatricial, enfermedad renal crónica de cualquier causa, poliquistosis renal, displasia renal multiquística, obstrucción ureteropiélica, hipoplasia renal unilateral, síndrome nefrótico congénito, disgenesia tubular, necrosis tubular aguda, necrosis cortical, nefritis intersticial, síndrome hemolítico urémico, obstrucción |
| Renovascular | Tromboembolismo, estenosis de la arteria renal, síndrome de aorta media, trombosis de la vena renal, displasia fibromuscular, cateterización de la arteria umbilical en el período neonatal, neurofibromatosis, arteritis |
| Cardíaca y pulmonar | Coartación de aorta, displasia broncopulmonar, neumotórax |
| Endocrina | Síndrome de Cushing, hiperplasia adrenal congénita, hiperaldosteronismo, hipertiroidismo, pseudohipoaldosteronismo tipo ii |
| Medicación/intoxicación | Glucocorticoides, antiinflamatorios no esteroideos, simpaticomiméticos, eritropoyetina, ciclosporina, tacrolimus, teofilina, cafeína, cocaína o heroína (maternas), intoxicación por vitamina D |
| Neoplasias | Tumor de Wilms, neuroblastoma, nefroma mesoblástico, feocromocitoma |
| Neurológica | Hipertensión intracraneal, convulsiones, hematoma subdural, dolor, disautonomía familiar |
| Miscelánea | Nutrición parenteral total, cierre de defecto de pared abdominal, hemorragia adrenal, hipercalcemia, ECMO, depresión perinatal, nefrocalcinosis |
Pruebas complementarias para el estudio etiológico de la hipertensión arterial en neonatos y lactantes
| De rutina | Sangre: hemograma, creatinina, urea, electrólitos, calcio, ácido úrico, glucemia, colesterol, triglicéridos |
| Orina: sistemático y sedimento de orina, cociente proteínas/creatinina, cociente albúmina/creatinina | |
| Ecocardiograma | |
| Ecografía abdominal con Doppler renal | |
| Específicos según la sospecha | Estudios hormonales (renina, aldosterona, esteroides suprarrenales, hormonas tiroideas), catecolaminas en orina, estudios de genética molecular, tóxicos, radiografía de tórax, estudios de imagen vasculares |
En cuanto al tratamiento de la HTA en lactantes, deben tenerse en mente algunas consideraciones previas. En atención a su carácter secundario, el primer paso terapéutico será la corrección de causas yatrogénicas (administración de fármacos, alteraciones electrolíticas como la hipercalcemia, etc.) y reversibles (terapia sustitutiva hormonal en enfermedades endocrinológicas, tratamiento de hipoxemia en pacientes con displasia broncopulmonar, cirugía en coartación de aorta, etc.). Posteriormente, se debe considerar detenidamente la indicación de iniciar tratamiento farmacológico, máxime teniendo en mente la ausencia de estudios adecuados en este rango de edad con la mayor parte de los fármacos de uso común. En general, se recomienda comenzar el tratamiento farmacológico cuando la PA está persistentemente por encima del percentil 99 y utilizar inicialmente un fármaco. Si no se logra un buen control de la PA se procederá a incrementar la dosis del mismo, evitando demoras excesivas, o a asociar otro fármaco si es preciso, con el objeto de lograr un buen control lo antes posible.
Las particularidades de esta etapa de la vida condicionan el empleo casi generalizado de fórmulas magistrales, lo que conlleva una dosificación más exacta de los fármacos empleados y favorece la adherencia terapéutica. Por el contrario, su mayor coste económico, su menor disponibilidad en farmacias y los problemas derivados de la estabilidad a largo plazo de algunas de ellas suponen limitaciones para su uso.
En la práctica clínica se pueden emplear diversos fármacos hipotensores, como diuréticos, IECA, betabloqueantes, antagonistas del calcio y vasodilatadores directos (hidralazina), aunque su uso cuenta habitualmente con la limitación de la ausencia de estudios específicos en este grupo de edad. En líneas generales, los fármacos más utilizados en la edad pediátrica son los IECA y los antagonistas del calcio. Los IECA tienen su indicación más habitual en las nefropatías (por su efecto de disminución de proteinuria) y en la insuficiencia cardíaca, mientras que están contraindicados en situaciones de hiperpotasemia, estenosis bilateral de arterias renales o estenosis de la arteria renal de riñón único funcionante (pueden precipitar un empeoramiento de la función renal al producir hipoperfusión renal). Sin embargo, su uso en neonatos es controvertido, especialmente en prematuros, ya que la participación del sistema renina-angiotensina-aldosterona es importante en la nefrogénesis en esta etapa del desarrollo, por lo que se especula que podrían perjudicar las fases finales de maduración de las nefronas17. Los antagonistas del calcio tienen un buen perfil hipotensor y su empleo debe evitarse en casos de insuficiencia cardíaca.
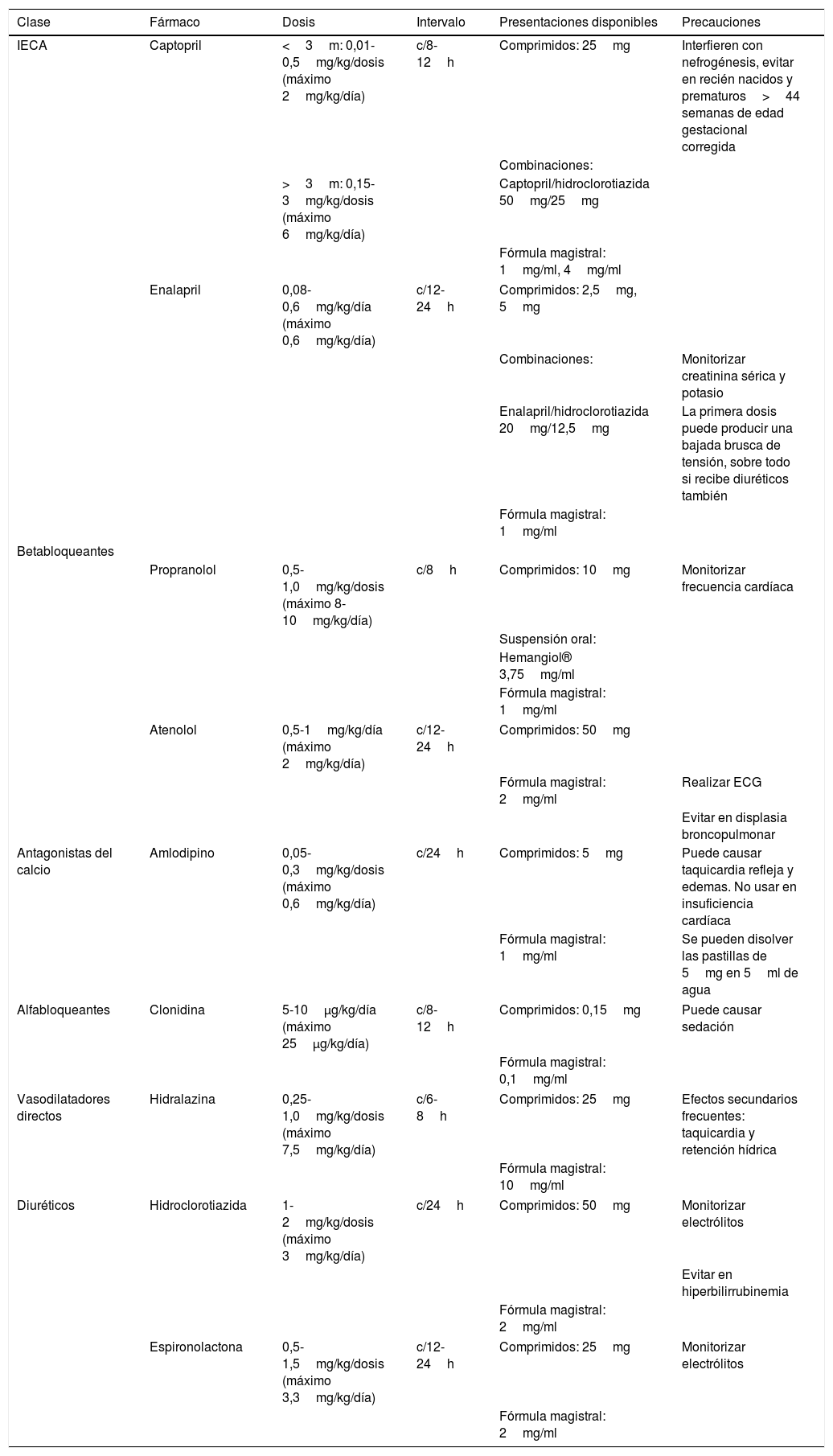
Los diuréticos y los betabloqueantes, al contrario que en los adultos, no suelen estar dentro del tratamiento de primera línea en edad pediátrica. Los diuréticos del asa son útiles en casos de insuficiencia cardíaca, mientras que no se deben emplear en casos asociados a nefrocalcinosis e hipercalciuria. Las tiazidas están contraindicadas en la hiperbilirrubinemia (especialmente neonatal), la hiperglucemia, la hiperuricemia y las dislipidemias. Los betabloqueantes también están indicados en la insuficiencia cardíaca (no en descompensaciones) y en el feocromocitoma en combinación con bloqueantes alfa-adrenérgicos, y se deben evitar en pacientes asmáticos y diabéticos (excepto los bloqueantes mixtos alfa y beta, como el carvedilol). La hidralazina iv supone un buen fármaco para las urgencias hipertensivas, pero sus efectos secundarios (taquicardia, rubor) desaconsejan su empleo de manera crónica34,35. Los fármacos hipotensores en perfusión intravenosa continua (labetalol, nicardipino, nitroprusiato) quedan reservados para las infrecuentes situaciones de urgencias hipertensivas. En la tabla 4 se muestran los fármacos antihipertensivos más usados en neonatos y lactantes, con sus correspondientes pautas de dosificación, presentaciones comerciales y precauciones.
Fármacos antihipertensivos orales habitualmente empleados en lactantes
| Clase | Fármaco | Dosis | Intervalo | Presentaciones disponibles | Precauciones |
|---|---|---|---|---|---|
| IECA | Captopril | <3m: 0,01-0,5mg/kg/dosis (máximo 2mg/kg/día) | c/8-12h | Comprimidos: 25mg | Interfieren con nefrogénesis, evitar en recién nacidos y prematuros>44 semanas de edad gestacional corregida |
| Combinaciones: | |||||
| >3m: 0,15-3mg/kg/dosis (máximo 6mg/kg/día) | Captopril/hidroclorotiazida 50mg/25mg | ||||
| Fórmula magistral: 1mg/ml, 4mg/ml | |||||
| Enalapril | 0,08-0,6mg/kg/día (máximo 0,6mg/kg/día) | c/12-24h | Comprimidos: 2,5mg, 5mg | ||
| Combinaciones: | Monitorizar creatinina sérica y potasio | ||||
| Enalapril/hidroclorotiazida 20mg/12,5mg | La primera dosis puede producir una bajada brusca de tensión, sobre todo si recibe diuréticos también | ||||
| Fórmula magistral: 1mg/ml | |||||
| Betabloqueantes | |||||
| Propranolol | 0,5-1,0mg/kg/dosis (máximo 8-10mg/kg/día) | c/8h | Comprimidos: 10mg | Monitorizar frecuencia cardíaca | |
| Suspensión oral: | |||||
| Hemangiol® 3,75mg/ml | |||||
| Fórmula magistral: 1mg/ml | |||||
| Atenolol | 0,5-1mg/kg/día (máximo 2mg/kg/día) | c/12-24h | Comprimidos: 50mg | ||
| Fórmula magistral: 2mg/ml | Realizar ECG | ||||
| Evitar en displasia broncopulmonar | |||||
| Antagonistas del calcio | Amlodipino | 0,05-0,3mg/kg/dosis (máximo 0,6mg/kg/día) | c/24h | Comprimidos: 5mg | Puede causar taquicardia refleja y edemas. No usar en insuficiencia cardíaca |
| Fórmula magistral: 1mg/ml | Se pueden disolver las pastillas de 5mg en 5ml de agua | ||||
| Alfabloqueantes | Clonidina | 5-10μg/kg/día (máximo 25μg/kg/día) | c/8-12h | Comprimidos: 0,15mg | Puede causar sedación |
| Fórmula magistral: 0,1mg/ml | |||||
| Vasodilatadores directos | Hidralazina | 0,25-1,0mg/kg/dosis (máximo 7,5mg/kg/día) | c/6-8h | Comprimidos: 25mg | Efectos secundarios frecuentes: taquicardia y retención hídrica |
| Fórmula magistral: 10mg/ml | |||||
| Diuréticos | Hidroclorotiazida | 1-2mg/kg/dosis (máximo 3mg/kg/día) | c/24h | Comprimidos: 50mg | Monitorizar electrólitos |
| Evitar en hiperbilirrubinemia | |||||
| Fórmula magistral: 2mg/ml | |||||
| Espironolactona | 0,5-1,5mg/kg/dosis (máximo 3,3mg/kg/día) | c/12-24h | Comprimidos: 25mg | Monitorizar electrólitos | |
| Fórmula magistral: 2mg/ml | |||||
En resumen, con el análisis de estos casos hemos pretendido sensibilizar al lector sobre la HTA en la etapa de lactante, dado que se trata de un proceso poco frecuente y de difícil detección, pero que puede llevar al diagnóstico de enfermedades subyacentes de gravedad y trascendencia clínica. Conocer esta afección y pensar en ella, por tanto, es fundamental para poder realizar un diagnóstico precoz mediante el cribado en pacientes de riesgo y posteriormente filiar su etiología, con el objetivo de llevar a cabo un manejo terapéutico adecuado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.