La utilización inadecuada de la vancomicina favorece la aparición de gérmenes resistentes y compromete la efectividad y la seguridad de los tratamientos. El objetivo del presente trabajo es el diseño y la validación de una pauta empírica inicial de dosificación de vancomicina en neonatos prematuros de acuerdo con sus características farmacocinéticas poblacionales.
Pacientes y métodosAnálisis retrospectivo de 129 muestras séricas procedentes de una cohorte de 53 neonatos en la que se identificaron grupos poblacionales homogéneos a partir de los parámetros farmacocinéticos individuales y de las características biométricas. El diseño del esquema de dosificación se realizó mediante simulación de las concentraciones plasmáticas de vancomicina que se alcanzarían a partir de diferentes pautas. La validación se hizo en otra cohorte de 30 neonatos y 108 muestras séricas.
ResultadosLa implantación del algoritmo aumentó significativamente (p < 0,05) el porcentaje de concentraciones iniciales obtenidas con valores de concentración mínima y concentración máxima correctos en la primera monitorización. El número medio de muestras séricas obtenidas por paciente para la monitorización del tratamiento disminuyó significativamente (3,6 ± 2 respecto a 4,9 ± 3).
ConclusionesLa implantación del algoritmo de dosificación de la vancomicina para neonatos prematuros mejora la eficiencia del tratamiento, reduce la necesidad de monitorización y optimiza las concentraciones séricas de la vancomicina desde su inicio.
Inappropriate use of vancomycin contributes to the development of resistant bacteria and jeopardizes the safety and effectiveness of treatment. The aim of this article was to design and validate an empirical dosing algorithm for vancomycin in premature neonates according to their population-based pharmacokinetic characteristics.
Patients and methodsWe performed a retrospective analysis of 129 serum samples from a cohort of 53 neonates. Homogeneous population groups were identified both from their individual pharmacokinetic parameters and from their biometric characteristics. The design of the dosing algorithm was based on simulation of the serum vancomycin concentration that would be reached with several different doses. The algorithm was validated in another cohort of 30 neonates and 108 serum samples.
ResultsIntroduction of the algorithm significantly increased the percentage initial values obtained with correct minimum and maximum concentrations in the first monitoring round (p < 0.05). The mean number of serum samples obtained per patient for treatment monitoring was significantly reduced (3.6 ± 2 vs. 4.9 ± 3).
ConclusionsThe implantation of the dosing algorithm for vancomycin in premature neonates increased the efficiency of treatment, reduced monitoring requirements, and optimized serum vancomycin concentrations from the start of treatment.
El aumento en la supervivencia alcanzada en los neonatos prematuros de las unidades de cuidados intensivos neonatales (UCIN) se ha asociado a una hospitalización más prolongada. Sin embargo, la inmadurez del sistema inmunológico junto con los factores de riesgo ambiental e instrumental, esenciales en el cuidado del paciente prematuro, también han elevado el riesgo de infección nosocomial1. Los estafilococos coagulasa-negativos resistentes a meticilina son la principal causa de infección y requieren tratamiento, inicialmente de forma empírica, con asociaciones de antibióticos que incluyen la vancomicina. La implantación de un tratamiento eficaz y seguro desde su inicio puede reducir no sólo la duración del tratamiento y la estancia hospitalaria, sino también los inconvenientes derivados de la monitorización de las concentraciones plasmáticas de la vancomicina y de la selección de flora resistente2,3.
La prescripción de un tratamiento antibiótico con dosis adecuadas desde su inicio y el posterior ajuste individualizado mediante la determinación y el análisis farmacocinético de las concentraciones plasmáticas del antibiótico mejorarán la eficiencia del tratamiento4–9.
La utilidad de la determinación de las concentraciones plasmáticas de antibióticos es objeto de debate. No obstante, debido a la elevada variabilidad farmacocinética interindividual e intraindividual en este grupo poblacional1,2, y a que algunos estudios han relacionado la aparición de concentraciones máximas de vancomicina elevadas con una mayor toxicidad y la persistencia de concentraciones mínimas inferiores a la concentración mínima inhibitoria al fracaso terapéutico10, la optimización del tratamiento con vancomicina en neonatos prematuros mediante la monitorización de las concentraciones plasmáticas es una práctica recomendada.
Los objetivos del presente trabajo son el diseño de una pauta inicial de dosificación de vancomicina en neonatos prematuros, de acuerdo con sus características farmacocinéticas poblacionales y la posterior validación prospectiva de la pauta de dosificación inicial propuesta.
PACIENTES Y MÉTODOSEl esquema de dosificación de la vancomicina se diseñó en una primera fase del estudio mediante el análisis retrospectivo de 129 muestras séricas procedentes de una cohorte de 53 neonatos prematuros de 1,3 ± 0,5kg de peso, 30 ± 3 semanas de edad gestacional y 23 ± 13 días de edad posnatal, ingresados en la UCIN, que recibieron tratamiento con vancomicina por sospecha clínica de sepsis neonatal tardía o infección probada por gérmenes grampositivos. Se excluyeron los neonatos con insuficiencia renal o edad posnatal superior a 40 días.
El protocolo de monitorización de los neonatos en tratamiento con vancomicina establece la obtención inicial de dos muestras séricas; una correspondiente a la concentración valle o mínima (Cmín), obtenida antes de la administración de la dosis, y otra una hora después de terminar la perfusión intravenosa de la vancomicina, que, desde el punto de vista clínico, se considera pico o máxima (Cmáx). Las muestras de sangre fueron obtenidas mediante venopunción durante el tercer día de tratamiento y fueron recogidas en tubos Microtainer® sin anticoagulantes. La sangre se centrifugó a 10.500rpm y el plasma fue analizado de forma inmediata. Durante el tratamiento, y dependiendo de la evolución del paciente o de la necesidad de modificar el esquema posológico, se obtuvieron muestras adicionales.
Las concentraciones séricas de vancomicina obtenidas en la primera monitorización se clasificaron como correctas o incorrectas según se encontrasen dentro de los intervalos de concentración objetivo establecidos. Los intervalos de concentración objetivo utilizados fueron de 5–10mg/l para la Cmín y de 20–40mg/l para la Cmáx4. La determinación de las concentraciones plasmáticas de vancomicina se llevó a cabo con el analizador de inmunofluorescencia de luz polarizada AxSYM® (Abbott Laboratories Diagnostics Division. Abbott Park, IL 60064, Estados Unidos). La sensibilidad del ensayo AxSYM® vancomicina es de 2mg/l.
Posteriormente, se realizó mediante una técnica bayesiana el análisis farmacocinético de las concentraciones séricas de vancomicina asumiendo un modelo monocompartimental abierto con eliminación de primer orden. Para cada uno de los neonatos se determinaron el aclaramiento plasmático (CLp) y el volumen de distribución (Vd) de la vancomicina. El análisis de los datos se realizó con el programa AbbottBase Pharmacokinetics System® (Abbott Laboratories Diagnostics Division. Abbott Park, IL 60064 Estados Unidos).
A partir de los valores de CLp y Vd obtenidos se procedió en una primera fase (fase 1) a la identificación de los grupos poblacionales de neonatos farmacocinéticamente homogéneos; es decir, grupos de neonatos en quienes el comportamiento farmacocinético de la vancomicina es similar y, por lo tanto, también los requerimientos de dosis e intervalo posológico. Se realizó para ello un análisis de correlación y de regresión lineal múltiple entre los parámetros farmacocinéticos individualizados de la vancomicina y las diferentes características biométricas de cada uno de los neonatos (edad posnatal, edad gestacional, edad posconcepcional, peso, sexo e índice de riesgo neonatal [CRIB]) con objeto de seleccionar aquellos parámetros biométricos que se correlacionan significativamente con el CLp o el Vd. Cada grupo poblacional quedará identificado por aquellos parámetros biométricos para los cuales los valores de CLp y Vd son homogéneos.
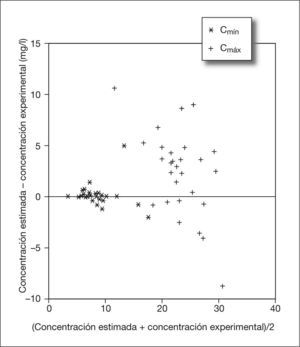
La pauta posológica más adecuada para cada uno de estos grupos poblacionales se estimó mediante la simulación de las dosis e intervalos de dosificación que serían necesarios para alcanzar concentraciones plasmáticas dentro del intervalo de concentración objetivo. La capacidad predictiva del modelo se evaluó mediante el análisis de concordancia entre las concentraciones estimadas y las concentraciones experimentales obtenidas en la primera monitorización; para ello se utilizó el coeficiente de correlación intraclase y el método gráfico propuesto por Bland y Altman11.
Posteriormente, y tras la implantación del esquema de dosificación de vancomicina propuesto, se realizó su validación mediante el análisis de 108 muestras séricas procedentes de una cohorte de 30 neonatos prematuros de 1,6 ± 0,4kg de peso, 31 ± 2 semanas de edad gestacional y 13 ± 8 días de edad posnatal, ingresados en la UCIN, que recibieron tratamiento empírico inicial con vancomicina según el esquema propuesto por sospecha clínica de sepsis neonatal tardía o infección probada por gérmenes grampositivos. Los resultados evaluados fueron: número de neonatos y de concentraciones séricas de vancomicina que alcanzan la concentración objetivo definida, y número de concentraciones séricas obtenidas para la monitorización de la vancomicina por ciclo de tratamiento.
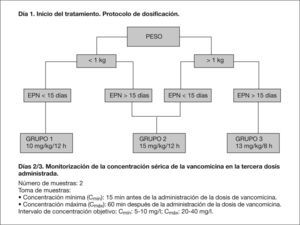
RESULTADOSEl peso y la edad posnatal fueron los parámetros biométricos que se correlacionaban con los parámetros farmacocinéticos, y permitió definir tres grupos poblacionales farmacocinéticamente homogéneos: a) grupo 1: neonatos con peso inferior a 1kg y edad posnatal por debajo de 15 días; grupo 2: neonatos con peso de menos de 1kg y edad posnatal por encima de 15 días o neonatos con peso de más de 1kg y edad posnatal por debajo de 15 días, y c) grupo 3: neonatos con peso de más de 1kg y edad posnatal por encima de 15 días. La figura 1 muestra el algoritmo de la dosificación y monitorización de la vancomicina en neonatos prematuros diseñado para alcanzar las concentraciones objetivo desde el inicio del tratamiento. La tabla 1 muestra las principales características biométricas de los neonatos evaluados, así como los parámetros farmacocinéticos que caracterizan los grupos poblacionales definidos.
Características biométricas de los neonatos prematuros incluidos en el estudio
| Grupo poblacional*** | Fase 1* | Fase 2** | ||||
| 1 | 2 | 3 | 1 | 2 | 3 | |
| Pacientes (n) | 10 | 27 | 16 | 5 | 15 | 10 |
| Peso (kg) | 0,8 ± 0,2 | 1,6 ± 0,8 | 1,7 ± 0,5 | 0,9 ± 0,9 | 1,7 ± 0,4 | 1,6 ± 0,4 |
| Sexo % (V/M) | 30/70 | 45/55 | 50/50 | 25/75 | 50/50 | 50/50 |
| Edad | ||||||
| Posnatal (días) | 10 ± 3 | 11 ± 5 | 28 ± 14 | 9 ± 3 | 9 ± 4 | 23 ± 10 |
| Gestacional (semanas) | 28,5 ± 3,4 | 31,5 ± 3,5 | 31,2 ± 3,4 | 27,8 ± 1,7 | 31,7 ± 2,2 | 30,6 ± 2,2 |
| Posconcepcional (semanas) | 30,0 ± 3,4 | 33,1 ± 3,0 | 35,0 ± 3,8 | 29,1 ± 2,1 | 33,1 ± 2,1 | 33,1 ± 1,9 |
| CRIB | 4±2 | 3 ± 2 | 0 ± 1 | 4 ± 3 | 3 ± 2 | 1 ± 1 |
| Parámetros farmacocinéticos | ||||||
| CLp (l/h/kg) | 0,05 ± 0,02 | 0,07 ± 0,02 | 0,09 ± 0,03 | 0,05 ± 0,02 | 0,08 ± 0,02 | 0,09 ± 0,02 |
| Vd (l/kg) | 0,52 ± 0,07 | 0,56 ± 0,07 | 0,54 ± 0,07 | 0,55 ± 0,05 | 0,54 ± 0,04 | 0,51 ± 0,04 |
CLp: aclaramiento plasmático; CRIB: índice de riesgo clínico para niños; M: mujer; V: varón; Vd: volumen de distribución.
Fase 1: valores procedentes de los 53 neonatos utilizados para el diseño del esquema de dosificación.
Fase 2: valores procedentes de los 30 neonatos en los que se utilizó el algoritmo de dosificación.
Cada grupo poblacional viene caracterizado por sus parámetros farmacocinéticos e identificado por sus características biométricas de peso y edad posnatal (EPN). Grupo 1: neonatos prematuros de peso < 1kg y EPN < 15 días; grupo 2: neonatos prematuros de peso < 1kg y EPN > 15 días o peso > 1kg y EPN < 15 días, y grupo 3: neonatos prematuros de peso > 1kg y EPN > 15 días.
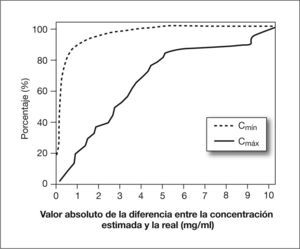
El análisis de concordancia entre las concentraciones de vancomicina estimadas y las concentraciones experimentales obtenidas revela un coeficiente de correlación positivo y estadísticamente significativo (r = 0,94). En la figura 2 se indica la diferencia entre las concentraciones estimadas y las experimentales respecto a su valor medio. La diferencia entre las estimaciones realizadas para la Cmín y la Cmáx y los valores experimentales obtenidos fue de 0,04 ± 1,1mg/l y 2,2 ± 4,1mg/l, respectivamente. La relevancia clínica de estas diferencias puede evaluarse mediante la figura 3, que representa el valor absoluto de la diferencia entre la concentración experimental y la estimada respecto al porcentaje de concordancia acumulado. Si se establece como un margen de error aceptable en la estimación de las Cmín experimentales de vancomicina de 1mg/l, se observa que en el 90 % de las ocasiones no se alcanza este valor, mientras que para alcanzar este grado de concordancia con los valores de Cmáx la diferencia sería de, aproximadamente, 8,5mg/l.
La tabla 1 muestra las principales características biométricas y farmacocinéticas de los neonatos evaluados. No se encontraron diferencias significativas (p < 0,05) entre los grupos poblacionales de neonatos de la fase 1 y de la fase 2 del estudio, respectivamente.
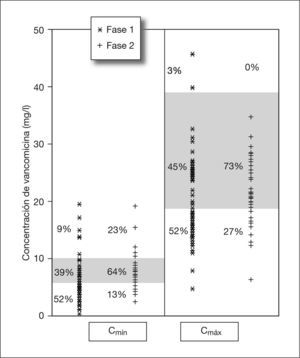
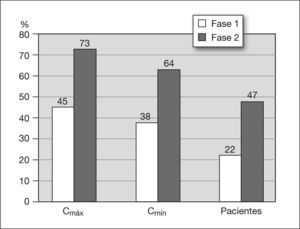
La figura 4 representa la distribución de las concentraciones plasmáticas experimentales antes de la implantación del esquema de dosificación y después de su aplicación. La implantación del algoritmo de dosificación propuesto aumentó, significativamente (p < 0,05) tanto el porcentaje de muestras con valores de Cmín y Cmáx en las concentraciones objetivo como el número de neonatos con ambas concentraciones adecuadas en la primera monitorización (fig. 5). También se encontraron diferencias significativas, favorables a la implantación del esquema de dosificación propuesto, en el número medio de muestras séricas que fue necesario obtener por paciente para la optimización del tratamiento con vancomicina (3,6 ± 2 frente a 4,9 ± 3; p = 0,04). En la tabla 2 se indica los porcentajes de pacientes y de concentraciones plasmáticas de vancomicina en el intervalo de concentración objetivo para cada uno de los grupos poblacionales en ambas fases del estudio.
Porcentaje de concentraciones mínimas (Cmn) y máximas (Cmáx) de la vancomicina y depacientes que alcanzan las concentraciones objetivo definidas antes (fase 1) y después (fase 2) de aplicar el esquema de dosificación de vancomicina. Las diferencias son significativas en todos los casos (p < 0,05).
Porcentaje de concentraciones mínimas (Cmín) y máximas (Cmáx) de la vancomicina que alcanzan las concentraciones objetivo definidas por grupo poblacional antes (fase 1) y después (fase 2) de aplicar el esquema de dosificación de la vancomicina (B)
| Grupo poblacional 1 | Grupo poblacional 2* | Grupo poblacional 3 | ||||
| Fase 1 | Fase 2 | Fase 1 | Fase 2 | Fase 1 | Fase2 | |
| Cmín | 36 % | 50 % | 27 % | 62 % | 57 % | 70 % |
| Cmáx | 50 % | 55 % | 37 % | 75 % | 48 % | 80 % |
| Cmín y Cmáx | 27 % | 25 % | 14 % | 50 % | 30 % | 50 % |
El estudio se realizó como consecuencia de que la Unidad de Farmacocinética Clínica del Servicio de Farmacia identificara un porcentaje muy elevado de concentraciones plasmáticas de vancomicina en neonatos prematuros de la UCIN con valores potencialmente subterapéuticos, que requerían ajustes posológicos y controles plasmáticos posteriores.
El análisis de los datos recogidos en la primera fase del estudio revela que más del 60 % de las Cmín y del 50 % de las Cmáx plasmáticas eran inadecuadas antes de la aplicación del nuevo esquema de dosificación. Se constata igualmente que la magnitud de las concentraciones que se encuentran fuera del intervalo de concentración objetivo es menor utilizando el esquema propuesto (v. fig. 4).
Además, se requerían casi cinco extracciones de sangre sólo para la monitorización del tratamiento con vancomicina, con una repercusión directa en el cuidado del paciente. La toma repetida de muestras puede dañar las venas del neonato prematuro y comprometer con ello la posibilidad de obtener otros datos analíticos relevantes, además de aumentar el riesgo de infección. Asimismo, es necesario realizar una transfusión cuando el volumen de las muestras de sangre representa el 10 % de la sangre total del neonato. Las características de este grupo poblacional hacen que esta práctica sea habitual por la elevada variabilidad fisiopatológica y los procedimientos diagnósticos y terapéuticos empleados. Así pues, se estima que en un neonato de 1.000g la extracción de un volumen total de 8ml de sangre puede hacer necesaria la administración de una transfusión sanguínea12. La implantación del esquema propuesto mejoró significativamente estos valores.
La dosificación de la vancomicina debe buscar un equilibrio adecuado entre la máxima efectividad y la mínima toxicidad posible. Sin embargo, la evaluación de la efectividad del tratamiento antibiótico en neonatos es complicada. Por ello, los esquemas de dosificación suelen estar basados en marcadores subrogados como las concentraciones séricas de vancomicina, el cociente entre el área bajo la curva de la concentración sérica-tiempo de vancomicina y la concentración mínima inhibitoria de los gérmenes implicados en el proceso infeccioso (AUC/CMI) o el tiempo durante el cual la concentración sérica de vancomicina es superior a la CMI13.
Los estudios in vitro aconsejan que la concentración de vancomicina no sea inferior a 4-5mg/l, pues las CMI de los principales gérmenes para los que se utiliza es inferior a 1-2mg/l. De esta forma se asegura que las concentraciones séricas de vancomicina son potencialmente efectivas durante todo el tratamiento. La monitorización de la Cmín de vancomicina permitirá asegurar que las concentraciones no son inferirores a 5mg/l, lo cual es especialmente recomendable cuando los intervalos de dosificación son superiores a 8h, como es el caso de los neonatos prematuros13. Con el esquema de dosificación de vancomicina propuesto se mejoraría significativamente, desde su inicio, la efectividad del tratamiento, obteniendo el 87 % de Cmín séricas superiores a 5mg/l respecto al 48 % previo a su utilización.
No obstante, la utilidad de la monitorización de las Cmáx de vancomicina es actualmente objeto de debate, pues no existen estudios que demuestren una clara asociación entre las Cmáx de vancomicina y su efectividad o toxicidad. Sin embargo, algunos autores recomiendan su monitorización en situaciones especiales, como es el tratamiento de neonatos con meningitis14.
La nefrotoxicidad asociada a la vancomicina es inferior al 5 % y no se ha evidenciado una toxicidad grave, únicamente incrementos transitorios en los valores de creatinina sérica4. La aparición de nefrotoxicidad se ha asociado a la acumulación de vancomicina en el riñón. En este sentido, la AUC es el parámetro farmacocinético que mejor refleja este fenómeno y la determinación conjunta de los valores de Cmín y Cmáx permitiría estimar su valor. Valores elevados de Cmín junto con valores elevados de Cmáx implican una AUC elevada y una potencial acumulación del fármaco. La monitorización de ambos puntos en poblaciones de elevado riesgo, como son los neonatos prematuros con una función renal inmadura, permitiría detectar AUC elevadas y ajustar los esquemas posológicos de vancomicina de tal forma que se mantuvieran valores de Cmín efectivos durante todo el esquema de tratamiento (Cmín > 5mg/l), reduciendo los valores de la AUC.
En la bibliografía publicada es posible encontrar diferentes propuestas de esquemas de dosificación de vancomicina en neonatos basados en parámetros como la edad gestacional, la edad posconcepcional, el peso, etc. Aunque los parámetros farmacocinéticos obtenidos en el estudio son similares a los presentados por otros autores4,13–16, el algoritmo presentado en este trabajo tiene la ventaja de que ha sido validado en una población distinta de neonatos a la utilizada para su diseño previo, pero en el mismo entorno asistencial y estructural, y sin variaciones temporales significativas entre ambas fases6,8,17. El tamaño muestral es superior al utilizado por otros autores6,18,19 y la estructura del algoritmo en los tres grupos poblacionales resulta de fácil identificación (peso y edad posnatal) y facilita su aplicación en la práctica clínica diaria respecto a las propuestas realizadas por otros autores, que requieren cálculos matemáticos y posteriores reajustes posológicos8,16,17.
La figura 2 permite observar las predicciones realizadas por el modelo como desviación entre la concentración estimada y la experimental de vancomicina. La dispersión no muestra una tendencia definida. No se aprecia la posible existencia de un sesgo sistemático a la sobreestimación o la subestimación de las concentraciones de vancomicina, distribuyéndose de forma similar alrededor del cero. Se observa igualmente que las mayores diferencias se asocian con los valores de Cmáx de vancomicina.
El algoritmo de dosificación propuesto es clínicamente válido, tal como se desprende de la figura 3. Más del 80 % de las Cmín obtenidas con este esquema y el 70 % de las Cmáx se ajustan a los valores previstos, con desviaciones inferiores al 20 %. De este modo se observa que la diferencia entre la concentración prevista de vancomicina y la experimental obtenida es de tan sólo 0,5mg/l en el 80 % de los casos, lo que representa un error en la estimación del 5-10 % (v. fig. 3). Una concentración inicialmente estimada de 8mg/l, en el 80 % de los casos, se situará experimentalmente entre 7,5 y 8,5mg/l.
Entre las limitaciones del estudio se pueden citar la exclusión de neonatos con insuficiencia renal y la utilización de neonatos con una edad posnatal superior a los 40 días. Las conclusiones, por lo tanto, no son extrapolables a grupos poblacionales de características diferentes. Del mismo modo, no fue posible evaluar indicadores finales como la efectividad o la toxicidad clínica del tratamiento. Por otra parte, la existencia de un 53 % de pacientes que siguen sin alcanzar concentraciones plasmáticas iniciales de vancomicina en el intervalo de concentraciones objetivo aconseja mantener una estrategia de monitorización a todos los neonatos sujetos a este tratamiento.
Los resultados mejoran significativamente los obtenidos antes de su aplicación, no sólo por incrementar el número de pacientes con concentraciones de vancomicina potencialmente eficaces y seguras desde el inicio del tratamiento, sino también en el número de muestras séricas que es necesario obtener para la monitorización. En los grupos 1 y 2 no fue posible detectar diferencias estadísticamente significativas con la utilización del algoritmo. No obstante, se trata de los grupos de pacientes menos habituales, pues la vancomicina se utiliza en sepsis neonatal tardía o en neonatos con procedimientos invasivos, por lo que la edad posnatal suele encontrarse entre los 5 y los 20 días. Así, aunque las diferencias encontradas no alcanzan significación, probablemente debido al escaso tamaño muestral, sí es posible apreciar tendencias, superiores al 60 % en algunos casos, favorables a la utilización de las dosis propuestas con el algoritmo. Actualmente, el esquema propuesto forma parte del protocolo de la UCIN para el diagnóstico y tratamiento precoz de la sepsis neonatal20. La utilización de algoritmos o protocolos para el tratamiento de la sepsis neonatal tardía en la UCIN ha demostrado su utilidad en la reducción de resistencias y en mejorar la seguridad y la eficacia de los tratamientos1.
El algoritmo propuesto no sustituye la necesidad de monitorizar las concentraciones plasmáticas de vancomicina. No obstante, se consigue reducir significativamente el número de extracciones séricas necesarias y proporciona concentraciones plasmáticas más adecuadas a los requerimientos establecidos desde el inicio del tratamiento que las obtenidas hasta el momento de su implantación.
En conclusión, la implantación del esquema de dosificación de la vancomicina para neonatos prematuros mejora la eficiencia del tratamiento, reduce la necesidad de monitorización y proporciona concentraciones séricas de vancomicina potencialmente más efectivas y seguras.