La enfermedad granulomatosa crónica (EGC) es una inmunodeficiencia primaria poco frecuente que se produce por la inactivación del complejo enzimático NADPH oxidasa. Estos pacientes presentan la función fagocítica alterada, lo que les hace más susceptibles a padecer infecciones bacterianas y/o fúngicas.
MétodosSe estudió a un niño de 6 años con sospecha de EGC. El estudio funcional de NADPH oxidasa estaba alterado, diagnosticándose de EGC. Simultáneamente, se nos informó del segundo embarazo de la madre y se solicitó consejo genético.
ResultadosSe identificó una mutación nueva causante de enfermedad mediante secuenciación directa del gen CYBB (EGC ligada al X) en el paciente afecto. Al mismo tiempo, se hizo el estudio prenatal cuyo resultado fue la identificación de la misma mutación en el feto.
ConclusionesEs necesario hacer el estudio molecular de la EGC para realizar el diagnóstico de certeza de la enfermedad del paciente con el objetivo de ofrecer diagnóstico prenatal y consejo genético en futuros embarazos.
Chronic Granulomatous Disease (CGD) is a rare primary immunodeficiency caused by the alteration of the enzyme complex NADPH oxidase, which affects the phagocytic function. CGD patients are susceptible to recurrent infections mainly caused by bacteria and/or fungi.
MethodsWe studied a 6 year-old boy with suspicion of CGD. The diagnosis was confirmed based on the functional study of NADPH oxidase. Simultaneously, the second pregnancy of the mother was reported and genetic counselling was requested.
ResultsWe identified a new disease-causing mutation by direct sequencing of the CYBB gene (X-linked CGD). The prenatal study resulted in the identification of the same mutation in the foetus.
CommentsMolecular genetics characterisation of CGD is needed to obtain an accurate diagnosis of the disease and to offer prenatal diagnosis and genetic counselling in future pregnancies.
La enfermedad granulomatosa crónica (EGC) es una inmunodeficiencia primaria que afecta aproximadamente a uno de cada 250.000 nacidos vivos1,2. Los pacientes con EGC son susceptibles de padecer infecciones recurrentes, particularmente aquellas causadas por bacterias catalasa positivas y hongos. En aproximadamente dos terceras partes de los enfermos sus primeros síntomas aparecen durante el primer año de vida. La clínica más frecuente es la infecciosa (linfadenitis, neumonías, abscesos cutáneos y hepáticos, osteomielitis, dermatitis) causada principalmente por S. aureus y bacterias gramnegativas (Serratia marcescens y Burkholderia cepacia), además de Aspergillus spp. Asimismo, la afectación gastrointestinal es común (hasta el 30% de los casos)3. Por otro lado, los pacientes con EGC pueden desarrollar granulomas difusos que pueden causar obstrucciones o síntomas dolorosos en esófago, estómago, uréteres, vejiga y vesícula biliar además de fenómenos inflamatorios en pulmón y sistema nervioso central1,3-5.
La EGC está causada por mutaciones en el complejo enzimático de la NADPH (nicotinamida adenina dinucleótido fosfato) oxidasa, por lo que los pacientes son incapaces de producir radicales libres, necesarios para la destrucción de bacterias y/u hongos. Este complejo enzimático activado cataliza la reducción de la NADPH dependiente de oxígeno (O2) para formar el anión superóxido (O−2) altamente reactivo, que se combina espontáneamente con el hidrógeno para formar peróxido de hidrógeno (H2O2). La NADPH oxidasa es un complejo enzimático localizado en la membrana plasmática de los fagocitos y está formado por elementos de membrana como el flavocitocromo b558 (formado por la subunidad gp91phox y p22phox) y por cuatro componentes citosólicos: p40phox, p47phox, p67phox y Rac 2. En fagocitos activados se ensamblan y forman un complejo enzimático activo6. Las mutaciones que afectan a cualquiera de los genes que codifican para las subunidades del complejo NADPH oxidasa pueden causar EGC. Aproximadamente, dos terceras partes de los casos de EGC son debidos a mutaciones en el gen CYBB (EGC ligadas al X), que codifica para la subunidad gp91 phox (OMIM 306400). En cuanto a las formas autonómicas recesivas, la más frecuente se debe a mutaciones en el gen NCF1, que codifica para la subunidad p47phox, mientras que deficiencias en las subunidades p22phox, p67 phox, Rac2 y p40phox son menos frecuentes (< 3% de los casos)3,5.
El diagnóstico de EGC se realiza mediante pruebas de laboratorio que demuestran un funcionamiento anormal de la enzima NADPH oxidasa. Hasta mediada la década de los noventa del siglo xx, el estudio funcional se hacía utilizando la prueba de azul de tetrazolio (NBT). Hoy en día, con la citometría de flujo se evalúa la actividad del complejo NADPH oxidasa midiendo la conversión de dihidrorodamina-123 (DHR) a rodamina-123 en fagocitos activados. Esta prueba es diagnóstica para la mayoría de los pacientes (excepto en la deficiencia primaria de mieloperoxidasa), y también puede ayudar a diferenciar entre las dos formas más comunes, EGC ligada al X (defecto de gp91phox) y EGC autosómica recesiva (defecto de p47phox)6.
El objetivo de este trabajo es dar a conocer mediante la descripción de un caso clínico de EGC una mutación nueva y su caracterización funcional y molecular, así como ofrecer un diagnóstico prenatal rápido y consejo genético ante un segundo embarazo.
Caso clínicoSe trata de un niño de 6 años, hijo de padres españoles que es derivado para descartar una inmunodeficiencia primaria. Sin antecedentes familiares previos de EGC. Antecedentes personales: a la edad de dos años, desarrolló un absceso latero-cervical izquierdo que necesitó drenaje quirúrgico. Posteriormente, entre los tres y los cinco años de vida desarrolló múltiples infecciones bacterianas de repetición: neumonías, sinusitis, otitis media aguda y abscesos (incluido un absceso periamigdalino). Presentó ocasionalmente fístulas perianales. No se objetivó retraso póndero-estatural. En el estudio inmunológico básico se observó hipergammaglobulinemia y poblaciones linfocitarias normales.
Considerando los antecedentes personales del paciente se sospechó una deficiencia de células fagocíticas y se realizó estudio por citometría de flujo de la actividad NADPH oxidasa (test DHR) (Burstest, BD biosciences, Madrid, Spain) tanto al paciente como a los padres7.
Además, se extrajo ADN genómico y ARN de sangre periférica del paciente y de sus padres. Se realizó la amplificación de los 13 exones (junto con las zonas de unión exón-intrón) del gen CYBB mediante PCR y posteriormente dichos amplificados se secuenciaron directamente en un secuenciador automático (Applied Biosystem 3100 Avant). El ADN fetal se extrajo de los amniocitos obtenidos de la funiculocentesis a las 14 semanas de gestación. Asimismo, se realizó análisis de los polimorfismos HLA, demostrándose que el ADN obtenido de los amniocitos era de origen fetal y no presentaba contaminación de origen materna8.
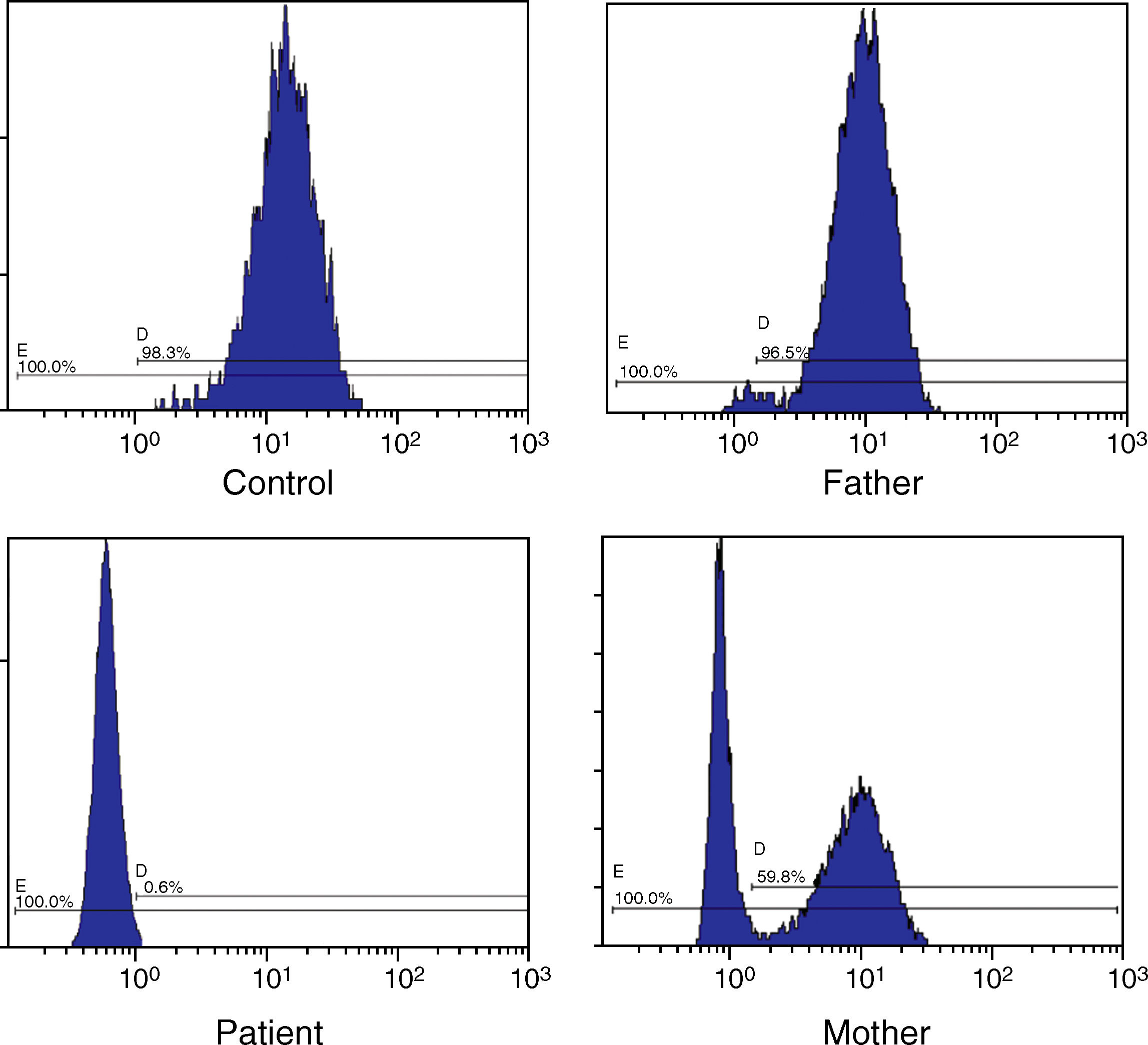
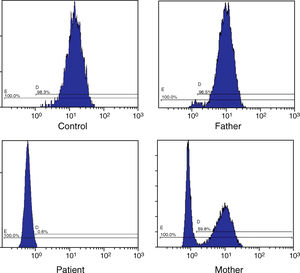
Resultados y discusiónLa prueba DHR en el paciente demostró la ausencia de la actividad de la NADPH oxidasa y por tanto confirmó la EGC. El patrón DHR materno mostró una distribución bimodal correspondiente a su estado de portadora y en el caso del padre la prueba DHR resultó ser normal como en el control sano (fig. 1)9. Por tanto, se pudo concluir que la forma de herencia de EGC era ligada al cromosoma X y que el componente proteico alterado era gp91phox codificado por el gen CYBB. En este momento, se nos informó del nuevo embarazo de la madre (feto varón). Ante el riesgo de que el feto también padeciera la EGC, rápidamente, se realizó una búsqueda de mutaciones en el paciente a lo largo de los 13 exones y de las uniones intrón-exón del gen CYBB.
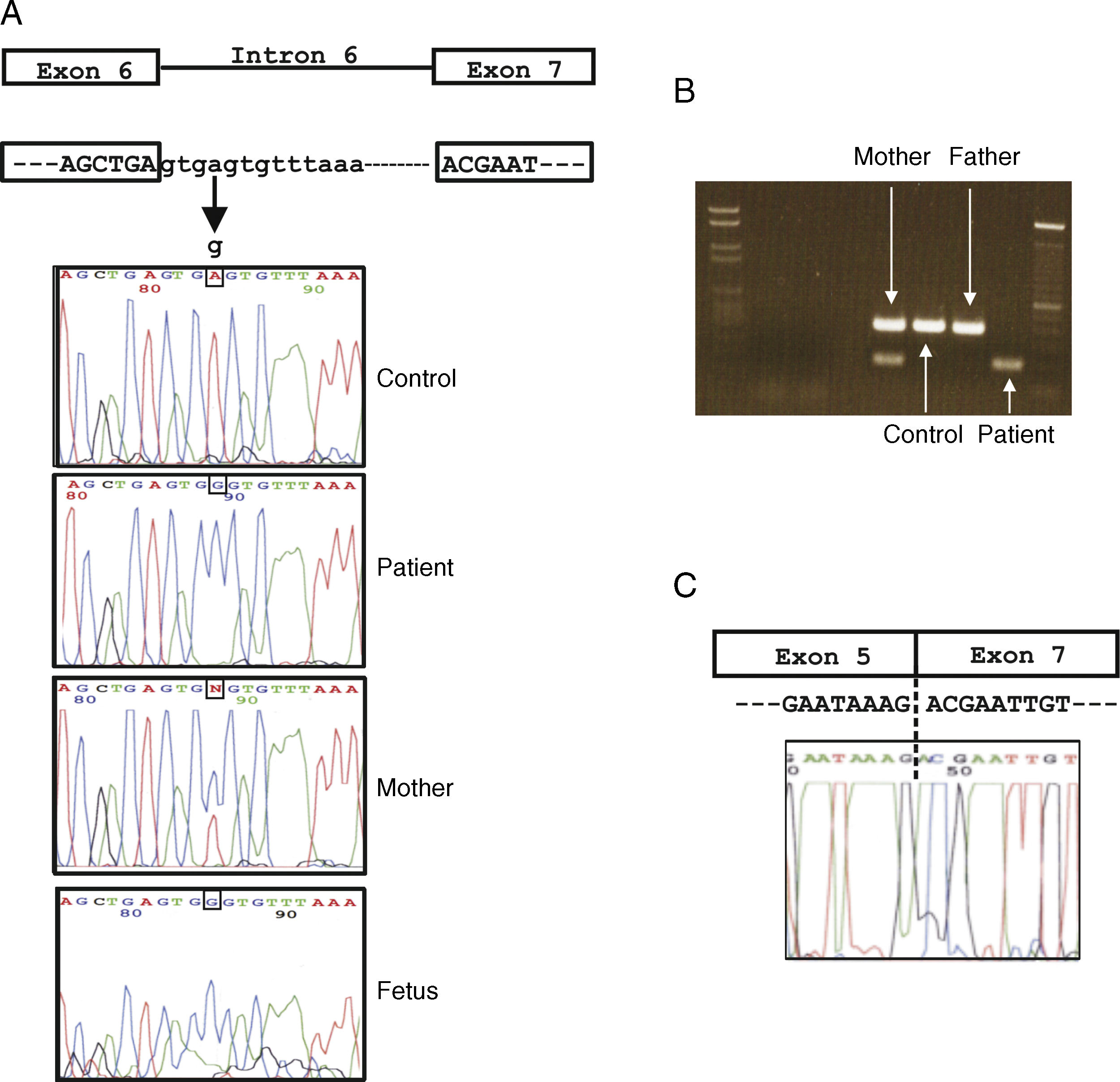
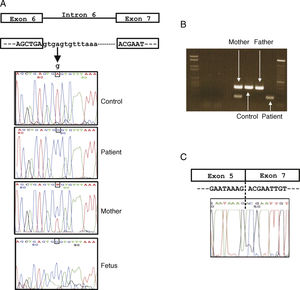
Mediante secuenciación directa se identificó un cambio que producía una sustitución de A>G en la posición +4 del intrón 6 (IVS6+4A>G) de la secuencia del paciente con respecto a la secuencia normal publicada. Además, se identificó el mismo cambio en uno de los dos alelos de su madre. Esta mutación no estaba descrita anteriormente en las bases de datos y con el objetivo de confirmar que esta alteración (IVS6+4A>G) era realmente una mutación causante de EGC (y no un polimorfismo) se descartó su presencia en 50 controles españoles sanos (fig. 2A)
Caracterización molecular de la mutación en el gen CYBB. A) Representación esquemática del gen y secuencias de ADN de la mutación (IVS6+4A>G) encontrada en el paciente, feto, madre portadora, padre y control sano. B) Amplificación por RT-PCR entre el exón 5 y el exón 7 en el paciente (amplificado más acortado debido a la deleción del exón 6), madre portadora (con 2 bandas), padre y control sano. C) Secuencia de ADNc del paciente mostrando la deleción del exón 6.
Además, se sospechó que esta sustitución de nucleótido encontrada en el paciente (IVS6+4A>G) podría afectar al procesamiento del ARN, debido a que esta posición es altamente conservada en las especies eucariotas10. Este hecho fue confirmado a través de una RT-PCR (fig. 2B) obteniendo un ADNc anormalmente más corto que el esperado. Posteriormente, se realizó la secuenciación de este amplificado y se confirmó la ausencia del exón 6 (fig. 2C). Por tanto, esta mutación nueva (IVS6+4A>G) causa un procesamiento incorrecto del ARN observándose que al finalizar el exón 5 comienza el exón 7 con ausencia completa del exón 6. La secuencia de ADN del paciente se envió al GenBank con el N.° GU248714.
La mutación provoca que esta zona conservada entre el exón 6-intrón 6 (fig. 2C) no se reconozca como tal y se produzca la deleción del exón 6 completo. Otros autores (Heyworth et al11 y Barese et al12) han descrito una mutación (IVS6+5G>C) en una posición distinta a la encontrada en nuestro paciente aunque muy cercana y que también provocaba, como en nuestro caso, la deleción del exón 6 y cuya consecuencia era la ausencia del citocromo b558 y un fenotipo de los pacientes X91°.
Una vez detectada la alteración molecular y confirmado que era la responsable de la enfermedad se realizó el diagnóstico prenatal de EGC ligada al X en la muestra fetal mediante secuenciación directa, evaluando el cambio descrito (IVS6+4A>G) (fig. 2A). De esta manera se pudo responder al consejo genético solicitado para el segundo embarazo.
En la actualidad hay más de 300 mutaciones descritas en el gen CYBB y se han registrado en la XCGDbase (http://bioinf.uta.fi/CYBBbase). La mayoría de las mutaciones están distribuidas en los 13 exones y en las uniones intrón-exón; casi 200 de estas mutaciones son únicas. Las mutaciones de los sitios de procesamiento del ARN representan cerca del 10% de ellas1,13.
En resumen, en los casos de EGC es necesario un estudio molecular rápido que permita obtener un diagnóstico de certeza para el correcto tratamiento del paciente, permitiendo al mismo tiempo ofrecer un diagnóstico prenatal y consejo genético en futuros embarazos.
FinanciaciónEste trabajo ha sido financiado parcialmente por el proyecto de investigación del Fondo de Investigaciones Sanitarias 06/0614. EM y LIGG obtuvieron un contrato de investigación de la Fundación Biomédica del Hospital Universitario 12 de Octubre.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosA la Dra. M.a Carmen Otero por enviarnos esta familia para estudio de inmunodeficiencia, al Dr. J. M. Millán por enviarnos las muestras de amniocitos y a María Jesús Torres, María José Díaz-Madroñero, Miguela Merchén, Isabel Castro y Carmen Domínguez por su excelente ayuda técnica.