El diagnóstico de la gripe pandémica A (H1N1) plantea diferentes retos según se aborde desde un punto de vista epidemiológico o clínico. Existe un interés epidemiológico claro por controlar al máximo la expansión y alcance de la nueva gripe, que apoyaría el diagnóstico microbiológico preciso de todos los pacientes con métodos válidos. Este interés contrasta con la realidad clínica, en la que debe considerarse la factibilidad del diagnóstico microbiológico en periodo epidémico, la disponibilidad y validez de las pruebas rápidas en los puntos de asistencia a pacientes y su rendimiento clínico.
La confirmación diagnóstica de la infección requiere el empleo de técnicas complejas como el cultivo viral o la reacción en cadena de la polimerasa (PCR). Por el retraso que implica el cultivo viral (días), las técnicas más recomendables son las basadas en la detección de material genómico, principalmente la PCR en tiempo real (RT-PCR), que pueden ofrecer resultados en horas. Aunque disponemos de pruebas de diagnóstico rápido, basadas en la detección de antígenos virales, que pueden facilitar resultados en pocos minutos, estas pruebas son caras, no permiten el diagnóstico específico de subtipos virales y su sensibilidad es limitada en comparación con las pruebas de referencia. Considerando estas limitaciones la utilidad de las pruebas rápidas dependerá no sólo de su validez sino de que demuestren su rendimiento en comparación con el diagnóstico de presunción clínico.
Asimismo, en la gripe pandémica deben tenerse en cuenta los criterios clínicos que permiten establecer un diagnóstico de sospecha, y seleccionar los pacientes candidatos para la realización de pruebas de confirmación microbiológica. Para ello interesa conocer la capacidad predictiva de los signos y síntomas en distintos escenarios asistenciales. En este sentido resultará fundamental establecer si puede diferenciarse en base a criterios clínicos la gripe pandémica de otros síndromes gripales.
¿Qué criterios clínicos debe cumplir un paciente para poder ser catalogado de gripe pandémica A (H1N1)?En una revisión sistemática (RS)1 sobre signos y síntomas de la gripe, con una muestra de estudios que incluye a adultos y niños, no se encontró ningún signo o síntoma aislado que diera lugar a un cociente de probabilidad (CP) positivo superior a 2 (se consideran útiles para el diagnóstico CP+ >2 y CP- <0,5). Sin embargo, la ausencia de algunos síntomas daban un CP- <0,5 indicando menor probabilidad de gripe: ausencia de fiebre (CP-: 0,40; intervalo de confianza del 95% [IC 95%]: 0,25–0,66), tos (CP-: 0,42; IC 95% 0,31–0,57) o congestión nasal (CP-: 0,49; IC 95% 0.42–0.59).
En una serie de niños menores de 13 años, atendidos en atención primaria por síntomas de infección respiratoria a los que se realizó cultivo viral3, la fiebre estuvo presente en el 95% de los 353 con cultivo positivo, sólo una cuarta parte presentaron tos, la mayoría tenían rinitis en los primeros días y uno de cada diez niños tuvo síntomas gastrointestinales. En esta misma serie, no hubo diferencias en la clínica entre los casos con gripe A y gripe B3. Con respecto a la validez del diagnóstico clínico, sin especificar síntomas o signos, mostró entre los siete y los 13 años una sensibilidad del 53% y una especificidad del 87%, mientras que en el grupo de menores de 3 años las cifras fueron 21% y 93%, respectivamente4.
Friedman y cols5 encontraron que en niños con fiebre (<17 años) atendidos en un servicio de urgencias, la presencia de tos, cefalea y faringitis se asociaba a cultivo positivo, con una sensibilidad del 80% (IC 95%: 69–91) y una especificidad del 78% (IC 95%: 67–89).
Respecto al nuevo virus A (H1N1) interesa destacar una serie de casos pediátricos ingresados en un hospital del Reino Unido entre los meses de junio y julio de 20096. La mediana de edad era 5,7 años (intervalo entre 0,1 y 16,3 años). El 40,8% de los pacientes no cumplían los criterios oficiales de caso (29/71). El 18,7% de los casos no tuvieron fiebre (12/64). Después de la fiebre los síntomas más comunes fueron tos (49/67) y rinorrea (45/73); otros síntomas fueron: disnea, polipnea, distrés respiratorio, dolor faríngeo, cefalea, vómitos, diarrea, dolor abdominal, mialgias y convulsiones febriles. El 40,2% de los pacientes tenían enfermedades previas (31/77): asma, enfermedad pulmonar crónica, retraso del desarrollo, inmunodeficiencia, prematuridad, enfermedades metabólicas y endocrinológicas.
En diversos artículos7–10 se describe la clínica de series de casos de gripe pandémica declarados. La presencia conjunta de fiebre mayor de 37,5° y tos estuvo presente en más del 80% de los casos. En Alemania9, sobre 10.000 casos detectados hasta agosto, la fiebre sólo estuvo presente en el 78%.
Según un documento publicado por el European Centre for Disease Prevention and Control (ECDC) el 25 de septiembre de 2009, existen indicios, derivados del estudio de contactos, de la existencia de casos asintomáticos. Para saber con precisión su cuantía será necesario esperar a los resultados de los estudios serológicos que están en marcha. Se supone que entre el 33 y el 50% de las infecciones pueden ser asintomáticas11.
Criterios definitorios de caso: los criterios definitorios de caso han sido establecidos por consenso, no existiendo estudios de validación de los mismos en muestras de pacientes con gripe pandémica. En la tabla 1 se presentan los criterios de gripe dictados el 28 de mayo de 2008 por el ECDC.
Definición de caso y clasificación de la nueva gripe A (H1N1). ECDC
| Criterios clínicos | Persona que presenta al menos, uno de estos tres signos:
|
| Criterios analíticos | Al menos una de las siguientes pruebas positivas:
|
| Clasificación de caso |
|
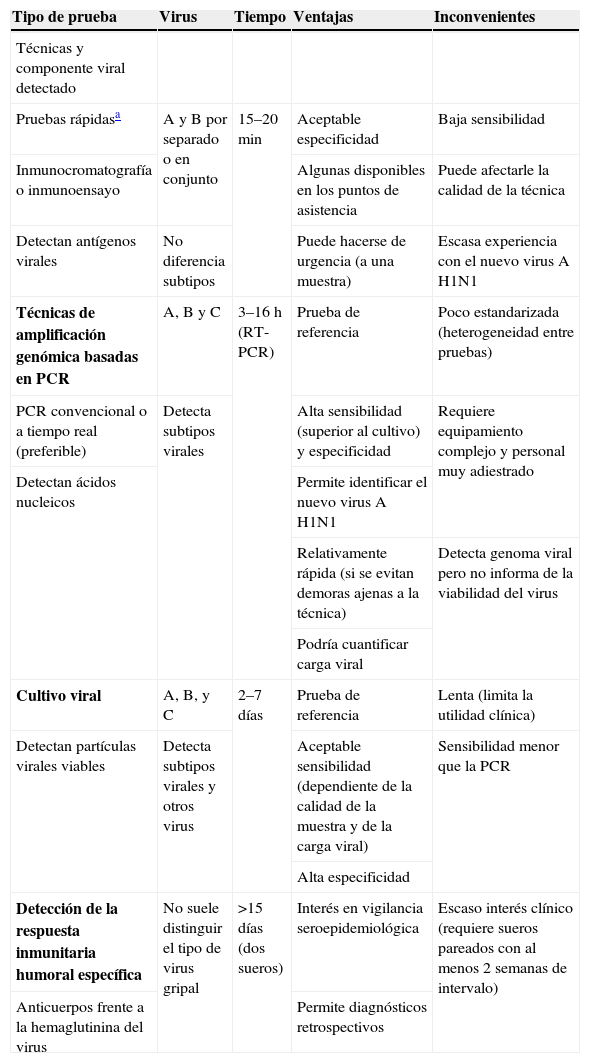
Existen diferentes tipos de pruebas diagnósticas para detectar la presencia de virus de la gripe en muestras respiratorias, incluyendo pruebas de detección antigénica, aislamiento de virus en cultivo celular o detección de ácidos nucleicos específicos mediante PCR. Estas pruebas difieren en cuanto a sensibilidad y especificidad, disponibilidad comercial, tiempo necesario para obtener resultados y capacidad para distinguir entre diferentes tipos de virus (A, B o C) o subtipos de virus A (nuevo virus pandémico H1N1, virus estacional H1N1, virus estacional H3N2). En la tabla 2 se presentan las características de las principales pruebas diagnósticas disponibles12–14.
Características de las principales pruebas diagnósticas disponibles (adaptado de protocolo del MSC, protocolo de la SEIMC y CDC)
| Tipo de prueba | Virus | Tiempo | Ventajas | Inconvenientes |
| Técnicas y componente viral detectado | ||||
| Pruebas rápidasa | A y B por separado o en conjunto | 15–20min | Aceptable especificidad | Baja sensibilidad |
| Inmunocromatografía o inmunoensayo | Algunas disponibles en los puntos de asistencia | Puede afectarle la calidad de la técnica | ||
| Detectan antígenos virales | No diferencia subtipos | Puede hacerse de urgencia (a una muestra) | Escasa experiencia con el nuevo virus A H1N1 | |
| Técnicas de amplificación genómica basadas en PCR | A, B y C | 3–16h (RT-PCR) | Prueba de referencia | Poco estandarizada (heterogeneidad entre pruebas) |
| PCR convencional o a tiempo real (preferible) | Detecta subtipos virales | Alta sensibilidad (superior al cultivo) y especificidad | Requiere equipamiento complejo y personal muy adiestrado | |
| Detectan ácidos nucleicos | Permite identificar el nuevo virus A H1N1 | |||
| Relativamente rápida (si se evitan demoras ajenas a la técnica) | Detecta genoma viral pero no informa de la viabilidad del virus | |||
| Podría cuantificar carga viral | ||||
| Cultivo viral | A, B, y C | 2–7 días | Prueba de referencia | Lenta (limita la utilidad clínica) |
| Detectan partículas virales viables | Detecta subtipos virales y otros virus | Aceptable sensibilidad (dependiente de la calidad de la muestra y de la carga viral) | Sensibilidad menor que la PCR | |
| Alta especificidad | ||||
| Detección de la respuesta inmunitaria humoral específica | No suele distinguir el tipo de virus gripal | >15 días (dos sueros) | Interés en vigilancia seroepidemiológica | Escaso interés clínico (requiere sueros pareados con al menos 2 semanas de intervalo) |
| Anticuerpos frente a la hemaglutinina del virus | Permite diagnósticos retrospectivos |
Considerando la mayor validez y relativa rapidez de las técnicas de detección genómica (PCR), éstas serían las pruebas ideales para el diagnóstico de la gripe pandémica. A pesar de la reconocida falta de estandarización de estas técnicas, existe información suficiente como para aceptar la validez de sus diagnósticos15–22. No obstante, en una situación epidémica, resulta inviable su uso masivo, al menos como prueba de diagnóstico clínico generalizado. Por ello, tendremos que considerar criterios de coste y utilidad para la selección de pacientes candidatos a su empleo.
Por tanto, en la mayoría de los pacientes con sospecha de gripe, la alternativa a considerar al diagnóstico clínico empírico es el empleo de pruebas de diagnóstico rápido, que si bien no permiten identificar el subtipo de virus, podrían orientar en el manejo del paciente.
Las pruebas de diagnóstico rápido más empleadas se basan en la detección de antígeno viral mediante inmunocromatografía o inmunoanálisis. Ofrecen resultados en menos de 30min, pudiendo ser realizadas en laboratorios clínicos o, algunas de ellas, a la cabecera del enfermo, por lo que podrían ser útiles en la toma de decisiones clínicas. Las pruebas rápidas comercializadas pueden detectar virus gripales A y B, en conjunto o por separado, o detectar sólo virus A13, pero ninguna puede distinguir entre subtipos de virus de la gripe A. Aunque se han elaborado pruebas rápidas para la detección de subtipos específicos de virus, la mayoría para uso animal con la gripe aviar, su validez no está establecida23.
Validez de las pruebas rápidas para el nuevo virus de la gripe pandémica A (H1N1)Aunque en estudios con diluciones de cultivos del nuevo virus de la gripe A (H1N1) las pruebas rápidas comercializadas se han mostrado reactivas24,25, se cuenta con pocos datos publicados sobre su validez en muestras clínicas26–28. Es previsible que su sensibilidad varíe en función de los subtipos analizados, en un intervalo similar al observado con el virus estacional. La sensibilidad relativa observada en 45 muestras positivas para el nuevo virus con las pruebas BinaxNOW Influenza A+B (Binax), Directigen EZ Flu A+B (Becton Dickinson) y QuickVue Influenza A+B (Quidel) se situó en un intervalo entre el 40 y el 69%, siendo menor cuanto menor era la carga viral de las muestras 27. Otro estudio similar sobre 84 muestras encontró resultados en un intervalo entre 38,3% y 53,3%29. En un reciente y amplio estudio con 1.831 muestras respiratorias (123 positivas para la nueva gripe A) la sensibilidad y especificidad de Binax Now A+B y 3M Rapid Detection Flu A+B en conjunto con respecto a un patrón combinado (inmunofluorescencia, cultivo y prueba rápida; identificación de subtipos en los positivos) fue de 21,2% y 99,5%28. Comparando Binax Now y 3M Rapid Detection con respecto al cultivo viral las sensibilidades para los nuevos virus A H1N1 fueron de 9,6% y 40%, valores similares a los observados con el conjunto de virus de la gripe A28. En otra serie de 49 casos, la sensibilidad de Remel Xpect Flu A&B respecto a una RT-PCR fue de 47% y la especificidad 86%30.
Validez de las pruebas rápidas para virus de la gripe estacionalEn una RS de 28 trabajos en los que se evaluó la validez de cinco pruebas sobre población pediátrica o general, empleando como patrón de referencia en la mayoría el cultivo viral (sólo en dos una RT-PCR)31. No se valoró la calidad de los estudios, por lo que las estimaciones de validez podrían estar sesgadas. Las medianas de sensibilidad y especificidad observadas fueron: para ZstatFlu (ZymeTx) 68,8% y 83%; para Directigen Flu A (Becton Dickinson) 87,2% y 98,1%; para Directigen Flu A+B (Becton Dickinson) 89,8% y 98,7% con el virus A y 87,5% y 96,8% con el virus B; para FLU OIA (Termo BioStar) 71,8% y 82%; y para QuickVue Influenza (Quidel) 79,2% y 91,9%. Es previsible que las sensibilidades hubieran sido menores si se hubieran comparado con técnicas de PCR.
En los últimos años se han publicado otros estudios32–55 con pruebas ya evaluadas en la RS de Uyeki31 y otras adicionales (ImmunoCard STAT Flu A y B, Binax NowFlu A+B, Xpect FluA/B, SD Bioline, actim Influenza A&B) con resultados de sensibilidad moderada-baja y especificidad alta. La información disponible no permite establecer una jerarquía clara entre las distintas pruebas. En conjunto la sensibilidad para el virus B de la gripe se ha situado entre un 20 a 30% por debajo de la del virus A.
Como resumen del conjunto de estudios que han evaluado pruebas de diagnóstico rápido, la sensibilidad es moderada-baja, encontrándose en un intervalo entre 50 y 80% para la gripe A estacional (valores menores para la gripe B), previsiblemente menor para la nueva gripe pandémica. La especificidad se encuentra alrededor del 90–99%, pudiendo ser similar para el nuevo virus. Un resultado negativo apenas orientará en el diagnóstico de gripe, mientras que un resultado positivo incrementaría de forma importante su verosimilitud (para una probabilidad preprueba de 25%, sensibilidad de 50% y especificidad de 95%, la probabilidad postprueba negativa sería 14,9% y la positiva 76,9%).
Validez según las características de la muestraLa calidad de las muestras influye en la sensibilidad de las técnicas. Así, se ha descrito que las muestras de lactantes tienen mayor rendimiento que las de niños más mayores38,40,47,55, en probable relación con una mayor carga viral en sus secreciones respiratorias38. También resulta importante el tipo de muestra, la calidad de la técnica de recogida, el retraso desde el inicio del cuadro, la demora en su procesamiento y las condiciones de almacenamiento y transporte.
Para alguna prueba rápida, se ha encontrado una superior sensibilidad de muestras obtenidas mediante frotis nasofaríngeo, con respecto al lavado nasofaríngeo, pero no con respecto al frotis nasal32; aunque estas diferencias no se han observado con otras pruebas56. En un estudio con técnicas de RT-PCR, no se encontraron diferencias entre el aspirado y el frotis nasofaríngeos, sugiriendo que el frotis podría tener más aceptación y generar menor riesgo de difusión viral57.
¿Resultan útiles las pruebas de diagnóstico rápido en el manejo de pacientes con sospecha de gripe pandémica (H1N1) en consultas de centros de salud y servicios de urgencias y permiten diferenciar la gripe pandémica de la gripe estacional?Se han realizado ensayos clínicos para valorar el impacto del uso de pruebas de diagnóstico rápido en servicios de urgencias sobre la realización de hemogramas, cultivos, radiografías de tórax, duración de la espera y prescripción de antibióticos, encontrando algunas diferencias a expensas, fundamentalmente, de la reducción de procedimientos entre los casos con resultado positivo36, 58–61. Una reciente RS, que resume los resultados de tres ensayos clínicos aleatorizados y uno cuasialeatorizado, mostró una reducción significativa en la realización de radiografías de tórax (RR: 0,77, IC 95%: 0,65 a 0,91), pero no de la estancia o de la petición de análisis de orina o sangre60.
En urgencias hospitalarias62, en niños menores de 36 meses, la inclusión de un test de diagnostico rápido de gripe redujo en los casos con un resultado positivo la estancia en el hospital y el número de procedimientos (análisis de orina y sangre, radiografías de tórax y punción lumbar). En un servicio de urgencias pediátrico en Francia63 se encontró una reducción de análisis, especialmente de urocultivos.
Además de los anteriores trabajos realizados en el entorno hospitalario, se han realizado algunos en el medio extrahospitalario. De la Rocque y cols64 encontraron una reducción de procedimientos y un menor uso de antibióticos en casos con prueba rápida positiva. Cohen y cols65 encontraron igualmente una reducción del uso de antibióticos, por parte de los médicos que disponían de la prueba rápida.
Estos estudios sugieren que disponer de test de diagnostico rápido da lugar a una reducción en los procedimientos prescindibles, tiempos de espera y uso de antibióticos entre los casos con resultado positivo. Por ello la utilidad de las pruebas depende de la frecuencia de infección y el tipo de paciente al que se aplique; si un paciente se encuentra en una situación clínica en la que la realización de procedimientos, el ingreso hospitalario o la prescripción de antibióticos es altamente probable, el uso de pruebas de diagnóstico rápido tendrá mayor impacto. Esto podría corresponder a lactantes, atendidos en urgencias hospitalarias en periodo epidémico, sin foco claro y con cierta afectación general; de ellos sólo se verían beneficiados los que tuvieran un resultado positivo (para una prevalencia del 25% y una sensibilidad del 50%, sólo uno de cada 8). Lamentablemente, no contamos con estimaciones válidas de coste-efectividad aplicables a nuestro medio; en un modelo teórico norteamericano con algunas asunciones dudosas, en el que se analizaban el coste-efectividad de las pruebas de diagnóstico rápido y del uso empírico de antivirales, las pruebas rápidas sólo resultaban coste-efectivas cuando la probabilidad de gripe era superior al 60%66. Desde el punto de vista epidemiológico, pueden resultar útiles en la detección del comienzo de una epidemia, aunque no permiten diferenciar el subtipo de virus implicado (gripe pandémica A H1N1 y estacional).
Cuadro resumen- •
El diagnóstico de gripe pandémica no puede efectuarse con seguridad a partir de la sintomatología clínica. En presencia de síntomas gripales resulta fundamental conocer la epidemiología local en cada momento para establecer el riesgo de infección de un paciente (Grado B; Nivel de evidencia 2b)
- •
El diagnóstico de infección por virus de la nueva gripe pandémica sólo puede establecerse mediante cultivo viral o técnicas de PCR. Desde el punto de vista clínico la RT-PCR es la prueba más recomendada para la confirmación diagnóstica. No parece factible el uso generalizado de estas pruebas en el curso de una epidemia, por lo que deben establecerse indicaciones por consenso basadas en nivel de riesgo (Grado de recomendación: B; Nivel de evidencia 2 b).
- •
Las pruebas de diagnóstico rápido son poco sensibles para el diagnóstico de infección gripal y no permiten distinguir entre subtipos virales (gripe A estacional o pandémica). Su especificidad es suficientemente alta, como para que los resultados positivos sean aceptables, desde el punto de vista clínico. La confirmación diagnóstica y en su caso la identificación de subtipo viral requerirá el empleo de otras pruebas, cuya indicación se valorará en función del interés epidemiológico o la gravedad del caso (Grado de recomendación: B; Nivel de evidencia 2 b)
- •
Se recomienda el empleo de muestras de frotis o aspirado nasofaríngeo para la realización de pruebas diagnósticas, aunque para las pruebas de diagnóstico rápido podría ser preferible el frotis (Grado de recomendación: B; Nivel de evidencia 2 b)
- •
No se recomienda el uso generalizado de pruebas de diagnóstico rápido para el manejo de pacientes con sospecha de gripe. Estas pruebas podrían resultar clínicamente útiles en pacientes con alto riesgo de infección, potencialmente expuestos a procedimientos diagnósticos o terapéuticos o ingreso hospitalario, aunque no podemos estimar su coste-efectividad (Grado de recomendación: C; extrapolación de nivel de evidencia 2 b y 3 b).
2.