La talla baja es motivo de consulta frecuente en Endocrinología Pediátrica, precisando en ocasiones tratamiento con hormona del crecimiento (GH). El objetivo del estudio fue analizar la respuesta al tratamiento en función de su inicio en la etapa puberal o prepuberal y analizar el posible beneficio de un comienzo precoz.
Pacientes y métodosEstudio longitudinal, retrospectivo y observacional en 139 pacientes tratados por déficit de GH idiopático (grave o parcial) hasta talla adulta. Principales variables estudiadas: a) antecedentes familiares: talla materna, paterna y genética; b) antecedentes perinatales; c) antropometría durante el seguimiento y al inicio puberal: peso, talla, índice de masa corporal, y d) variables durante el seguimiento y al inicio puberal: velocidad de crecimiento, edad ósea y pronóstico de crecimiento. Variables de respuesta final: talla adulta, talla adulta respecto a talla genética, talla adulta respecto al pronóstico de crecimiento inicial, talla adulta respecto a talla al inicio del tratamiento y talla adulta respecto a talla al inicio puberal.
ResultadosLa ganancia puberal total fue de 0,84±0,6 DE. Un 61,9% de los pacientes iniciaron tratamiento con GH en prepubertad. El inicio del tratamiento en la etapa prepuberal y una mayor ganancia puberal total se relacionaron con una mejor talla final (p=0,001, y r=0,507, p=0,00 respectivamente). Además, una mayor duración del tratamiento en la prepubertad se correlacionó con una mejor respuesta final (r=0,328, p=0,00).
ConclusionesEl inicio del tratamiento en la prepubertad y una mayor duración durante este periodo son factores determinantes para alcanzar una mejor respuesta a largo plazo. La ganancia puberal total fue mayor en los pacientes que iniciaron el tratamiento en etapa puberal.
Short stature is the most frequent reason for consultation in Pediatric Endocrinology consultations and sometimes requires treatment with growth hormone. The aim of the study was to analyze the response to treatment based on its onset in pubertal or prepubertal stages and to analyze the possible benefit of an early onset.
Patients and methodsLongitudinal, retrospective and observational study in 139 patients treated for idiopathic growth hormone deficiency up to adult height. Main variables studied: (a) genetic background: maternal, paternal and genetic height; (b) perinatal history; (c) anthropometry during follow-up and at pubertal onset: weight, height, body mass index; (d) variables during follow-up and at pubertal onset: growth rate, bone age and growth prognosis. Final response variables: adult height, adult height with respect to target height, adult height with respect to initial growth prediction, adult height with respect to initial height at the start of treatment and adult height with respect to height at pubertal onset.
ResultsTotal pubertal gain was 0.84±0.6 SD. 61.9% of the patients started treatment with rhGH in prepuberty. The initiation of treatment in the prepubertal stage and a higher total pubertal gain are correlated with a better final height (P=.001 and r=0.507, P=.00, respectively). Furthermore, a longer duration of treatment in pre-puberty is correlated with a better final response (r=0.328, P=.00).
ConclusionsThe start of treatment in the prepubertal stage and its longer duration during this period are determining factors to achieve a good long-term response. Total pubertal gain was greater in patients who started treatment in the pubertal stage.
La pubertad y el crecimiento son 2fenómenos fisiológicos muy relevantes que conllevan enormes cambios1. Con el aumento de la secreción gonadal de esteroides se inicia el brote de crecimiento puberal2. Esto determina la velocidad de crecimiento (VC) en la pubertad, la maduración sexual y la edad de la menarquia3. La pubertad normal comienza en niños a partir de 9 años, con un tamaño testicular igual o mayor de 4ml medido con el orquidómetro de Prader, y en niñas a partir de 8 años, cuando aparece el botón mamario4. La importancia del crecimiento durante la pubertad radica en que supone aproximadamente el 25% de la altura posnatal total, siendo ligeramente mayor en los hombres5. Sus alteraciones suponen un motivo frecuente de consulta de gran interés clínico1.
La talla baja es el motivo de consulta más frecuente en Endocrinología Pediátrica6. Se considera talla baja a aquella menor de –2 desviaciones estándar (DE) de la media de la población de referencia para igual edad y sexo7.
El déficit de hormona del crecimiento (DGH) supone una causa importante de talla baja en la infancia8. Se manifiesta de manera diferente según la etapa de desarrollo (precoz tras el nacimiento, durante la infancia, en la pubertad o en la edad adulta), la causa o el mecanismo (genético, adquirido o idiopático), la intensidad del déficit y si es la única hormona afectada en la hipófisis, se combina con otras hormonas hipofisarias o forma parte de un síndrome complejo9. Está ampliamente demostrada la importancia de un diagnóstico y un tratamiento precoz del DGH debido a su influencia en el adecuado desarrollo neurológico, metabólico y auxológico8.
El objetivo principal del tratamiento con rhGH en estos pacientes es normalizar la talla durante la infancia y adolescencia, y alcanzar una talla adulta (TA) en rango normal y acorde con su talla genética (TG)10,11. Diferentes ensayos clínicos demuestran la eficacia del tratamiento con rhGH para que estos niños consigan un crecimiento recuperador7.
Múltiples estudios apoyan que el inicio del tratamiento con rhGH a una edad temprana favorece que los pacientes alcancen una TA acorde con su TG. Así, el tratamiento debe iniciarse lo antes posible para lograr la máxima respuesta en el crecimiento10,12. Otros estudios defienden que la exposición total a rhGH durante los años prepúberes es un factor significativo y correlacionan la ganancia de talla en prepubertad con la ganancia de talla total, mostrando la importancia de comenzar el tratamiento antes del inicio puberal13,14.
Por tanto, nos planteamos como objetivo del estudio evaluar la respuesta al tratamiento en función del inicio en etapa puberal o prepuberal, estudiar la posible correlación de un inicio del tratamiento en etapa prepuberal con una mejor respuesta final y, en aquellos que inician el tratamiento en prepubertad, analizar el posible beneficio de un comienzo precoz del mismo.
Pacientes y métodosPoblación a estudioSe trata de un estudio longitudinal, retrospectivo y observacional con pacientes controlados en consultas de Endocrinología Infantil de un hospital terciario, nacidos entre 1989 y 2004, que habían sido tratados por DGH idiopático. Se define DGH idiopático grave si el pico de GH máxima en los test de estímulo es menor de 3 ng/ml y DGH parcial si se encuentra entre 3-10 ng/ml.
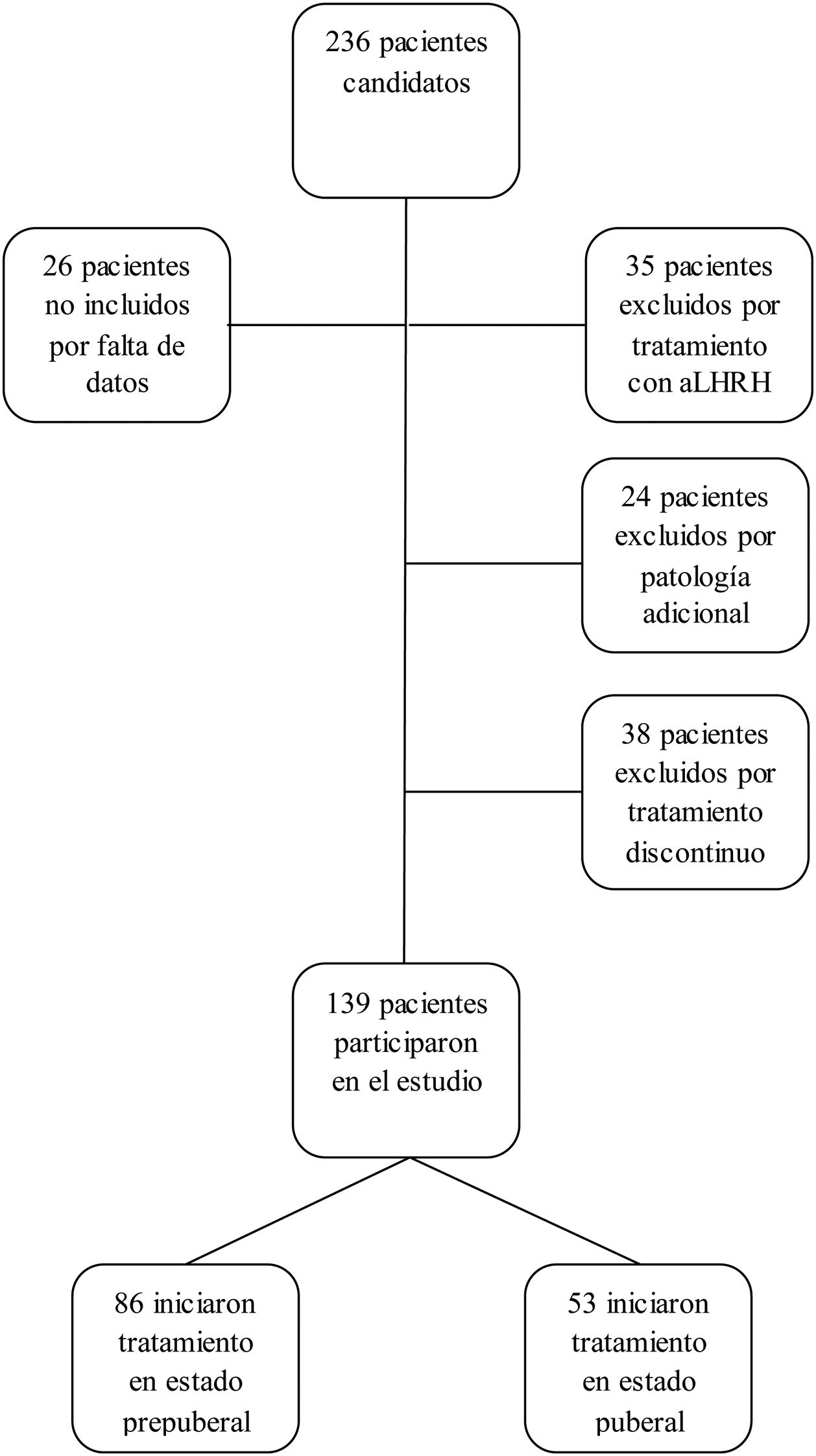
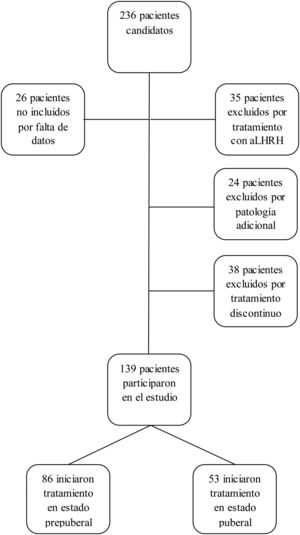
Los criterios de inclusión en el estudio fueron: pacientes con talla menor de –2 DE para edad y sexo al diagnóstico de DGH, con GH<10 ng/ml en 2test de estímulo, que recibieron tratamiento con GH a dosis sustitutivas durante al menos un año y alcanzaron la casi-TA. Se considera casi-TA cuando el ritmo de crecimiento es <0,5cm/año y la edad ósea es de 15 años en mujeres o 17 años en varones. Se ha utilizado este concepto cuando se hace referencia a la TA ya que los pacientes fueron dados de alta antes de alcanzar la TA final. Los criterios de exclusión del estudio fueron: DGH de etiología orgánica, pacientes con enfermedad adicional que pudiera condicionar el crecimiento y pronóstico de talla (cáncer, cardiopatías congénitas, parálisis cerebral infantil, síndromes o cromosomopatías), pacientes que habían recibido tratamiento concomitante con análogos de hormona liberadora de la hormona luteinizante, pacientes diagnosticados de DGH con un test de estímulo o pacientes que recibieron tratamiento con rhGH de manera discontinua, excluyéndose del estudio a 97 pacientes (n=97), siendo el grupo final de 139 pacientes (n=139). No se excluyó a ningún paciente por mala respuesta o efectos adversos al tratamiento (fig. 1).
Recolección de datos a estudioLas variables estudiadas fueron: 1) antecedentes genéticos: talla materna, talla paterna y TG; 2) antecedentes perinatales: tipo de gestación, edad gestacional al nacimiento, tipo de parto, enfermedad perinatal asociada y antropometría neonatal; 3) antropometría durante el seguimiento: peso, talla, índice de masa corporal (IMC); 4) antropometría al inicio puberal (considerando inicio puberal en mujeres la aparición de telarquia y en varones el incremento del tamaño testicular ≥ 4ml): peso, talla, IMC; 5) variables durante el seguimiento: VC, edad ósea, pronóstico de crecimiento (PC) y TA; 6) variables al inicio puberal: VC, edad ósea y PC; 7) resultados analíticos: estudio del eje GH-factor de crecimiento insulínico (IGF) (pico máximo de GH tras test de estímulo), IGF tipo 1 (IGF-1), IGF-proteína transportadora 3 del factor de crecimiento similar a la insulina (IGFBP3), y 8) tratamiento: dosis de rhGH (μg/kg/día).
Las variables talla, peso e IMC fueron calculadas y expresadas en valor absoluto y en DE según los Estudios españoles de crecimiento 201015. La variable VC fue expresada en valor absoluto y en DE según los Estudios españoles de crecimiento 201016. Para el cálculo de la edad ósea se utilizó el atlas radiográfico de maduración ósea de Greulich y Pyle17 y se calculó el pronóstico de TA basado en la talla y la edad ósea, por el método de Bayley y Pinneau18. El desarrollo puberal fue evaluado según los criterios de Tanner. Para realizar la comparación del crecimiento en pubertad se utilizó el estudio longitudinal de niños españoles normales desde el nacimiento hasta edad adulta19. Todas las variables estudiadas fueron evaluadas un año antes, al inicio del tratamiento con rhGH, al inicio puberal y anualmente hasta alcanzar la casi-TA.
Como criterios de respuesta final al tratamiento se consideraron:
- a.
TA (DE).
- b.
TA con respecto a la TG (DE).
- c.
TA con respecto al PC inicial (DE).
- d.
TA con respecto a la talla al inicio del tratamiento (DE).
- e.
TA con respecto a la talla al inicio puberal (DE).
Se analizaron la eficacia del tratamiento con rhGH en la TA en el DGH y la respuesta al mismo en función de su inicio en la etapa puberal o prepuberal, y se estudió la posible correlación de un inicio del tratamiento en la etapa prepuberal con una mejor respuesta final. Además, se analizó a los pacientes que iniciaron tratamiento en la etapa prepuberal y se estudió si un inicio precoz del mismo se correlaciona con una mejor respuesta final.
Análisis estadísticoSe realizaron un estudio de normalidad previo al estudio estadístico y posteriormente un estudio de comparación de medias y correlaciones. Para estudiar la relación entre variables categóricas se utilizó la prueba de la chi al cuadrado. Para estudiar la relación entre variables cuantitativas se aplicó el coeficiente de correlación de Pearson. Para estudiar la relación entre variables cuantitativas y categóricas se utilizó la prueba de la t de Student. Para el estudio estadístico se utilizó el programa SPSS (Satatistical Package for the Social Sciences), versión 15.0, considerando significación estadística p<0,05.
Este proyecto de investigación ha sido aprobado por el Comité de Ética de la Investigación de la Comunidad de Aragón.
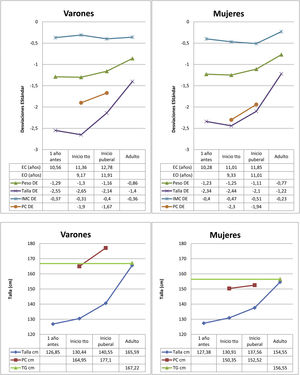
ResultadosLa muestra se compone de 139 pacientes (96 mujeres y 43 varones). El 71,2% de ellos correspondían a DGH grave y el 28,2% a DGH parcial. La cifra media de GH en los test de estímulo al diagnóstico fue 4,04±2,57 ng/ml (0 ng/ml-9,86 ng/ml). La edad media al inicio de tratamiento fue de 11,1±2,5 años, con una duración de 4,2±2 años y una dosis media inicial de 26,14±2 μg/kg/día, siendo de 26,02±2,52 μg/kg/día en aquellos que inician tratamiento en prepubertad, y de 26,33±2,14 μg/kg/día en los que lo hacen en pubertad, sin diferencias estadísticamente significativas entre ellos (p=0,454). Las dosis continuaron siendo similares durante el desarrollo puberal. La edad media al final del tratamiento fue de 15,3±1,2 años. La TG fue de –1,3±0,7, la TI de –2,5±0,4 y el PC inicial de –2,19±0,6, es decir, 150,35±3,40cm en mujeres y 164,9±2,87cm en varones. La menarquia tuvo lugar con una edad media de 13,67±1 años.
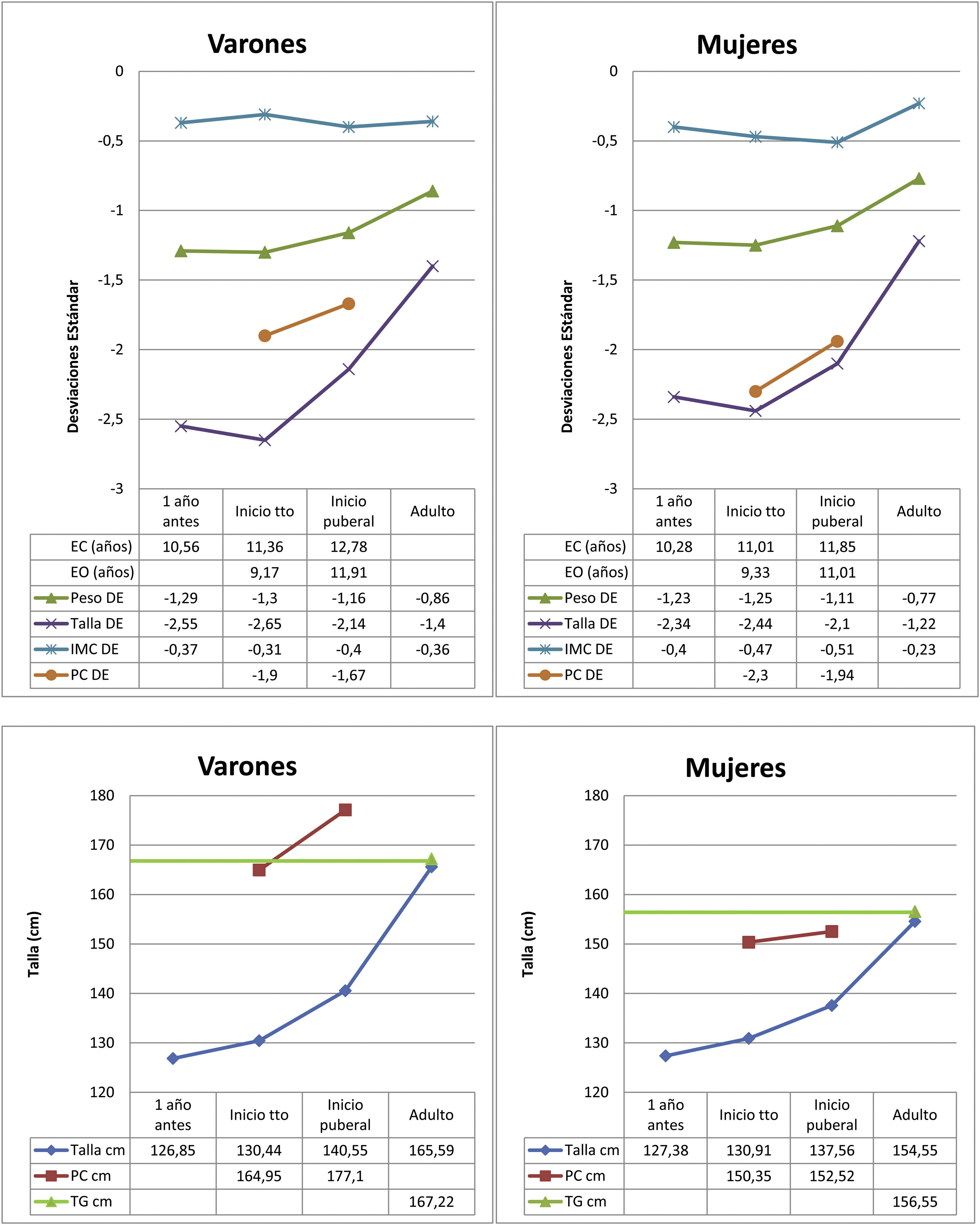
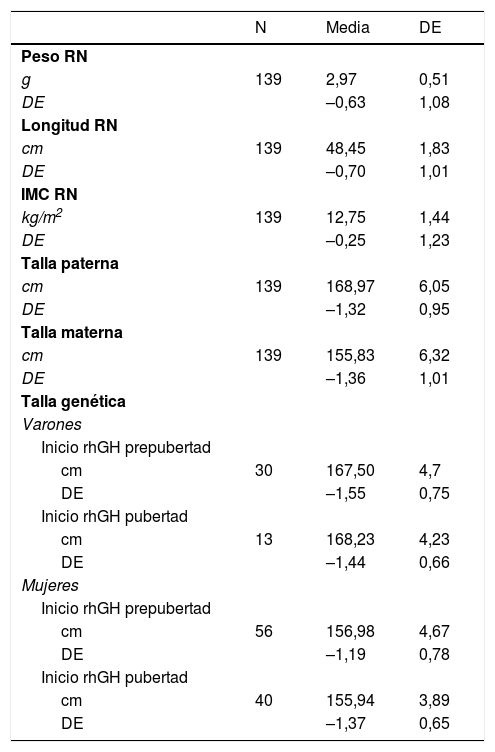
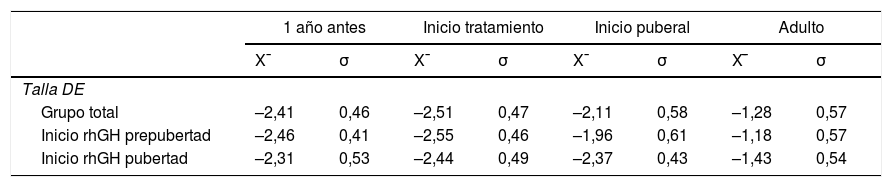
Los datos del nacimiento, las tallas de los padres y la TG se muestran en la tabla 1. Las principales características descriptivas y su evolución durante el seguimiento se muestran en la figura 2. La evolución de la talla en función del inicio de tratamiento en prepubertad o pubertad se muestra en la tabla 2.
Datos del nacimiento, tallas de los padres y talla genética, expresadas en valor absoluto y en desviaciones estándar
| N | Media | DE | |
|---|---|---|---|
| Peso RN | |||
| g | 139 | 2,97 | 0,51 |
| DE | –0,63 | 1,08 | |
| Longitud RN | |||
| cm | 139 | 48,45 | 1,83 |
| DE | –0,70 | 1,01 | |
| IMC RN | |||
| kg/m2 | 139 | 12,75 | 1,44 |
| DE | –0,25 | 1,23 | |
| Talla paterna | |||
| cm | 139 | 168,97 | 6,05 |
| DE | –1,32 | 0,95 | |
| Talla materna | |||
| cm | 139 | 155,83 | 6,32 |
| DE | –1,36 | 1,01 | |
| Talla genética | |||
| Varones | |||
| Inicio rhGH prepubertad | |||
| cm | 30 | 167,50 | 4,7 |
| DE | –1,55 | 0,75 | |
| Inicio rhGH pubertad | |||
| cm | 13 | 168,23 | 4,23 |
| DE | –1,44 | 0,66 | |
| Mujeres | |||
| Inicio rhGH prepubertad | |||
| cm | 56 | 156,98 | 4,67 |
| DE | –1,19 | 0,78 | |
| Inicio rhGH pubertad | |||
| cm | 40 | 155,94 | 3,89 |
| DE | –1,37 | 0,65 | |
cm: centímetros; DE: desviación estándar; IMC: índice de masa corporal; RN: recién nacido.
Evolución de los valores medios y desviación estándar de la talla en función del inicio de tratamiento con rhGH en prepubertad o pubertad, expresadas en desviaciones estándar
| 1 año antes | Inicio tratamiento | Inicio puberal | Adulto | |||||
|---|---|---|---|---|---|---|---|---|
| X¯ | σ | X¯ | σ | X¯ | σ | X¯̄ | σ | |
| Talla DE | ||||||||
| Grupo total | –2,41 | 0,46 | –2,51 | 0,47 | –2,11 | 0,58 | –1,28 | 0,57 |
| Inicio rhGH prepubertad | –2,46 | 0,41 | –2,55 | 0,46 | –1,96 | 0,61 | –1,18 | 0,57 |
| Inicio rhGH pubertad | –2,31 | 0,53 | –2,44 | 0,49 | –2,37 | 0,43 | –1,43 | 0,54 |
DE: desviación estándar; x̄: media aritmética; σ: desviación estándar.
Un 61,9% de los pacientes iniciaron el tratamiento con rhGH en prepubertad (el 40,3% de las mujeres y el 21,6% de los varones), con una edad cronológica al inicio del tratamiento de 9,87±1,9 años en mujeres y 10,14±3,2 años en varones. Desde el inicio del tratamiento con rhGH al inicio puberal pasaron 1±2,2 años, siendo 1,4±2,9 años en varones y 0,8±1,7 años en mujeres. En el 38,1% que comenzaron el tratamiento sustitutivo tras el inicio puberal las edades iniciales fueron de 12,6±0,9 años en mujeres y 14,19±1,4 años en varones.
Se alcanzó una TA que supera en DE a la TI con respecto a su población de referencia (TA=–1,28±0,6 y TI=–2,5±0,4), siendo de 154,5±3,7cm en mujeres y 165,6±4,1cm en varones. La TA con respecto a la TG fue de 0,06±0,7 y la TA con respecto al PC inicial de 0,9±0,6. Se constató un incremento de la TA con respecto a la TI de 1,2±0,6, siendo de +0,4±0,5 en prepubertad y de +0,84±0,6 en pubertad, sin diferencias significativas entre sexos. La TA aumentó 0,57±0,6 con respecto al PC al inicio puberal. La ganancia puberal total (GPT) fue de 16,96±3,9cm en mujeres y 25,04±5,3cm en varones. Este incremento fue mayor en los pacientes que iniciaron el tratamiento en pubertad.
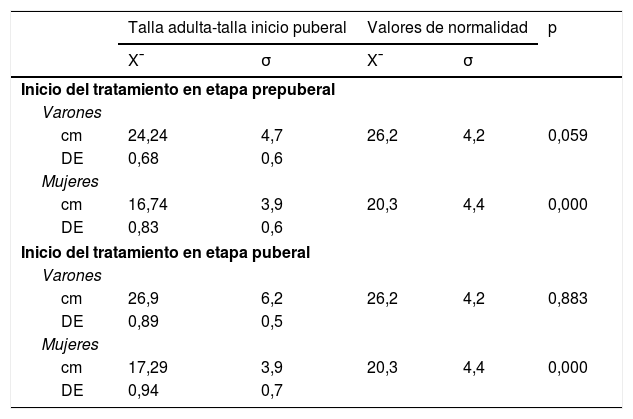
El crecimiento de la muestra durante la pubertad es similar respecto al estudio de referencia en los varones (25,04±5,3cm vs. 26,2±4,2cm), existiendo una tendencia (no significativa) a tener un menor crecimiento en aquellos que inician el tratamiento en prepubertad (24,24±4,7cm vs. 26,2±4,2cm, p=0,059). Sin embargo, las cifras de crecimiento en mujeres son menores (16,96±3,9cm vs. 20,3±4,4cm), observando diferencias estadísticamente significativas con los valores de referencia en aquellas que inician tratamiento en prepubertad (16,74±3,9cm vs. 20,3±4,4cm, p=0,00), y en pubertad (17,29±3,9cm vs. 20,3±4,4cm, p=0,00) (tabla 3). Una mayor GPT se correlaciona de manera estadísticamente significativa con una mejor talla final (r=0,507, p=0,00).
Valores medios y desviación típica de la ganancia puberal total, en función del inicio del tratamiento con rhGH
| Talla adulta-talla inicio puberal | Valores de normalidad | p | |||
|---|---|---|---|---|---|
| X¯ | σ | X¯ | σ | ||
| Inicio del tratamiento en etapa prepuberal | |||||
| Varones | |||||
| cm | 24,24 | 4,7 | 26,2 | 4,2 | 0,059 |
| DE | 0,68 | 0,6 | |||
| Mujeres | |||||
| cm | 16,74 | 3,9 | 20,3 | 4,4 | 0,000 |
| DE | 0,83 | 0,6 | |||
| Inicio del tratamiento en etapa puberal | |||||
| Varones | |||||
| cm | 26,9 | 6,2 | 26,2 | 4,2 | 0,883 |
| DE | 0,89 | 0,5 | |||
| Mujeres | |||||
| cm | 17,29 | 3,9 | 20,3 | 4,4 | 0,000 |
| DE | 0,94 | 0,7 | |||
Expresado en centímetros y DE, y dividido por sexos, y comparado con los valores del «Estudio longitudinal de niños españoles normales desde el nacimiento hasta la edad adulta».
Se considera significación estadística p<0,05
DE: desviación estándar; p: nivel de significación; x̄: media aritmética, σ: desviación típica.
Fuente: Ferrández Longás et al.19.
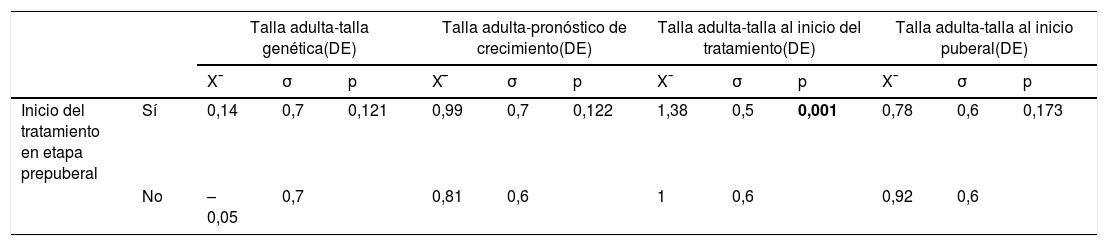
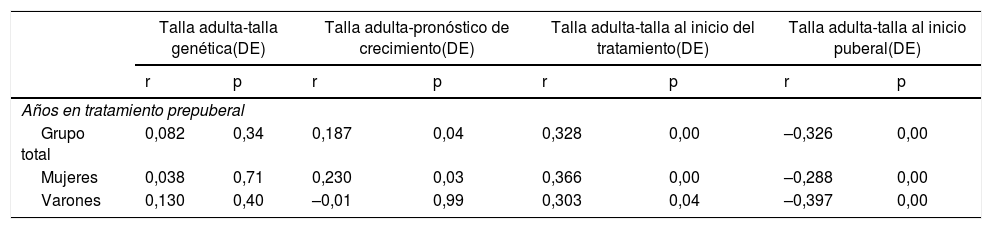
Tanto los pacientes que inician tratamiento en la etapa prepuberal (N=86, TA-TG=0,14±0,7) como en la etapa puberal (N=53, TA-TG=–0,05±0,7) alcanzan su TG, sin diferencias estadísticamente significativas entre ellos (p=0,126). Un inicio del tratamiento en la etapa prepuberal se asocia con una mejor respuesta final (TA con respecto a TI, p=0,001) (tabla 4). Además, una mayor duración del mismo durante esta etapa se correlaciona de manera estadísticamente significativa con una mejor respuesta final (tabla 5).
Relación entre la respuesta final al tratamiento en función del inicio del mismo en la etapa prepuberal o puberal
| Talla adulta-talla genética(DE) | Talla adulta-pronóstico de crecimiento(DE) | Talla adulta-talla al inicio del tratamiento(DE) | Talla adulta-talla al inicio puberal(DE) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| X¯ | σ | p | X¯̄ | σ | p | X¯ | σ | p | X¯ | σ | p | ||
| Inicio del tratamiento en etapa prepuberal | Sí | 0,14 | 0,7 | 0,121 | 0,99 | 0,7 | 0,122 | 1,38 | 0,5 | 0,001 | 0,78 | 0,6 | 0,173 |
| No | –0,05 | 0,7 | 0,81 | 0,6 | 1 | 0,6 | 0,92 | 0,6 | |||||
Se considera significación estadística p<0,05.
Los datos presentados en negrita representan resultados con significación estadística.
DE: desviación estándar; p: nivel de significación; X¯: media aritmética, σ: desviación típica.
Correlaciones entre años de tratamiento en etapa prepuberal y variables de respuesta final al tratamiento, en el grupo de inicio del tratamiento en etapa prepuberal
| Talla adulta-talla genética(DE) | Talla adulta-pronóstico de crecimiento(DE) | Talla adulta-talla al inicio del tratamiento(DE) | Talla adulta-talla al inicio puberal(DE) | |||||
|---|---|---|---|---|---|---|---|---|
| r | p | r | p | r | p | r | p | |
| Años en tratamiento prepuberal | ||||||||
| Grupo total | 0,082 | 0,34 | 0,187 | 0,04 | 0,328 | 0,00 | –0,326 | 0,00 |
| Mujeres | 0,038 | 0,71 | 0,230 | 0,03 | 0,366 | 0,00 | –0,288 | 0,00 |
| Varones | 0,130 | 0,40 | –0,01 | 0,99 | 0,303 | 0,04 | –0,397 | 0,00 |
Se considera significación estadística p<0,05.
DE: desviación estándar; p: nivel de significación; r: coeficiente de correlación de Pearson.
El estudio incluye a 139 pacientes tratados con rhGH durante al menos un año por DGH y que ya han alcanzado la casi-TA, lo que permite valorar la evolución de un número significativo de pacientes. Más de la mitad de los pacientes del estudio eran mujeres, porcentaje similar al observado en estudios previos como los realizados por Ranke et al.20,21, Rachmiel et al.22 o Straetemans et al.23, suponiendo un porcentaje mayor al que se observa en otros estudios con predominio del sexo masculino, como los realizados por Carrascosa et al.24,25 o Ariza Jiménez et al.26. Este hecho puede ser debido al tamaño muestral del presente estudio y probablemente con un incremento de la muestra esta proporción se igualaría. Sin embargo, el hecho de que haya más proporción de mujeres remarca la importancia de realizar un diagnóstico precoz, ya que, al iniciar antes la pubertad, alcanzan antes la talla final, repercutiendo en los años potenciales totales de tratamiento.
Los beneficios del tratamiento con rhGH en el incremento de la VC están ampliamente demostrados en la literatura7,10,11 y respaldan los resultados de este trabajo, en el que el tratamiento con rhGH consigue alcanzar una TA normal y en rango genético. Además, es fundamental conocer la adherencia al mismo para poder realizar este tipo de estudios e incluir más parámetros que nos permitan realizar una valoración más integral27.
La edad de inicio puberal en varones en este estudio fue similar a lo observado en otros estudios3,19,28, salvo en el de Bundak et al.29, en cuya población los niños empiezan la pubertad más precozmente. Sin embargo, la edad de inicio puberal en mujeres fue superior a lo publicado3,4,19, en las que se aproxima a los 10 años, salvo en el estudio publicado por Maghnie et al.28, que muestra una edad media de 12,6 años. La edad ósea al inicio puberal estuvo en consonancia con los estudios de García-Cuartero et al.4, Ferrández Longás et al.19 y Maghnie28. La talla y el IMC al inicio puberal de las mujeres del presente estudio fueron similares a lo revisado en la literatura3,4,28. En varones, los valores de talla fueron inferiores a lo publicado por García Cuartero et al.4, Maghnie et al.28 Bundak et al.29, con tallas que se aproximan a los 147cm, pero manteniendo un IMC similar. La edad media de la menarquia en este estudio fue superior a lo publicado por Carrascosa et al.3 y Ferrández Longás et al.19 en sus estudios longitudinales, siendo de 12,9±1,1 y 12,6±0,9, respectivamente. El retraso en la edad de inicio puberal y de la menarquia en mujeres, superior a lo publicado en estudios longitudinales de niños sanos, probablemente esté en relación con la fisiopatología del DGH, ya que produce un fenotipo caracterizado por un hipocrecimiento armónico y posnatal, incluyendo retraso puberal30 y retraso de la edad ósea31. Sin embargo, a pesar de que la edad de inicio puberal y de la menarquia en las mujeres de nuestra muestra es superior a otras series, es importante resaltar que la duración total desde el inicio puberal hasta la aparición de la menarquia está en consonancia con lo publicado en otras series y con la población de referencia3,19.
Múltiples trabajos apoyan que el inicio del tratamiento con rhGH a una edad temprana favorece que los pacientes alcancen una TA acorde con su TG. Así, el tratamiento debe iniciarse lo antes posible para lograr la máxima respuesta en el crecimiento10,12. Un 61,9% de los pacientes iniciaron el tratamiento con rhGH en prepubertad, con una edad cronológica al inicio del tratamiento acorde con estudios como el de Ranke y Lindberg32 o el estudio KIGS33 en ambos sexos. Sin embargo, un 38,1% comenzó el tratamiento tras el inicio puberal, ya que los primeros pacientes incluidos en el estudio son antiguos e iniciaron el tratamiento cuando apareció la indicación, no siendo reflejo de la situación actual, donde se realizan los diagnósticos precozmente, pero son útiles para comparar la respuesta al tratamiento. De hecho, es interesante destacar que se objetiva un descenso progresivo de la edad de inicio de tratamiento desde los primeros pacientes hasta los más recientes de esta muestra.
En el presente estudio se produjo una GPT en consonancia con los datos existentes en la literatura en los estudios de Maghnie et al.28 y Bundak et al.29, pero superior a los presentados por García-Cuartero et al.4. Según los datos obtenidos en este estudio, una mayor GPT se correlaciona con una mejor talla final, lo que apoya lo presentado en otros trabajos, como el de Ariza Jiménez et al.26 o Maghnie et al.28. Además, siendo un hecho no reseñado previamente por otros autores, se establece que la GPT fue mayor en los pacientes que iniciaron el tratamiento en la etapa puberal, mostrando la influencia de la pubertad sobre la talla final. Esto puede ser debido a que los pacientes que inician tratamiento en prepubertad han recuperado el déficit parcialmente antes de iniciar el desarrollo puberal, mientras que aquellos que lo inician en pubertad todavía no han iniciado la recuperación, por lo que la ganancia total durante la pubertad es mayor en estos últimos.
La duración del tratamiento en estadio prepuberal fue muy inferior a lo referido por Carrascosa et al.3 en su estudio longitudinal, en el que era de 3,6 años. Esto es debido probablemente a que, como se ha comentado previamente, algunos de los pacientes del presente estudio son pacientes antiguos.
Múltiples estudios han relacionado un inicio del tratamiento en prepubertad con una respuesta final más favorable. En el trabajo realizado por Patel et al.13 se encontró que, en pacientes con DGH, una menor edad y un estado prepuberal al inicio del tratamiento se relacionaba con un mejor resultado final. Root et al.12, en concordancia con el concepto de que la sensibilidad a la rhGH es mayor durante la infancia y que los esfuerzos terapéuticos para conseguir una mejor talla final deben centrarse en la etapa prepuberal, constataron que el crecimiento recuperador de estos pacientes se logró durante la infancia, antes del inicio de la pubertad. Reiter et al.14 sugirieron en su estudio que la exposición total a rhGH durante los años prepúberes puede ser un factor significativo en la mejor ganancia de talla final, objetivando que la ganancia de talla en estado prepuberal estuvo altamente correlacionada con la ganancia de talla total, confirmando la importancia del inicio del tratamiento antes de la pubertad. Además, Cavarzere et al.34, en un reciente estudio, concluyeron que la secreción de GH debe revaluarse a mediados de la pubertad, para reducir posibles efectos secundarios y minimizar costes, sin afectar la talla final. Por tanto, la efectividad y el costo-efectividad del tratamiento con rhGH es mayor en la etapa prepuberal10,32. Así, y según lo observado en este trabajo, un inicio del tratamiento en la etapa prepuberal se correlaciona con una mejor respuesta final. Sin embargo, en el presente estudio se incluye a pacientes que inician el tratamiento en etapa prepuberal y puberal, observando una relación entre la respuesta final y el inicio de tratamiento en etapa prepuberal valorado mediante la diferencia de TA-TI. El resultado novedoso de este trabajo es que un diagnóstico de DGH en pubertad no debe limitar el tratamiento con rhGH, puesto que la respuesta al mismo también es adecuada, pero asumiendo que, al ser de menor duración, será inferior que si se inicia en prepubertad.
Según el estudio realizado por Ranke et al.20, y basándose en el hecho de que la tasa de crecimiento disminuye con la edad durante la etapa prepuberal, se vio que dentro del grupo de pacientes que inició tratamiento en prepubertad la respuesta a rhGH fue mayor entre los pacientes más jóvenes. Siguiendo esta línea de trabajo, y según los resultados obtenidos en el presente estudio, dentro del grupo de pacientes que iniciaron el tratamiento en la etapa prepuberal, una mayor duración del mismo en este periodo se correlaciona con una mejor respuesta final.
En conclusión, los hallazgos de este estudio muestran que los pacientes que inician el tratamiento en la etapa prepuberal presentan una mejor respuesta final. Además, cuanto menor sea la edad de inicio y mayor sea la duración durante esta etapa, mejor será el resultado, aunque un diagnóstico de DGH en pubertad no deber limitar el tratamiento con rhGH, puesto que la respuesta al mismo también es adecuada. Asimismo, una mayor ganancia de talla durante la pubertad conseguirá una mejor talla final. Estos resultados avalan lo publicado en otros estudios, siendo de gran utilidad, ya que pueden ayudar en la toma de decisión sobre el momento más adecuado para comenzar el tratamiento, y obtener un mayor beneficio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.