Muchos antivirales, como la hidroxicloroquina, se han utilizado para el tratamiento de COVID-19. La prolongación del QTc es un efecto adverso preocupante, escasamente estudiado en pediatría.
Pacientes y métodosLos pacientes pediátricos con COVID-19 que recibieron tratamiento antiviral se emparejaron (1:2) con controles no infectados ni expuestos al tratamiento. Se analizaron prospectivamente los electrocardiogramas basales, en las primeras 72 horas de tratamiento y posterior a 72 horas.
ResultadosOnce (22,9%) de 48 pacientes pediátricos ingresados por COVID-19 (marzo a julio del 2020) recibieron terapia antiviral. Todos presentaban patologías de base; destacando cardiopatías (4/11; 36,4%) e inmunosupresión (3/11; 27,3%); 5/11 (45,5%) recibían tratamiento de base con potencial efecto sobre el QTc. No hubo diferencias en el QTc basal entre casos y controles: 414,8 ms (49,2) vs. 416,5 ms (29,4) (p = 0,716). Se observó QTc prolongado basal en 2/11 casos y 2/22 controles. De los casos, 10/11 (90,9%) recibieron hidroxicloroquina, principalmente asociada a azitromicina (8/11; 72,7%); tres recibieron lopinavir/ritonavir, uno remdesivir. La mediana de incremento del QTc tras 72 horas fue de 28,9 ms (IQR 48,7) (p = 0,062); 4/11 (36,4%) presentaron un QTc largo, de los cuales en tres ≥ 500 ms. En uno se paró el tratamiento (QTc 510 ms) pero no se documentaron arritmias ventriculares.
ConclusionesEl uso de fármacos antivirales causó un incremento del QTc tras 72 horas de tratamiento, considerándose un QTc largo en el 36,4% de los pacientes, aunque no se objetivaron eventos arrítmicos. El uso de hidroxicloroquina y antivirales requiere monitorización activa del QTc y se recomienda suspender el tratamiento si el QTc > 500 ms.
Many antiviral agents, such as hydroxychloroquine, have been used to treat COVID-19, without being broadly accepted. QTc prolongation is a worrisome adverse effect, scarcely studied in pediatrics.
Patients and methodsPediatric patients affected from COVID-19 who received antivirals were matched (1:2) with controls not infected nor exposed. Electrocardiograms were prospectively analyzed at baseline, during the first 72 h in treatment and after 72 h.
ResultsEleven (22.9%) out of 48 patients admitted due to COVID-19 (March–July 2020) received antiviral therapy. All had underlying diseases: congenital heart disease (4/11; 36.4%) and immunosuppression (3/11; 27.3%) stand out. 5/11 (45.5%) received treatment at baseline with a potential effect on QTc. There where no differences observed in the baseline QTc between cases and controls: 414.8 ms (49.2) vs. 416.5 ms (29.4) (p = 0.716). Baseline long QT was observed in 2/11 cases and 2/22. Among cases, 10/11 (90.9%) received hydroxychloroquine, mainly associated with azithromycin (8/11; 72.7%), 3 received lopinavir/ritonavir and one remdesivir. The median increase in QTc after 72 h under treatment was 28.9 ms (IQR 48.7) (p = 0.062). 4/11 (36.4%) patients had a long QTc at 72 h, resulting in 3 patients ≥500 ms; treatment was stopped in one (QTc 510 ms) but ventricular arrhythmias were not documented.
ConclusionsThe use of antivirals caused an increase on the QTc interval after 72 h of treatment, being the QTc long in 36.3% of the patients, although no arrhythmic events were observed. The use of hydroxychloroquine and antivirals requires active QTc monitoring and it is recommended to discontinue treatment if QTc >500 ms.
La epidemia del síndrome respiratorio agudo grave coronavirus 2 (SARS-CoV-2) o coronavirus 2019 (COVID-19) fue declarada pandemia y emergencia de salud pública internacional por la Organización Mundial de la Salud el pasado 30 de enero del 2020 1, y sigue siendo la mayor causa de preocupación para los diferentes Sistemas de Salud a nivel mundial con más de 100 millones de casos confirmados y más de 2.500.000 defunciones registradas1,2. En España, se han confirmado más de 3.000.000 casos de COVID-19 con más de 70.000 defunciones en el momento actual1,3.
En las publicaciones iniciales sobre COVID-19, los casos pediátricos graves reportados fueron excepcionales, pero con el tiempo, el número de casos descritos en población pediátrica ha aumentado4–6, estando aún muy lejos de la gravedad que ha supuesto en la población adulta. En España, solamente el 0,8% de casos corresponden a menores de 18 años4.
Actualmente, no existen terapias aprobadas ni aceptadas universalmente para el tratamiento etiológico de esta enfermedad. Numerosos agentes terapéuticos han sido estudiados y múltiples estudios publicados sin llegar a aceptarse universalmente ningún tratamiento antivírico2,7,8.
Las primeras publicaciones con datos limitados in vitro de supresión de actividad de SARS-CoV-2 llevaron al uso de fármacos del grupo de las aminoquinoleinas: cloroquina e hidroxicloroquina, igual que previamente fueron usados para el ébola, la gripe H7N9 y la infección por el virus del SARS2,7. Los regímenes terapéuticos utilizados fueron diferentes según el país u hospital, en el uso clínico y en los estudios publicados9,10. Investigaciones actuales de metodología más robusta no han conseguido replicar estos hallazgos; además estos fármacos no quedan exentos de potencial dañino con múltiples efectos adversos posibles, sobre todo cardiacos2,7,11,12
De los efectos secundarios descritos con hidroxicloroquina, la prolongación del intervalo QT y la aparición de arritmias ventriculares graves es uno de los que más preocupación ha generado13,14, sobre todo con el uso concomitante de otros fármacos con potencial efecto similar como la azitromicina11,15.
En el paciente pediátrico, la literatura sobre alteraciones electrocardiográficas en COVID-19 es muy escasa16. Tampoco existen, fuera de la epidemia por COVID-19, series largas de pacientes pediátricos en tratamiento con hidroxicloroquina y otros fármacos antivirales. La relación entre hidroxicloroquina y los trastornos de conducción, establecida en adultos sigue siendo impredecible en el paciente pediátrico, solo un estudio en sujetos con lupus eritematoso sistémico ha intentado establecer sin éxito esta relación17.
Nuestro objetivo es describir el grado de prolongación del intervalo QT en nuestra población de pacientes pediátricos con COVID-19 en relación con la administración de hidroxicloroquina y fármacos con efecto antivírico recomendados para la COVID-19: lopinavir/ritonavir, remdesivir y azitromicina.
Pacientes y métodosLos individuos incluidos en el estudio se seleccionaron de la muestra total de pacientes pediátricos ingresados por COVID-19 en el Hospital Universitario Vall d’Hebron (Barcelona) con confirmación microbiológica por reacción en cadena de la polimerasa (PCR) en aspirado nasofaríngeo o serología positiva. La recogida prospectiva de datos se realizó desde el mes de marzo a julio del 2020.
El criterio de inclusión en el estudio fue la administración de uno de los siguientes cuatro fármacos para el tratamiento de la neumonía por COVID-19: hidroxicloroquina, azitromicina, lopinavir/ritonavir o remdesivir durante el período de estudio, que representa un total de 11 casos.
Los casos fueron emparejados por edad y sexo, y en una proporción 1:2 con controles sin patología cardiaca estructural que no habían sido expuestos a ninguno de los fármacos a estudio ni infectados por COVID-19.
Para todos los pacientes, se obtuvo información sobre el diagnóstico de COVID-19 y las condiciones médicas preexistentes. Respecto al tratamiento, se registraron los distintos administrados y la duración de estos. La elección de cada esquema terapéutico responde a las indicaciones documentadas en el protocolo específico del hospital en el momento que ingresó cada paciente, basado en las recomendaciones y la evidencia del momento.
El régimen terapéutico estándar con hidroxicloroquina vía oral era de 6,5 mg/kg/día en menores de seis años de edad y 10 mg/kg/día en mayores de seis años, durante un total de cinco días y con una dosis máxima de 400 mg/día. La dosis de remdesivir era de 2,5 mg/kg/día endovenosos durante nueve días (máximo 100 mg), tras una primera dosis de carga de 5 mg/kg el primer día (máximo 200 mg). El tratamiento con lopinavir/ritonavir se administró vía oral a una dosis de lopinavir de 600 mg/m2/día en menores de tres meses, 24 mg/kg/día en pacientes hasta 15 kg de peso y 20 mg/kg/día en pacientes de más de 15 kg hasta una dosis máxima de 800 mg/kg/día. La azitromicina se administró vía oral a 10 mg/kg/día durante tres días.
Todos los electrocardiogramas fueron evaluados manualmente por la misma persona. Los intervalos QT se calcularon en tres latidos diferentes y se utilizó la fórmula de Bazett (QT corregido [QTc] = QT/√ RR) para determinar los intervalos QT corregidos. Se consideró un QTc prolongado si era superior a 440 ms en niños y a 460 ms en niñas. Las variables clínicas de evaluación fueron los cambios en el electrocardiograma objetivados durante la administración de los fármacos estudiados respecto el estudio basal. Con este objetivo se realizaron tres puntos de corte electrocardiográficos: previo al inicio del tratamiento, antes de las 72 horas del inicio del mismo y tras más de 72 horas en tratamiento, y se calculó la diferencia en QTc entre el momento basal y las primeras 72 y entre estas últimas y después de 72 horas de tratamiento. Dadas las difíciles circunstancias del momento, en dos casos no se guardó el electrocardiograma realizado previamente al inicio de la terapia.
Las variables categóricas se describieron utilizando proporciones y el estudio de significación empleado fue el test F de Fisher. Las variables cuantitativas se expresan con medianas y rango intercuartílico (IQR) al no presentar una distribución normal. Las variables continuas se compararon usando la prueba U de Mann-Whitney o el test de Kruskal-Wallis. Para el estudio de la evolución del QTc se utilizó la prueba de Wilcoxon Signed Rank para muestras emparejadas. Se consideró un valor de p < 0,05 para representar el umbral de significación estadística. Los análisis estadísticos se efectuaron con el programa SPSS versión 27.0 (IBM).
ResultadosDesde el mes de marzo al mes de diciembre del 2020, un total de 48 pacientes pediátricos han requerido ingreso hospitalario en nuestro centro en contexto de infección por COVID-19. Del total, solamente 11 recibieron alguno de los fármacos estudiados, representando una proporción del 22,9%, todos entre los meses de marzo y mayo. Ningún paciente pediátrico recibió ninguno de estos tratamientos posteriormente.
Destaca un amplio rango de edad entre los pacientes incluidos, siendo el menor de 17 días de vida y la mayor de 15 años de edad, la mediana de edad de los pacientes es nueve años (IQR 10,5 años). El 45,5% (5/11) de la muestra son pacientes de sexo femenino. Las características demográficas se presentan en la tabla 1 y en la tabla 2.
Descripción individual de los pacientes incluidos en el estudio
| Paciente | Edad | Género | Patología de base | Tratamiento COVID-19 | Medicación previa con efecto sobre intervalo QT | QT basal prolongado | QTc (ms) | Discontinuación del tratamiento | Aparición de arritmias | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Basal | < 72h | >72h | |||||||||
| 1 | 15 años | Fem | Estenosis e insuficiencia mitral congénita, portadora de válvula mecánica.Bloqueo AV completo postquirúrgico.Insuficiencia cardiaca crónica. | Lopinavir/ritonavir | Sotalol Flecainida | Sí | 470 | 487 | 500 | No | No |
| 2 | 17 días | Masc | Dextrocardia y situs inversus.Comunicación interauricular. | HidroxicloroquinaAzitromicinaLopinavir/ritonavir | No | 414 | 415 | 464 | No | No | |
| 3 | 12 meses | Fem | Displasia broncopulmonar severa.Déficit congénito de surfactante. | HidroxicloroquinaAzitromicinaLopinavir/ritonavirRemdesivir | HidroxicloroquinaAzitromicina | No | - | 379 | 392 | No | No |
| 4 | 21 meses | Masc | Leucemia aguda linfoblástica B. | HidroxicloroquinaAzitromicina | Cotrimoxazol | No | 428 | 373 | 404 | No | No |
| 5 | 15 años | Fem | Asma | HidroxicloroquinaAzitromicina | No | - | 416 | 431 | No | No | |
| 6 | 6 meses | Fem | Canal auriculoventricular completo.Síndrome de Down. | HidroxicloroquinaAzitromicina | No | 412 | 403 | 442 | No | No | |
| 7 | 9 años | Masc | Disgenesia de tronco encefálico con megacisterna magna.Tetraparesia espástica distónica. | HidroxicloroquinaAzitromicina | No | 387 | 453 | 413 | No | No | |
| 8 | 11 años | Masc | Trasplantado hepático por cirrosis biliar secundaria a déficit de alfa-1-antitripsina. | HidroxicloroquinaAzitromicina | Tacrolimus | No | 415 | 413 | 402 | No | No |
| 9 | 12 años | Fem | Leucemia aguda linfoblástica BObesidad. | HidroxicloroquinaAzitromicina | Cotrimoxazol | No | 379 | 436 | 425 | No | No |
| 10 | 6 meses | Masc | Miocardiopatía dilatada. | Hidroxicloroquina | Sí | 489 | 471 | 510 | Sí | No | |
| 11 | 11 años | Masc | Hipotiroidismo | Hidroxicloroquina | No | 419 | 430 | 500 | No | No | |
AV: auriculoventricular; QTc: QT corregido.
Características demográficas de la muestra. Comparación entre casos y controles
| Característica | Casos: n (%) | Controles: n (%) | Valor p |
|---|---|---|---|
| Número total | 11 (100%) | 22 (100%) | |
| Edad en meses: | |||
| Mediana (rango intercuartílico) | 110 (136) | 110 (140) | 0.895 |
| Género | |||
| MasculinoFemenino | 6 (54,5%)5 (45,5%) | 12 (54,5%)10 (45,5%) | 0.645 |
| ComorbilidadCardiopatíaNeumopatíaEnfermedad hematológica malignaTrasplante de órgano sólidoEnfermedad neurológicaEnfermedad endocrinológica | 11 (100%)4 (36,4%)2 (18,2%)2 (18,2%)1 (9,1%)1 (9,1%)1 (9,1%) | 6 (27,3%)0 (0%)2 (9,1%)4 (18,2%)0 (0%)0 (0%)0 (0%) | |
| Medicación previa domiciliariaCon efecto sobre el QT | 9 (81,1%)5 (45,5%) | 4 (18,2%)2 (9,1%) | |
| Intervalo QTc previo al tratamiento | |||
| Mediana (rango intercuartílico) | 414,8 (49,2) | 416,5 (29,4) | 0,716 |
| Tratamiento recibidoHidroxicloroquinaAzitromicinaLopinavir/ritonavirRemdesivir | 10 (90,9%)8 (72,7%)3 (27,3%)1 (9,1%) | 0 (0%) | |
| Severidad del episodio | |||
| Ingreso en planta de HospitalizaciónIngreso en unidad de cuidados intensivos | 5 (45,5%)6 (54,5%) | 0 (0%)0 (0%) |
QTc: Qt corregido.
Destaca entre las características de la muestra, la presencia de comorbilidades significativas en los 11 pacientes incluidos, patologías que contribuyeron en la mayor parte de los casos a la necesidad de ingreso hospitalario en contexto de la infección por el nuevo coronavirus. Dentro de las principales patologías previas de los pacientes estudiados destacan las cardiopatías (4/11; 36,4%) y las patologías que condicionan inmunodepresión (3/11; 27,3%) siendo dos individuos con enfermedades hematológicas malignas y un trasplantado hepático. El 54,5% (6/11) de los pacientes requirieron ingreso en la unidad de cuidados intensivos dada la severidad del cuadro presentado.
Respecto al tratamiento, el 90,9% (10/11) recibió hidroxicloroquina, siendo el fármaco más utilizado. En la mayoría de ocasiones, se asoció hidroxicloroquina a azitromicina (8/11; 72,7%, todos los pacientes que recibieron hidroxicloroquina excepto dos) representando esta la principal combinación de fármacos empleada. Tres sujetos (27,3%) recibieron lopinavir/ritonavir y uno (9,1%) remdesivir. La única paciente pediátrica que recibió remdesivir se trata de una niña de 12 meses afecta de déficit congénito de surfactante que previamente ya recibía hidroxicloroquina y azitromicina como tratamiento de base, fármacos a los que se añadió lopinavir/ritonavir y remdesivir. Ninguno de los pacientes estudiados recibió terapia con tocilizumab.
Dos pacientes del grupo COVID-19 (2/11; 18,2%) y dos del grupo control (2/22; 9,1%) presentaban un QTc largo basal (> 440 ms en niños y >460 ms en niñas). La mediana del intervalo QTc basal de los sujetos estudiados fue 414,8 ms (IQR 49,2) sin observarse diferencias respecto al de los de control: QTc 416,5 ms (IQR 29,4; p = 0,716). Tanto los pacientes tratados como el grupo control presentaban multiples patologías de base. De hecho, hasta el 45,5% (5/11) del grupo COVID-19 recibía medicación con efecto sobre el intervalo QTc: una paciente recibía sotalol y flecainida, un individuo tacrolimus, dos cotrimoxazol y la paciente ya comentada en terapia con azitromicina y hidroxicloroquina de base. Todos estos tratamientos eran de larga duración. Entre los controles, dos (9,1%) presentaban enfermedades respiratorias crónicas y cuatro (18,2%) estaban afectos de enfermedades hematológicas malignas, dos de ellos en tratamiento con fármacos con efecto sobre el QT (cotrimoxazol).
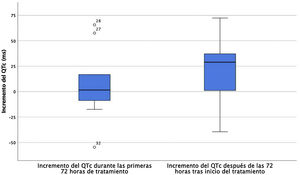
El estudio del cambio del QTc en el grupo tratado demostró un incremento mediano del QTc de solo 1,5 ms (IQR 50,25) entre el electrocardiograma (ECG) basal y el de las primeras 72 horas tras el inicio del tratamiento. El incremento mediano del QTc entre el ECG realizado las primeras 72 horas y después de este período tras el inicio del tratamiento fue de 28,9 ms (48,7); p = 0,062 (fig. 1). Presentaron un QTc prolongado por encima de los valores normales para la edad 4/11 pacientes (36,4%), dos de los cuales ya tenían un QTc alargado de forma basal. Tres (27,2%) de ellos, presentaron una prolongación del QTc ≥ 500 ms y en uno se descontinuó el tratamiento con hidroxicloroquina de forma precoz por presentar un valor de QTc 510 ms (los otros dos tenían un QTc de 500 ms). No se documentaron episodios de arritmias ventriculares graves durante el ingreso y no hubo ningún exitus.
Evolución del incremento de QTc en las primeras 72 horas del inicio del tratamiento y entre las primeras 72 horas y después de 72 horas del inicio del tratamiento. El valor central corresponde a la mediana y los extremos de la caja al rango intercuartílico. Los puntos con sus numeraciones corresponden a casos con valores extremos de QTc.
QTc: QT corregido.
Respecto a las diferencias entre fármacos antivirales recibidos, de los tres pacientes que tomaron lopinavir/ritonavir, dos presentaron un QTc largo, uno de los cuales ya tenía un QTc largo de forma basal (esta misma paciente es la única de la cohorte que no recibió hidroxicloroquina). Respecto al remdesivir, el único sujeto que lo recibió no presentó alargamiento del intervalo QTc, este mismo también recibió lopinavir/ritonavir y estaba en tratamiento con azitromicina y hidroxicloroquina de forma basal por su enfermedad de base.
DiscusiónHasta el momento, los datos de afectación electrocardiográfica en pacientes afectos de COVID-19 en población pediátrica son muy escasos. Este estudio presenta el análisis de la serie de pacientes que recibieron tratamiento con efecto antiviral de un centro hospitalario de tercer nivel en Barcelona (11 de un total de 48 pacientes pediátricos ingresados en el año 2020).
Destaca la gran prevalencia de comorbilidades significativas, siendo probablemente un factor determinante para el ingreso hospitalario y como consecuencia para el tratamiento médico. Además de las enfermedades crónicas, destaca la medicación de base, en algunos casos con efecto sobre el intervalo QTc (5/11; 45,5%), teniendo dos pacientes (18,2%) un QTc largo de forma basal. La presencia de un porcentaje de sujetos con diferentes patologías en el grupo control (6/22, 27,3%; 2/22, 9,1% en tratamiento con fármacos con efecto sobre el QTc) y el pequeño tamaño muestral podrían afectar a no poder excluir que el QTc basal de los dos grupos no sea diferente.
Respecto al uso de fármacos antivirales con potencial arritmogénico, como la hidroxicloroquina, debido a su larga vida media (aproximadamente un mes), el uso crónico dará como resultado una mayor acumulación y mayores concentraciones que con las dosis a corto plazo, siendo probablemente los regímenes cortos más seguros utilizados para tratar COVID-1910,13.
Contrariamente, los pacientes con COVID-19 podrían representar una población con mayor riesgo arrítmico dada la ya descrita alta incidencia de lesión miocárdica e insuficiencia cardiaca asociadas a la enfermedad18. Asimismo, estos pacientes suelen presentar en mayor proporción otros factores de riesgo arritmogénicos como sepsis, hipoxia, alteraciones electrolíticas, fallo multiorgánico y el uso concomitante de otros fármacos que prolongan el QT10,19 especialmente en nuestra muestra con enfermedades crónicas y tratamiento de base (45,5% con tratamiento con efecto sobre el intervalo QTc). En la tabla 3 se presentan los factores de riesgo de alargamiento del QT conocidos10. La hipoxia severa, que ha sido descrita en algunos pacientes con neumonía por COVID-19, también contribuiría al mayor riesgo arritmogénico20, siendo los pacientes más graves los más susceptibles a la aparición de arritmias severas10. En esta muestra de 11 individuos, ninguno llegó a presentar arritmias a pesar de ser el 54,5% de los casos severos como para requerir ingreso en la unidad de cuidados intensivos y dos de ellos necesitar ventilación mecánica invasiva.
Factores de riesgo de alargamiento del intervalo QT
| Factores de riesgo generales | Factores de riesgo relacionados con la enfermedad |
|---|---|
| Síndrome de QT largo congénitoUso de medicación con efecto de alargamiento del intervalo QTSexo femenino | HipopotasemiaHipomagnesemiaSepsisDaño miocárdico, isquemia miocárdica o fallo cardiacoDisfunción renalBradicardia (frecuencia cardiaca < 60 lpm)Reversión reciente de fibrilación auricular |
Fuente: Jankelson et al.10
De los distintos tratamientos utilizados, la hidroxicloroquina ha sido el más ampliamente administrado dados sus optimistas datos preclínicos7,11,13. Tiene una estructura similar a la quinidina, fármaco antiarrítmico de clase IA, que mediante su efecto prolonga el intervalo QTc y aumenta el riesgo de torsades de pointes14. La hidroxicloroquina actúa mediante la inhibición de los canales de potasio KCNH2 (también conocidos como hERG), causando el bloqueo del componente rápido de la corriente rectificadora tardía de potasio (IKr) y aumentando el riesgo de alargamiento del intervalo QTc19,21.
El intervalo QTc largo es la representación electrocardiográfica de retraso en la repolarización ventricular y permite la aparición de despolarizaciones tempranas que podrían dar paso a la torsade de pointes10. A pesar del significativo porcentaje de pacientes con QTc largo basal (2/11;18,2%) y después del tratamiento recibido (4/11;36,4%), ninguno llegó a presentar torsade de pointes ni otras arritmias.
En este estudio se ha visto que la diferencia principal entre el intervalo QTc aparece a partir de las 72 horas de tratamiento, siendo el aumento de 28,9 ms de mediana aunque las diferencias descritas no son estadísticamente significativas (p = 0,062). Probablemente esta ausencia de significación se deba al pequeño tamaño de la muestra estudiada, siendo esta la principal limitación del estudio. Estudios multicéntricos con análisis de mayor número de pacientes serían recomendables para confirmar esta asociación, aunque la desaparición de estos fármacos de los protocolos terapéuticos de COVID-19 complican su realización. Actualmente, no existen estudios con muestras significativas de pacientes pediátricos tratados con hidroxicloroquina en el contexto epidémico actual, solamente pequeñas cohortes de estos16 por lo que nuestro estudio es una de las pocas series de pacientes pediátricos publicadas.
Muchos de los protocolos terapéuticos usados para el nuevo coronavirus incluían la asociación de azitromicina con hidroxicloroquina. La azitromicina también afecta al intervalo QT mediante el bloqueo del corriente IKr22,23, habiéndose postulado el riesgo mayor de alargamiento del QTc en pacientes tratados con la combinación de los dos fármacos; así como un mayor riesgo de aparición de bloqueo de rama9. Además, el corriente IKr también se podría ver afectado en pacientes infectados por COVID-19 por la elevada producción de interleukina-624. Dada la escasez de evidencia sobre el beneficio del uso de hidroxicloroquina y su combinación con azitromicina, algunas publicaciones recomiendan intentar evitar su empleo25.
Otros fármacos utilizados para el tratamiento del nuevo coronavirus, como favipiravir y lopinavir/ritonavir también pueden prolongar el intervalo QT y causar torsade de pointes13. La asociación de diversos fármacos con efecto sobre el QT cobra especial importancia en personas con tratamiento de base con efecto sobre el intervalo QT como el caso de la paciente tratada con sotalol y flecainida y QTc largo basal.
Dado que los pacientes ingresados son principalmente pluripatológicos, con múltiples tratamientos de base y visto el posible efecto sobre el intervalo QTc de los fármacos analizados, los médicos deben valorar cuidadosamente los riesgos y beneficios al usarlos, realizando un seguimiento estrecho del QTc. Existen diversas publicaciones con orientación sobre cómo monitorizar la prolongación del intervalo QT en pacientes tratados con hidroxicloroquina en COVID-19. No todas las publicaciones coinciden entre ellas, recomendando en algunos casos la monitorización con ECG basal y durante el tratamiento10,13,26 y otros reservan esta recomendación a la población de riesgo27, siendo los mayores impedimentos a la monitorización la alta carga de trabajo y sobre todo la mayor exposición a pacientes infectados26.
En los pacientes pediátricos, parece razonable realizar siempre un ECG antes del inicio del tratamiento, y monitorizar el ECG de forma seriada principalmente tras las primeras 72 horas para evaluar si el QTc se ha prolongado de forma sustancial y recomendar la suspensión del tratamiento en aquellos sujetos en los que el QTc es superior a 500 ms de forma sostenida.
Los resultados han sido enviados al 54th Annual Meeting For European Paediatric and Congenital Cardiology, que se celebrará el próximo 25-27 de mayo en Goteborg.