Debido a su gravedad y a las consecuencias de un diagnóstico tardío, los defectos cardíacos congénitos críticos (DCCC) representan un reto, por lo que es necesario su diagnóstico muy precoz, idealmente antes del comienzo de los síntomas clínicos, que normalmente preceden al colapso circulatorio o muerte del recién nacido.
Por ello es importante su diagnóstico prenatal y posnatal muy precoz; sin embargo, tanto el diagnóstico por ecocardiografía fetal como la exploración física del recién nacido pueden ser insuficientes para diagnosticar un número importante de estos DCCC. El cribado de DCCC mediante el uso de pulsioximetría ha demostrado ser un método eficaz, no invasivo y de bajo coste, además de bien tolerado, para detectar a recién nacidos asintomáticos y afectos de DCCC en las primeras horas después del nacimiento.
La Sociedad Española de Neonatología, a través de su Comisión de Estándares, hace una recomendación, basada en la evidencia actual, para la implementación en nuestro medio de la pulsioximetría como cribado neonatal de DCCC, y poder ofrecer a estos recién nacidos el mejor tratamiento posible en cada caso.
Due to its severity, as well as the consequences of a late diagnosis, critical congenital heart defects (CCHD) represent a challenging situation, making an early diagnosis necessary and ideally before symptoms appear when circulatory collapse or death of the newborn can occur.
Due to this, a prenatal and very early postnatal diagnosis is very important. Prenatal ultrasound screening and physical examination of the newborn can miss a considerable number of CCHD cases. Pulse oximetry screening has been demonstrated to be an effective, non-invasive, inexpensive, and well accepted tool in the early diagnosis of CCHD.
The Spanish National Society of Neonatology, through its Standards Committee, and based on the current evidence, recommend the implementation of pulse oximetry screening of CCHD in Spain, and then to offer the best therapy possible to these newborn infants.
En 2011, los EE. UU.1 establecieron la recomendación para el cribado de defectos cardíacos congénitos críticos (DCCC) mediante pulsioximetría (PO), seguida del consenso de un grupo de trabajo2,3. Desde Europa se reclama la recomendación del cribado4.
Este documento de la Comisión de Estándares de la Sociedad Española de Neonatología incorpora la recomendación de realizar el cribado en recién nacidos a término o casi a término que estén asintomáticos y no precisen ingreso en unidades neonatales. Esta medida se adopta con la intención de reducir el riesgo del diagnóstico tardío de DCCC, definidos como aquellos que precisan intervención invasiva o dan lugar a fallecimiento en los primeros 30 días de edad5.
MetodologíaRevisión sistematizada, empleando fuentes de búsqueda mediante palabras clave y búsqueda libre en Medline e ISI Web of Knowledge.
La calidad de la evidencia y la fuerza de la recomendación se han considerado según los criterios de la clasificación adoptada por el Centre for Evidence-Based Medicine (http://www.cebm.net) y las recomendaciones de la Canadian Task Force on Preventive Health Care6.
Justificación del cribadoLa incidencia de las formas moderadas y graves de cardiopatías congénitas es de 6/1.000 nacidos vivos (19/1.000 en el caso de incluir la aorta bicúspide), y si se incluyen todas, la estimación es de 75/1.000 nacidos vivos7.
La incidencia de los DCCC es de 2,3/1.000 nacidos vivos a 1/26.000 (25% de todas)5,7. El 30% de los DCCC se diagnostican tardíamente8.
La ecocardiografía fetal ha demostrado una baja sensibilidad (68,1%, IC 95% 59,6-75,5)9. Aun cuando en algunos centros el diagnóstico prenatal puede ser mayor, esto no es aplicable a la mayoría10,11, habiéndose demostrado, en una población semejante a la de nuestro entorno, un diagnóstico de solo el 60% de los DCCC por ecografía antenatal12.
La exploración clínica no detecta hasta el 20-30% de los DCCC13,14. Los soplos no siempre están presentes, y pueden aparecer hasta en un 60% de los recién nacidos sanos15,16. La observación clínica de la cianosis no es eficaz para detectar la hipoxemia17,18.
La combinación de ecografía antenatal y exploración clínica puede llegar a no diagnosticar desde un 29,5% de los DCCC8 a un 20%12.
Pulsioximetría en el cribado de los defectos cardíacos congénitos críticosEn 2012 se realizó una revisión sistemática con 13 estudios y 229.421 recién nacidos. La sensibilidad del cribado con PO fue del 76,5%, la especificidad, del 99,9%, y el índice de falsos positivos, del 0,14%19. La conclusión fue que la PO cumple los criterios para ser empleada como cribado de los DCCC.
Además, el cribado mediante PO ha sido bien aceptado tanto por el personal sanitario como por las familias20.
Existe evidencia suficiente para recomendar el cribado neonatal mediante PO en las primeras horas después del nacimiento, de forma combinada con la detección antenatal y la exploración clínica (nivel de evidencia A).
Momento del cribadoCuando se realiza el cribado 24h después del nacimiento los falsos positivos pueden descender hasta el 0,05%, y si se realiza antes de las 24h tras el nacimiento, este porcentaje es del 0,50%19.
Los falsos positivos pueden representar otras entidades, lo que implica un falso positivo «rentable».
Al analizar los ensayos de cribados tardíos (>24h) se comprueba como la mitad de los DCCC aparecen en las primeras 24h y el 20% lo hacen con colapso cardíaco21.
En una revisión retrospectiva de cribado realizado antes de las 12h (algoritmo británico), se detectaron 9 DCCC de 26.000 recién nacidos, siendo los falsos positivos del 0,8%. Sin embargo, el 79% de los falsos positivos padecían alteraciones médicas que precisaron intervención urgente. El 21% restante presentaban trastornos de la adaptación circulatoria (falsos positivos reales)22.
El algoritmo nórdico23 recomienda el cribado antes de 24h. La mitad de los pacientes en los que el cribado pudo ser positivo presentaron síntomas antes del momento de realizarlo12,24.
En nacimientos domiciliarios, se ha demostrado que es posible realizarlo en las primeras horas, siendo la mediana de la primera determinación del cribado de 1,8h (intervalo intercuartil 1,3-2,8h) y la de la segunda determinación, de 37h (intervalo intercuartil de 27-47h), con un porcentaje de falsos positivos del 1%. La aceptabilidad por las familias de realizar el cribado en el domicilio es elevada25,26.
Con base en la evidencia disponible, un cribado precoz (antes de 24h tras el nacimiento) es recomendable sobre un cribado tardío (después de 24h), siendo más eficaz cuando se realiza en las primeras 12h, aun a expensas de incrementarse el número de falsos positivos (nivel de evidencia B).
Dónde ha de colocarse el sensorAun cuando en el metaanálisis no se obtuvieron diferencias significativas en la sensibilidad entre los estudios en los que se colocó el sensor solo posductal o posductal y preductal19, la colocación combinada pre y posductal aumenta la detección de alteraciones del tracto de salida del ventrículo izquierdo27.
La saturación pre y posductal identifica un mayor número de DCCC, equivalente a 7 por cada 100.000 nacimientos, aun cuando esto puede aumentar el número de falsos positivos en comparación con la colocación de solo el sensor posductal24,27.
Por lo tanto, la medición pre y posductal incrementa el número de DCCC detectados en el cribado, siendo su desventaja la mayor necesidad de tiempo empleado (nivel de evidencia B).
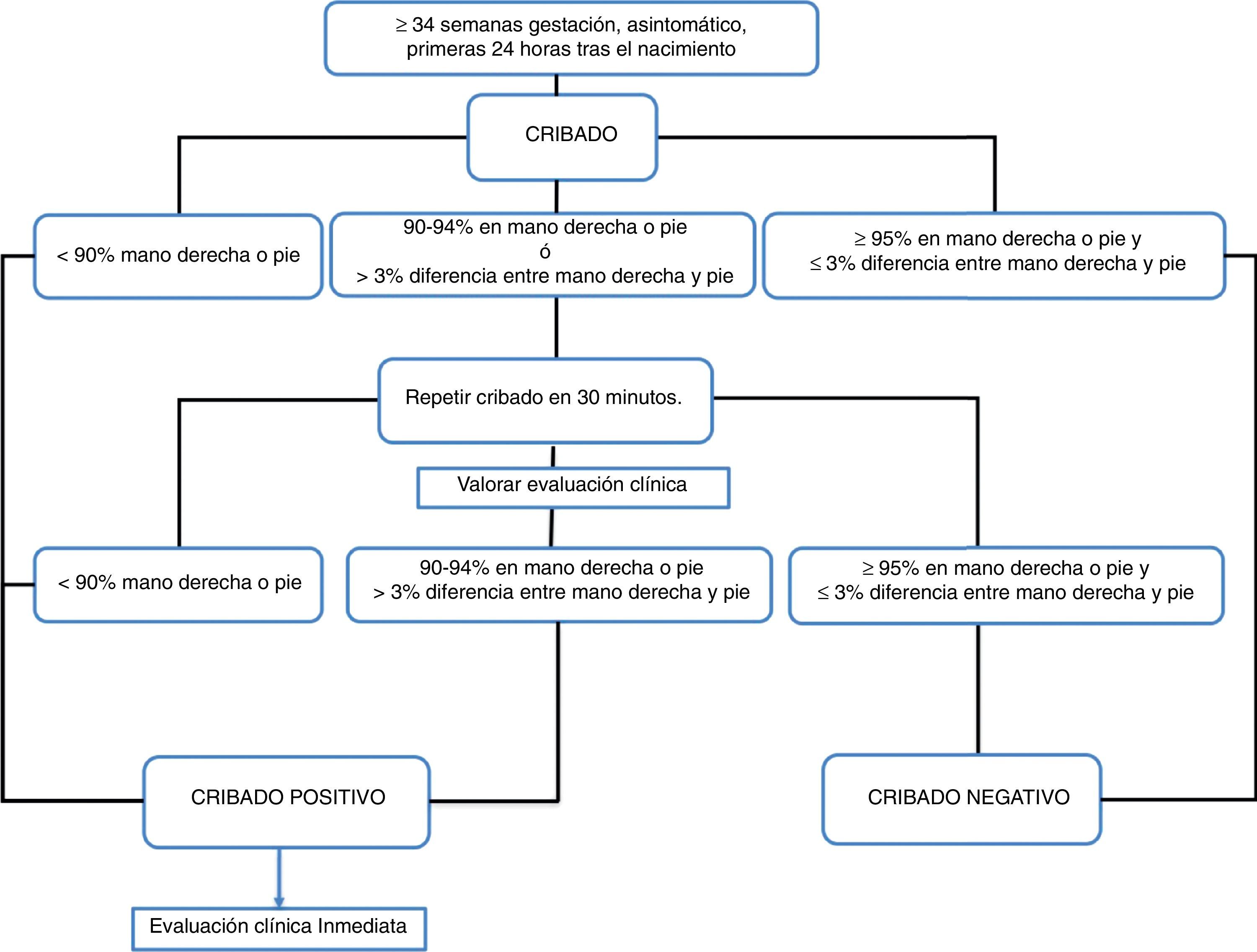
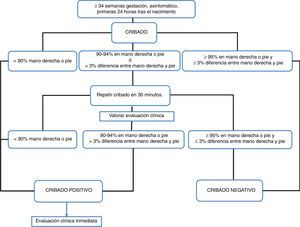
Definición de test positivoEl valor de corte de la PO por los algoritmos es del 95%, considerándose un valor absoluto de positividad del test en menos del 90% y un valor de positividad relativa cuando la saturación es de 90-94%.
Según la Academia Americana de Pediatría, el test positivo se define como una saturación inferior al 90% en una de las 2 extremidades superiores o inferiores, o entre 90-94% en ambas a la vez, o una diferencia entre ambas saturaciones mayor del 3%, en 3 ocasiones realizadas con una hora de diferencia entre ellas antes de la valoración clínica del recién nacido3.
Según el algoritmo del Reino Unido, la positividad se establece cuando la saturación es inferior al 90% en cualquier momento, o entre 90-94% en la mano derecha o en uno de los pies, o existe una diferencia mayor al 2% entre ambas extremidades en 2 mediciones separadas 2h entre ellas siempre y cuando esté asintomático. La presencia de síntomas hace positivo el cribado inmediatamente27.
En el algoritmo nórdico23 el test es positivo cuando en una de ambas localizaciones la saturación es inferior al 90%, o si la saturación es 90-94% en ambas localizaciones o existe una diferencia pre-posductal mayor de un 3%, repitiéndose 2 veces a intervalos de 30min antes de considerarlo positivo.
Por lo tanto, el valor óptimo para la negatividad del test es≥95% y un valor absoluto de positividad inferior al 90% o ante la presencia de síntomas en cualquier valor de saturación (nivel de evidencia B)19, y es razonable aplicar el criterio de positividad cuando existe una saturación inferior al 95% en cualquiera de ambas extremidades o una diferencia superior al 3% entre ambas (nivel de evidencia B).
Existen discrepancias sobre cómo interpretar valores de entre el 90 y el 94%. Existen 2 actitudes para considerarlo positivo: cuando en ambas extremidades el valor es inferior al 95% o existe una diferencia superior al 3% entre ambas mediciones24, y cuando existe una saturación inferior al 95% en cualquiera de ambas extremidades o una diferencia del 2% entre ambas28, siendo la tasa de falsos positivos menor en el primer caso comparado con el segundo (0,15 vs. 0,8%).
Existe falta de consenso ante un test 90-94% en cuanto a la repetición de este y la actitud médica. Las posibles ventajas de esperar y repetir el test se basan en reducir los falsos positivos y la desventaja es el retraso en el diagnóstico.
Es razonable que ante unos valores de saturación entre 90-94% se realice una valoración clínica y se repita el test solo una vez (nivel de evidencia B).
Qué dispositivo usarLos dispositivos deben ser adecuados para uso neonatal, demostrar tolerancia al movimiento y una sensibilidad alta en rango de saturaciones bajas (nivel de evidencia B). Además, es aconsejable que se empleen equipos de nueva generación1,3,29. Esto es importante para saturaciones mayores del 70%30.
Impacto esperado del cribadoCon el cribado en las primeras 24h se estiman 6,25 ingresos/1.000 nacimientos22 y 9 ecografías cardíacas extra por cada 18.801 cribados (42 meses de cribado)31.
Coste-efectividad del cribadoLa mayoría de los estudios concluyen que el cribado de DCCC con PO es coste-efectivo. La estimación global de cada test es de 3,88-14US$, con un coste de cada paciente diagnosticado de DCCC por todos los pacientes necesarios de cribar de 46.300US$32–34.
Duración estimada y coste asociado a la realización del cribadoEn la mayoría de los estudios el tiempo dedicado al procedimiento es de 5,5-9min, sin ser necesario un incremento del personal que atiende a los recién nacidos32,34.
Recomendaciones- 1.
Es necesario implementar un sistema de cribado posnatal de DCCC en recién nacidos sanos, asintomáticos, no hospitalizados (A).
- 2.
La PO es útil y segura en el cribado de los DCCC en el recién nacido (A).
- 3.
El momento de realizar el cribado afecta a la sensibilidad del mismo, siendo mayor cuanto más precoz (A).
- a.
El cribado precoz, inferior a 24h, reduce el riesgo de inicio con síntomas graves o muy graves en los DCCC, a expensas de aumentar los falsos positivos, los cuales en su mayoría implican otros trastornos que pueden precisar igualmente observación, diagnóstico y tratamiento médico, por lo que es preferible al cribado más tardío (>24h).
- b.
El cribado muy precoz (<12h) puede implicar un número excesivo de falsos positivos, lo que debería ser evaluado de forma local.
- c.
En caso de alta muy precoz, el cribado debe realizarse antes de la misma en cualquier momento.
- d.
Es recomendable realizar el cribado entre las 6 y 24h (B).
- a.
- 4.
El nacimiento domiciliario no es motivo para no realizar el cribado de DCCC (B).
- 5.
Es recomendable emplear la medición de PO pre y posductal para mejorar el rendimiento diagnóstico del cribado (B).
- 6.
Deben emplearse equipos de PO con algoritmos neonatales con tolerancia al movimiento y sensibilidad fiable en rango de saturaciones bajas (B).
- 7.
El valor absoluto de positividad en saturación es<90% en mano derecha o pie, o ante la presencia de síntomas. En esta situación el recién nacido deberá recibir una exploración clínica médica adecuada (B).
- 8.
El valor absoluto de negatividad es≥95% en mano derecha y pie o≥95% en alguna de las extremidades y la diferencia es≤3% entre ambas localizaciones (B).
- 9.
Si los valores se encuentran entre el 90 y el 94% en mano derecha o pie, o la diferencia entre ambos es>3%, repetir en 30min (B). Es recomendable en este momento realizar una valoración clínica (B).
- 10.
Si tras la segunda determinación el recién nacido sigue presentando una saturación del 90-94% en mano derecha o pie, o una diferencia entre ambos>3%, se considerará positivo (B).
- 11.
Es necesario un entrenamiento básico del personal que realizará el cribado (B).
En la figura 1 se presenta el algoritmo de cribado de cardiopatías congénitas críticas recomendado por el Comité de Estándares de la Sociedad Española de Neonatología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.